小麦矮缩病毒引起的植株矮化与赤霉素代谢的相关性分析
吴慧娟,刘艳,王锡锋
小麦矮缩病毒引起的植株矮化与赤霉素代谢的相关性分析
吴慧娟,刘艳,王锡锋
(中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京100193)
【目的】由异沙叶蝉()传播的小麦矮缩病毒病是近年来中国西北部麦区严重发生的小麦病毒病害之一。受侵染的小麦植株严重矮化,有效分蘖减少,产量损失严重。论文旨在明确小麦矮缩病毒(,WDV)侵染小麦植株后矮化症状形成与赤霉素代谢调控的关系,为该病害的防治打下基础。【方法】以小麦品种扬麦12为试验材料,以异沙叶蝉为传毒介体饲毒后转移到1叶期的健康幼苗(3头/株)上进行传毒,同时以无毒异沙叶蝉取食健康幼苗为对照。根据试验需要,不同时间取样备用。为保证试验的准确性,经PCR检测为阳性的作为处理组试验材料;采用间接酶联免疫吸附(ELISA)法,利用植物赤霉素(GA3)试剂盒测定分析侵染第21天取样的小麦叶片赤霉素含量;将带毒条沙叶蝉接种的小麦苗分为两个平行处理组,接种后第7天分别用GA3(浓度为50 mg·L-1)和H2O进行叶面喷施处理,每隔一周处理一次。以无毒叶蝉接种后长势一致的小麦苗作为对照组,根据株高统计结果分析外施赤霉素对受侵染小麦植株的表型变化;以山羊草()的内根-贝壳杉烯合成酶(-kaurene synthase-like 3,)的基因编码区序列为参考基因设计引物(KSL3-F:5′-ATGATGGTGAATCCGCCGC-3′;KSL3-R:5′-TTAATGGTTGATCTTTGTTT-3′),对扬麦12的进行克隆和序列分析;分别取接种后7、14和21 d的小麦植株叶片,提取RNA后反转录,以克隆得到的基因序列设计引物(TaKSL3-F:5′-GAGACATGTGCCATGGCGTTC-3′;TaKSL3-R:5′-CGTGTCACTCAGATCGGTGGAG-3′),选择小麦翻译延伸因子1A()作为内参基因,利用荧光定量PCR方法分析赤霉素代谢相关基因的转录水平。【结果】经ELISA检测发现,接种21 d的发病植株赤霉素含量与健康植株相比降低了28.9%;通过施用浓度为50 mg·L-1的赤霉素后,发病植株的平均株高相比对照组显著增加35.9%;采用同源克隆得到了完整的小麦赤霉素合成途径关键酶的编码区序列,长度为1 827 bp,编码608个氨基酸,BLAST比对分析发现该DNA序列与山羊草编码区序列相似度为85.2%。经荧光定量检测发现受小麦矮缩病毒侵染后小麦表达量显著下降,接种14 d降低为对照组的35.7%,21 d降低为对照组的9.6%。【结论】小麦矮缩病毒的侵染导致赤霉素合成途径关键酶的表达量降低,可能使赤霉素合成受阻,赤霉素含量降低引发受赤霉素调节的细胞生物学过程异常,从而诱导矮化症状形成。研究结果为揭示小麦矮缩病毒侵染的致病机理和病害防控打下了基础。
小麦矮缩病毒;矮化;赤霉素;内根-贝壳杉烯合成酶;致病机理
0 引言
【研究意义】小麦矮缩病毒(,WDV)是双生病毒科()玉米线条病毒属()病毒成员[1],由异沙叶蝉()以持久性非增殖方式传播[2-3]。该病毒可以侵染包括小麦()、大麦()、燕麦()等多种禾本科植物及杂草[4],引起植株严重矮化、黄化、条斑及分蘖增多等症状,严重威胁小麦产量[5-7]。该病害于1961年在前捷克斯洛伐克首次报道[8],随后逐渐波及到欧洲、非洲和大洋洲以及亚洲的许多国家[9-11]。2007年,小麦矮缩病在陕西韩城北部地区严重发生,发病面积约为700hm2,造成发病田块减产50%—80%,严重地块甚至绝收[12],正成为威胁中国西北、华北和西南麦区重要的病毒病[13]。因此,研究该病毒的致病机理,对于有效控制病害的发生具有重要意义。【前人研究进展】植物激素参与植物生长发育的整个过程,各种激素的稳态平衡是植物正常生长发育的前提条件。植物在遭受病原物胁迫时,会依赖激素调节进行自我防御,激素稳态平衡被打破时可能导致代谢紊乱以及各种病变的发生[14]。其中,赤霉素调控植物生长发育的多方面,包括茎的伸长和叶的伸展[15]。相关研究发现赤霉素缺失突变体常常表现为叶片小、茎短[16]。另外,病毒的侵染也会干扰赤霉素的正常代谢,如水稻受矮缩病毒(,RDV)侵染以后赤霉素合成受阻,植株表现为典型的矮化症状[17]。Fan等[18]对甜菜坏死黄脉病毒(,BNYVV)侵染本氏烟后叶片组织转录组进行测序,鉴定出的多个差异表达基因涉及到植物激素代谢途径。通过体外喷施赤霉素矮化症状消失,说明病毒侵染本氏烟导致矮化症状可能是寄主体内赤霉素的积累受阻以及细胞壁合成相关基因表达下调共同作用的结果。国内外学者也发现水稻感染水稻草矮病毒(,RGSV)和水稻条纹病毒(,RSV)后,植株赤霉素含量均低于健康植株[19-20]。【本研究切入点】小麦受矮缩病毒侵染后植株同样明显矮化,笔者实验室王亮基于RNA-seq技术分析WDV侵染后小麦的基因表达差异,发现赤霉素合成相关基因内根-贝壳杉烯合成酶()的表达水平显著下降[21],但是目前关于赤霉素在WDV侵染过程中的作用机理尚无深入研究。【拟解决的关键问题】采用ELISA法测定赤霉素的含量以明确WDV的侵染对赤霉素水平的影响,通过外施赤霉素进一步明确赤霉素变化与矮化症状形成的相关性。应用同源克隆获得小麦矮缩病高感品种扬麦12的赤霉素合成相关的编码区全长,并通过荧光定量PCR方法明确其在小麦受侵染过程中的表达水平变化,以期在分子水平解析赤霉素代谢在小麦矮缩病毒致病过程中的关键作用,进而为生产上有针对性地防治该病害提供理论依据。
1 材料与方法
试验于2016年在中国农业科学院植物病虫害生物学国家重点实验室完成。
1.1 供试材料、试剂及仪器
1.1.1 供试材料 小麦品种为扬麦12,由江苏里下河地区农科所提供,笔者实验室繁殖并保存;传毒介体异沙叶蝉采自陕西韩城,经脱毒后常年饲养于小麦幼苗上,饲养条件为温度(22±1)℃,光周期为16 h光照/8 h黑暗,相对湿度40%—50%;WDV毒源来自陕西韩城发病麦田,病株带回实验室后用无毒异沙叶蝉取食带毒后传至健康的扬麦12号小麦幼苗上。
1.1.2 主要试剂 植物赤霉素(GA3)及其ELISA试剂盒分别购自泉州市科诺迪生物科技有限公司和国药集团化学试剂有限公司;快捷型植物基因组DNA提取系统购自天根生化(北京)有限公司;TRIzol购自Invitrogen公司;反转录试剂盒等PCR试剂购自TaKaRa(大连)公司;荧光定量PCR试剂TransScript@ All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)和TransStart Top Green qPCR SuperMix购自北京全式金生物技术有限公司。
1.1.3 主要仪器 酶标仪550(伯乐中国有限公司);Biometra PCR仪(德国Analytik Jena公司);水平电泳仪(北京六一科技有限公司);微量紫外分光光度计ND-1000(美国Thermo Scientific公司);美国ABI 7500型实时荧光定量PCR系统(美国Applied Biosystems公司)。
1.2 方法
1.2.1 小麦材料的获得 将异沙叶蝉置于受WDV侵染的小麦植株上饲毒4 d,然后转移到1叶期的健康幼苗(3头/株)上进行传毒,4 d后移除,以无毒异沙叶蝉取食健康幼苗为对照。所有植株置于光照培养箱中生长,条件为温度(20±1)℃,光周期16 h光照/8 h黑暗[22]。接种21 d后,带毒植株出现典型症状,取小麦叶片待测。为保证试验的准确性,经PCR检测为阳性的作为试验材料。其中,DNA的提取使用快捷型植物基因组DNA提取系统,操作见说明书。检测所用上游引物F:5′-ATGGTGACCAACAAGGA CTC-3′,下游引物R:5′-CTGAATGCCGATGGCTTTGA-3′,目的片断大小为783 bp。PCR反应体系及参数:模板DNA,1 μL;引物F,0.5 μL;引物R,0.5 μL;dNTP,2 μL;10×PCR buffer,2.5 μL;TaqDNA聚合酶,0.2 μL;ddH2O补至总体积25 μL。反应程序:94℃预变性4 min;94℃变性30 s,58℃退火30 s,72℃延伸90 s,33个循环;72℃延伸10 min;4℃冷却停止反应。
1.2.2 赤霉素(GA3)含量测定 将1.2.1获得的供试材料(21 dpi)按照10 mg组织加入100 μLPBS缓冲液(1﹕10)的比例稀释,用植物赤霉素ELISA试剂盒测定供试小麦材料赤霉素含量,具体操作详见说明书。以所测标准品的OD值为横坐标,标准品的浓度值(pmol·L-1)为纵坐标,用Excel 2016绘制标准曲线,并得到直线回归方程,将样品的OD值代入方程,计算出样品的浓度(pmol·L-1),按照鲜重配比1 mL相当于0.1 g进行浓度折算得出赤霉素含量(pmol·L-1)。试验设置3个生物学重复。
1.2.3 外施赤霉素处理 分别用带毒和无毒的异沙叶蝉接种于小麦幼苗,方法同1.2.1。去虫3 d后将带毒叶蝉接种后长势相似的小麦苗分为两个平行处理组,分别用GA3(浓度为50 mg·L-1)和H2O进行叶面喷施。每隔一周处理一次,第4次喷施后隔周测量小麦植株高度。以无毒叶蝉接种后长势一致的小麦苗作为对照组。对于带毒叶蝉接种的小麦经PCR检测为阳性的统计有效,检测方法同1.2.1。数据采用SAS软件进行显著性分析及方差分析。
1.2.4 小麦编码区的克隆 用TRIzol试剂提取总RNA,琼脂糖凝胶电泳和NanoDrop-1000紫外分光光度计检测RNA的质量和浓度,以确保达到要求。经反转录得到cDNA,以亲缘关系较近的山羊草()的内根-贝壳杉烯合成酶()基因编码区序列(登录号:EMT15962)为参考基因[23],设计引物(KSL3-F:5′-ATGATGGTGAATCCGCC GC-3′;KSL3-R:5′-TTAATGGTTGATCTTTGTTT-3′)进行PCR。反应体系及参数:模板cDNA,3 μL;引物F,0.5 μL;引物R,0.5 μL;dNTP,2 μL;10×反应buffer,2.5 μL;TaqDNA聚合酶,0.2 μL;ddH2O补至总体积25 μL。反应程序:94℃预变性4 min;94℃变性30 s,57℃退火30 s,72℃延伸2 min,33个循环;72℃延伸10 min;4℃冷却停止反应。将PCR产物连接至pMD19-T克隆载体,经转化将得到的阳性克隆送生工生物工程(上海)股份有限公司测序。
1.2.5的表达分析 用带毒异沙叶蝉接种小麦幼苗,方法同1.2.1,分别取接种后7、14和21 d的小麦植株叶片,保存于-80℃备用。设3次生物学重复,同时以无毒异沙叶蝉接种的小麦幼苗作为平行对照组。待测样品RNA的提取及质量和浓度检测方法同1.2.4。取1 μg RNA为模板,按照TransScript@ All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)试剂盒说明书描述的方法进行反转录操作,引物以克隆得到的目的基因序列进行设计(F:5′-GAGACATGTGCCATGGCGTT C-3′;R:5′-CGTGTCACTCAGATCGGTGGAG-3′),选择在小麦体内稳定表达的持家基因翻译延伸因子1A()作为内参基因(F:5′-GTCAGATTGGCAA CGGCTACG-3′;R:5′-CTCCAGCTCCTTACCAGATC GC-3′),利用qPCR方法对目的基因进行表达量分析,依据TransStart Top Green qPCR SuperMix试剂盒说明书中的进行qPCR操作。为了保证结果的科学性,设置3次技术性重复。相对表达量的计算采用2-∆∆Ct法[24],采用Excel 2016进行数据分析,采用SAS软件进行方差分析。
2 结果
2.1 小麦矮缩病毒侵染小麦后植株赤霉素含量变化
采用ELISA法测定了小麦受侵染第21天后内源赤霉素中的最有效成分GA3的含量,3次生物学重复共计60株。利用标准品得到赤霉素含量()和吸光度()线性相关情况,回归方程为=62.76-0.7498(2=0.9966)(图1)。结果表明,受WDV侵染的小麦内源赤霉素GA3含量较同期健康小麦植株降低了28.9%(<0.0001)(图2)。
2.2 外源赤霉素(GA3)的施用
为了进一步验证赤霉素含量的减少与小麦矮缩症状形成的相关性,通过外施赤霉素来观察受WDV侵染的小麦生物学表型变化。结果表明受WDV侵染后小麦植株严重矮化,相对株高仅达健康植株的43.8%;而施用浓度为50 mg·L-1赤霉素(GA3)植株的相对株高要比水处理的发病小麦植株高达35.9%(<0.0001)(图3)。说明通过外施赤霉素能够缓解小麦矮缩病毒引起的矮缩症状。
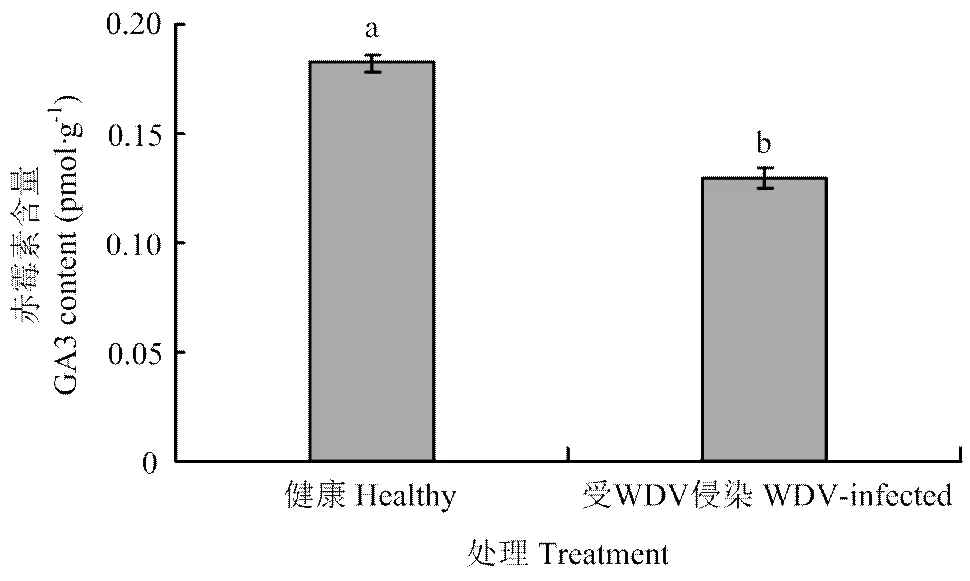
不同小写字母表示经双样本T检验在P<0.05水平差异显著
2.3 小麦内根-贝壳杉烯合成酶()基因的获得
以扬麦12叶片为材料,提取RNA并反转录获得cDNA。以cDNA为模板,KSL3-F和KSL3-R为引物进行PCR,获得了大小2 000bp左右的特异性片段(图4)。将扩增片段测序结果进行序列拼接并比对,得到了完整的小麦的编码区序列,长度为1 827 bp,编码608个氨基酸。经BLAST比对分析发现,该DNA序列与山羊草编码区序列相似度为85.2%。对小麦KSL3保守结构域分析,如图5所示,该蛋白属于Terpene synthase family,具有-kaur-16-ene synthase(KS)的PLN02279保守结构域。萜类合成酶(terpene synthase,TPS)是萜类合成的关键酶,几乎所有的萜类合成酶都含有一个对于催化活性起重要作用的天冬氨酸富集基序(DD××D),分析发现得到的KSL3蛋白同样具有DDFFD结构。由以上结果推断,同源克隆所获得的小麦基因序列是正确的,命名为(GenBank登录号为KY643786)。
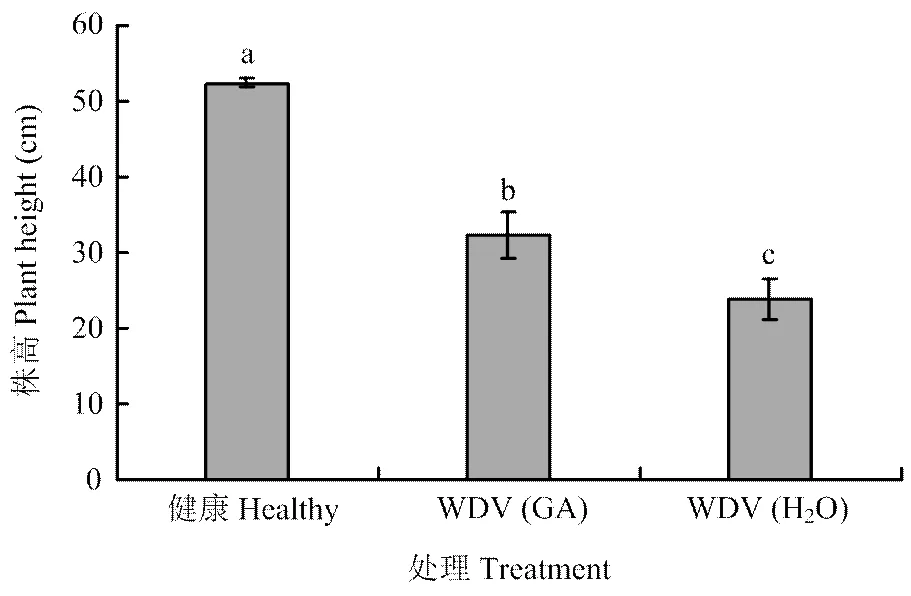
不同小写字母表示经Tukey’s LSD检验在P<0.05水平差异显著

M:DL5000 ladder DNA marker;1—5:PCR产物Amplicons of PCR
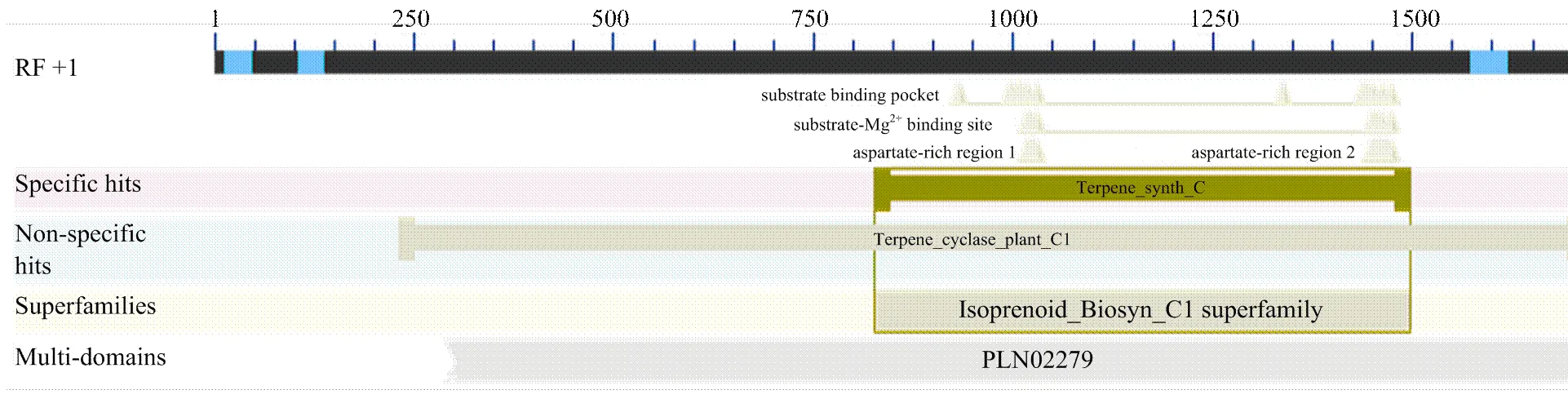
图5 小麦TaKSL3蛋白的保守结构域分析
2.4 小麦内根-贝壳杉烯合成酶()的表达分析
以小麦为内参,以未侵染的小麦叶片为平行对照,实时定量检测小麦受WDV侵染过程中第7、14和21天的相对表达量。结果显示与健康植株相比,受侵染植株该基因的表达水平随侵染时间呈现下降趋势(图6)。WDV侵染初期表达量基本没有变化,第14天降低为对照组的35.7%,第21天降低为对照组的9.6%,此时植株已表现出明显的矮化,表明的相对表达量与矮化症状的严重度呈负相关性关系。
3 讨论
植物病毒的侵染常引起植物生理、生化和代谢过程的改变,导致植株矮化、花叶、萎蔫等症状的形成。对于很多植物病毒病来说,植株生长发育的改变是由于病毒的侵染干扰赤霉素等植物激素代谢引起的[25]。Zhu等[17]发现水稻矮缩病毒P2蛋白和水稻贝壳杉烯氧化酶互作,使得赤霉素含量下降,水稻植株明显矮化,同样,黄炎霞[26]发现南方水稻黑条矮缩病毒(,SBRDV)可通过调控赤霉素代谢使侵染水稻发病矮化。
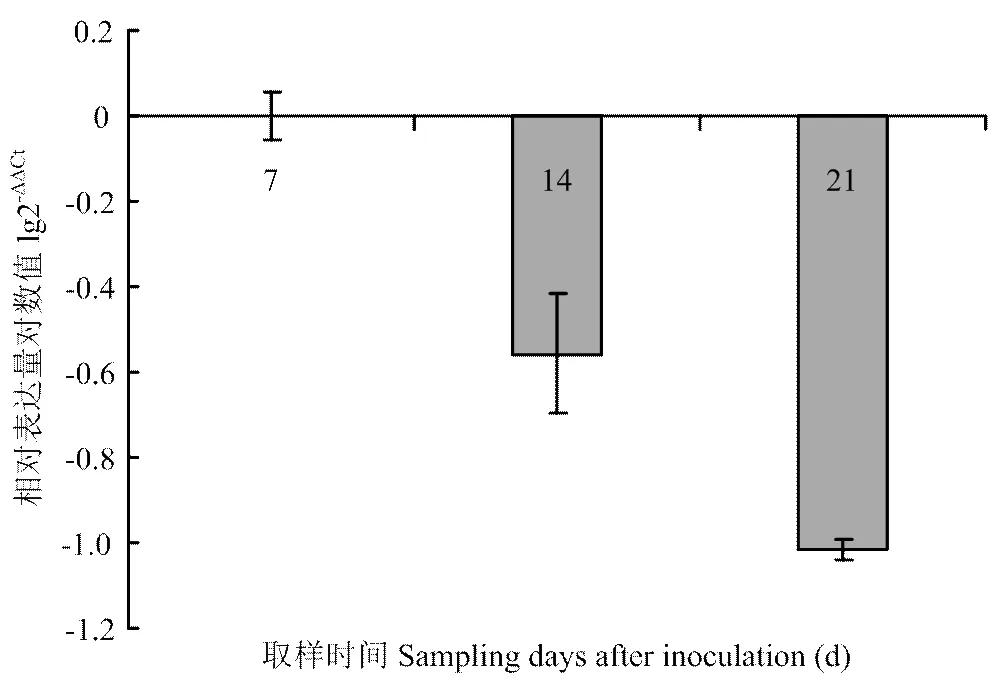
图6 定量检测受小麦矮缩病毒侵染后TaKSL3的表达水平
小麦矮缩病毒的侵染可引起植株矮化,推测也是一种典型的赤霉素缺陷症状。本研究通过ELISA测定发现具矮化症状的病株与健康植株的赤霉素含量存在显著差异,而植株的矮化症状可以通过施用一定浓度的外源赤霉素得以缓解,说明赤霉素含量和矮化症状形成具有相关性。另外,内根-贝壳杉烯合成酶是催化赤霉素合成过程中的第二个关键酶[27]。为进一步研究小麦矮缩病毒干扰赤霉素代谢途径的致病分子机理,采用同源序列克隆了小麦品种扬麦12号的,通过荧光定量PCR分析发现受小麦矮缩病毒侵染的植株叶片表达量明显下降。推测的表达受到抑制可直接导致赤霉素生物合成受阻,从而赤霉素含量降低,引发受赤霉素调节的细胞生物学过程异常,可能是造成感病植株矮化症状形成的重要原因。
病毒与寄主基因之间的互作使得病毒侵染后症状的发生成为一个错综复杂的过程。已有的研究报道侵染后表现矮化症状的植物病毒(如RDV、SBRDV)与寄主体内参与赤霉素合成相关的酶存在互作[17,26],那么小麦矮缩病毒和寄主小麦之间在此通路上是否也存在这种互作关系?本研究中已获得了完整的小麦的编码区序列,可对的分子调控机制进行深入研究。目前正利用酵母双杂交及Pull-down等技术手段验证与小麦矮缩病毒编码的外壳蛋白、复制酶相关蛋白的互作关系,以期明确赤霉素合成关键酶在小麦矮缩病毒侵染过程中的调控机理。该研究将为深入探讨小麦矮缩病毒的致病机理打下基础,最终为小麦矮缩病毒及其他病毒病的防治提供重要的理论指导。
4 结论
小麦矮缩病毒的侵染可导致植株体内的赤霉素含量显著降低,赤霉素合成途径关键酶的相对表达量下降。推测赤霉素合成受阻导致赤霉素含量降低,通过外施赤霉素可在一定程度上缓解矮化症状。
References
[1] Schalk H J, Matzeit V, Schiller B, Schell J,Gronenborn B., a geminivirus of graminaceous plants needs splicing for replication., 1989, 8(2): 359-364.
[2] Hogenhout S A, Ammar E D, Whitfield A E, RedinbaughM G. Insect vector interactions with persistently transmitted viruses., 2008, 46: 327-359.
[3] 赵艺泽,刘艳,王锡锋. 利用酵母双杂交系统筛选介体异沙叶蝉中与小麦矮缩病毒外壳蛋白互作的蛋白质.中国农业科学,2015,48(12):2354-2363.
Zhao Y Z, Liu Y, Wang X F. Screening of putative proteins in vectorL. that are interacted with coat protein ofby a split-ubiquitin yeast membrane system., 2015,48(12):2354-2363.(in Chinese)
[4] Kvarnheden A, Lindblad M, Lindsten K, Valkonen J PT.Genetic diversity of., 2002, 147(1): 205-216.
[5] Eugene V K, Tatyana V I. Geminivirus replication proteins are related to prokaryotic plasmid rolling circle DNA replication initiator proteins., 1992, 73(10): 2763-2766.
[6] MacDowell S W, Macdonald H, Hamilton1 WDO, Coutts RHA, Buck KW. The nucleotide sequence of clonedDNA., 1985, 4(9): 2173-2180.
[7] Kumar J, Kumar J, Singh S P,Tuli RAssociation of satellites with a mastrevirus in natural infection: complexity ofdisease., 2014, 88(12): 7093-7104.
[8] Vacke J.disease., 1961, 3(3): 228-233.
[9] Legg J P, Fauquet C M.in Africa., 2004, 56(4): 585-599.
[10] Koklu G, Ramsell J N, Kvarnheden A. The complete genome sequence for a Turkish isolate of(WDV) from barley confirms the presence of two distinct WDV strains., 2007, 34(3): 359-366.
[11] Xie J J, Wang X F, Liu Y, Zhou G. First report of the occurrence ofin wheat in China., 2007, 91(1): 111.
[12] 王江飞, 柳树宾, 吴蓓蕾, 谢家建, 王锡锋. 陕西韩城严重发生的小麦矮缩病病原鉴定与原因分析. 植物保护, 2008, 34(2): 17-21.
Wang J F, Liu S B, Wu B L, Xie J J, Wang X F. Identification and analyses of the pathogen causing thein Hancheng of Shaanxi Province, China., 2008, 34(2): 17-21. (in Chinese)
[13] 王锡锋, 刘艳, 韩成贵, 吴云峰, 赵中华. 我国小麦病毒病害发生现状与趋势分析. 植物保护, 2010,36(3):13-19.
Wang X F, Liu Y, Han C G, Wu Y F, ZHAO Z H. Present situation and development strategies for the research and control of wheat viral diseases., 2010, 36(3): 13-19. (in Chinese)
[14] Kazan K, Lyons R. Intervention of phytohormone pathways by pathogen effectors., 2014, 26(6): 2285-2309.
[15] Yamaguchi S. Gibberellin metabolism and its regulation., 2008, 59: 225-251.
[16] Koornneef M, Van der Veen J H. Induction and analysis of gibberellin sensitive mutants in(L.) Heynh., 1980, 58(6): 257-263.
[17] Zhu S F, Gao F, Cao X S, Chen M, Ye J Y, Wei C H, Li Y. TheP2 protein interacts with-kaurene oxidases, leading to reduced biosynthesis of gibberellins and rice dwarf symptoms., 2005, 139(4): 1935-1945.
[18] Fan H Y, Sun H W, Wang Y, Zhang Y L, Wang X B, Li D W, Yu J L, Han C G. Deep sequencing-based transcriptome profiling reveals comprehensive insights into the responses oftoinfections containing or lacking RNA4., 2014, 9(1): e85284.
[19] ShimizuT, SatohK, KikuchiS, OmuraT. The repression of cell wall-and plastid-related genes andthe induction of defense-related genes in rice plants infected with., 2007, 20(3): 247-254.
[20] Satoh K, Yoneyama K, Kondoh H, Shimizu T, Sasaya T, Choi I R, Yoneyama K, Omura T, Kikuchi S. Relationship between gene responses and symptoms induced by., 2013, 4(2): Article 313.
[21] 王亮. 基于RNA-Seq技术分析小麦矮缩病毒侵染后小麦的基因表达差异[D]. 北京: 中国农业科学院, 2015.
Wang L. Analysis of gene expression changes in wheat leaves in response to WDV infection using RNA-Seq[D]. Beijing: Chinese Academy of Agricultural Sciences, 2015. (in Chinese)
[22] Wang YJ, Mao QZ, Liu WW,Mar T T, Wei T Y, Liu Y, Wang X F. Localization and distribution ofin its vector leafhopper,., 2014, 104(8): 897-904.
[23] Jia J, Zhao S, Kong X Y, Li Y R, Zhao G Y, He W M, Appels R, Pfeifer M, Tao Y, Zhang X Y,.draft genome sequence reveals a gene repertoire for wheat adaptation., 2013, 496(7443): 91-95.
[24] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2− ΔΔCTmethod., 2001, 25(4): 402-408.
[25] Jameson P E, Clarke S F. Hormone-virus interactions in plants., 2002, 21(3): 205-228.
[26] 黄炎霞. 赤霉素调控的南方水稻黑条矮缩病的发病[D]. 福州: 福建农林大学, 2014.
Huang Y X. Southern black rice dwarf disease development through regulation ofgibberellin[D]. Fuzhou: Fujian Agriculture and Forestry University, 2014. (in Chinese)
[27] Hayashi K I, KawaideH, NotomiM, SakigiY, MatsuoA, NOZAKI H. Identification and functional analysis of bifunctional-kaurene synthase from the moss., 2006, 580(26): 6175-6181.
(责任编辑 岳梅)
Correlational Analyses Between Dwarfing of Plant Height Induced by(WDV) Infection and Gibberellin Metabolism
WU HuiJuan, LIU Yan, WANG XiFeng
(State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193)
【Objective】In recent years, wheat dwarf virus disease transmitted by leafhopper () is becoming one of the severe virus disease on triticeae crops in the northwest of China. Infected plants may be severely dwarfed and reduced effective tillering so that it causes serious production loss. The objectives of this study are to clear the correlation between dwarfing of plant height induced by(WDV) infection and gibberellin metabolism and provide a solid basis for the control of the disease.【Method】The cultivar Yangmai 12was used as experimental material. Leafhoppers were fed on viruliferous wheat containing WDV and then transferred to healthy seedling atsingle-leaf stage (3heads/plant).The leaves were collected as samplesat different time pointsaccording to experimental requirementsand the seedlings treated with non-viruliferous leafhoppersas control.To guarantee the accuracy of the experiment, all the infectedsamples were validated by PCR. The plant GA3ELISA Kit was used to assay the GA3 contentsof both healthy and WDV-infected wheat leavesat 21 days post-infection (dpi). Viruliferous treatments were divided into two parallel groups, one was treated with spraying of exogenous GA3 at 50 mg·L-1and the other treated with water at 7dpi. The spraying of GA3solutionwas carried out 4 times every 7 days. Meanwhile, the control group consisted of similar size seedlingswere treated with non-viruliferous leafhoppers. The phenotype was analyzed by statistical analysis of the plant heightsafter application of exogenous GA3 at 50 mg·L-1.According to the coding sequence of-kaurene synthase-like 3(offor reference, the complete coding sequence ofof Yangmai 12 was cloned with the primer pair (KSL3-F: 5′-ATGATGGTGAATCCGCCGC-3′, KSL3-R: 5′-TTAATGGTTGATCTTTGTTT-3′) and its structure was analyzedwith BLAST. The total RNA of infected plants at 7, 14 and 21 dpi were prepared and reversed transcription into cDNA. The primers were designed following the obtained sequence of(TaKSL3-F: 5′-GAGACATGTGCCATGGCGTTC-3′, TaKSL3-R: 5′-CGTGTCACTC AGATCGGTGGAG-3′). Withasthereferencegene, RT-qPCR was used to analyze the expression level of gene related to GA metabolism pathway.【Result】The GA3 content of infected plants was reduced by 28.9% at 21 dpi by indirect ELISA and the height of infected plants increased by 35.9% owing to application of exogenous GA3 at 50 mg·L-1compared with control. Using homology-based cloning, the complete coding sequence of Yangmai 12was obtained, which is the key enzyme in gibberellinsynthesis pathway. Thesequenceofhas the length of 1 827 bp, encoding 608 amino acids. By BLASTanalysis, its DNA sequence was found to have a similarity of 85.2% compared withof.Particularly, by qRT-PCR analysis, the expression level ofcompared to healthy plants significantly decreased to 35.7% at 14 dpi and 9.6% at 21dpi, respectively.【Conclusion】It was concluded that WDV could interfere the biosynthesis of GA leading to the decreased content of GA, which was responsible for thedevelopmentof dwarf symptom that can be relieved by exogenous GA.This study will provide a solid basis for further research on pathogenesis of WDV and controlof the disease.
(WDV); dwarfing; gibberellin;-kaurene synthase; pathogenesis
2017-03-06;接受日期:2017-04-24
国家公益性行业(农业)科研专项(201303021)、政府间科技创新合作项目(2016YFE0131000)
吴慧娟,E-mail:wuhuijuan12345@163.com。通信作者刘艳,E-mail:yliu@ippcaas.cn

