Cyclin D1 siRNA转染人肝癌细胞的增殖、凋亡变化及其机制
张弘英,胡利琳,元文峰,丁浩
(1南昌大学第二附属医院,南昌330006;2南昌大学医学院;3江西省乐安县人民医院344300)
Cyclin D1 siRNA转染人肝癌细胞的增殖、凋亡变化及其机制
张弘英1,胡利琳2,元文峰3,丁浩1
(1南昌大学第二附属医院,南昌330006;2南昌大学医学院;3江西省乐安县人民医院344300)
目的观察Cyclin D1 siRNA转染的人肝癌细胞增殖、凋亡变化,并探讨其机制。方法培养人肝癌细胞株Hep3B,将细胞分为空白对照组、阴性对照组和实验组。阴性对照组和实验组分别通过脂质体转染NC siRNA和Cyclin D1 siRNA,转染48 h后收获细胞。采用MTT法检测细胞增殖能力;流式细胞仪观察凋亡细胞并计算细胞凋亡率;免疫组化法检测各组细胞中的Caspase-3蛋白;采用RT-PCR法检测各组细胞中的乙型肝炎病毒x蛋白(HBx)、着色性干皮病基因蛋白D(XPD)、Bcl-2、Bax mRNA;Western blotting法检测各组细胞中的HBx、XPD、Bcl-2、Bax蛋白。结果与空白对照组和阴性对照组相比,实验组细胞增殖能力减弱、凋亡率升高、Caspase-3相对表达量增高(P均<0.01)。与空白对照组和阴性对照组相比,实验组HBx、Bcl-2 mRNA及蛋白表达下调,XPD、Bax mRNA及蛋白表达上调(P均<0.01)。结论Cyclin D1 siRNA转染的人肝癌细胞增殖受到抑制、凋亡增多,其机制可能与HBx、Bcl-2表达下调及XPD、Bax表达上调有关。
细胞周期蛋白D1;肝细胞癌;细胞增殖;细胞凋亡;人剪切修复基因
Abstract:ObjectiveTo observe the changes of proliferation and apoptosis of human hepatocellular cells transfected with Cyclin D1 siRNA, and to explore the mechanism.MethodsThe cultured human hepatoma cell line Hep3B was divided into the blank control group, negative control group, and experimental group. The negative control group and the experimental group were transfected with NC siRNA and Cyclin D1 siRNA by liposomes, and the cells were harvested after 48 h. MTT was used to detect cell proliferation; the flow cytometry was used to observe apoptotic cells and we calculated apoptosis rate; the Caspase-3 protein in cells of each group was detected by immunohistochemistry; the mRNA and protein expression levels of hepatitis B virus x protein (HBx), xeroderma pigmentosum D (XPD), Bcl-2, and Bax in cells of each group were detected by RT-PCR and Western blotting, respectively.ResultsCompared with the blank control group and the negative control group, the cell proliferation ability of the experimental group decreased, the apoptosis rate increased, and the relative expression of Caspase-3 increased (allP<0.01). Compared with the blank control group and the negative control group, the mRNA and protein expression levels of HBx and Bcl-2 in the experimental group were down-regulated, while those of XPD and Bax were up-regulated (allP<0.01).ConclusionThe proliferation of human hepatoma cells transfected with Cyclin D1 siRNA is inhibited and the apoptosis increases, and the mechanism may be related to the down-regulation of HBx and Bcl-2 expression, and up-regulation of XPD and Bax expression.
Keywords: Cyclin D1; hepatocellular carcinoma; cell proliferation; apoptosis; human shear repair genes
肝细胞癌(HCC)是全世界最普遍的恶性肿瘤之一,其发病率和病死率均较高[1]。HCC的发生发展是十分复杂的过程,不仅与抑癌基因失活和癌基因或癌相关基因激活有关,还涉及多种信号转导通路功能失调[2]。长期慢性乙型肝炎(乙肝)病毒(HBV)感染是导致HCC发病的重要原因之一,这一过程可能与乙肝病毒x蛋白(HBx)对肝细胞周期与凋亡的影响有关[3]。HBx蛋白可通过反式激活细胞启动子和增强子来增强病毒基因的表达和复制,这有助于病毒的持续性感染[4]。目前尚无效果显著的方法用于治疗HBV相关HCC。Cyclin D1是调控细胞周期G1期(DNA合成前期)的关键蛋白,现已证实Cyclin D1与包括肝癌在内的多种恶性肿瘤的发生发展有关[5]。本研究将靶向Cyclin D1基因的小干扰RNA(siRNA)转染人肝癌细胞株Hep3B细胞,观察Cyclin D1 siRNA转染的人肝癌细胞增殖、凋亡变化,并探讨其机制。
1 材料与方法
1.1 主要实验材料 人肝癌细胞Hep3B由本实验室保存。MEM培养基和胎牛血清购自Gibco公司。阴性对照siRNA(NC siRNA)和Cyclin D1 siRNA均由上海吉凯公司合成,在前期实验中已证实Cyclin D1 siRNA序列(5′-UUCUCCGAACGUGUCACGUTT-3′)具有沉默效果。NC siRNA序列为5′-ACAAACAGATCATCCGCAA-3′,Cyclin D1 siRNA序列为5′-UUCUCCGAACGUGUCACGUTT-3′。MTT试剂购自Solarbio公司。Annexin V-FITC细胞凋亡检测试剂盒购自杭州联科生物公司。TRIzol及脂质体LipofectamineTM2 000均购自Invitrogen公司。Caspase-3 一抗购自Abcam公司。逆转录试剂盒购自Fermentas公司。2×浓缩PCR扩增预混液购自天根生物技术有限公司。所用引物由Generay Biotech公司合成。总蛋白提取试剂盒购自北京普利莱基因技术有限公司。Cyclin D1、HBx、Bcl-2、XPD、Bax、β-actin的一抗购自Santa Cruz公司。作为二抗的HRP-Goat anti Mouse IgG购自北京中杉金桥公司。
1.2 细胞培养及Cyclin D1 siRNA转染 用含双抗(100 μg/mL的链霉素和100 U/mL的青霉素)、10%胎牛血清的MEM培养基培养Hep3B细胞,然后将装有Hep3B细胞的培养瓶置于5% CO2、37 ℃恒温孵箱内培养。往6孔板内平铺细胞,控制细胞密度为1×106/孔,24 h后在显微镜下观察到Hep3B细胞融合率约为90%。将Hep3B细胞分为空白对照组、阴性对照组和实验组。阴性对照组和实验组分别通过脂质体转染NC siRNA和Cyclin D1 siRNA。实验每组重复6次。siRNA浓度为100 nmol/L,脂质体每孔5 μL。转染48 h后收获细胞。经RT-PCR法测得空白对照组、阴性对照组和实验组Cyclin D1 mRNA相对表达量分别为3.53±0.99、3.64±1.37、0.99±0.62,经Western blotting法测得三组Cyclin D1蛋白相对表达量分别为1.56±0.29、1.62±0.49、0.18±0.12,实验组Cyclin D1 mRNA及蛋白相对表达量均低于空白对照组和阴性对照组(P均<0.05),说明Cyclin D1 siRNA转染成功,实验组Cyclin D1表达下调。
1.3 细胞增殖能力检测 将人肝癌Hep3B细胞种植于96孔板内,留出空白凋零孔,不添加细胞。每孔内均加入15 mg/mL的MTT溶液20 μL,孵育4 h后弃去上清,再分别往每孔内加入二甲基亚枫(DMSO)150 μL,振荡10 min。放入酶联免疫监测仪(Labststems,芬兰),波长设置为492 nm,测定96孔板内各孔的光密度值(OD值),以此反映细胞增殖能力。
1.4 细胞凋亡率测算 用胰酶消化并收集空白对照组、阴性对照组及实验组细胞。PBS溶液分别洗涤细胞2次,用Binding Buffer缓冲液(含Ca2+的缓冲液)500 μL进行悬浮。分别往各组细胞中加入PI、Annexin V-FITC染色体荧光各5 μL。流式细胞仪观察凋亡细胞,计算细胞凋亡率。
1.5 各组细胞中Caspase-3蛋白检测 采用免疫组化法。先将收获的细胞固定,石蜡包埋,切片,脱蜡。用3%的过氧化氢阻断内源性过氧化物酶,然后用Caspase-3的一抗(工作浓度为1∶100)孵育,再用相应的二抗孵育。切片先后用二氨基联苯胺、苏木精染色,显微镜下观察,Caspase-3阳性为细胞呈棕黄色或棕褐色染色。根据染色强度和阳性细胞百分比判定结果[6]:黑褐色或棕褐色计3分,棕黄色或深黄色计2分,淡黄色计1分,无明显着色计0分;阳性细胞百分比>75%计4分,>50%~75%计3分,>25%~50%计2分,>5%~25%计1分,0~5%计0分;上述两项得分相乘,1~12为Caspase-3蛋白表达阳性。
1.6 各组细胞中HBx、XPD、Bcl-2、Bax mRNA及蛋白检测
1.6.1 HBx、XPD、Bcl-2、Bax mRNA检测 采用RT-PCR法。HBx基因上游引物序列为5′-CACTTCGCCTCACCTCTG-3′,下游引物序列为5′-TCGGTCGTTGACATTGCT-3′,产物长度112 bp;Bcl-2基因上游引物序列为5′-AAGCCGGCGACGACTTCT-3′,下游引物序列为5′-GGTGCCGGTTCAGGTACTCA-3′,产物长度258 bp;XPD基因上游引物序列为5′-TCTGCCTCTGCCCTATGAT-3′,下游引物序列为5′-GGTGCCGGTTCAGGTACTCA-3′,产物长度363 bp;Bax基因上游引物序列为5′-GGATGCGTCCACCAAGAA-3′,下游引物序列为5′-GCACTCCCGCCACAAAGA-3′,产物长度386 bp;内参β-actin基因上游引物序列为5′-CGGGAAATCGTGCGTGAC-3′,下游引物序列为5′-TGGAAGGTGGACAGCGAGG-3′,产物长度434 bp。PCR反应体系:上下游引物各1 μL,cDNA 500 ng,2×浓缩的PCR扩增预混液12.5 μL,然后在反应体系内添加去离子水至体系最终体积为25 μL。PCR反应扩增条件:预变性94 ℃ 5 min,1个循环;DNA变性94 ℃ 40 s、引物退火55 ℃ 40 s、DNA聚合酶延伸72 ℃ 55 s,35个循环;最终延伸72 ℃ 7 min,1个循环。PCR反应结束后,取PCR产物5 μL进行琼脂糖凝胶电泳,后置于凝胶成像仪下观察并拍照。用Bland Leader3.00凝胶电泳图像分析软件分析结果,以目的基因/β-actin比值代表目的基因相对表达量。
1.6.2 HBx、XPD、Bcl-2、Bax蛋白检测 用RIPA裂解液提取细胞总蛋白,BCA试剂盒测定蛋白浓度,然后取蛋白20 μg进行SDS-聚丙烯酰胺凝胶电泳。将凝胶上分离到的蛋白条带通过转移电泳方式转至硝酸纤维素膜上,3% BSA封闭膜,放于4 ℃环境过夜,然后分别用非标记一抗(工作浓度1∶200)及辣根过氧化物酶标记的二抗进行孵育。使用DAB显色试剂显色1~30 min后照相。采用Quantity One4.62分析结果。以目的基因/β-actin比值表示目的蛋白相对表达量。
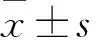
2 结果
2.1 各组细胞增殖能力、凋亡率及Caspase-3蛋白表达比较 与空白对照组和阴性对照组相比,实验组细胞增殖能力减弱、凋亡率升高、Caspase-3相对表达量增高(P均<0.01)。详见表1。
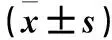
表1 各组细胞增殖能力、细胞凋亡率及Caspase-3蛋白相对表达量
注:与实验组相比,*P<0.01。
2.2 各组细胞中HBx、XPD、Bcl-2、Bax mRNA及蛋白表达比较 与空白对照组和阴性对照组相比,实验组HBx、Bcl-2 mRNA及蛋白表达下调,XPD、Bax mRNA及蛋白表达上调(P均<0.05)。详见表2。
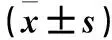
表2 各组HBx、XPD、Bcl-2、Bax基的mRNA和蛋白表达比较
注:与实验组相比,*P<0.01,#P<0.05。
3 讨论
HCC是最常见的恶性肿瘤之一。我国乙肝的高发,使肝癌患者占全世界较大比例[7]。HBx具有多种生物学功能,能够影响宿主细胞基因表达,从而调节宿主细胞的增殖与分化、影响细胞的信号转导通路等。HBV相关HCC的发生可能与HBx对肝细胞分裂周期与凋亡的影响有关[8]。HBV相关HCC目前尚无特效治疗手段。基因治疗具有独特优势,可能是HBV相关HCC治疗的新方向。
生物体正常的生存、繁殖与细胞周期的准确调控具有密不可分的关系。细胞周期蛋白对细胞周期的各时相均起调控作用,其中参与细胞周期调控的主要因子是Cyclin。细胞周期中G1期的启动是细胞周期的关键,而调控G1期的关键蛋白之一是Cyclin D1。Cyclin D1含295个氨基酸,由染色体11q13上的基因编码[9]。动物模型和细胞实验均表明,Cyclin D1蛋白过度表达可使细胞G1期缩短,对分裂原的依赖性减弱[10]。正常细胞周期中,Cyclin D1仅在G期呈低水平或恒定表达,而在肿瘤细胞中Cyclin D1呈过度表达,可缩短G1期,导致肿瘤细胞过度增殖。现已证实许多恶性肿瘤的发生发展与Cyclin D1过度表达有关[11]。肝癌的发病同样与G/S期检测点缺陷有关[12]。且Cyclin D1高表达的肝癌患者预后不良,而Cyclin D1下调能促进肝癌细胞株Huh7细胞凋亡,使其停滞在G1期[13]。
本研究将靶向Cyclin D1基因的siRNA转染人肝癌细胞株Hep3B构建Cyclin D1表达下调的肝癌细胞模型,观察Cyclin D1表达下调对人肝癌细胞增殖、凋亡的影响。本研究结果显示,与空白对照组和阴性对照组相比,实验组细胞增殖能力减弱、凋亡率升高、Caspase-3相对表达量增高。Caspase-3是细胞凋亡过程中最主要的终末剪切酶,其活性增强意味着凋亡被诱导[14]。由此可见,Cyclin D1基因表达下调能抑制肝癌细胞的增殖并促进其凋亡。
HBx能整合进入宿主肝细胞的DNA内,从而影响肝细胞的DNA转录和蛋白翻译,继而影响肝细胞的增殖与分化,影响细胞内信号转导通路功能等,是HBV致肝癌的重要因素之一[15, 16]。Hep3B细胞是能表达HBx的人肝癌细胞株。本研究发现,Cyclin D1基因表达下调能抑制HBx的表达,提示下调Cyclin D1基因表达也许能降低感染HBV肝细胞恶变的可能性。XPD是转录因子ⅡH组成成分之一。许多研究发现XPD参与核苷酸的损伤修复过程,并影响癌基因和抑癌基因的表达,与肿瘤的发生密切相关[17,18]。本课题组前期研究[19]也证实,XPD基因可促进肝癌细胞凋亡并抑制肝癌细胞的生长。Bcl-2、Bax同属Bcl-2基因家族,而前者是原癌基因,后者是抑癌基因。Bax/Bcl-2可调节细胞增殖与凋亡之间的平衡[20],Bcl-2/Bax比值越大,说明肿瘤细胞的增殖能力越强、凋亡越少。本研究结果显示,Cyclin D1基因表达下调能抑制肝癌细胞中原癌基因Bcl-2表达,能上调抑癌基因XPD、Bax的表达。这些结果进一步提示,Cyclin D1基因表达下调对肝癌细胞的增殖抑制、促凋亡作用可能与HBx、Bcl-2表达下调和XPD、Bax表达上调有关。
[1] 丁婕妤,王璇,翁苓苓,等.天冬多糖对低氧条件下人肝癌细胞生长、侵袭及迁移的影响[J].山东医药,2017,57(14):23-26.
[2] Xu W, Yu J, Wong VW. Mechanism and prediction of HCC development in HBV infection[J]. Best Pract Res Clin Gastroenterol, 2017,31(3):291-298.
[3] Yang SL, Ren QG, Zhang T, et al. Hepatitis B virus X protein and hypoxia inducible factor-1α stimulate Notch gene expression in liver cancer cells[J]. Oncol Rep, 2017,37(1):348-356.
[4] He Z, Yu Y, Nong Y, et al. Hepatitis B virus X protein promotes hepatocellular carcinoma invasion and metastasis via upregulating thioredoxin interacting protein[J]. Oncol Lett, 2017,14(2):1323-1332.
[5] Li Z, Qu L, Luo W,et al. Mig-6 is down-regulated in HCC and inhibits the proliferation of HCC cells via the P-ERK/Cyclin D1 pathway[J].Exp Mol Pathol, 2017,102(3):492-499.
[6] Zhang HL, Zhang H. Withaferin-A Induces Apoptosis in Osteosarcoma U2OS Cell Line via Generation of ROS and Disruption of Mitochondrial Membrane Potential[J]. Pharmacogn Mag, 2017,13(51):523-527.
[7] 袁媛,陈骥,王亚莉.HBeAg阴性慢性乙肝合并肝硬化患者血清HBV-DNA水平与肝功能的关系[J].山东医药,2017,57(1):81-83.
[8] Kong F, Hu W, Zhou K, et al. Hepatitis B virus X protein promotes interleukin-7 receptor expression via NF-κB and Notch1 pathway to facilitate proliferation and migration of hepatitis B virus-related hepatoma cells[J]. J Exp Clin Cancer Res, 2016,35(1):172.
[9] Ren K, Li Y, Lu H, et al. miR-3940-5p Functions as a Tumor Suppressor in Non-Small Cell Lung Cancer Cells by TargetingCyclin D1 and Ubiquitin Specific Peptidase-28[J]. Transl Oncol, 2016,10(1):80-89.
[10] Wang WJ,Zhao YM,Yang J,et al.Cyclin D1 polymorphism and oral cancer: a meta-analysis[J]. Mol Biol Rep,2013, 40(1):87-95.
[11] Ferreira-Silva GA, Ortega MM, Banionis MA,et al. A novel ruthenium complex that effectively inhibits ERK activation and cyclin D1 expression in A549 cells[J].Toxicol In Vitro,2017,10(44):382-391.
[12] Steven BH, Curt W. Topology and Control of the Cell-Cycle-Regulated Transcriptional Circuitry[J]. Genetics, 2014,196(1):65-90.
[13] Zhang J, Qin L, Han L, et al. Role of MicroRNA-93 I in Pathogenesis of Left Ventricular Remodeling via Targeting Cyclin-D1[J]. Med Sci Monit, 2017,17(23):3981-3988.
[14] 张立成,周毅.结直肠腺癌组织中EZH2、Caspase-3蛋白的表达变化及意义[J].山东医药,2017,57(25):48-50.
[15] Yin D, Wang Y, Sai W, et al. HBx-induced miR-21 suppresses cell apoptosis in hepatocellular carcinoma by targeting interleukin-12[J]. Oncol Rep, 2016,36(4):2305-2312.
[16] 姚雪兵,杨林,朱建芸,等.野生型及羧基端缺失突变HBx对肝癌细胞增殖的影响[J].广东医学,2015,36(24):3742-3745.
[17] Ravegnini G, Nannini M, Simeon V, et al. Polymorphisms in DNA repair genes in gastrointestinal stromal tumours: susceptibility and correlation with tumour characteristics and clinical outcome[J]. Tumour Biol, 2016,37(10):13413-13423.
[18] Wang XC, Wang F, Quan QQ. Roles of XRCC1/XPD/ERCC1 Polymorphisms in Predicting Prognosis of Hepatocellular Carcinoma in Patients Receiving Transcatheter Arterial Chemoembolization[J]. Genet Test Mol Biomarkers, 2016,20(4):176-184.
[19] 丁浩,张吉翔.人着色性干皮病基因D对HepG2细胞Mdm2和Mdm4表达的影响[J].中国病理生理杂志,2014,30(1):48-52.
[20] Zhang S, Qin F, Yang L, et al. Nucleophosmin Mutations Induce Chemosensitivity in THP-1 Leukemia Cells by Suppressing NF-κB Activity and Regulating Bax/Bcl-2 Expression[J]. J Cancer, 2016,7(15):2270-2279.
Changes in proliferation and apoptosis of human hepatocellular carcinoma cells transfected with Cyclin D1 siRNA
ZHANGHongying1,HULilin,YUANWenfeng,DINGHao
(1TheSecondAffiliatedHospitalofNanchangUniversity,Nanchang330006,China)
10.3969/j.issn.1002-266X.2017.35.007
R735.7
A
1002-266X(2017)35-0022-04
2017-06-14)
国家自然科学基金资助项目(81300348);江西省自然科学基金资助项目(20151BAB205100)。
张弘英(1963-),女,副主任医师,主要从事肝病的研究。E-mail:ladh_2000@163.com
丁浩(1981-),男,博士学历,副主任医师,主要从事肝病的研究。E-mail: efydinghao@163.com

