二甲双胍研究进展及其在结核病治疗中的应用前景
刘浩然 李传友 王伟 高孟秋
·综述·
二甲双胍研究进展及其在结核病治疗中的应用前景
刘浩然 李传友 王伟 高孟秋
结核病的患病率和死亡率仍居高不下,亟需新的治疗方法和策略。二甲双胍(MET)作为2型糖尿病(D2M)的一线治疗药物,在其他多种疾病中也发挥着一定的作用。作者简述了MET的研究历史和进展,介绍了MET在抗结核药物治疗中的潜在作用和机制。MET可以通过激活腺嘌呤核糖核苷酸(AMP)依赖的蛋白激酶(AMPK)通路、促进活性氧(ROS)的产生、抑制细菌氧化呼吸链复合体等多种途径加强宿主对抗结核分枝杆菌的能力。MET还具有一定的抗炎作用,在结核病的治疗过程中起到积极作用。MET还可以促进被感染细胞的自噬作用,以及加强常规抗结核药物的疗效。
二甲双胍; 结核; 治疗应用; 综述
结核病是严重危害人类健康的主要传染病,是全球共同关注的严峻问题。现已知在全球范围内,约有5%的结核病为耐多药结核病(MDR-TB)[1]。当今抗结核药物治疗主要为多种药物联合的化疗方案,疗程较长,一般为6~9个月。虽然现在的传统治疗方案对于药物敏感的MTB引起的病变治疗是有效的,但是由于不合规范的治疗和用药情况,以及各种多耐药菌株的出现,使结核病的治疗再一次成为难题。这就更加迫切地要求我们研究和了解更多新的MTB耐药的机制,以及开发新的替代策略来解决这些问题。显然发现新的治疗药物和治疗方案已迫在眉睫[1]。
二甲双胍(metformin,MET)是治疗2型糖尿病的一线用药。笔者主要介绍MET的研究进展,以及MET在结核病治疗中所具有的应用前景。
MET的研究进展
一、MET的发现及其降糖作用
MET结构为1,1-二甲基双胍,是一种亲水性药物,通常以质子化的形式存在。在美国糖尿病协会(American Diabetes Association,ADA)和欧洲糖尿病研究学会(European Association for the Study of Diabetes,EASD)的相关指南中,都推荐MET作为治疗糖尿病的口服一线用药[2-3]。1957年,Jean研究了MET的降糖作用,并发表文章将MET命名为格华止[4]。MET的耐受性很好,是很安全并且价格低廉的有效药物,临床应用时患者发生乳酸酸中毒严重不良事件非常罕见。同时与胰岛素相比,MET很少引起低血糖,这是因为其降糖作用主要是通过提高现有胰岛素的敏感性和减少肝脏的葡萄糖产生而发挥作用的[5],可见其安全性是可靠的[6]。因此,MET凭借其稳定的降糖作用,十分少见的不良反应及良好的安全性,被广泛应用于糖尿病患者的治疗。
作为控制2型糖尿病的一线降糖药物,MET是胰岛素增敏剂,并且是线粒体氧化呼吸链复合物-1的特异性抑制剂,主要通过减少肝脏的葡萄糖产生[7],抑制肝脏糖异生作用[8-9],增加骨骼肌对葡萄糖的利用来发挥降糖作用。MET还可以通过激活腺嘌呤核糖核苷酸(AMP)依赖的蛋白激酶(AMP-activated protein kinase, AMPK)通路,减少肝脏的葡萄糖输出,改善血糖水平。近年来还有越来越多的降糖机制被发现,比如MET还可以通过抑制胰高血糖素信号而减少葡萄糖的增加,抑制蛋白激酶A(protein kinase A, PKA)激活所介导的生糖作用,抑制肝细胞线粒体的磷酸甘油脱氢酶进而抑制糖异生作用,等等[10]。
二、MET在其他疾病治疗中的研究进展
近些年的许多研究表明,MET除了在糖尿病中有可靠的治疗作用外,在许多其他疾病中也起到了一定的积极治疗作用。
MET在治疗多囊卵巢综合征中可以有效地控制多毛、胰岛素抵抗和各种代谢异常;MET还被应用于治疗妊娠期糖尿病而未发现对胎儿有不良影响;MET还可以减少微血管并发症的风险,并降低心血管疾病及其并发症的死亡率,等等[4, 11-13]。MET还被应用于多种肿瘤性疾病的辅助治疗,如MET可以通过降低雌激素和雄激素在循环中的水平而影响乳腺癌的生长[14];对并发结肠、直肠癌的糖尿病患者,MET治疗后可以提高患者的总生存率,降低死亡风险[15-16];Preston等[17]指出,增加MET的使用疗程和强度可以减少前列腺癌的发病率等。这些都提示,MET在多种疾病中具有较好的应用价值,但其具体机制仍有待研究。
MET在抗结核病中的应用前景
一、 MET可加强宿主的抗菌(MTB)作用
(一) AMPK通路
AMPK是一种进化保守的丝氨酸/苏氨酸蛋白激酶,它是生物能量代谢调节的关键分子。当体内的AMP/ATP比例升高时,AMPK将被激活,因此它被视为一种能量检测计,具有检测机体和细胞能量状态的功能。在机体处于低氧、缺血、营养缺乏等不良状态时,AMPK对保护细胞的正常功能起到了至关重要的作用。它的激活使细胞由合成代谢转向分解代谢,进而使能量状态恢复平衡[18]。 AMPK的激活与MET的多种作用密切相关。
Singhal等[19]研究发现,用MET在体外处理感染了MTB标准株H37Rv的人单核巨噬细胞,通过观察MTB的生存情况,发现在24 h内比较明显地抑制了MTB的生长,24 h以后则无明显变化。而当敲除AMPK相关基因或用化学方法抑制AMPK以后,再应用MET去处理感染MTB的细胞时,发现MET对MTB的生长失去了抑制作用。可见MET的抑菌作用依赖于AMPK的活性,因此研究也提出MET可以诱导促进AMPK的磷酸化。但是并没有观察到MET可以直接抑制MTB的生长。
此外,还有研究指出:MET并不能直接激活AMPK,它对AMPK的上游激酶丝氨酸/苏氨酸激酶-11 (liver kinase B1, LKB1)也没有直接的影响作用[20]。但是可以确定的是,MET的应用确实在一定程度上抑制了MTB的生长,而AMPK是一条可能的通路。
(二)MET促进活性氧(reactive oxygen species,ROS)的产生
ROS是机体对抗细菌的有效杀伤武器,其中又分为线粒体活性氧(mitochondrial ROS,mROS)和细胞内活性氧(cytoplasmic ROS,cROS)。mROS可以使线粒体膜溶解,细胞色素C释放入胞质中,启动内源性凋亡途径[21]。在体外实验中,在用MET处理感染了MTB的人类单核巨噬细胞THP-1时发现,在MET的作用下,4 h内促进了mROS的产生;而在这一时间内,cROS并没有明显变化。实验中发现,MET促进mROS的产生具有剂量依赖性和时间依赖性,在应用mROS清除剂N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)和谷胱甘肽(glutathione,GSH)后,发现MET失去了促进mROS产生的作用,并且被抑制的MTB的生长也有所恢复,提示MET促进mROS的产生可能是关键的抑菌机制[19]。并推测可能是MET抑制了线粒体氧化呼吸链复合体-1的活性[22-23]。
(三)MET抑制细菌氧化呼吸链复合体
相关研究指出,在MTB“对抗”现有的一线治疗药物时,可能通过改变其代谢通路的方式;如已发现的MTB的细菌呼吸链复合体(NDH-I)合成途径可能成为替代其烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)从头合成途径的一种方式,进而产生新的耐药表型,从而产生持久的耐药性。这种改变表型的途径也就为对抗MTB感染的耐药情况提供了一种新的解决策略[1]。
NDH-I与线粒体呼吸链复合体-1在结构与功能上都十分类似[24-25],而MET为线粒体氧化呼吸链复合物-1的抑制剂,可以有效地抑制线粒体复合体-1[23]。研究表明, NDH-I同样可以被线粒体氧化呼吸复合物-1的抑制剂所抑制。另外的相关研究确定,MET为癌细胞线粒体复合物-1的抑制剂,研究还提示了MET在降低肿瘤发生中的作用[23]。这也提示了MET作用于MTB呼吸链复合体的可能性。
(四)MET可加强常规一线抗结核药物的抑菌作用
MET可以加强一线抗结核药物的疗效。在小鼠结核病感染模型中发现,应用MET和异烟肼联合治疗时的抗结核效果要优于单用异烟肼,即MET对异烟肼的杀菌有辅助作用[19]。
二、 MET的抗炎作用
宿主有效的免疫反应系统是抵抗MTB感染和潜伏感染的重要因素。MET正是调节宿主免疫反应的候选药物。有研究证实,MET可以减少免疫反应中有害的炎症反应(图1),并加强免疫细胞的活性[26]。
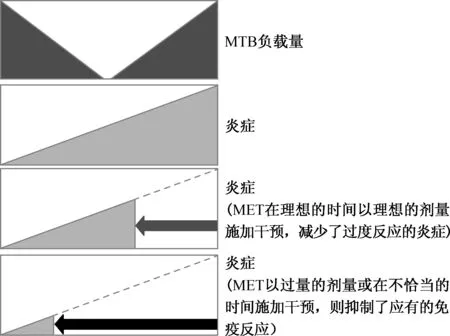
深色与浅色区域显示MTB的承载量和炎症反应的相关性。在初期MTB的负荷很大,炎症反应较弱,随着炎症反应的加强,MTB的负荷逐渐下降,超过平衡点后,炎症反应持续加强,而MTB的承载量发生反弹现象,即逐渐增加。短箭头表示在理想的时间以理想的剂量加入MET后,可以控制炎症反应在理想的范围内。长箭头表示如果在非最佳时期,或不理想的剂量等情况下,导致炎症反应被不恰当地抑制。深色区域:MTB负担;浅色区域:炎症水平[26]图1 MET的抗炎作用
MET的抗炎作用,主要是通过激活AMPK而介导的。AMPK是非常重要的能量感受器,当细胞内的腺嘌呤核苷三磷酸(ATP)降低时,它可以抑制糖酵解而促进氧化磷酸化[27]。这会导致需要葡萄糖供能(糖酵解)的炎性细胞的增殖受到抑制,而不需要葡萄糖供能(通过脂肪酸氧化供能)的非炎性细胞的增殖得到相对的促进。通过这一主要的途径,MET可以起到抗炎的作用。
有相关的研究指出,MET的应用可以提高宿主的免疫细胞水平。在动物实验中发现,感染MTB的小鼠接受MET的治疗后,其肺组织的CD4+和CD8+T淋巴细胞明显增加,未感染的小鼠在应用了3周MET后,同样提高了其肺组织中的CD8+T淋巴细胞水平。这些数据表明,不论感染MTB与否,MET均可以提高宿主肺组织中的免疫细胞水平[19]。该研究还发现,在被结核感染的宿主体内,炎症相关基因的表达是上调的。而在应用MET治疗的动物模型中,炎症相关基因却发生下调,如:白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、单核细胞趋化蛋白-1(MCP-1)等。干扰素信号也发生下调,这对于抗结核治疗是有利的[19]。
三、 MET影响细胞自噬
自噬是为了适应低能量或低营养状态等不利因素时,机体的自身细胞成分依赖溶酶体的一种自我消化过程,以此来维持必要的活性和生存能力[28-29]。多种应激状态可以激活AMPK进而促进自噬作用[30-33]。在缺乏葡萄糖的状态下,AMPK通过使Ser317和Ser777磷酸化直接激活自噬启动激酶ULK1,进而启动自噬[34]。而在营养充足等情况下,哺乳动物雷帕霉素靶蛋白(mTOR)会使ULK1 的Ser757磷酸化进而抑制其自噬作用[34-36]。这种相互协调的磷酸化过程是调节自噬的重要机制。
有研究指出,MET可以促进被感染细胞的自噬作用,即使用自噬抑制剂3-甲基腺嘌呤阻断细胞的自噬作用,仍没有阻断MET抑制细菌生长的作用。这提示MET可能通过激活AMPK的途径进而促进自噬作用,然而这一途径可能在抑制细菌生长方面并不起主要作用[19, 37],其具体机制还有待进一步研究与探讨。
四、 MET在无糖尿病的结核病患者中的作用
在流行病学调查中显示,患有糖尿病的人群比普通人群更容易患结核病[38]。而MET同样可以在无糖尿病的结核病患者中减少过度的炎症反应,并且加强对MTB的杀灭作用。MET可能通过以下几个方面来发挥抗结核的作用:(1)控制结核病患者的非糖尿病性-短暂性的高血糖状态,从而加强对MTB的控制;(2)调节免疫控制开关,抑制过度的有害性免疫炎症反应,起到抗炎作用;(3)增强细胞吞噬作用,加强吞噬溶酶体融合和细胞自噬,增强巨噬细胞的抗结核功能;(4)影响ROS的产生,改善抗结核作用及改善预后[26]。
展 望
MET作为治疗2型糖尿病的常规用药,安全性好,不良反应小,在其他疾病方面的应用价值正在逐渐被挖掘,其在结核病的治疗中也有着一定的应用前景。MET可以通过调节细胞的免疫状态、促进细胞自噬、调节机体炎症反应进而有效地抑制MTB的生长及减轻结核病引起的炎性损伤,并且与常规抗结核药物具有协同作用。这些也提示了在糖尿病并发肺结核的患者中,MET可以起到一定的辅助抗结核作用,有助于提高糖尿病并发结核病患者的管理水平[39]。最近也有临床研究指出,应用MET治疗组的失败和复发率低于未应用MET组,但差异无统计学意义[40];该研究指出仍需要扩大样本量,有继续进行深入研究的价值[40]。
根除结核病一直是全人类的梦想,新药研发和新型免疫治疗方法的开发是结核病治疗领域的重点方向,MET通过调节免疫发挥抗结核活性,这一点值得被关注。尤其是在糖尿病并发肺结核的患者中,MET的治疗可以起到两方面的积极作用,既有利于患者的糖尿病控制又有利于抗结核的治疗。然而,MET在抗结核治疗中的具体机制尚不完全清楚,尤其是在细胞自噬中的作用和影响仍有待进一步研究,为发现新的辅助疗法奠定基础。
[1] Vashisht R,Brahmachari SK. Metformin as a potential combination therapy with existing front-line antibiotics for tuberculosis. J Transl Med, 2015, 13(1): 83.
[2] Adler AI, Shaw EJ, Stokes T, et al. Newer agents for blood glucose control in type 2 diabetes: summary of NICE gui-dance. BMJ, 2009, 338: b1668.
[3] Nathan DM, Buse JB, Davidson MB, et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and the European Association for the study of diabetes. Diabetes Care, 2009, 32(1): 193-203.
[4] Tan MH, Alquraini H, Mizokami-Stout K, et al. Metformin: from research to clinical practice. Endocrinol Metab Clin North Am, 2016, 45(4): 819-843.
[5] Lalau JD. Lactic acidosis induced by metformin: incidence, management and prevention. Drug Saf, 2010, 33(9): 727-740.
[6] Eurich DT, Weir DL, Majumdar SR, et al. Comparative safety and effectiveness of metformin in patients with diabetes mellitus and heart failure: systematic review of observational stu-dies involving 34,000 patients. Circ Heart Fail, 2013, 6(3): 395-402.
[7] Cusi K, Consoli A, DeFronzo RA. Metabolic effects of metformin on glucose and lactate metabolism in noninsulin-depen-dent diabetes mellitus. J Clin Endocrinol Metab, 1996, 81(11): 4059-4067.
[8] Hundal RS, Krssak M, Dufour S, et al. Mechanism by which metformin reduces glucose production in type 2 diabetes. Diabetes, 2000, 49(12): 2063-2069.
[9] Natali A, Ferrannini E. Effects of metformin and thiazolidinediones on suppression of hepatic glucose production and stimulation of glucose uptake in type 2 diabetes: a systematic review. Diabetologia, 2006, 49(3): 434-441.
[10] Madiraju AK, Erion DM, Rahimi Y, et al. Metformin suppresses gluconeogenesis by inhibiting mitochondrial glycerophosphate dehydrogenase. Nature, 2014, 510(7506): 542-546.
[11] Viollet B, Guigas B, Sanz Garcia N, et al. Cellular and mole-cular mechanisms of metformin: an overview. Clin Sci, 2012, 122(6): 253-270.
[12] Selvin E, Bolen S, Yeh HC, et al. Cardiovascular outcomes in trials of oral diabetes medications: a systematic review. Arch Intern Med, 2008, 168(19): 2070-2080.
[13] Lamanna C, Monami M, Marchionni N, et al. Effect of metformin on cardiovascular events and mortality: a meta-analysis of randomized clinical trials. Diabetes Obes Metab, 2011, 13(3): 221-228.
[14] Campagnoli C, Berrino F, Venturelli E, et al. Metformin decreases circulating androgen and estrogen levels in nondiabetic women with breast cancer. Clin Breast Cancer, 2013, 13(6): 433-438.
[15] Garrett CR, Hassabo HM, Bhadkamkar NA, et al. Survival advantage observed with the use of metformin in patients with type 2 diabetes and colorectal cancer. Br J Cancer, 2012, 106(8): 1374-1378.
[16] Yin M, Zhou J, Gorak EJ, et al. Metformin is associated with survival benefit in cancer patients with concurrent type 2 diabetes: a systematic review and meta-analysis. Oncologist, 2013, 18(12): 1248-1255.
[17] Preston MA, Riis AH, Ehrenstein V, et al. Metformin use and prostate cancer risk. Eur Urol, 2014, 66(6): 1012-1020.
[18] Viollet B, Guigas B, Leclerc J, et al. AMP-activated protein kinase in the regulation of hepatic energy metabolism: from physiology to therapeutic perspectives. Acta Physiol (Oxf), 2009, 196(1): 81-98.
[19] Singhal A, Jie L, Kumar P, et al. Metformin as adjunct antituberculosis therapy. Sci Transl Med, 2014, 6(263): 263ra159.
[20] Hardie DG. Neither LKB1 nor AMPK are the direct targets of metformin. Gastroenterology, 2006, 131(3): 973-975.
[21] Marchi S, Giorgi C, Suski JM, et al. Mitochondria-ros crosstalk in the control of cell death and aging. J Signal Transduct, 2012, 2012: 329635.
[22] Owen MR, Doran E, Halestrap AP. Evidence that metformin exerts its anti-diabetic effects through inhibition of complex 1 of the mitochondrial respiratory chain. Biochem J, 2000, 348(3): 607-614.
[23] Wheaton WW, Weinberg SE, Hamanaka RB, et al. Metfor-min inhibits mitochondrial complex 1 of cancer cells to reduce tumorigenesis. Elife, 2014,3: e02242.
[24] Yagi T, Yano T, Bernardo SD, et al. Procaryotic complex 1 (NDH-1), an overview. Biochim Biophys Acta, 1998, 1364(2): 125-133.
[25] Cole ST, Brosch R, Parkhill J, et al. Deciphering the biology ofmycobacteriumtuberculosisfrom the complete genome sequence. Nature, 1998, 393(6685): 537-544.
[26] Restrepo BI. Metformin: candidate host-directed therapy for tuberculosis in diabetes and non-diabetes patients. Tuberculosis (Edinb), 2016, 101: S69-S72.
[27] Zhou G, Myers R, Li Y, et al. Role of AMP-activated protein kinase in mechanism of metformin action. J Clin Invest, 2001, 108(8): 1167-1174.
[28] He C, Klionsky DJ. Regulation mechanisms and signaling pathways of autophagy. Annu Rev Genet, 2009,43: 67-93.
[29] Wang RC, Levine B. Autophagy in cellular growth control. FEBS Lett, 2010, 584(7): 1417-1426.
[30] Vingtdeux V, Giliberto L, Zhao H, et al. AMP-activated protein kinase signaling activation by resveratrol modulates amyloid-beta peptide metabolism. J Biol Chem, 2010, 285(12): 9100-9113.
[31] Herrero-Martin G, Hoyer-Hansen M, Garcia-Garcia C, et al. TAK1 activates AMPK-dependent cytoprotective autophagy in TRAIL-treated epithelial cells. Embo J, 2009, 28(6): 677-685.
[32] Liang J, Shao SH, Xu ZX, et al. The energy sensing LKB1-AMPK pathway regulates p27(kip1) phosphorylation mediating the decision to enter autophagy or apoptosis. Nat Cell Biol, 2007, 9(2): 218-224.
[33] Meley D, Bauvy C, Houben-Weerts JH, et al. AMP-activated protein kinase and the regulation of autophagic proteolysis. J Biol Chem, 2006, 281(46): 34870-34879.
[34] Kim J, Kundu M, Viollet B, et al. AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1. Nat Cell Biol, 2011,13(2): 132-141.
[35] Sudarsanam S, Johnson DE. Functional consequences of mTOR inhibition. Curr Opin Drug Discov Devel, 2010,13(1): 31-40.
[36] Jung CH, Ro SH, Cao J, et al. mTOR regulation of auto-phagy. FEBS Lett, 2010,584(7): 1287-1295.
[37] Labuzek K, Liber S, Gabryel B, et al. Metformin increases phagocytosis and acidifies lysosomal/endosomal compartments in AMPK-dependent manner in rat primary microglia. Naunyn Schmiedebergs Arch Pharmacol, 2010,381(2): 171-186.
[38] Baker MA, Lin HH, Chang HY, et al. The risk of tuberculosis disease among persons with diabetes mellitus: a prospective cohort study. Clin Infect Dis, 2012,54(6): 818-825.
[39] 谭守勇.提高糖尿病并发结核病患者的治疗管理水平.中国防痨杂志,2017,39(2):109-110.
[40] 王淑霞,杜亚东,马艳,等. 二甲双胍对复治肺结核并发糖尿病患者的疗效初探.中国防痨杂志,2017,39(5):476-481.
(本文编辑:范永德)
Researchprogressofmetforminanditsapplicationprospectintreatmentoftuberculosis
LIUHao-ran,LIChuan-you,WANGWei,GAOMeng-qiu.
DepartmentofBacteriologyandImmunology,BeijingKeyLaboratoryforDrugResistanceTuberculosisResearch,BeijingChestHospital,CapitalMedicalUniversity,BeijingTuberculosisandThoracicTumorResearchInstitute,Beijing101149,China
Correspondingauthors:WANGWei,Email:wangwei010@aliyun.com;GAOMeng-qiu,Email:gaomqwdm@aliyun.com
The prevalence and mortality of tuberculosis (TB) are still high, and new treatment methods and strategies are urgently needed. Metformin (MET), as a first-line drug for treatment of type two diabetes mellitus (D2M), also plays the positive roles in treatment of other diseases. In this paper, the research history and progress of the MET development were reviewed, and its potential role and mechanism in anti-TB treatment were introduced. MET can activate the pathway of AMP-activated protein kinase (AMPK), promote the generation of reactive oxygen species(ROS) and inhibit the bacterial oxidation respiratory chain complex (NDH-I) to enhance the ability of the host againstMycobacteriumtuberculosis. MET also has some anti-inflammatory effects, and it plays a positive role in the treatment of TB. MET can also induce the autophagy of the infected cells and enhance the efficacy of the conventional anti-TB drugs.
Metformin; Tuberculosis; Therapeutic use; Review
10.3969/j.issn.1000-6621.2017.10.019
北京市医院管理局“登峰”计划(DFL20151501);北京市通州区科技计划(KJ2017CX076)
101149 首都医科大学附属北京胸科医院 北京市结核病胸部肿瘤研究所 耐药结核病研究北京市重点实验室细菌免疫室(刘浩然、李传友、王伟),结核科(高孟秋)
王伟,Email:wangwei010@aliyun.com;高孟秋,Email:gaomqwdm@aliyun.com
2017-04-27)

