不同免疫抑制剂及甲泼尼龙对小鼠肺间质纤维化的疗效对比
赵丽珂,穆冰瑶,周荣伟,程永静,黄慈波
(北京医院风湿免疫科 国家老年医学中心,北京 100730)
·基础研究·
不同免疫抑制剂及甲泼尼龙对小鼠肺间质纤维化的疗效对比
赵丽珂,穆冰瑶,周荣伟,程永静,黄慈波
(北京医院风湿免疫科 国家老年医学中心,北京 100730)
目的比较环磷酰胺、来氟米特和甲泼尼龙对博来霉素诱导的肺间质纤维化小鼠模型的疗效。方法将75只C57BL/6小鼠随机分成空白组、模型组、环磷酰胺组、来氟米特组及甲泼尼龙组(n=15)。空白组气管内注入0.9%氯化钠注射溶液0.2 mL,其余5组气管内注入博来霉素(5 mg/kg)建立肺纤维化模型,24 h后分别对空白组、模型组每日用0.2 mL 0.9%氯化钠注射溶液灌胃,药物组每日分别用环磷酰胺 (50 mg/kg)、来氟米特 (4 mg/kg)和甲泼尼龙灌胃(10 mg/kg)。并于造模后第7、14、28 天分批处死小鼠,取小鼠肺脏评估肺泡炎程度及纤维化的程度。结果(1)博来霉素诱导组小鼠体质量较对照组减轻(P<0.05),环磷酰胺、来氟米特组和甲泼尼龙组小鼠在第7、14、28天小鼠体质量较模型组均明显增加(P<0.05)。(2)与模型组相比,环磷酰胺组与甲泼尼龙组小鼠7天、14天时肺泡炎评分降低(P<0.05);第7天、14天、28天时纤维化评分明显降低(P<0.05)。而来氟米特组小鼠肺泡炎及纤维化评分较模型组差异无统计学意义。结论环磷酰胺和甲泼尼龙能显著降低博来霉素诱导的小鼠肺间质纤维化,减轻肺组织肺泡炎及肺纤维化程度,但来氟米特没有类似作用。
肺纤维化;免疫抑制剂;激素类;博来霉素;环磷酰胺;甲泼尼龙
间质性肺病 (ILD)指主要累及肺间质、肺泡和(或)细支气管的一组肺部弥漫性疾病[1]。目前发现部分肺间质纤维化常继发于结缔组织病(CTD)如类风湿关节炎、系统性硬化症、系统性红斑狼疮、多肌炎/皮肌炎等。有文献证实,15%的ILD是由CTD引起的[2],称之为结缔组织病相关的间质性肺疾病(CTD-ILD),它是CTD 呼吸系统并发症的重要临床表现之一,也是引起死亡的重要原因。CTD-ILD中无论非特异性间质性肺炎或寻常型间质性肺炎,其病理学特征早期均可见炎性细胞浸润,随之才是成纤维细胞增生和胶原沉积。间质纤维化一旦形成,将不可逆地导致严重的甚至威胁生命的呼吸循环功能障碍。目前,国内外对于肺纤维化的治疗效果并不理想,且存在各种争议;而动物模型可以帮助观察不同的药物对肺间质纤维化的治疗效果,目前,国际上应用最为广泛的是博来霉素诱导的肺纤维化动物模型[3]。本研究拟采用气管内滴注博来霉素的方法建立小鼠肺间质纤维化模型,探讨常用于结缔组织病药物环磷酰胺、来氟米特及激素对于博来霉素诱导的肺间质纤维化小鼠模型的疗效差异。
1 材料和方法
1.1 实验动物 清洁级C57BL/6,雄性小鼠,5周龄。购于北京维通利华公司,饲养于北京朝阳医院医学研究中心动物室。
1.2 药物与试剂 博来霉素A5(15 毫克/支,日本化药株式会社产);小鼠细胞因子/趋化因子磁珠检测试剂盒(购于上海升联医疗器械有限公司);Masson染色试剂盒(购自福州迈新生物技术开发有限公司)。
1.3 动物模型建立及给药 将75只C57BL/6小鼠用苦味酸进行编号标记,然后使用随机数字表法进行分组,随机分成空白组、模型组、环磷酰胺组、来氟米特组及甲泼尼龙组(每组15只)。小鼠在实验室饲养一周后,采用4%水合氯醛0.1mL腹腔注射麻醉,无菌条件下作气管切开,空白组气管内注入0.9%氯化钠注射溶液0.2 mL,其余5组所有小鼠(模型组和药物组)气管内一次性给予博来霉素0.2 mL(5 mg/kg)制作实验动物模型。
于造模后第2天起,空白组和模型组每日给予0.2 mL 0.9%氯化钠注射溶液灌胃,艾拉莫德组每日给予0.2 mL艾拉莫德灌胃(90 mg/kg),环磷酰胺组每周给予0.2 mL环磷酰胺灌胃(50 mg/kg),来氟米特组每日给予0.2 mL来氟米特灌胃(4 mg/kg),甲泼尼龙组每日给予甲泼尼龙0.2 mL(10 mg/kg)灌胃。期间每天观察小鼠体质量、食欲和活动等。
1.4 标本收集 五组小鼠分别于造模后第7、14、28天随机死5只小鼠(每次每组随机抽取5只小鼠),开胸取肺并称重,切取右肺叶置于10%的甲醛溶液中固定,然后进行HE染色及Masson染色,光学显微镜下观察肺组织病理结构变化。同时摘除小鼠眼球取血行细胞因子检测。
1.5 细胞因子检测 血清细胞因子检测步骤根据Mouse Luminex Screening Assay试剂盒说明书进行,方法为ELISA检测法。
1.6 结果判定标准 病理学评分根据Szapiel等[4]报道的方法确定肺泡炎和肺纤维化的程度,将肺泡炎和肺纤维化分级并计算积分进行分析。1级:1分,无肺泡炎;2级:2分,轻度肺泡炎和肺间质纤维化,单核细胞浸润使肺泡间隔增宽仅限于局部,面积不到全肺的20%,肺泡结构正常;3级:3分,中度肺泡炎和肺间质纤维化,面积占全肺的20%~50%;4级:4分,重度肺泡炎和肺间质纤维化,面积超过全肺的50%,偶见肺泡腔内有单核细胞及出血造成。
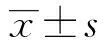
2 结果
2.1 一般情况及体质量 体质量资料列表,经整体分析(单因素方差分析),除0天外,其余时间点,五个组的整体差异有统计学意义(P<0.05)。两两比较并结合主要情况来看:空白组小鼠生长良好,除体质量自然增长外,其他无异常改变;博来霉素诱导的C57BL/6小鼠活动减少,饮食进水较前减少,部分小鼠可见皮毛暗淡无光泽,皮毛紊乱甚至伴有脱毛现象。与空白组对比,模型组、环磷酰胺组、来氟米特组和甲泼尼龙组在第7、14、28天小鼠体质量下降(P<0.05);与模型组对比,环磷酰胺组小鼠第7、14天重低于模型组小鼠体质量但差异无统计学意义,第28天体质量有所增加(P<0.05),甲泼尼龙组小鼠在第7、14、28天小鼠体质量均明显增加(P<0.05),来氟米特组与模型组相比体质量差异无统计学意义。见表1。
2.2 小鼠肺组织HE染色情况及肺泡炎评分
2.2.1 小鼠肺组织HE染色情况 各组小鼠肺组织HE染色显示(图1):(1)空白组:肺泡间隔和肺泡腔内未见炎性细胞浸润,肺泡间隔未见增厚,无新生血管形成。(2)模型组:第7天肺泡间隔和肺泡腔内有炎性细胞浸润,以单核巨噬细胞为主,成纤维细胞逐渐增多;第14天肺泡萎缩压扁、间隔增宽,肺泡上皮肿胀,炎性细胞浸润较明显,成纤维细胞明显增多并可见纤维组织增生,出现肺纤维化改变;第28天肺泡间隔炎性细胞减少,但肺泡结构破坏,纤维组织呈条索样瘢痕改变,肺间质纤维化形成。(3)来氟米特组在第7、14、28天病理变化同模型组变化基本相同;(4)环磷酰胺组及甲泼尼龙组第7、14天肺泡萎缩不明显,间隔略增宽,肺泡上皮略显肿胀,炎性细胞浸润减少,成纤维细胞较少;第28天部分肺泡结构破坏,局部肺间质有成纤维细胞聚集,形成轻中度肺间质纤维化。

表1 五组小鼠不同时间体质量变化比较
注: 两两比较为HSD-q检验;与对照组比较,aP<0.05;与模型组比较,bP<0.05;与环磷酰胺组比较,cP<0.05;与来氟米特组比较,dP<0.05
与空白组相比,博来霉素诱导组小鼠(模型组、 环磷酰胺组、来氟米特组及甲泼尼龙组)肺部肺泡炎症程度均增加。与模型组相比,来氟米特组小鼠肺部病变程度同模型组基本相似,但环磷酰胺组和甲泼尼龙组小鼠肺部病变较模型组有明显减轻。
2.2.2 小鼠肺组织肺泡炎评分 如表2所示,整体分析,差异有统计学意义(P<0.05)。两两比较并结合主要数据分析:使用博来霉素诱导的各组小鼠模型(模型组、 环磷酰胺组、来氟米特组及甲泼尼龙组)肺泡炎在7、14、28 d炎症评分均明显高于对照组(P<0.05)。环磷酰胺组与甲泼尼龙组7 d、14 d时肺泡炎程度评分较模型组减轻(P<0.05);28 d时与模型组肺泡炎程度差异无统计学意义(P>0.05)。环磷酰胺组和甲泼尼龙组两组之间肺泡炎程度差异无统计学意义(P>0.05)。来氟米特组7天、14天、28天与模型组肺泡炎程度比较均差异无统计学意义(P>0.05)。
2.3 小鼠肺组织Masson染色情况 各组小鼠肺组织Masson染色显示(图2):胶原纤维呈蓝色,肌纤维呈红色,红细胞呈橘红色,细胞核呈蓝黑色。空白组:肺组织无明显变化,仅于大气道和血管壁周围可见少量蓝色的基质胶原纤维。模型组:第7天小鼠肺间质、和肺泡间隔可见蓝色胶原沉积;第14天可见呈小灶样蓝色的胶原纤维;第28天肺间质胶原增生沉积呈弥漫性,并伴有肺泡的融合。来氟米特组肺组织病理改变基本同模型组,环磷酰胺组与甲泼尼龙组肺组织病理改胶原纤维沉积程度较模型组减轻,成纤维细胞灶均有所减少。与空白组对比,灌注博来霉素各组Masson染色显示的胶原沉积程度均增加。
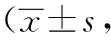
表2 肺组织病变HE染色评分比较分)
注: 两两比较为HSD-q检验;与对照组比较,aP<0.05;与模型组比较,bP<0.05;与环磷酰胺组比较,cP<0.05;与来氟米特组比较,dP<0.05
2.4 小鼠肺组织肺纤维化评分 整体比较得知,五组各时间点处整体差异有统计学意义(P<0.05)。两两比较并结合主要数据分析:使用博来霉素诱导的各组小鼠模型(模型组、 环磷酰胺组、来氟米特组及甲泼尼龙组)肺纤维化在7、14、28天评分均明显高于对照组(P<0.05)。来氟米特组7天时较模型组纤维化程度减轻(P<0.05),14天、28天较模型组纤维化程度差异无统计学意义(P>0.05);环磷酰胺组与甲泼尼龙组7天、14天、28天时纤维化程度均较模型组明显减轻(P<0.05)。见表3。

a:对照组第7天;b:对照组第14天;c:对照组第28天,肺泡间隔和肺泡腔内未见明显异常;d:模型组第7天;e:模型组第14天;f:模型组第28天;g:环磷酰胺组第7天、h:环磷酰胺组第14天,肺泡萎缩不明显,间隔略增宽,肺泡上皮略显肿胀,炎性细胞浸润减少,成纤维细胞较少;i:环磷酰胺组第28天:部分肺泡结构破坏,局部肺间质有成纤维细胞聚集,形成轻中度肺间质纤维化;j:来氟米特组第7天,均可见肺泡间隔和肺泡腔内有以单核巨噬细胞为主的炎性细胞浸润,可见成纤维细胞;k:来氟米特组第14天,均可见肺泡萎缩压扁,肺泡上皮肿胀,炎性细胞浸润明显,成纤维细胞较多并可见纤维组织增生;l:来氟米特第28天均可见肺泡间隔炎性细胞减少,但肺泡结构破坏,纤维组织呈条索样瘢痕改变;m:甲泼尼龙组第7天肺泡间隔和肺泡腔内有炎性细胞浸润,可见少量成纤维细胞;n:甲泼尼龙组第14天肺泡间隔有炎性细胞浸润,肺泡上皮略肿胀,成纤维细胞较多;o:甲泼尼龙组第28天肺泡间隔炎性细胞较少,部分肺泡结构破坏,肺间质有成纤维细胞聚集
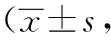
图1 小鼠肺病理HE染色结果(×100)
注:两两比较为HSD-q检验;与对照组比较,aP<0.05;与模型组比较,bP<0.05;与环磷酰胺组比较,cP<0.05;与来氟米特组比较,dP<0.05

a:对照组第7天;b:对照组第14天;c:对照组第28天,肺组织纤维染色未见明显异常;d:模型组第7天;e:模型组第14天;f:模型组第28天;g:环磷酰胺组第7天,肺间质可见少量蓝色的基质胶原纤维;h:环磷酰胺组第14天,肺间质见较多蓝色的胶原纤维;i:环磷酰胺组第28天,肺间质胶原增生沉积呈轻度弥漫性;j:来氟米特组第7天;k:来氟米特组第14天,均可见肺间质和肺泡间隔可见蓝色胶原沉积;l:来氟米特组第28天,均可见肺间质胶原增生沉积呈弥漫性,并伴有肺泡的融合;m:甲泼尼龙组第7天,仅于血管壁周围可见少量蓝色的基质胶原纤维,余未见明显异常;n:甲泼尼龙组第14天,肺间质见较多蓝色的胶原纤维;o:甲泼尼龙组第28天,肺间质胶原增生明显,未见肺泡的融合
图2小鼠肺病理Masson染色结果(×100)
3 讨论
目前CTD-ILD的治疗目前仍没有共识,缺乏有效的治疗方法,检索近年国内外的相关文献报道,所涉及的CTD-ILD 常用的治疗药物有:糖皮质激素、免疫抑制剂、生物制剂等[5-11]。糖皮质激素作为首选药物被应用于临床,结果表明激素对肺间质纤维化的疗效确是有限的[12-13]。免疫抑制剂中报道较多的有甲氨蝶呤、环磷酰胺、吗替麦考酚酯等。其中环磷酰胺在CTD-ILD 的治疗中疗效相对肯定,而来氟米特(LEF)在CTD-ILD的治疗报道几乎未见。环磷酰胺作为一种强有力的经典的免疫抑制剂,主要通过杀伤免疫细胞(T细胞和B细胞)并抑制免疫细胞的数量和功能发挥作用,其起效慢、作用时间持久。来氟米特是丙二腈酰胺类免疫抑制剂,其通过抑制二氢乳酸脱氢酶活性发挥抑制淋巴细胞增殖作用,起效慢、作用时间持久、副作用较其他大多数免疫抑制剂少。本研究对比了环磷酰胺、来氟米特及甲泼尼龙对小鼠肺间质纤维化疗效差异。
鉴于博来霉素广泛用于建立肺纤维化的动物模型,本研究构建了博来霉素诱导的肺纤维化小鼠模型,发现博来霉素诱导后小鼠肺组织炎性细胞浸润明显,肺间质和肺泡间隔胶原纤维增生呈弥漫性并伴有肺泡的融合;而使用环磷酰胺或者甲泼尼龙干预后,小鼠在疾病的不同时间炎性细胞浸润明显减轻,肺间质和肺泡间隔胶原染色中胶原纤维减少,肺泡炎和肺纤维化病理评分明显降低。提示环磷酰胺及甲泼尼龙可以抑制炎性细胞的浸润,降低小鼠肺泡炎和肺纤维化的程度,对肺纤维化小鼠有一定的积极干预作用。但是来氟米特干预组小鼠肺泡炎程度及纤维化程度较模型组差异无统计学意义,提示来氟米特对ILD暂无明确疗效。
本实验结果显示环磷酰胺和甲泼尼龙能减轻及抑制博来霉素诱导的小鼠的炎性反应和肺间质纤维化的发生发展,而来氟米特对小鼠肺间质纤维化无明显抑制作用,临床医师在使用来氟米特治疗CTD-ILD时,需先评估患者的肺部情况,严格掌握适应证,谨慎使用LEF,有肺部基础疾病的患者尽量避免使用。
[1] STRIETER RM.Pathogenesis and natural history of usual interstitial pneumonia:the whole story or the last chapter of a long nove[J].Chest,2005,128(5 Suppl 1):526-532.
[2] STRANGE C,HIGHLAND KB.Interstitial lung disease in the patient who has connective tissue disease[J].Clin Chest Med,2004,25(3):549-559.
[3] SCHRIER DJ,KUNKEL RG,PHAN SH.The role of strain variation in murine bleomycin-induced pulmonary fibrosis[J].Am Rev Respir Dis,1983,127(1):63-66.
[4] SZAPIEL SV,ELSON NA,FULMER JD,et al.Bleomycin-induced interstitial pulmonary disease in the nude,athymic mouse[J].Am Rev Respir Dis,1979,120(4):893-899.
[5] TASHKIN DP,ELASHOFF R,CLEMENTS PJ,et al.Cyclophosphamide versus placebo in scleroderma lung disease[J].N Engl J Med,2006,354(25):2655-2666.
[6] DHEDA K,LALLOO UG,CASSIM B,et aI.Experience with azathioprine in systemic sclerosis associated with interstitial lung disease[J].Clin Rheumatol,2004,23(4):306-309.
[7] ZAMORA AC,WOLTERS PJ,COLLARD HR,et al.Use of mycophenolate mofetil to treat sclerodermaassociated interstitial lung disease[J].Respir Med,2008,102(1):150-155.
[8] TANIGUCHI H,EBINA M,KONDOH Y,et al.Pirfenidone in idiopathic pulmonary fibrosis[J].Eur Respir J,2010,35(4):821-829.
[9] RAPTAKIS E,KOUGAS N,KOUTSIPETSIDIS V,et al.Effectiveness of cyclosporine in treatment of interstitial lung disease in patients with rheumatoid arthritis[J].Ann Rheum Dis,2009,68(Suppl 3):586.
[10] LIM SW,GILLIS D,SMITH W,et al.Rituximab use in systemic lupus erythematosus pneumonitis and a review of current repots[J].Intem Med J,2006,36(4):260-262.
[11] GERBINO AJ,GOSS CH,MOLITOR JA.Effect of mycophenolate mofetil on pulmonary function in scleroderma—associated interstitial lung disease[J].Chest,2008,133(2):455-460.
[12] RICHEELDI L,DAVIES HR,FERRARA G,et al.Corticosteroides for idiopathic pulmonaryfibrosis[J].Cochrane Database Syst Rev,2003(3):CD002880.
[13] AMERICAN THORACIC SOCIETY.Idiopathic pulmonary fibrosis:diagnosis and treatment.International consensus statement.American Thoracic Societ(ATS),and the European Respiratory Society(ERS)[J].Am J Respir Crit Care Med,2000,161(2Pt1):646-664.
Effectsofimmunosuppressiondrugsandprednisoloneonmicemodelofbleomycin-inducedpulmonaryfibrosis
ZhaoLike,MuBinyao,ZhouRongwei,ChengYongjing,HuangCibo
(DepartmentofRheumatology,BeijingHospital,NationalCenterofGerontology,Bejing100730,China)Correspondingauthor:HuangCibo,Email:huangcibo1208@139.com
ObjectiveTo explore the effect of cyclophosphamide(CTX),leflunomide(LEF) and methylprednisolone(MP) on mouse model of bleomycin-induced pulmonary fibrosis.MethodsA total of 75 C57BL / 6 mice were randomly and evenly divided into control group,model group,CTX group,LEF group and MP group(n=15 in each group).The mice in control group were injected 0.2 mL normal saline from endotracheal ,and others were injected with 0.2mL bleomycin(5 mg/kg) from endotracheal to induce the pulmonary fibrosis model.The next day,the mice in control group and model group were fed with 0.2mL normal saline every day;The mice in other groups were fed with respectively 0.2 mL CTX (50 mg/kg) ,0.2 mL LEF(4 mg/kg)and 0.2 mL MP (10 mg/kg) every day respectively.Finally the mice were sacrificed at day 7,day 14,day 28 separately,and the lung tissue was examined by HE staining and Masson staining to evaluate the degree of alveolitis and fibrosis.Results(1) The body mass of mice in bleomycin-induced groups were decreased compared with control group;(2) The pathological alveolitis scores in CTX group and MP group were significantly decreased compared with mode group at day 7 and day 14(P<0.05),and the pathological fibrosis scores were decreased dramatically compared with mode group at day 7,day 14 and day 28(P<0.05).While there was no statistical significance between LEF group and model group.ConclusionsThe CTX and MP can reduce and inhibit bleomycin-induced lung inflammation and fibrosis in mices,but not LEF.
Pulmonary fibrosis;Immunosuppressive agents;Hormones;Bleomycin;Cyclophosphamide;Methylprednisolone
R563.13
A
10.3969/J.issn.1672-6790.2017.05.027
2017-01-20)
首都医学发展基金(首发-1-4051)
赵丽珂,主治医师,Email:likezhao@126.com
黄慈波,主任医师,硕士生导师,Email:huangcibo1208@139.com

