NtNramp1基因参与不同镉积累基因型烟草品种镉积累差异的功能解析
蔡海林,李帆,曾维爱,杨红武,唐仲
1 湖南省烟草公司长沙市公司,烟叶生产技术中心,长沙市雨花区劳动东路359号 410011;
2 湖南省烟草公司,科技处,长沙市芙蓉南路一段628号 410004;
3 南京农业大学,资源与环境科学学院,南京市玄武区卫岗1号 210095
生物技术
NtNramp1基因参与不同镉积累基因型烟草品种镉积累差异的功能解析
蔡海林1,李帆1,曾维爱1,杨红武2,唐仲3
1 湖南省烟草公司长沙市公司,烟叶生产技术中心,长沙市雨花区劳动东路359号 410011;
2 湖南省烟草公司,科技处,长沙市芙蓉南路一段628号 410004;
3 南京农业大学,资源与环境科学学院,南京市玄武区卫岗1号 210095
【目的】探究不同品种烟草镉积累差异的分子机制。【方法】采用同源克隆方法从烟草不同镉积累基因型品种中克隆拟南芥AtNramp1同源基因NtNramp1;应用生物信息学方法分析烟草不同镉积累基因型品种中NtNramp1基因序列差异;通过酵母异源表达系统研究烟草不同镉积累基因型品种的NtNramp1对镉的转运活性差异。【结果】金英和Komotini Basma两个烟草品种对镉的积累存在显著差异;从镉积累显著差异的两个烟草品种中克隆到的NtNramp1基因(分别命名为NtNramp1a和NtNramp1b)编码区存在57个单碱基差异,其中NtNramp1a1305位碱基变异(G>A)导致所编码蛋白比NtNramp1b编码蛋白缺少C端两次跨膜;酵母异源表达结果表明来自低镉含量品种金英的NtNramp1a转运镉的活性比来自高镉含量品种Komotini Basma的NtNramp1b转运镉活性显著降低。【结论】金英和Komotini Basma两个烟草品种中NtNramp1蛋白活性差异是导致两烟草品种镉积累差异的重要原因。
烟草;镉;Nramp基因;序列差异;酵母异源表达
随着我国工业化、城镇化的快速发展,环境重金属污染问题日益突出。根据国土资源部的调查结果,我国受重金属污染耕地已超过3亿亩[1]。国内外大量的研究表明,重金属镉(Cd)对人体毒性较强,被国际卫生组织列为生物毒性最强的重金属元素之一,而且比较容易从土壤被植物吸收进入食物链,也是影响农产品安全最重要的重金属污染元素之一。烟草是我国重要的经济作物,也是一种易积累镉的作物[2],环境中过量的Cd被烟草吸收和积累,不仅会影响烟草的生长发育,造成烟叶产量及品质的下降[3],同时烟叶中积累的Cd也能通过呼吸道进入人体,可对人体的肾脏、骨骼、免疫系统、神经系统、心血管系统和生殖系统等产生毒性[4-5]。随着社会对烟草的关注度越来越高,烟草的安全性问题受到高度重视。因此,烟叶中镉的控制成为近年来烟草减害的研究热点之一。植物对镉的吸收存在基因型差异,利用这种差异,已经培育出低镉累积的小麦、向日葵、大豆等[6],培育低镉品种在控制作物镉含量中显示出了良好的应用前景。烟草对镉的吸收和积累也存在基因型差异,但造成烟草品种间镉吸收积累差异的原因尚不清楚。
天然抗性相关巨噬细胞蛋白家族(natural resistance-associated macrophage protein, NRAMP) 是古老的膜整合转运蛋白家族,也是广泛存在于细菌、真菌、动物和植物中的一个高度保守的膜蛋白家族,参与多种二价金属离子(如Mn2+、Zn2+、Fe2+、Cd2+等)的运输[7]。NRAMP蛋白最早在哺乳动物中发现,小鼠中NRAMP1是第一个被鉴定的NRAMP家族成员,该基因主要在吞噬细胞中特异性表达,其通过对金属离子如Mn2+和Fe2+等的转运来参与巨噬细胞对病菌侵染的抵御过程[8-9]。已发现在酵母中存在3个NRAMP同源基因SMF1~3,具有调节Mn、Cu、Cd、Fe和Co运输的功能[10-12]。在高等植物中鉴定到多个NRAMP家族基因。拟南芥中存在6个NRAMP基因,分别为AtNramp1-AtNramp6。AtNramp1基因表达受缺铁诱导,其编码的蛋白不仅是重要的铁转运体,也是一种高亲和锰转运蛋白,参与拟南芥锰的吸收转运[13-14]。AtNramp3和AtNramp4 都是定位在液泡膜上的NRAMP蛋白,参与液泡中镉离子外排至细胞质中[15]。拟南芥过量表达AtNramp3,4和6均能增加拟南芥对Cd的敏感性[15-17]。水稻中OsNramp1参与根系细胞对Cd 的吸收和转运,不同品种间根系OsNramp1表达量的差异是品种间Cd积累的差异的重要原因之一[18]。OsNramp5主要在根系成熟区外皮层和内皮层细胞表达,是水稻主要的Cd吸收转运体,对水稻Cd吸收能力的贡献率超过90%[19-20]。尽管很多研究表明NRAMP在植物对Cd的吸收和转运过程中起着重要作用,但目前还没有不同烟草品种中NRAMP基因功能活性差异的研究报道。
本文采用同源序列分析法从两种镉积累显著差异的烟草品种中克隆获得与拟南芥AtNramp1同源的NtNramp1基因,通过实时荧光定量PCR方法比较了NtNramp1基因在不同镉积累品种中的表达,对不同品种来源NtNramp1基因序列及预测蛋白结构差异进行了分析;同时通过酵母异源表达系统对烟草不同镉积累品种中NtNramp1活性进行了比较。初步揭示了造成不同烟草品种镉积累能力差异的原因,本文可为培育低镉烟草品种提供参考。
1 材料与方法
1.1 试验材料
供试烟草品种为晒烟品种金英(Nicotiana tabacumL.)和香料烟品种Komotini Basma(Nicotiana tabacumL.)。烟草种子灭菌后于28℃黑暗条件下催芽,发芽后移入蛭石:营养土(1:2)培养基中培养至6叶1心期备用。烟苗培养在恒温光照培养箱中进行,控制条件为光照16 h/d,温度28℃(昼)/20℃(夜),相对湿度为70%。
RNA提取试剂盒购自北京百泰克生物技术有限公司;反转录试剂盒HiScript 1st Strand cDNA Synthesis Kit及荧光定量试剂盒HiScript Q RT SuperMix for qPCR (+gDNA wiper)均购自南京诺唯赞生物科技有限公司;测序及引物合成均在南京金斯瑞生物科技有限公司进行。
供试酵母菌株为SEY6210 (MATα; leu2–3112;ura3–52; his3-Δ200; trp1-Δ901; suc2-Δ9; lys2–801);酵母表达质粒pYES2购自Invitrogen公司。
1.2 试验设计
采用苗期水培试验,设置0和0.5 μmol/L两个镉处理水平,每处理4次重复。具体操作为:选取大小基本一致的6叶1心期烟苗,用1/2 Hoagland营养液预培养1周后,将烟苗移入5 L含Cd营养液(CdCl2配制)的塑料小盆,每盆移栽8株,每品种4株。培养期间每3天更换1次营养液,除镉处理外,培养条件与预培养一致。培养3天后,将烟苗从盆中取出,先用自来水冲洗3次,再用去离子水冲洗3次,最后用0.5 mM CaCl2溶液洗根10 min,滤纸吸干表面水分,将根系及地上部分开,于70℃烘箱烘干至恒重备用。
1.3 测定项目及方法
1.3.1 镉含量测定
植物样品中镉含量采用NY/T1100-2006硝酸高氯酸混合酸的消解方法进行消解,采用ICP-MS(PerkinElmer公司)进行镉含量测定。
1.3.2NtNramp1基因克隆
利用RNA提取试剂盒提取幼苗根系的总RNA,用核酸浓度测定仪测定提取的RNA的浓度和纯度。以提取的总RNA为模板,反转录合成cDNA。根据NCBI(www.ncbi.nlm.nih.gov)公布的拟南芥AtNramp1的基因序列,BLAST NCBI数据库中普通烟草物种基因组。检索到相似性较高的序列,登录号为XM_016625392.1,根据该序列设计上下游引物NtNramp1F: 5’-CGTTTACCTGACATCAGAACAAC-3’,NtNramp1R: 5’-GGGATATCAGCAAGATCCTCTC-3’,以烟草根系反转录cDNA为模板,进行PCR扩增。反应体系为25.0 μL:cDNA 1.0 μL,上、下游引物各1.0 μL,Taq 聚合酶1μL,5 X Taq Buffer 4 μL,dNTP Mixture(2.5 mmol/L each)2 μL,ddH2O 15.0 μL。 扩增条件为:95℃ 5 min;95℃ 30s,55℃ 30s,72℃90s,进行30个循环;72℃7min;4℃10min。
PCR产物经1%琼脂糖凝胶电泳,目标片段切胶回收。回收产物与pEASY-Blunt载体连接,转化大肠杆菌DH5a感受态细胞。阳性克隆进行菌液PCR验证,并挑选阳性菌株送金斯瑞公司测序。
1.3.3NtNramp1基因序列及进化分析
采用DNAMAN软件进行多序列比对;采用NCBI的BLAST序列比对工具进行同源性比对;使用TMHMM 软件 (http://www.cbs.dtu.dk/services/TMHMM-2.0/)分析跨膜结构域。
1.3.4NtNramp1基因表达量分析
将两基因型烟草6叶期幼苗预培养后,1/2 Hoagland营养液中添加终浓度为10 μM CdCl2处理24h后,去离子水清洗根系两遍,液氮速冻备用。利用百泰克公司RNA提取试剂盒提取根系总RNA。紫外分光光度计测定OD260/OD280,确定总RNA的质量。采用南京诺唯赞生物科技有限公司的反转录试剂盒HiScript 1st Strand cDNA Synthesis Kit合成总RNA的第一链cDNA。根据已克隆的基因序列用Premier5.0软件设计特异性检测引物(qNtNramp1F: 5’-CGTAGTATTTCCGTTGATGGC-3’;qNtNramp1R:5’-TGGATTGTCCTTAATTGGGTC-3’)。以UBC(GenBank: AB026056.1)为内参基因,引物为:qUBCF:5’-GCGAGATTGTTGAACAGAGCT-3’;qUBCR:5’-TACATAGTCCATTCGTAGTTGAGC-3’,采用SYBR GREEN染料法, CFX96定量PCR仪(BioRad公司)进行实时荧光定量PCR检测。反应程序为:95℃ 5min;95℃ 20s,55℃ 20s,72℃20s,40个循环;72℃单点检测SYBR GREEN 荧光信号。结束后最后加入熔解曲线程序:95℃ 0s,60℃15s,0.5 ℃递增至95℃,每梯度10s,连续检测信号。根据数据分析得到各个样品的CT值,相对表达量水平采用2-ΔΔCT的方法进行计算。
1.3.5NtNramp1基因酵母异源表达分析
提取的重组质粒pYES2-NtNramp1a,pYES2-NtNramp1b以及空载pYES2采用醋酸锂的方法[21]转化酿酒酵母SEY6210,接种重组酵母菌株(转有目的基因的实验组与对照组)单菌落于SD-U中活化,30℃摇床中培养至OD600=1.0时,将其菌液分别稀释 10-1、10-2、10-3、10-4、10-5,取2μL点板在含有 0、10、20和30 μM镉的SD-U固体培养基上,30℃培养3d,观察酵母菌生长情况并拍照记录,每种镉浓度处理3个重复。
1.3.6 酵母转化子镉处理条件下的生长曲线
为了解NtNramp1酵母转化子的耐镉能力,挑取转化后的酵母SEY6210 单菌落(分别含空表达载体和目的基因表达载体,分别命名为WT+PYES2,WT+NtNramp1a和WT+NtNramp1b),接种至5mLSD-U液体培养基中活化培养,30℃下220 rpm振荡过夜培养。测定OD600值至0.5左右。各取1 mL过 夜培 养 的WT+PYES2, WT+NtNramp1a和WT+NtNramp1b菌液,将OD600调整至0.5后各取0.1 ml接种至50 mL分别含5 μM CdCl2的SD-U液体培养基中,混合均匀后测得初始的OD600值。随后在30℃、220 rpm条件下振荡培养,每隔2-4h 测定一次OD600值,至58 h。每种菌液重复三次接种,并通过OD600值作出生长曲线图。
1.3.7 酵母转化子镉含量测定
为了测试转基因酵母内的镉含量,分别取WT+PYES2, WT+NtNramp1a和 WT+NtNramp1b菌液加镉处理,处理条件同1.3.6,培养48 h 后,用50 mL离心管以2500 rpm 的转速离心2 min,除去上清。加入50 mL蒸馏水重悬,2500 rpm,离心2 min,除去上清,并重复洗涤3次。将50 mL离心管置于80℃烘箱中烘干至恒重。万分位天平秤取一定量的样品放入消化管中,加5 mL硝酸高氯酸混合酸,石墨炉消解仪中180℃下消解, 直至消解管中剩0.5 mL的液体,冷却至室温后,双蒸水冲洗后定容至25 mL,应用ICP-MS测定镉含量。
1.3.8 数据分析
采用Excel和SPSS18.0 软件进行数据分析,叶片和根系镉含量数据采用student’s T-test检验;酵母镉含量数据用Tukey多重比较检验,所有数据均在5%水平进行显著性分析,以a、b、c表示其差异性,未标有相同小写字母表示差异有统计学意义。
2 结果与分析
2.1 两基因型品种根系与地上部镉含量比较
同一水培镉处理条件下,两种基因型烟草品种叶片和根系镉积累如图1A所示,金英品种叶片镉含量为7.41mg kg-1,显著低于Komotini Basma品种叶片镉含量13.7 mg.kg-1,金英叶片中镉含量约为Komotini Basma叶片种镉含量的54%;金英品种根系中镉含量约为Komotini Basma根系镉含量的60%(图1B),根系中镉含量差异呈现与叶片镉含量差异一致的趋势。

图1 两基因型品种叶片与根系镉含量比较Fig.1 Cd concentration in roots and leaves of two tobacco cultivars
叶片/根系镉含量比值能反应镉从根系往叶片转运情况[22],分析图2结果可以看出两个烟草品种间叶片/根系镉含量比无显著差异(图2),说明两个烟草品种间镉从根系往叶片转运的能力没有显著差异。

图2 两基因型品种叶片/根系镉含量比Fig.2 The shoot/root ratio of Cd in two tobacco cultivars
2.2 两基因型品种NtNramp1基因克隆与序列分析
将拟南芥镉转运蛋白基因AtNRAMP1序列在NCBI数据库进行比对,获得普通烟草NtNRAMP1基因序列(登录号:XM_016625392.1),根据NtNRAMP1基因序列设计特异引物 (NtNramp1F和NtNramp1R),分别对烟草品种金英和Komotini Basma的cDNA进行扩增,产物克隆至pEasy-blunt载体测序,得到两基因型烟草品种NtNramp1基因序列,分别命名为NtNramp1a和NtNramp1b,从两序列比对结果(图3)看出,烟草品种金英中NtNramp1a编码区序列与Komotini Basma中NtNramp1b编码 区 序 列 存 在57个SNP(Single Nucleotide Polymorphisms,单核苷酸多态性)位点(图3),编码区序列翻译成氨基酸发现,金英品种中NtNramp1a在编码区1305位的碱基变异(G>A)(图3箭头所示处)导致蛋白翻译提前终止,形成一个不完整的蛋白(图4A),跨膜分析表明金英中NtNramp1a蛋白(图4B)比Komotini Basma中NtNramp1b蛋白(图4C)缺少两次跨膜,这可能会导致两个品种NtNramp1蛋白活性存在差异。

图3 两基因型品种NtNramp1基因编码区序列差异Fig.3 Sequence difference in coding region ofNtNramp1between two tobacco cultivars

图4 两基因型品种NtNramp1基因氨基酸序列及跨膜结构差异Fig.4 The difference of amino acid sequence and transmembrane structure ofNtNramp1between two tobacco cultivars
2.3 两基因型品种NtNramp1的表达
为了解两基因型烟草品种中NtNramp1基因的表达模式,分析了镉处理条件下,两基因型烟草品种根系和叶片中NtNramp1的表达量,结果发现NtNramp1基因主要在根系表达,叶片中几乎检测不到;不加镉处理中,金英和Komotini Basma根系中NtNramp1基因表达量并无显著差异;在10 μM镉处理中,金英和Komotini Basma根系中NtNramp1基因表达量有受诱导的趋势,但差异不显著,说明镉处理不会显著诱导或抑制烟草中NtNramp1基因的表达(图5)。另外,该结果也表明两基因型烟草根系中NtNramp1基因的表达量对两基因型烟草镉积累差异没有显著影响。

图5 两基因型品种NtNramp1基因表达Fig.5 Expression ofNtNramp1in the roots of two tobacco cultivars
2.4 两基因型品种NtNramp1酵母异源表达分析
为弄清NtNramp1a和NtNramp1b蛋白转运镉的活性是否存在差异,分别构建NtNramp1a和NtNramp1b酵母过表达载体,将NtNramp1a、NtNramp1b酵母表达载体和空载体分别转入SEY6210酵母中,筛选阳性菌株,摇菌活化后稀释成相同的倍数并在含有 0 μM、10 μM、20 μM 和 30 μM CdCl2的SD-U 固体培养基上培养3d。结果(图6)发现,在不加镉的培养基上,含有空表达载体、NtNramp1a和NtNramp1b基因表达载体的酵母菌落大小和数量基本一致,长势也基本一致。10 μM镉处理中,含有空载体的酵母生长几乎不受影响,表达NtNramp1a酵母的生长受到轻微抑制,而表达NtNramp1b基因的酵母转化子受抑制情况比表达NtNramp1a酵母转化子严重;20 μM镉处理时,含有空载体的酵母生长受到轻微抑制,表达NtNramp1a和NtNramp1b两种酵母的生长均受到一定程度的抑制,但表达NtNramp1b基因的酵母转化子受抑制程度比表达NtNramp1a酵母转化子严重,尤其是30 μM浓度下,趋势更为明显。该结果表明,在镉处理条件下,异源表达NtNramp1a和NtNRAMP1b基因增加了酵母对镉的吸收积累,从而产生严重的镉毒害作用,而表达NtNramp1b基因的酵母比表达NtNramp1a基因的酵母受镉毒害更为严重,说明NtNramp1b转运镉的能力比NtNramp1a更强。

图6 镉胁迫下NtNramp1基因的酵母异源表达Fig.6 Heterologous expression ofNtNramp1aandNtNramp1bin yeast under Cd stress
2.5 酵母转化子在镉胁迫条件下的生长曲线
为进一步了解表达NtNramp1a和NtNramp1b基因对酵母耐镉能力的影响,将分别含有空载体、NtNramp1a和NtNramp1b基因表达载体的酵母转化子过夜培养。接种相同的菌液至含10 μM CdCl2和不含镉的SD-U液体培养基中,处理培养58 h,测定生长曲线。结果(图7)发现:在不加镉条件下, 0 h至14 h内,空载体酵母和表达NtNramp1a、NtNramp1b基因的酵母长势较为一致,而14 h之后,随着时间的增长,三种酵母的OD600值均表现为指数增长的状态,三种酵母之间增长幅度并无显著差异;在加10 μM CdCl2条件下,0 h至27 h内空载体酵母和表达NtNramp1a、NtNramp1b基因的酵母长势较为一致,而27 h之后,含有空载体的酵母OD600值开始表现为指数增长的状态,而表达NtNramp1a基因的酵母OD600值在培养40 h后才开始表现为指数增长的状态,表达NtNramp1b基因的酵母在培养45 h后才缓慢生长,且OD600值在培养58 h后才达到0.1左右。以上结果表明,在镉处理条件下,表达NtNramp1b基因的酵母生长状况较表达NtNramp1a基因的酵母转化子差。酵母转化子在镉处理条件下生长曲线的实验结果与点板实验结果一致,均表明表达NtNramp1b基因的酵母比表达NtNramp1a基因的酵母在镉胁迫下生长受更严重的抑制。
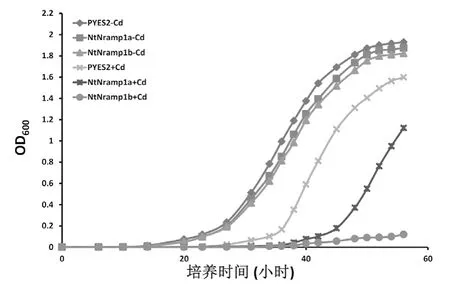
图7 两基因型烟草NtNramp1转基因酵母耐镉性比较Fig.7 Difference of growth curve between the yeast expressedNtNramp1aandNtNramp1b
2.6 酵母转化子镉含量测定
为了更进一步分析NtNramp1a和NtNramp1b基因对酵母积累镉的影响,分别将带有空载体、NtNramp1a和NtNramp1b基因的酵母SEY6210活化,在含5 μM CdCl2的SD-U液体培养基中培养48 h,测定其镉含量。结果(图8)发现,在镉处理条件下,在酵母菌株SEY6210中,表达NtNramp1b基因酵母的镉含量显著高于表达NtNramp1a和空载体酵母的镉含量。综合上述结果一方面可以说明NtNramp1a和NtNramp1b基因的表达均增加了转基因酵母对镉离子的吸收,转基因酵母体内积累了更多的镉离子,从而引起更为严重的镉毒害作用,使转基因酵母生长受抑制,另一方面也说明NtNramp1b转运镉离子能力显著强于NtNramp1a。
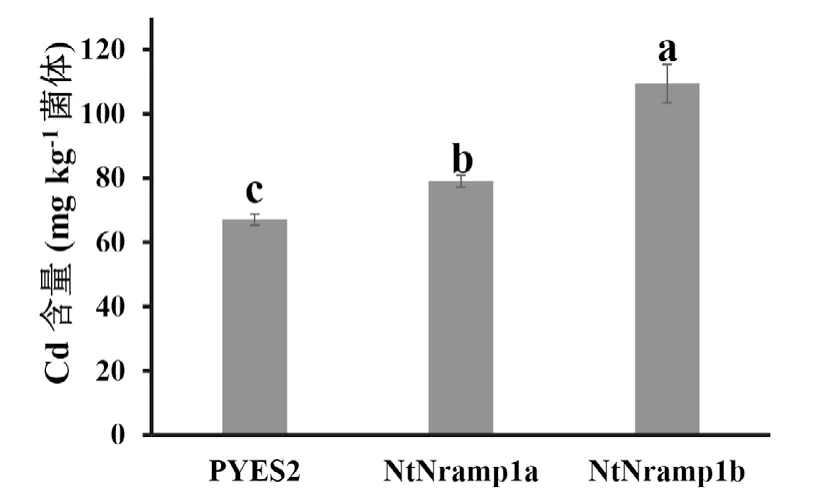
图8 两基因型烟草NtNramp1转基因酵母镉含量差异Fig.8 Cd concentration in the yeast expressedNtNramp1aandNtNramp1b
3 讨论与结论
植物对有毒重金属的吸收积累与基本矿质营养元素的吸收密切相关,已有的研究表明重金属如镉、砷等进入并分布到植物体内是通过矿质养分的吸收运输通道来实现的[18-19,23]。转运蛋白不仅在植物体内矿质必需元素运输过程中发挥重要作用,而且可转运重金属。大多数NRAMP转运蛋白有运输必需元素如铁(Fe)、锰(Mn)的能力,也能运输如镉的有毒重金属[13-20]。尽管目前已经从多种植物中克隆了多个NRAMP家族基因,并对其作用机制进行了研究,但在镉超积累经济作物烟草中对NRAMP家族基因参与烟草镉吸收积累的研究较少。
为进一步解析不同烟草品种间镉积累能力差异的分子机制,本研究从前期工作筛选到的两个具有显著镉积累差异的烟草种质资源中克隆得到2个NtNramp1基因,这两个基因的编码区序列存在57个SNP差异。高镉积累品种Komotini Basma中NtNramp1b编码一个538个氨基酸组成的NtNramp1b蛋白,而低镉积累品种金英中NtNramp1a因1305位SNP导致翻译提前终止,编码一个不完整的NtNramp1a蛋白。通过跨膜结构分析发现NtNramp1a比NtNramp1b在C端缺少两次跨膜,这可能会导致两者活性存在差异。
本研究通过酵母异源表达NtNramp1a和NtNramp1b研究两者对镉转运的影响,发现低镉积累烟草品种金英中NtNramp1a对镉的转运活性显著低于高镉积累烟草品种Komotini Basma中的NtNramp1b。由于两基因型烟草品种间镉从根系向叶片转运的能力并没有显著差异,因此造成两基因型烟草品种间镉积累差异的主要原因可能是根系对镉的吸收能力的差异,结合两基因型烟草品种中NtNramp1转运蛋白对镉的转运活性存在显著差异,可以认为两基因型烟草品种中根系NtNramp1蛋白活性差异是导致两基因型烟草品种间镉积累差异的主要原因。
本研究表明不同烟草品种对重金属镉的吸收积累具有基因型差异,不同烟草品种中NtNramp1基因对镉转运活性的差异是引起不同烟草品种镉积累差异的重要原因。因此,下一步的研究可以通过遗传操作敲除烟草根系中具有镉吸收活性的NtNramp1基因,验证NtNramp1基因功能缺失对降低烟草镉积累的效果。当然植物中存在多个参与重金属镉吸收积累的基因,植物对镉的吸收积累特性是由多个基因共同参与控制调节,因此克隆更多不同镉积累基因型烟草相关基因序列,进一步深入探讨不同基因型烟草镉积累的分子机制对于培育低镉烟草品种、降低烟草镉含量具有重要意义。
[1]环境保护部,国土资源部.全国土壤污染状况调查公报[J].中国环境管理,2014,6(2):26.The Ministry of Environmental Protection; The Ministry of Land and Resources Report on the national soil contamination survey[J].Chinese Journal of Environmental Management, 2014, 6(2): 26.
[2]Clarke B B,Brennan E.Differential cadmium accumulation and phytotoxicity in sixteen tobacco cultivars[J].Journal of the Air and Waste Management Association,1989,39(10)∶ 1319-1322.
[3]马新明,李春明,田志强,等.镉污染对烤烟光合特性、产量及其品质的影响[J].生态学报,2006,12: 4039-4044.MA Xinming, LI Chunming, TIAN Zhiqiang, et al.Effects of Cd pollution on photosynthetic characteristics, yield and quality of tobacco leaves[J].Acta Ecologica Sinica, 2006, 12: 4039-4044
[4]邓新,温璐璐,迟鑫姝.镉对人体健康危害及防治研究进展[J].中国医疗前沿,2010,10: 4-5.DENG Xin, WEN Lulu, Chi Xia shu.The research progress of cadmium hazards to human health and the prevention[J].National Medical Frontiers of China, 2010, 10: 4-5.
[5]Satarug S and Moore M R.Adverse health effects of chronic exposure to low-level cadmium in foodstuffs and cigarette smoke[J].Environmental Health Perspectives, 2004, 112(10):1099-1103.
[6]Grant C A, Clarke J M, Duguid S, et al.Selection and breeding of plant cultivars to minimize cadmium accumulation[J].Science of The Total Environment, 2008, 390(2/3): 301-310.
[7]Nevo Y and Nelson N.The NRAMP family of metal-ion transporters[J].Biochimica Et Biophysica Acta-Molecular Cell Research, 2006, 1763(7): 609-620.
[8]Vidal S M, Danielle M, Kyle V, et al.Natural resistance to infection with intracellular parasites: Isolation of a candidate for Bcg[J].Cell, 1993, 73(3):469-485.
[9]Cellier M, Belouchi A, Gros P.Resistance to intracellular infections: comparative genomic analysis of Nramp[J].Trends in Genetics, 1996, 12(6): 201-204.
[10]Supek F, Supekova L, Nelson H, et al.A yeast manganese transporter related to the macrophage protein involved in conferring resistance to mycobacteria[J].Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(10): 5105-5110.
[11]Liu X F, Supek F, Nelson N, et al.Negative control of heavy metal uptake by the Saccharomyces cerevisiae BSD2 gene[J].Journal of Biological Chemistry, 1997, 272(18): 11763-11769.
[12]Fleming M D, Trenor C C, Su M A, et al.Microcytic anaemia mice have a mutation in Nramp2, a candidate iron transporter gene[J].Nature Genetics, 1997, 16(4): 383-386.
[13]Curie C, Alonso J M, Le Jean M.et al.Involvement of NRAMP1 from Arabidopsis thaliana in iron transport[J].Biochemical Journal,2000, 347: 749-755.
[14]Cailliatte R, Schikora A, Briat J F, et al.High-af fi nity manganese uptake by the metal transporter NRAMP1 is essential for Arabidopsis growth in low manganese conditions[J].Plant Cell,2010, 22(3):904-917.
[15]Thomine S, Lelievre F, Debarbieux E, et al.AtNRAMP3, a multispeci fi c vacuolar metal transporter involved in plant responses to iron de fi ciency[J].Plant Journal, 2003, 34(5):685-695.
[16]Lanquar V, Lelievre F, Barbier-Brygoo H, et al.Regulation and function of AtNRAMP4 metal transporter protein[J].Soil Science and Plant Nutrition, 2004, 50(7): 1141-1150.
[17]Cailliatte R, Lapeyre B, Briat J F, et al.The NRAMP6 metal transporter contributes to cadmium toxicity[J].Biochemical Journal, 2009, 422:217-228.
[18]Takahashi R, Ishimaru Y, Senoura T, et al.The OsNRAMP1 iron transporter is involved in Cd accumulation in rice[J].Journal of Experimental Botany, 2011, 62(14):4843-4850.
[19]Sasaki A, Yamaji N, Yokosho K, et al.Nramp5 is a major transporter responsible for manganese and cadmium uptake in rice[J].Plant Cell, 2012, 24(5):2155-2167.
[20]YANG Meng, ZHANG Yuanyuan, Zhang Lejing, et al.OsNRAMP5 contributes to manganese translocation and distribution in rice shoots[J].Journal of Experimental Botany, 2014, 65(17): 4849-4861.
[21]崔铁忠,卢康荣,李银霞,等.酿酒酵母遗传缺陷型菌株化学转化方法研究[J].现代生物医学进展,2016,8:1420-1423.CUI Tiezhong, LU Kangrong, LI Yinxia, et al.Research on a chemical-based yeast transformation method for defective Saccharomyces Cerevisiae[J].Progress in Modern Biomedicine,2016, 8: 1420-1423.
[22]Uraguchi, S, Mori, S, Kuramata, M, Arao, T, Ishikawa, S.Rootto-shoot Cd translocation via the xylem is the major process determining shoot and grain cadmium accumulation in rice[J].Journal of Experimental Botany, 2009, 60(9):2677-2688.
[23]WU Zhongchang, REN Hongyan, McGrath S P, et al.Investigating the contribution of the phosphate transport pathway to arsenic accumulation in rice[J].Plant Physiology, 2011, 157(1):498-508.
Functional analysis ofNtNramp1pariticipating in Cd accumulation in tobacco of different Cd accumulating genotypes
CAI Hailin1,LI Fan1,ZENG Weiai1,YANG Hongwu2,TANG Zhong3*
1 Hunan Changsha Municipal Tobacco Company, Changsha 410011, China;
2 Hunan Provincial Tobacco Company, Changsha 410004, China;
3 Nanjing Agricultural University, Nanjing 210095, China
The present study was conducted to investigate the molecule mechanism of different cadmium accumulation ability among tobacco varieties.Based onAtNramp1sequence ofArabidopsis thaliana,NtNramp1gene from Jinying and Komotini Basma with different cadmium accumulation ability were cloned and their sequence was analyzed by bioinformatics methods.Yeast heterologous expression system was used to analyze different cadmium transport activity of NtNramp1.Results showed that Jinying and Komotini Basma were two tobacco varieties (Nicotiana tabacumL.) that had significant difference of cadmium accumulation ability.NtNramp1cloned from Jinying and Komotini Basma were named asNtNramp1aandNtNramp1brespectively.There were 57 single nucleotide polymorphisms(SNP) in the coding region betweenNtNramp1aandNtNramp1b.The SNP in 1305 bp ofNtNramp1aled to premature termination of protein translation, which resulted in missing of two transmembrane structure in the C-terminal compared withNtNramp1b.Heterologous expression ofNtNramp1aandNtNramp1bin yeast showed that the yeast strain expressingNtNramp1bwas more sensitive to cadmium than the that expressingNtNramp1a, suggesting that cadmium transport activity of NtNramp1b was significantly stronger than that of NtNramp1a.Different cadmium transport activities ofNtNramp1between Jinying and Komotini Basma resulted in signi fi cant cadmium accumulation difference between the two tobacco varieties.
Nicotiana tabacum L.; cadmium; Nramp gene; sequence difference; yeast heterologous expression
蔡海林,李帆,曾维爱,等.NtNramp1基因参与不同镉积累基因型烟草品种镉积累差异的功能解析[J].中国烟草学报,2017, 23(4)
长沙市烟草公司科技专项(CYKJ2014-03)
蔡海林(1979—),博士,农艺师,主要研究方向烟草病虫害绿色防控技术,Tel:0731- 87969507,Email:hailincai@126.com
唐 仲(1985—),博士,讲师,主要研究方向为植物重金属积累与解毒的分子机制,Tel:025-84399551,Email:tangzhong@njau.edu.cn
2016-11-18;< class="emphasis_bold">网络出版日期:
日期:2017-03-23
:CAI Hailin,LI Fan,ZENG Weiai, et al.Functional analysis ofNtNramp1pariticipating in Cd accumulation in tobacco of different Cd accumulating genotypes [J].Acta Tabacaria Sinica, 2017, 23(4)
*Corresponding author.Email:tangzhong@njau.edu.cn

