烟叶中多菌灵农药残留的降解规律和影响因素
李义强,周杨全,3,徐金丽,徐光军,韦建玉,苏赞,胡亚杰,张纪利
1 中国农业科学院烟草研究所,国家烟草专卖局病虫害监控与综防重点实验室,青岛 266101;
2 广西中烟工业有限责任公司,南宁 530001;
3 云南省烟草公司曲靖市公司,曲靖 655000
烟叶中多菌灵农药残留的降解规律和影响因素
李义强1,周杨全1,3,徐金丽1,徐光军1,韦建玉2,苏赞2,胡亚杰2,张纪利2
1 中国农业科学院烟草研究所,国家烟草专卖局病虫害监控与综防重点实验室,青岛 266101;
2 广西中烟工业有限责任公司,南宁 530001;
3 云南省烟草公司曲靖市公司,曲靖 655000
为探索有效控制烟叶中多菌灵农药残留的措施,采用液相色谱-串联质谱检测技术,研究了多菌灵及其他常见苯并咪唑类杀菌剂在烟草上的农药残留特征及环境因子、采收后处理方式和储存条件对其降解的影响,明确了合理使用条件下多菌灵农药残留水平与形成机制。结果表明:基于QuEchERS前处理与液相色谱-串联质谱检测技术可以快速、准确检测3种常用苯并咪唑类杀菌剂,标准曲线、定量限、添加回收率符合农药残留检测方法要求;多菌灵、苯菌灵、甲基硫菌灵在鲜烟叶中的理论半衰期为6.8、6.3、6.6 d;25℃、湿度60%的环境最利于多菌灵降解;3种农药残留在冻干、杀青、烘烤过程的加工因子分别为5.11~5.66、3.95~4.55、2.96~3.39;多菌灵在常温和恒温条件下储存烟叶中的半衰期为224~365 d。在植物体内活性酶的作用下,田间降解是农药残留降解的主要方式,施药时药液浓度、末次施药到采收的间隔时间对多菌灵残留量有显著影响,加工方式、储存环境及储存时间也与其有一定关系。
多菌灵;苯并咪唑类杀菌剂;烟叶;农药残留;降解
多菌灵属于苯并咪唑类杀菌剂中的主要农药品种,苯并咪唑类杀菌剂具有较强内吸性和高效、广谱、低毒等特点,对植物病原真菌有较强的杀菌作用,广泛应用于蔬菜、水果等多种作物的真菌性病害防治。市场上推广应用的苯并咪唑类杀菌剂产品主要有多菌灵、苯菌灵和甲基硫菌灵等。甲基硫菌灵、苯菌灵为不稳定化合物,在植物体内可代谢为多菌灵[1-3]。根据中国农业部农药登记资料,甲基硫菌灵为在烟草上登记使用的农药,用于烟草白粉病、根黑腐病的防治。苯菌灵和多菌灵未在烟草登记,但多菌灵和苯菌灵的不同剂型及复配制剂在蔬菜、水果和粮食作物病虫害防治中广泛登记,在农业生产中应用较普遍,也常有违规乱用于烟叶生产的情况。近几年烟叶中多菌灵农药残留检出率较高,对烟叶质量安全带来一定风险。为进一步明确多菌灵农药残留的形成机制,从源头上解决多菌灵农药残留问题,本研究针对苯并咪唑类杀菌剂开展了其残留特征、于烟叶田间生长和储存环节的降解及影响因子、采收后处理方式等一系列研究,旨在探索多菌灵农药残留的关键因子和控制对策。
1 材料与方法
1.1 实验试剂
多菌灵标准品(99.0%)、苯菌灵标准品(98.5%)、甲基硫菌灵标准品(97.7%),皆购自德国Dr.Ehrenstorfer GmbH公司。50%多菌灵可湿性粉剂(江苏省福达农化有限公司,推荐用量750~900 g.a.i./hm2),50%苯菌灵可湿性粉剂(江苏泰仓农化有限公司,推荐用量500-600倍液),36%甲基硫菌灵可湿性粉剂(江苏蓝丰生物化工股份有限公司,防治烟草根黑腐病,推荐用量800~1000倍液)。N-丙基乙二胺(PSA,Agela Technologies 公司);无水 MgSO4、NaCl、柠檬酸钠、柠檬酸氢二钠(上海国药集团化学试剂有限公司,均为分析纯);甲醇(色谱纯,德国Merck公司);甲酸(色谱纯,德国CNW Technologies 公司);乙腈(色谱纯,德国Merck公司;上海国药,分析纯);蒸馏水。
1.2 仪器设备及检测条件
液相色谱-三重四极杆质谱联用仪LC-MS/MS(TSQ QUANTUM ULTRA,美国Thermo公司);BSA323型万分之一电子天平(瑞士赛多利斯公司);T-25 basic ULTRA-TURRAX 高速植物组织捣碎机(德国IKA 公司);HYQ-3110涡旋混匀器(美国Crystal公司);多管涡旋混合仪(杭州奥盛仪器有限公司);3K15高速离心机(美国Sigma公司)。
1.3 试验方法
1.3.1 苯并咪唑类杀菌剂在烟草中残留量与降解规律田间试验
田间试验分别于山东青岛、四川西昌进行,供试烟草品种为中烟100(山东)和云烟87(四川),整个田间生产过程符合当地良好农业规范(GAP)生产要求。参照农业部《农药残留试验准则》和《农药登记残留田间试验标准操作规程》[4-5],动态试验按照1.5倍推荐高剂量用药,最终试验按照不同施药剂量和施药次数进行试验。每小区面积30 m2,小区试验重复3次,随机排列,设置小区保护带与对照小区。
烟叶中农药残留消解动态田间试验 烟株现蕾后期,叶面均匀喷雾施药多菌灵、苯菌灵和甲基硫菌灵的有效成分用量分别为1350、1350、607 g a.i./hm2,用水量900 L/hm2。于施药后1 h,1、3、5、7、14、21、28、35、42 d采样,样品去主脉、切碎、混匀,四分法留样不少于200 g,-20℃环境保存,待检测。
烟叶烘烤前后及不同采收间隔期最终残留量田间试验 旺长中后期至成熟期施药。3种农药分别按照1.5倍推荐高剂量(1350、1350、607 g a.i./hm2)、推荐高剂量(900、900、405 g a.i./hm2),分别施药3、4次,用水量900 L/hm2,叶面均匀喷雾。于最后一次施药后7天,采用半叶法实验研究烘烤前后农药残留量的降解变化:随机采集烟叶样品不少于100片,半叶法称重编杆后,经三段式烘烤工艺烘烤,进行烘烤处理,另外一半烟叶直接切碎混匀称重留样。最后一次施药后14、21、28 d,随机采集烟叶样品不少于100片,经三段式烘烤工艺烘烤,烟叶去主脉粉碎,缩分后留样不低于100 g,-20℃环境保存,待检测。
1.3.2 不同制样方法对苯并咪唑类杀菌剂残留量的影响试验
最后一次施药后7 d,随机采集烟叶样品不少于100片,半叶法称重后,分别进行烘烤、杀青和冻干处理,另外一半烟叶直接称重。烘烤:烟叶按照三段式工艺烘烤,经历变黄-定色-干筋三个阶段,时间大致6 d。杀青:鲜烟叶置于烘箱中,于 105℃下杀青30 min, 再于 60℃下烘至足干。冻干:鲜烟叶置于低温冷冻干燥机内,在-20℃条件下冷冻干燥48 h。所有烟叶去主脉粉碎,缩分后留样不低于100 g,-20℃环境保存,待检测。
1.3.3 不同环境因子对多菌灵残留降解规律影响的盆栽试验
用直径为40 cm的花盆,栽种130份盆栽烟草,正常水肥管理至现蕾期,按照多菌灵1350 g a.i./hm2的剂量喷雾施药,用水量900 L/hm2。施药后2 h待药液干后,分别移入不同温度、湿度、光照条件的3 m×4 m的人工气候室或小拱棚中,每种环境条件的气候室10盆,摆放密度为0.5 m×1 m。在施药后2 h、1d、3d、5d、7d、10d、14d、21d、28d、35 d 从烟株上中下各部位取样,每株取3片烟叶,切碎、混匀,四分法留样100 g,-20℃保存,待处理和检测。温度条件:气候室温度分别设置为20、25、30、35℃,湿度条件统一设定为65%±2%。湿度条件:分别置于环境湿度为40%、60%、80%、100%的人工气候室,温度统一设定为25±1℃。光照条件:烟株放入3个不同光照强度的小拱棚内,田间行株距1×0.5m,用遮阴网封闭,调节遮阴网的层数与相对位置,用光照计检测遮阴棚内光强,使光照强度分别为25%自然光,50%自然光,75%自然光。3个棚适当通风,保持温湿度基本一致。
1.3.4 不同地点烟叶储存过程中多菌灵降解试验
选择不含多菌灵农药的烟叶样品,切丝,添加适量多菌灵标样,充分混合均匀。为保证后期能够检测到数据,选择了5 mg/kg和25 mg/kg作为添加初始浓度,充分混合均匀后,盛于纸箱中。高低浓度的纸箱分别置于25℃、60%的恒温恒湿箱和自然环境中。分 别 于 添 加 后 0、5、10、15、30、45、60、90、120、180、240、300、360、420 d从纸箱中取20 g样品,检测多菌灵农药残留含量。
1.4 残留检测
1.4.1 农药残留前处理方法
在文献基础上[6-10],研究优化形成了QuEchERS前处理与LC-MS/MS检测相结合的测定烟草中甲基硫菌灵、苯菌灵及代谢物多菌灵残留量的方法。具体操作如下:烟叶样品用组织捣碎机研磨,称取磨碎的鲜烟叶5.0 g(或烤后烟叶、烟丝2.0 g,加2 mL蒸馏水浸润,静置5 min)盛于离心管中,加入10 mL乙腈,于多管涡旋混合仪上振荡提取10 min,加入混合盐包(1 g NaCl、0.5 g柠檬酸氢二钠、4 g无水MgSO4和1 g柠檬酸钠),立即振荡2 min,以4000 r/min离心10 min。移取1.5 mL上清液,置于离心管中,加入25 mg PSA和150 mg无水MgSO4,振荡2 min,以13000 r/min 离心5 min,吸取上清液500 μL,加入500 μL初始流动相乙腈/0.1%甲酸水(v:v=1:9),过0.22 µm有机相滤膜,装瓶待测。
1.4.2 农药残留检测条件
LC-MS/MS色谱条件:色谱柱Thermo Hypersil GOLD C18 (3.0 µm,2.1×100 mm);流动相为甲醇溶液和0.1%甲酸水溶液(v/v),流速:0.25 mL/min,采用 1:9(v/v,0~1 min)-9:1(v/v,1~7.5 min)-1:9(v/v,7.5~10 min)梯度洗脱;柱温25℃;进样量10 µL。质谱条件:离子源:电喷雾离子源ESI;扫描方式:正离子源;喷雾电压:3000 V;毛细管温度:300℃;鞘气压力:50 Arb;辅助气压力:20 Arb;检测方式:多重反应监测(MRM,具体条件见表1)。

图1 多菌灵(B、C)、苯菌灵(H、I)、甲基硫菌灵(E、F)典型TIC色谱图Fig.1 Typical TIC spectrum of three benzimidazole fungicides

表1 三种苯并咪唑类杀菌剂的MRM条件Tab.1 The instrument conditions of three benzimidazole fungicides in MRM
1.4.3 标准曲线与添加回收率
分别称取并配置浓度为100 mg/L的多菌灵、苯菌灵、甲基硫菌灵标准溶液。再用鲜烟叶、干烟叶空白提取液稀释,配得浓度为0.005、0.01、0.05、0.1、0.5、1、5 mg/L的基质加标系列标准溶液,在上述仪器条件下测定。分别以进样浓度(mg/kg)为横坐标,相应色谱测定峰面积为纵坐标,绘制标准曲线。分别用空白鲜烟叶、干烟叶添加0.01、0.1、2 mg/kg 不同浓度的多菌灵、苯菌灵、甲基硫菌灵标准溶液,按照前处理方法提取、净化、检测,每个水平重复5次,进行添加回收率检测验证。
2 结果分析
2.1 标准曲线、检出限与添加回收率
在0.001~5 mg/kg范围内,3种农药的峰面积与质量浓度呈良好的线性关系。以3倍信噪比进行计算,得出多菌灵、苯菌灵、甲基硫菌灵的最低仪器检出限(LOD)均为1.0×10-11g,同时根据最小添加水平得到3种农药的定量限(LOQ)为0.01~0.05 mg/kg。(表2)。多菌灵、苯菌灵、甲基硫菌灵在LOQ、0.2、2 mg/kg 3个水平的添加回收率结果分别为:89.5%~98.5%、84.9%~93.8%、81.1%~101.5%,相对标准偏差分别为:1.8%~6.6%、3.6%~5.0%、3.2%~8.1%。添加回收率结果均符合残留检测方法要求,可以用于烟叶中3种农药的多残留检测。

表2 多菌灵、苯菌灵、甲基硫菌灵在烟叶中的线性方程、相关系数与定量限Tab.2 Regression, correlation coefficient, LOD and LOQ of three benzimidazole fungicides
2.2 常见苯并咪唑农药在烟叶中残留量与降解半衰期
3种苯并咪唑类杀菌剂在山东、四川1年2地烟叶中最终残留试验结果(表3)表明,末次施药14 d后多菌灵在烟叶中的残留量为1.82~3.64 mg/kg,21 d后降解为0.93~2.44 mg/kg,28 d后最终残留量为0.73~1.88 mg/kg。末次施药14 d 后苯菌灵在烟叶中(以多菌灵计)的残留量为2.44~6.34 mg/kg,21 d后降解为 1.61~3.36 mg/kg,28 d后最终残留量为 1.03~1.98 mg/kg。末次施药14 d 后,甲基硫菌灵(以多菌灵计)在烟叶中的残留量为4.68~15.69 mg/kg,21 d后降解为 0.91~5.99 mg/kg,28 d后最终残留量为 0.2~1.74 mg/kg。
经检测,烘烤前鲜烟叶中多菌灵、苯菌灵、甲基硫菌灵的含量为2.74、0.42、1.10 mg/kg(烘烤前后干鲜烟叶的重量比为1:6.25,去除含水量后折算的3种农药含量分别为17.12、2.62、6.88 mg/kg),烘烤后干烟叶中含量为8.12、1.34、3.74 mg/kg。烘烤过程农药残留降解率为45.7%~52.7%。烟叶烘烤是保证烟叶香吃味、提高其商品特性的特殊加工过程,在烘烤过程中烟叶内含物质充分转化,促进香气形成,农药在高温高湿条件下又可明显降解。

表3 三种苯并咪唑类杀菌剂在烟叶中的最终残留Tab.3 Terminal residue of three benzimidazole fungicides in cured tobacco leaves
3种农药在鲜烟叶中的消解曲线见图2。多菌灵、苯菌灵、甲基硫菌灵在鲜烟叶中的原始沉积量分别为41.1~55.6、15.7~28.4、16.0~17.7 mg/kg,施药 7 d 后消解率超过50%,施药28 d后消解率超过90%,多菌灵、苯菌灵、甲基硫菌灵在鲜烟叶中的理论半衰期为 6.8、6.3、6.6 d。

图2 多菌灵、苯菌灵、甲基硫菌灵在烟叶中农药残留降解曲线Fig.2 Dissipation curves of three benzimidazole fungicides in fresh tobacco leaves
2.3 不同制样方式对烟叶中农药残留量的影响
目前针对烟叶样品常采用直接鲜样储存、烘烤、杀青和冻干等不同的处理方式。检测结果显示(表4),鲜烟叶中多菌灵、苯菌灵、甲基硫菌灵的浓度为2.74、0.42、1.10 mg/kg,以冻干方式处理的烟叶中多菌灵、苯菌灵、甲基硫菌灵残留量为15.5、2.15、6.24 mg/kg,以杀青方式处理的烟叶中多菌灵、苯菌灵、甲基硫菌灵残留量为12.5、1.66、4.93 mg/kg,以三段式烘烤方式处理的烟叶中多菌灵含量为8.12、1.34、3.74 mg/kg。经过称重计算,干鲜烟叶的重量比为1:6.25。冻干、杀青、烘烤3种处理方式,烟叶中农药残留都有一定程度降解,其中冻干过程3种农药残留降解较弱,损失率为9.4%~18.2%;杀青过程农药残留有一定程度降解,损失率为36.9%~28.4%;烘烤过程农药残留有较大幅度降解,损失率为45.7%~52.7%。3种农药残留在冻干、杀青、烘烤过程的加工因子分别为 5.11~5.66、3.95~4.55、2.96~3.39。
冻干、杀青、烘烤3种处理过程,3种农药的损失率均为烘烤>杀青>冻干。烟叶杀青处理过程中,105℃的高温条件使微生物彻底变性失活,高温也会使部分农药分解。冻干处理过程中,微生物失活,低温也不利于农药分解,可作为保持烟叶中农药残留基础水平的制样方式。
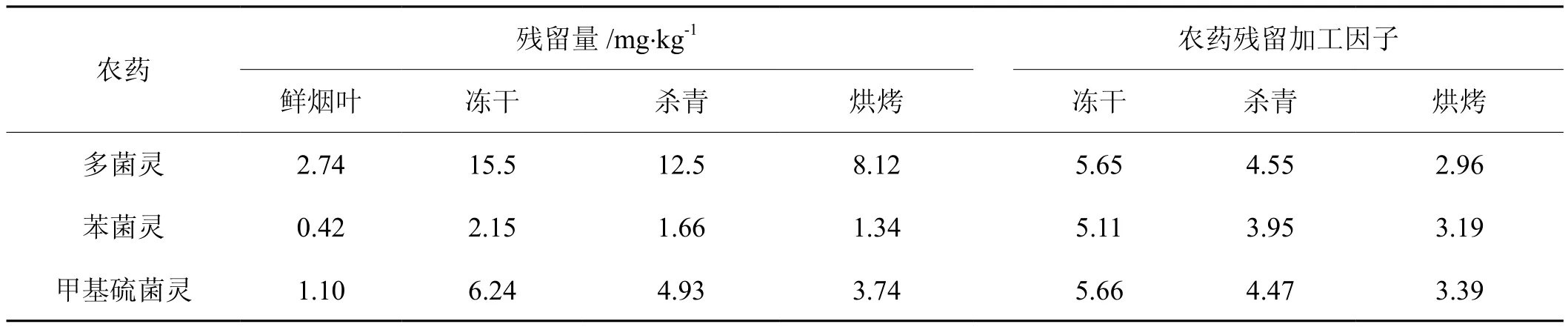
表4 不同农药在不同加工过程中的残留量与加工因子Tab.4 Three benzimidazole fungicides residues and processing factors in tobacco leaves after lyophilizing, fixing, curing
2.4 气象因子对烟叶中多菌灵农药残留降解的影响
2.4.1 温度对烟叶中多菌灵降解的影响
温度对多菌灵在烟叶中降解的影响差异较大(表5)。当环境温度为25℃时,其降解速率达到最快,半衰期最短,在温度为35℃时降解速率最慢。25℃条件下烟叶生长较好,酶的活性最强,对农药残留降解和代谢能力较强。35℃条件下,烟叶在高温胁迫下,酶的活性有一定程度干扰,代谢能力较低,多菌灵的降解转化传导能力较低。
2.4.2 湿度对烟叶中多菌灵降解的影响
在40%湿度条件下处理的烟叶多菌灵的原始沉积量为51.3 mg/kg,在7 d时消解超过50%,28 d时消解超过90%,消解半衰期为8.4 d(表6)。在60%湿度条件下处理的烟叶多菌灵的原始沉积量为47.6 mg/kg,5 d时消解即超过50%,21 d消解率超过90%,消解半衰期为6.5 d。在80%湿度条件下处理的烟叶多菌灵的原始沉积量为53.5 mg/kg,14 d时消解率超过50%,35 d时消解率超过90%,消解半衰期为9.9 d。100%湿度条件下的烟叶多菌灵的原始沉积量为48.3 mg/kg,21 d时消解率超过50%,35 d时消解率尚未达到90%,消解半衰期为14.2 d。分析可知,在一定的湿度范围内,随着湿度的升高,多菌灵在烟叶中的降解速率也逐渐加快。在湿度为60%半衰期最短,降解速率最快,在湿度为100%时,半衰期最长,降解速率最慢。

表5 不同温度下多菌灵的残留降解及相关动力学参数Tab.5 Carbendazim residue degradation and dynamic parameters at different temperatures mg.kg-1, %

表6 不同湿度下多菌灵在烟叶中的残留降解及相关动力学参数Tab.6 Carbendazim residue degradation and dynamic parameters at different humidity mg.kg-1, %
2.4.3 光照强度对烟叶中多菌灵降解的影响
在不同光照强度下烟叶中多菌灵的残留降解测定结果见表7。结果显示25%自然光照条件下处理的烟叶多菌灵的原始沉积量为43.60 mg/kg,在21 d时消解超过50%,35 d时消解超过80%,消解半衰期为13.4 d。50%自然光照条件下处理的烟叶中多菌灵的原始沉积量为43.60 mg/kg,14 d时消解即超过50%,35 d消解率超过90%,消解半衰期为9.6 d。75%自然光照条件下处理的烟叶多菌灵的原始沉积量为48.60 mg/kg,5 d时消解率超过50%,28 d时消解率超过90%,消解半衰期为7.4 d。自然光照条件下的烟叶多菌灵的原始沉积量为46.50 mg/kg,5 d时消解率超过50%,28 d时消解率超过90%,消解半衰期为6.7 d。由此可见,在25%-100%自然光范围内,随着光照强度的增加,烟叶中多菌灵的半衰期逐渐减小,消解速率逐渐升高。可能是随着光照强度的增大,烟叶中农药的光解作用增强,另一方面也可能是烟叶光合作用增加,对多菌灵的吸收转化能力增加,加快了多菌灵的降解速率。
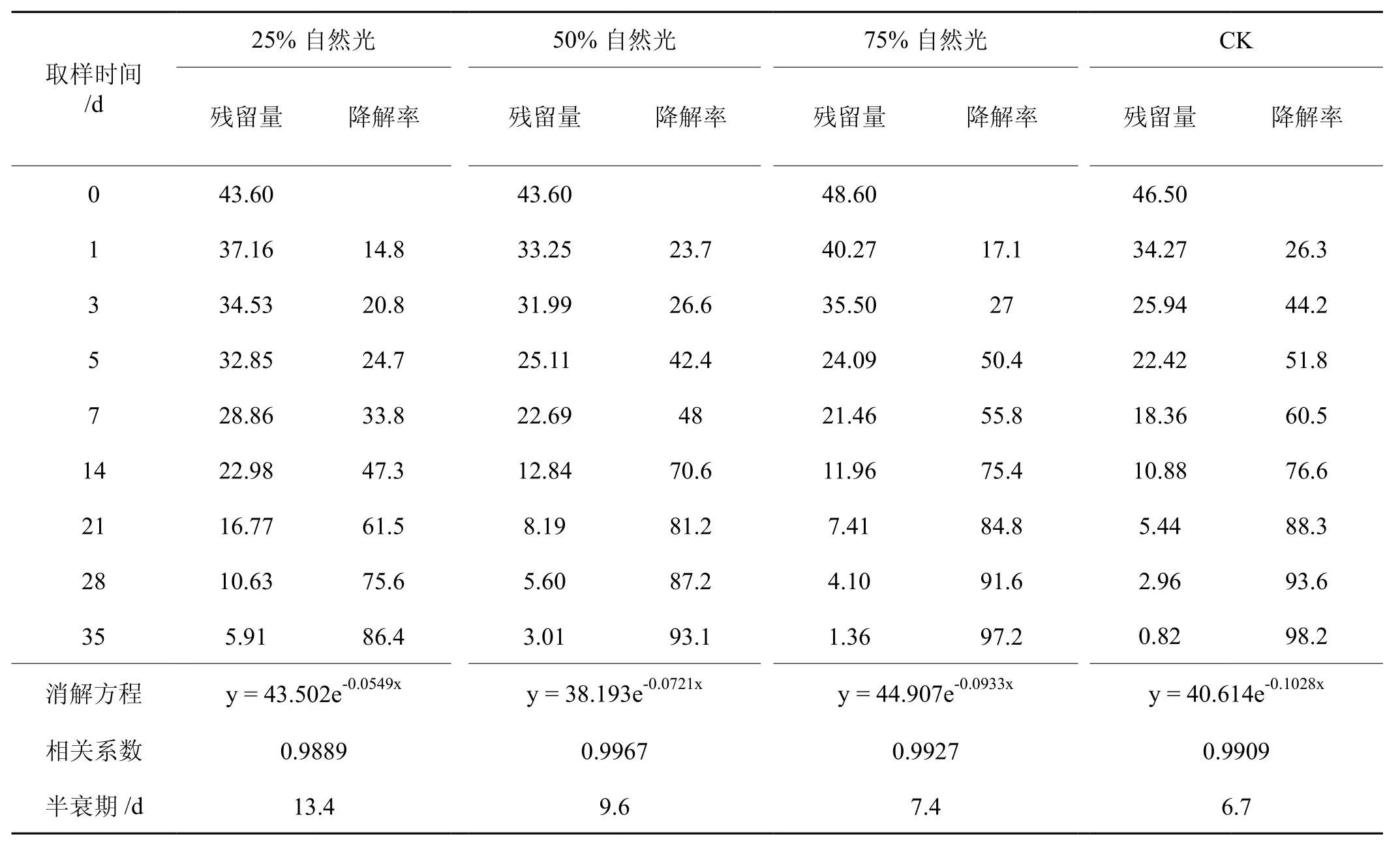
表7 不同光照强度下多菌灵的残留降解及相关动力学参数Tab.7 Carbendazim residue degradation and dynamic parameters at different light intensity mg.kg-1, %
2.5 储存过程中多菌灵农药残留降解规律
多菌灵在烟丝中的消解动态结果见表8。低浓度处理的烟丝原始沉积量为4.89~4.91mg/kg,高浓度处理的烟丝原始沉积量为24.84~24.87mg/kg。常温贮存与恒温恒湿贮存下的低浓度处理烟丝原始沉积量差别不大,高浓度处理烟丝原始沉积量差别不大。常温常湿条件下,低浓度多菌灵处理的烟丝中多菌灵降解最快,恒温恒湿条件下,高浓度多菌灵处理的烟丝中多菌灵降解最慢。分析原因,可能是夏天外界温度高,常温下的温度较高,造成了烟丝中多菌灵降解较快。低浓度常温处理的烟丝在贮藏300 d时降解超过50%,高浓度常温处理的烟丝在贮藏420 d 时降解超过50%,低浓度恒温恒湿处理的烟丝在贮藏240 d时降解超过50%,高浓度恒温恒湿处理的烟丝在贮藏300 d时降解超过50%。多菌灵在烟丝中的残留量与贮藏时间具有较高的相关性,符合一级动力学方程。理论半衰期分别为239 d、365 d、224 d、247 d。
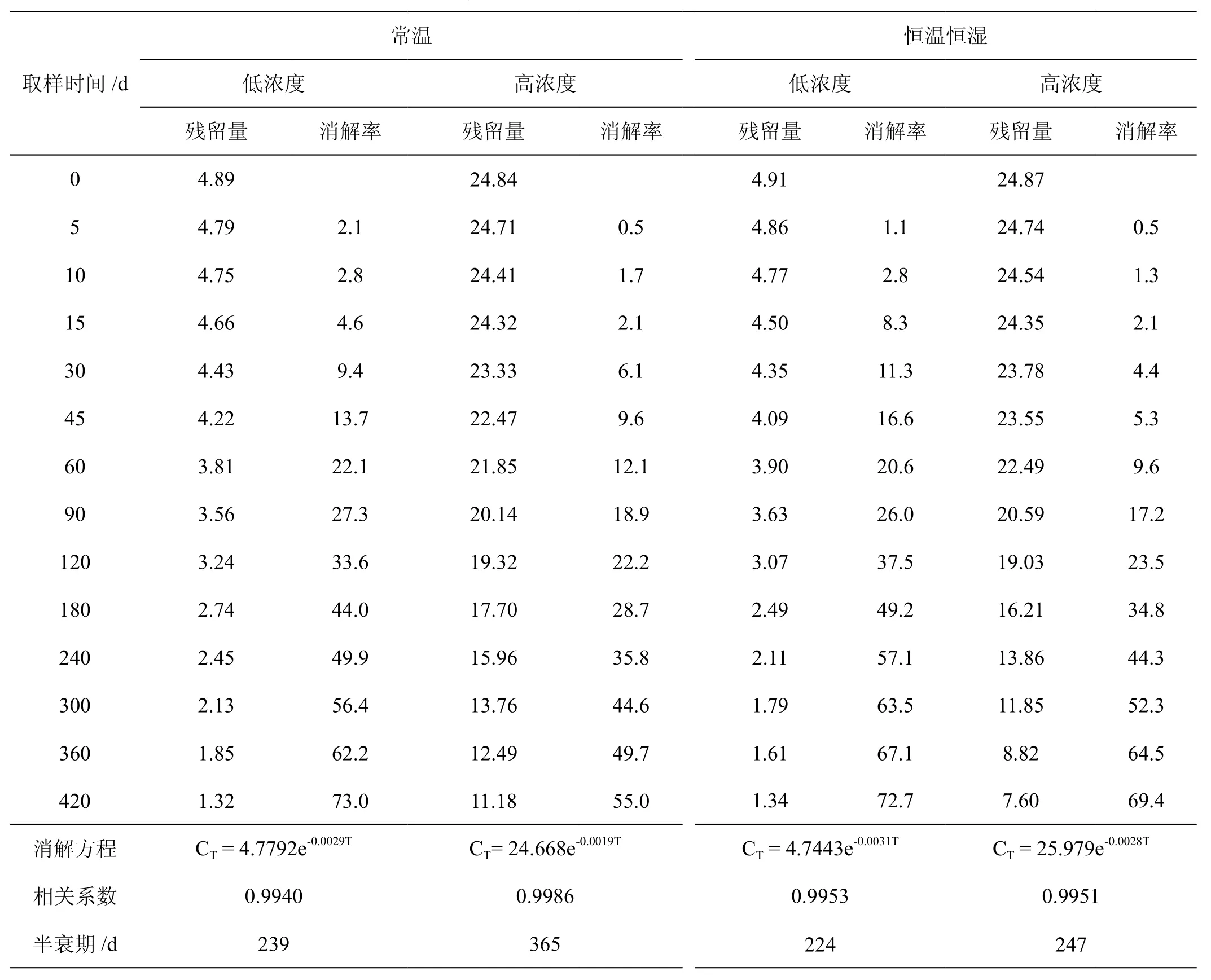
表8 多菌灵在贮藏过程中的消解动态结果Tab.8 Degration dynamics of carbendazim in storage condition mg.kg-1, %
3 结论与讨论
虽然多菌灵未在烟草病害防治中登记,但多菌灵是农业生产中常用的农药,在烟草生产中有较广泛的应用,同时登记用于防治烟草根黑腐病的甲基硫菌灵在烟株内也可以转化为多菌灵。目前国际烟草合作研究中心(CORESTA)和中国烟草总公司企业标准中,规定了多菌灵、甲基硫菌灵(以多菌灵计)、苯菌灵(以多菌灵计)的农药残留限量为2 mg/kg[11]。按照正常剂量和次数使用,末次施药后28d,苯并咪唑类杀菌剂的农药残留低于限量水平。根据烟草生长发育过程及病害发生特点,在现蕾期以前,可以使用几种苯并咪唑类杀菌剂防治烟草根黑腐病、烟草白粉病,但在烟叶现蕾至成熟采烤期,严格控制使用该类农药。
温湿度和光照试验中,环境条件的差异对多菌灵降解影响效果明显。有学者认为,在25~70℃温度范围内,随着温度的升高,多菌灵的水解速度明显加快[12];内吸性杀菌剂施用后会很快被吸收到烟草植株体内,烟草植株本身的生长发育及生理生化特性会影响其对内吸性杀菌剂的吸收传导[13]。40%~60%湿度范围内,随着湿度的增加,烟叶的生长条件越来越合适,烟叶生长较快,对多菌灵的吸收传导能力越来越高,因此在环境湿度为60%时,烟叶处理生长最适湿度,农药降解最快。当超过60%时,随着湿度的增加,烟叶中多菌灵向空气扩散能力及在烟株中传导能力降低,多菌灵降解较慢。有学者认为,烟株本身的生长稀释作用会对农药在烟叶中的积累和降解造成差异,内吸性杀菌剂施用后会很快被吸收到烟草植株体内,烟草植株本身的生长发育及生理生化特性会影响其对内吸性杀菌剂的吸收传导和降解[14-17],在温度25℃、湿度60%和100%光照条件下,烟叶生长发育最快,酶活性最强,生长稀释和传导也是促进农药残留降解的因素。
加工或制样过程对农药残留水平的影响有较大差异,通常采用加工因子(Processing Factors,PF)来表示[18]。在烟叶种植和加工的不同阶段,苯并咪唑类农药残留有较明显差异。在烟叶田间生长过程中,由于温度、湿度、光照等外部条件影响下,叶片表面及叶肉组织中的农药残留可以得到明显降解[19],其中以25℃、相对湿度60%、阳光充足时农药残留降解迅速。烘烤过程中,高温可以促进农药残留迅速降解[20],正常烘烤前期温度相对较低,湿度相对较高,此时烟叶中微生物活性较高,对3种农药的分解仍在继续进行,而烘烤处理的时间较长,也是导致烟叶中农药降解较快的一个关键因素[21-22]。但烟叶失水导致多菌灵农药残留的浓缩作用大于其自身降解,烤后干烟叶比烤前鲜烟叶中的农药残留量增高,烘烤过程中农药残留加工因子为2.96~3.39,冻干过程中农药残留损失极小,可作为保持烟叶中农药残留基础水平的制样方式。干烟叶中生物酶活性丧失,同时储存过程对烟叶水分含量和环境湿度有较严格要求,烟叶内含物或外源物质代谢缓慢,导致多菌灵农药残留降解较慢,半衰期为224~365d。对于多菌灵农药残留的控制,由于储存期农药残留降解缓慢,所以需要发挥田间生长过程中农药残留降解快的优势,充分利用光解、酶解、雨淋、自然降解等各种因素,采取控制使用剂量和次数,保证施药到采收的安全间隔期等措施。
[1]刁春玲, 刘芳, 宋宝安.农用杀菌剂作用机理的研究进展[J].农药, 2006, 45(6): 374-377.DIAO Chunling, LIU Fang, SONG Baoan.Research progress on the mechanism of action of agricultural fungicides [J].Agrochemicals, 2006, 45(6): 374-377.
[2]张英, 杨松, 宋宝安等.苯并咪唑类化合物杀菌活性的研究进展 [J].农药, 2008, 47(3): 164 - 170.ZHANG Ying, YANG Song, SONG Baoan, et al.Recent Advances in the Antimicrobial Activity of Benzimidazole Compounds[J].Agrochemicals, 2008, 47(3): 164-170.
[3]Matin Danaher, Hendrik De Ruyck, Steven R.H.Crooks,et al.Review of methodology for the determination of benzimdazole residue in biological matrices[J].Joural of chromatography B,2007, 84 (5): 1-37.
[4]王运浩.农药登记残留田间试验标准操作规程[M].北京: 中国标准出版社, 2007.WANG Yunhao.Standard oprating procedures on pesticide registration residue fi eld trials[M].Beijing, China: China Standard Press, 2007.
[5]NY/T 788-2004, 农药残留试验准则[S].北京: 中国农业出版社,2004.
[6]NY/T 788-2004.Guideline on pesticide residue trials[S].Beijing,China: China agriculture press, 2004.YC/T405.1-2011, 烟草及烟草制品 多种农药残留量的测定 第1部分:高效液相色谱-串联质谱法[S].北京: 中国标准出版社,2011.YC/T405.1-2011, Tobacco and tobacco products--Determination of multi-pesticide residues Part 1:High performance liquid chromatography-tandem mass spectrometry method[S].Beijing, China: China Standard Press,2011.
[7]杨飞, 边照阳, 唐纲岭,等.LC-MS/MS同时检测烟草中的6种杀菌剂[J].烟草科技, 2012(11):45-50.YANG Fei, BIAN Zhaoyang, TANG Gangling, et al.Simultaneous Determination of 6 Antiseptics in Tobacco with LC-MS/MS Method[J].Tobacco Science & Technology, 2012, 45(11): 45-50.
[8]刘谦, 刘丽丽, 周杨.高效液相色谱串联质谱测定水果和蔬菜中的甲基硫菌灵和多菌灵残留[J].农药科学与管理, 2014,35(2): 22-26.LIU Qian, LIU lili, ZHOU Yang.Determination of Thiophanatemethyl and Carbendazim in vegetables and fruits by LC /MS/MS[J].Pesticide Science and Administration, 2014, 35(2): 22-26.
[9]张志勇, 龚勇, 单炜力, 等.QuEChERS-高效液相色谱-串联质谱法测定黄瓜和土壤中甲基硫菌灵和多菌灵 [J].色谱, 2012,30(1): 91-94.ZHANG Zhiyong, GONG Yong, SHAN Weili, et al.Determination of thiophanate-methyl and carbendazim in cucumber and soil by QuEChERS-high performance liquid chromatography-triple quadrupole tandem mass spectrometry[J].Se pu= Chinese journal of chromatography/Zhongguo hua xue hui, 2012, 30(1): 91-94.
[10]Schenck F J, Hobbs J E.Evaluation of the quick, easy, cheap,effective, rugged, and safe (QuEChERS) approach to pesticide residue analysis[J].Bulletin of environmental contamination and toxicology, 2004, 73(1): 24-30.
[11]CORESTA guidance No.1-2013The concept and implementation of CPA guidance residue level[DB/OL](2016-07).http://www.coresta.org/Guides/Guide-No01-GRLs(4th-Issue-July2016).pdf.
[12]郭振华, 王健, 贾临芳等.多菌灵在不同水环境中的残留降解动态分析[C].第五届全国农业环境科学学术研讨会论文集.2013.4: 743-748.GUO Zhenhua, WANG Jian, JIA Linfang, et al.Residue and degradation dynamic analysis of carbendazim in different water environment[C].Proceedings of the Fifth National Symposium on Agricultural Environmental Science, 2013.4: 743-748.
[13]李晓亮,秦智伟,候利园,等.土壤环境因素对残留农药降解的影响.东北农业大学学报,2009, 4(4): 132-135.LI Xiaoliang, QIN Zhiwei, HOU Liyuan, et al.Influence of environmental factors on degradation of residual pesticide in soil [J].Journal of Northeast Agricultural University, 2009, 4(4): 132-135.
[14]梅立永, 赵智杰, 尹璇, 等.拟除虫菊酯类农药环境行为与归趋模拟[J].农业环境科学学报.2007,26(6): 2316 – 2322.MEI Liyong, ZHAO Zhijie, YIN Xuan, et al.Simulating the Environment Behavior and Fate of Synthetic Pyrethroids [J].Journal of Agro-Environment Science, 2007,26(6): 2316 – 2322.
[15]张洋, 李文龙, 王玉军.理化性质对农药降解影响的研究进展[J].科技信息, 2012 (3): 8-9.ZHANG Yang, LI Wenlong, WANG Yujun.Advance and prospect of the effects of physics and chemistry properties to pesticidedegrading[J].Scienti fi c Information, 2012 (3): 8-9.
[16]王秀国, 张倩, 徐金丽, 等.噻菌茂在烟叶和土壤中的残留消解动态及安全性评价[J].农业环境科学学报, 2012, 31(11): 2180-2185.WANG Xiuguo, ZHANG Qian, XU Jinli, et al.Residue Dynamics and Safety Evaluation of Saijunmao in Tobacco Leaves and Soil [J].Journal of Agro-Environment Science, 2012, 31(11): 2180-2185.
[17]TEWARY D K,KUMARY V, RAVINDRANATH S D, et al.Dissipation behavior of bifenthrin residues in tea and its brew[J].Food Control,2005, 16(3): 231-237.
[18]陈志强,徐志,冯信平,等.加工过程对农药残留的影响研究进展[J].农药科学与管理,2013,34(8):32-36.CHEN Zhiqiang, XU Zhi, FENG Xinping, et al.Progress in Research of the Effect of Processing on Pesticide Residues[J].Pesticide Science and Administration, 2013,34(8): 32-36.
[19]Xu XM, Murray RA, et al.The effects of temperature, humidity and rainfall on captan decline on apple leaves and fruit in controlled environment conditions[J].Pest Manag Sci.2008 Mar ;64(3):296-307.
[20]李玲琴.茶叶中农药残留动态及降解技术[D].福建农林大学,2007.LI Lingqin.The dynamic trende and degradation techniques of pesticide residues in tea[D].Fujian Agriculture and Forestry University, 2007.
[21]王传义, 张忠锋, 徐秀红, 等.烟叶烘烤特性研究进展[J].中国烟草科学, 2009, 30(1): 38-41.WANG Chuanyi, ZHANG Zhongfeng, XU Xiuhong, et al.Advance in Leaf Curing Characteristics of Flue-cured Tobacco [J].Chinese Tobacco Science, 2009, 30(1): 38-41.
[22]黄宝勇, 肖志勇, 欧阳喜辉.贮藏温度条件对蔬菜基质中农药残留稳定性的影响[J].农产品质量与安全.2013,2(2): 48-51.HUANG Baoyong, XIAO Zhiyong, OUYANG Xihui.Effects of storage temperature on pesticide residue stability in vegetable[J].Quality And Safety Of Agro-Products, 2013,2(2): 48-51.
Degradation characters and in fl uencing factors of carbendazim residues in tobacco leaf
LI Yiqiang1*, ZHOU Yangquan1, XU Jinli1, XU Guangjun1, WEI Jianyu2, SU Zan2, HU Yajie2, ZHANG Jili2
1 Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Key laboratory of Tobacco Pest Monitoring Controlling & Integrated Management, Qingdao 266101, Shandong, China;
2 China Tobacco Guangxi Industrial Co., Ltd., Nanning 530001, China;
3 Yunnan Qujing Municipal Tobacco Company, Qujing 655000, Yunnan, China
In order to effectively control carbendazim pesticide residues in tobacco leaves, a modi fi ed QuEChERS combined with LCMS/MS method to detect and characterize pesticide residue of carbendazim and other three benzimidazole fungicides in tobacco leaf was developed.The method successfully indicated influence of environmental factors, processing methods and storage conditions on degradation, and clearly demonstrated the level and formation mechanism of carbendazim residue under reasonable utilization.Results showed that the standard curve, the quantitative limit and the recoveries conformed to the requirements of pesticide residue detection method.The theoretical degrading half-life of carbendazim, benomyl and thiophanate-methyl in fresh tobacco leaf was 6.8, 6.3 and 6.6 days, respectively.The best condition for degradation of carbendazim was 25℃ and 60% humidity.The processing factors of freeze-drying,editing and curing for the three pesticide residues were 5.11-5.66, 3.95-4.55 and 2.96-3.39, respectively.The half-life of carbendazim in cured tobacco leaf was 224-365 days in normal and constant temperature.Findings of this study also suggested that the degradation rate of carbendazim were obviously different with a rapid and crucial dissipation in growing period under active enzyme, and the carbendazim residue level was significantly influenced by the original pesticide concentration and intervals between last pesticide application and harvest.Moreover, the processing method, storage conditions and duration also had some impact on the residue level.
carbendazim; benzimidazole fungicides; tobacco leaf; pesticide residue; degradation
李义强,周杨全,徐金丽,等.烟叶中多菌灵农药残留的降解规律和影响因素[J].中国烟草学报,2017, 23(4)
国家烟草专卖局项目(TS-06-20110039) ;农业行业财政专项(201203091)
李义强(1976—),博士,研究员,主要从事农药残留与农产品质量安全研究,Tel:0532-88702236,Email:liyiqiang@caas.cn
2016-10-21;< class="emphasis_bold">网络出版日期:
日期:2017-06-02
:LI Yiqiang, ZHOU Yangquan, XU Jinli, et al.Degradation characters and in fl uencing factors of carbendazim residues in tobacco leaf [J].Acta Tabacaria Sinica, 2017, 23(4)
*Corresponding author.Email:liyiqiang@caas.cn

