金属有机框架配合物在药物传输方面的研究进展
徐 蕴,丁 芳,朱世胜,刘倩南,杨培培
①
(淮北师范大学 化学与材料科学学院,安徽 淮北 235000)
金属有机框架配合物在药物传输方面的研究进展
徐 蕴,丁 芳,朱世胜,刘倩南,杨培培
①
(淮北师范大学 化学与材料科学学院,安徽 淮北 235000)
金属有机框架材料(metal-organic frameworks,MOFs)因其稳定性好、比表面积大、易于修饰和剪裁等特点,在气体吸附、催化、光学以及生物医学等方面受到广泛关注.近年来,MOFs作为药物传输的一种新材料,具有较高的载药量、生物可降解性及可控性等优点,而被用来传输像布洛芬、5-FU、NO、普鲁卡因胺等的治疗药物.MIL(Materials of Institute Lavoisier),NMOFs(Nanoscale Metal-organic Frameworks),bio-MOFs是MOFs的几个重要分支,重点介绍这几种MOFs材料在药物传输方面的研究进展.
金属有机框架配合物;药物传输;研究进展
0 引言
金属有机框架材料(metal-organic frameworks,MOFs)是一种新颖的功能材料,它是由金属离子或者离子簇和有机配体链接而成的一系列具有二维或三维周期性结构的复合材料[1-5].该材料同时兼备无机材料和有机材料的优势.与传统材料相比,MOFs具有孔隙率高,比表面积大,种类多样,表面可修饰性等特点,其中一个标志性的特点是其内在的孔隙率,这使得它们能够被用于气体储存、分离、催化以及多种依赖于高特异性主-客体相互作用的应用等方面[6-10].MOFs这些结构特点使其成为最精彩、最多样,也是发展最快的现代化学研究领域之一.MOFs如此好的结构特点决定它不仅可以应用在气体储存、分离、催化等方面,还可以同生物医药领域相结合,作为药物传输的载体应用到临床医学上.药物载体是实现药物传输的介质,是药物传输的重要组成部分,也是实现药物缓释各种优点的主要因素.国内外学者对药物载体研究的深入,不同种类的药物载体具有不同的给药效果.目前所研究的可以作为药物载体材料的有大分子材料、脂质体、可生物降解的高分子材料、无机介孔材料等[11-13],但这些材料有一定的缺点:稳定性差,易分解,载药量少,不均匀,污染环境等等.金属有机框架材料具有可作为药物载体的理想特征:比表面积大,孔隙率高,能够包裹更多的药物分子,易变化的金属-配位键致使其有一定的生物降解能力,药物分子容易与其合成嫁接等.在过去的几年中,MOFs作为药物载体装载和释放药物分子的例子已经被报道过[14-17].本文将从MOFs的中几个典型的药物传输分支,介绍MOFs在药物传输方面的研究进展.
1 几种常见的MOFs药物载体
1.1 MIL系列作为药物载体
作为潜在药物传输系统被研究的第一组MOFs是MIL家族,它是由Férey课题组提出来的[18].MIL家族是由三价金属离子中心和羧酸配体桥连而成,因其有较大的孔洞(2.5~3.4 nm)和好的比表面积(3 100-5 900 m2/g),而在药物传输中很有发展前途.Férey课题组研究基于铬的MIL-101和MIL-100对布洛芬药物分子的储存和释放,如图1所示,两种材料都显示出对布洛芬具有较高的承载能力:MIL-100,0.347 g布洛芬/g MOF;MIL-101,1.376 g布洛芬/g MOF.造成这两种材料药物装载量不同的主要原因在于其孔径大小[19].通过在37℃体外模拟实验中观察布洛芬的释放效果来研究药物传输机理,MIL-100装载的布洛芬在最初的2 h内快速释放,3 d后释放完全,MIL-101装载的布洛芬在最初的8 h内缓慢释放,6 d后释放完全.在用MOFs作为药物传输的载体时,载体材料的毒性,金属与有机配体的生物相容性往往是要考虑在内的.由于这种MOFs包含有毒性的铬离子,所以在药物传输中的应用受到很大限制,而铁离子是血红蛋白的重要组成部分,并且氧化铁纳米粒子已被批准可作为临床上的磁共振造影剂,体外实验也表明这种粒子没有毒性[20].因此,Férey课题组又采用毒性很小的类似物MIL-101(Fe)替代前面的MIL-101(Cr)[21],这种材料应该更适合作为药物载体.Férey课题组同样报道MIL-53的药物缓释[22],MIL-53(Cr)和MIL-53(Fe)的药物装载量分别为0.220 g布洛芬/g MOF,0.210 g布洛芬/g MOF.同样地,也研究在37℃体外模拟实验中布洛芬的释放效果的药物传输机理.所装载的药物在3周之后释放完全,如此长的释放周期可能归属于MIL-53框架材料的柔性以及药物与载体之间的强相互作用.

图1 MIL-100/MIL101的合成及孔径对比[19]
MIL家族的载药量比先前所研究的任何一种药物载体的载药量都要高,且MIL载体是多孔疏水性材料,任何一个中心金属离子都可以构建具有多孔疏水性的MOFs材料,从而应用到药物传输中.MIL载体材料还可以设计成带有正电荷或者负电荷的多孔亲水性材料,用它运载与之带有相反电荷的药物分子.
1.2 NMOFs作为药物载体
理想的药物载体除了具备较高的载药量,较高的封闭性,适宜的制备及提纯方法等,还应当具有适当的粒径与粒形.大尺寸的MOFs不适宜人体系统循环,因而在药物传输中受到限制,相对于较大的微米级颗粒,纳米微粒具有非常大的优势,它们通过静脉注射(IV,Intravenous injection)进行药物传输,应用范围比大尺寸的MOFs更为广泛.人体中最小的毛细血管直径在5~6 μm,因此,载药微粒必须保证分布到血液中的粒子大小明显小于5 μm,这样微粒才不会形成聚集体而导致栓塞[23].鉴于以上原因,将MOFs缩小至纳米级别也就是NMOFs.NMOFs的优势在于可以通过多种给药途径进行药物治疗,而且能够提高负载药物的药代动力学性质[24].Lin等[25]用稀土元素Tb3+和Pt4+配合物(顺式二氯二胺合铂)合成NMOFs:NCP-1,该纳米颗粒直径约为58.3±11.3 nm.该颗粒很不稳定,容易降解,半衰期约为1 h.对其表面用非晶硅修饰后,它的稳定性增加,降解时间得到有效提高,约为9 h.细胞毒性的结果表明,该配位聚合物载体有效提高铂药物的效率,降低毒副作用.最近,Lin等[26]用Fe3+,2-氨基对苯二甲酸通过微波加热溶剂热法制备颗粒直径约为200 nm NMOFs,然后用它同时装载荧光成像剂和四价铂前体药物,该NMOFs是八面体结构,孔洞很大,比表面积达3 700~4 535 m2/g,荧光成像剂负载量达11 wt%,且它们能够穿过细胞膜释放荧光成像剂,四价铂前体药物负载量达12.8 wt%.对其表面用非晶硅修饰,它在体外的稳定性得到提高,体外模拟实验表明,半衰期约为14 h,而未负载的半衰期为1.2 h,这种两种物质同时装载的多功能NMOFs,达到治疗和成像一体化的效果.苏忠民课题组[27]用Zn2+和氮杂多羧基配体(5,5′,5″-(1,3,5-三嗪-2,4,6-三氨基)-三间苯二甲酸TATAT)合成具有良好控释性能的高孔材料,由于该材料具有很好的三棱柱形纳米笼结构孔道,他们研究该配合物对5-氟尿嘧啶的传输性能,发现其对5-氟尿嘧啶有很好的承载能力(约为0.501 g/g).除此之外,该课题组还研究Zn2+和2-甲基咪唑形成的多孔配合物对5-FU的承载和控释性能,发现5-FU与晶体质量比为2:1,且在甲醇中浸泡时间为3 d时,装载量达到最大值为14.49 wt%,在PBS缓冲液(pH=7.4)和醋酸盐的缓冲溶液(pH=5.0)中观察5-FU的释放效果,维持在37℃的环境中可以发现,在PBS缓冲液中5-FU是缓慢释放的,一周内大约89.27%的药物分子被释放出来;在醋酸盐的缓冲溶液中5-FU是爆发式释放的,释放速度明显比在PBS缓冲液中要快,在12 h内80%的药物分子被释放出来[28],如图2所示.它作为药物传输载体时,大大减少在正常机体中的副作用,提高其在病灶区的药物性能.近年来,通过化学修饰将药物分子包裹于不同载体材料中制成纳米粒,形成一种新的药物释放体系来降低其毒副作用已成为研究热点[29].通过对NMOFs修饰使其携带多种功能基团,从而具有不同特征属性.如通过叶酸修饰NMOFs,通过有机官能团相互结合,使其表面携带叶酸,成为具有可以与叶酸受体结合的靶向性载体,以此降低药物的毒副作用,克服存在的缺点,然后装载5-FU尿嘧啶,使得药物装载量增加,同时达到缓释效果,在抗肿瘤方面有很好的应用前景.也可用磁性纳米粒子,如铁的氧化物对其进行修饰,以此达到药物传输和荧光成像的双重效果.
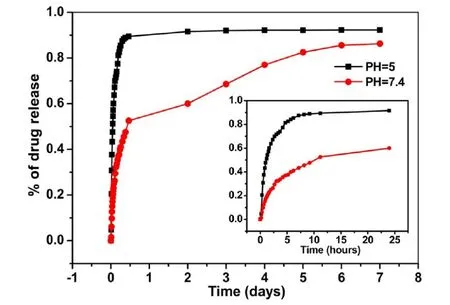
图2 不同环境下5-FU分子在ZIF-8中的释放速率[28]
1.3 Bio-MOFs作为药物载体
理想的药物载体还要求具有生物相容性和生物可降解性.新一代的MOFs应该根据特定的组成标准(这些组成标准应当能够解决它们的环境以及生物相适性)去设计.Bio-MOFs指含有无毒的金属离子(Mg2+,Ca2+,Fe3+,Zn2+等)和低毒或者无毒的有机配体而构成,具有良好的生物学适应性,在生物医学方面有潜在应用价值的MOFs材料[30].Bio-MOFs的分子储存释放能力和潜在的生物相容性以及他们的微小化特性是输送功能药品、疫苗、基因等方面的潜在应用材料,因此可以被用在药品、医药和化妆品领域.以生物小分子构筑的Bio-MOFs也称之为MBioFs(Metal-biomolecule frameworks).构筑MBioFs的配体极为丰富,有氨基酸,肽,蛋白质,碱基及糖等[31-41].但是到目前为止,这样一些MBioFs在生物医学方面的应用并没有被完全开发出来,只有部分的MBioFs被用来研究其药物传输性能.Rosi课题组[23]最近用Zn2+,腺嘌呤,4,4-联苯二甲酸合成MBioFs药物载体材料.如图3,这种MBioFs是阴离子型骨架结构,它通过与孔洞中原有的二甲胺阳离子进行交换装载到材料的孔腔中,从而进行储存和释放阳离子药物普鲁卡因胺(一种抗心律失常药).除此之外,普鲁卡因酰胺的释放可以在PBS缓冲液中被检测到,它展示缓冲液中的离子交换在药物释放过程中起非常重要的作用,每克MBioFs中装载0.22 g的普鲁卡因酰胺,Rosi课题组用HPLC检测负载后的普鲁卡因胺释放机理,发现在PBS缓冲溶液中72 h后药物才释放完全,而在纯水溶液中药物只能释放20%,这说明PBS缓冲溶液中的阳离子促进药物的释放,药物分子中的阳离子与PBS缓冲溶液中的阳离子发生交换.此外,发现全过程药物载体材料依然完好无损.普鲁卡因胺因在人体内快速释放,需要每3~4 h就要给予一定剂量,所以在临床上的应用一直以来受到限制,Rosi课题组的这一发现,给普罗卡因胺的传输载体的寻找带来很大的希望.这种MBioFs只是适度的在水和生物缓冲液中保持稳定几周,但是它的毒性需要进一步的研究[42].有些MOFs的中心金属离子采用Zn2+,Mg2+,Fe2+,Ca2+等具有生物活性的金属离子,它们既没有毒性,又可以给人体补充所需的微量元素,也可视为Bio-MOFs的范畴.苏忠民等[43]用Mg2+和间苯二甲酸合成晶体,用其装载5-FU和布洛芬,在37℃PBS缓冲液中可观察到5-FU和布洛芬的释放速度都比较快,经过6~8 h后均释放完全,这比bio-MIL-101(Fe)的释放速率要快.
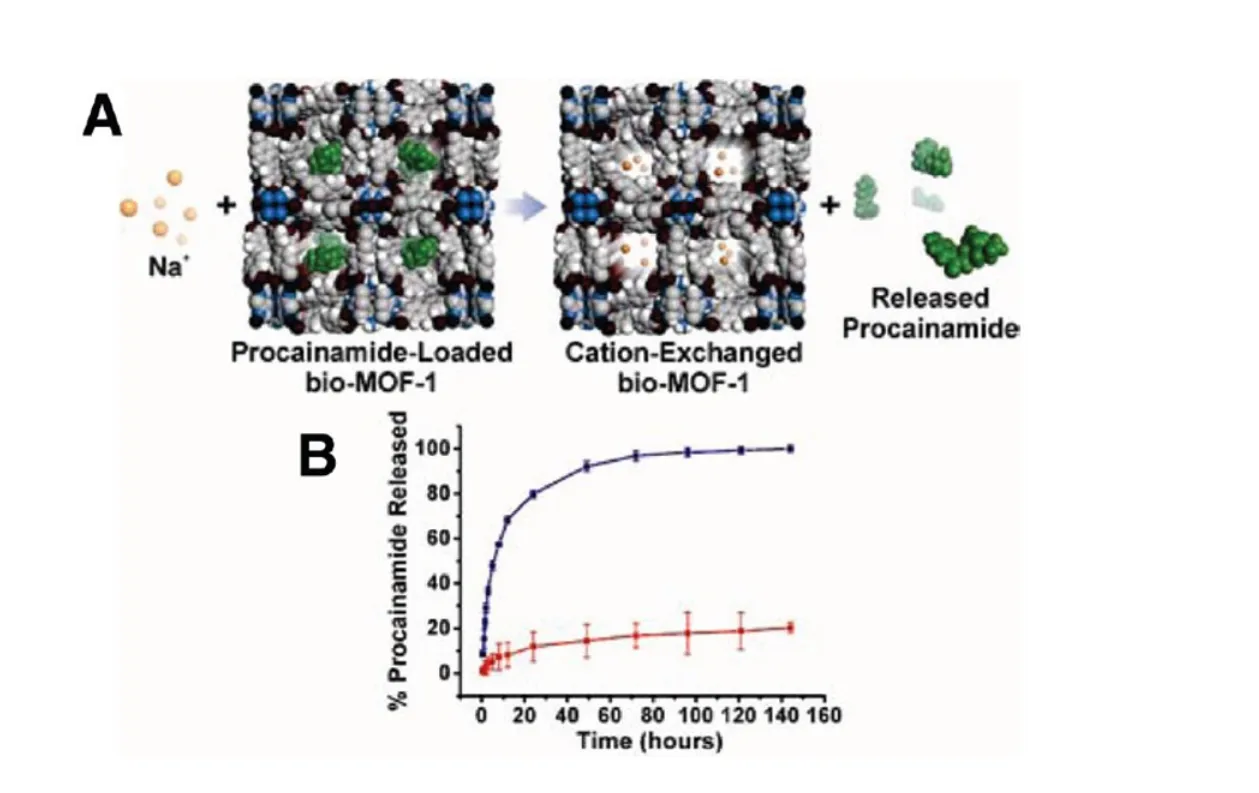
图3 离子型BioMOF-1对普鲁卡因酰胺控释[23]
2 结论和展望
随着人类对健康水平要求的提高,更多的药物分子被开发出来,这就需要研制更多的药物载体,MOFs因其孔隙率高,比表面积大,种类多样,表面可修饰性等特点,目前在药物传输、催化剂、传感器以及储存和分离系统中有着广泛的应用.而MOFs在药物传输方面的应用由于涉及到体内的医疗应用,要比其它类型的商业活动的应用要求更为严格.人和动物的监管审批需要很多的投资,因此临床使用需要更多的改进和完善.NMOFs是将MOFs缩小至纳米级别,优势在于可以通过多种给药途径进行药物治疗,而且能够提高负载药物的药代动力学性质.MBioFs是从生物分子的基础上建立起来的,生物分子提供理想的特性去建立更多的生物性相适的并且容易回收的MOFs,而且给予MOF一些卓越的特性,比如说手性和特殊的识别自组装性质,以及作为亚微观尺度的基础材料,与MOFs用传统的有机连接体的合成方法相比,对MBioFs的合成探索还处于初期阶段.BioMOFs在生物医学中的应用较MOFs材料具有更好地可控性和生物学适应性,同时也可以发展配合物新的合成和结晶方法.以此扩展MOFs家族的结构特性和实践应用范围.MOFs材料在药物传输方面的应用涉及到化学、生物、医学等多学科领域,这些研究需要不同领域的科学家相互合作,以发掘更多更适宜的MOFs药物载体材料.虽然MOFs在生物医学上的应用还处于初期阶段,但是早期迹象表明,MOFs为治疗和诊断提供很大的希望,前途十分光明.
[1]穆翠枝,徐峰,雷威.功能金属-有机骨架材料的应用[J].化学进展,2007,19(9):1345-1356.
[2]周元敬,杨明莉,武凯,等.金属-有机骨架(MOFs)多孔材料的孔结构调节途径[J].材料科学与工程学报,2007,25:307-312.
[3]林之恩,杨国昱.多孔材料化学:从无机微孔化合物到金属有机多孔骨架[J].结构化学,2004,23(12):1388-1398.
[4]HUANG X C,LIN Y Y,ZHANG J P,et al.Ligand-directed strategy for zeolite-type metal-organic frameworks:Zinc(II)imidazolates with unusual zeolitic topologies[J].Angew Chem,2006,118(10):1587-1589.
[5]FANG Q,ZHU G,XUE M,et al.A metal-organic framework with the zeolite MTNtopology containing large cages of vol⁃ume 2.5 nm3[J].Angew Chem Int Ed,2005,44(25):3845-3848.
[6]JHUNG S H,LEE J H,YOON J W,et al.Microwave synthesis of chromium terephthalate MIL-101 and its benzene sorp⁃tion ability[J].Adv Mater,2007,19(1):121-124.
[7]BHATTACHARJEE S,YANG DA,AHN WS.A new heterogeneous catalyst for epoxidation of alkenes via one-step postfunction alization of IRMOF-3 with a manganese(ii)acetylacetonatecomplex[J].Chem Commun,2011,47(12):3637-3639.
[8]CHO HY,YANG DA,KIM J,et al.CO2adsorption and catalytic application of Co-MOF-74 synthesized by microwave heat⁃ing[J].Catal Today,2012,185(1):35-40.
[9]MUELL U,SCHUBERT M,TEICH F,et al.Metal-organic frameworks-prospective industrial applications[J].J Mater Chem,2006,16(7):626-636.
[10]KLIMAKOW M,KLOBES P,THÜNEMANN A F,et al.Mechano chemical synthesis of metal-organic frameworks:a fast and facile approach toward quantitative yields and high specific surface areas[J].Chem Mater,2010,22(18):5216-5221.
[11]李榕,何玉凤,马琼,等.蛋白质高分子药物载体研究进展[J].化学通报,2014(6):484-489.
[12]毛世瑞,田野,王琳琳.药物纳米载体-聚合物胶束的研究进展[J].沈阳药科大学学报,2010(12):979-986.
[13]韩冬琳,亓洪昭,赵瑾,等.增强纳米药物载体肿瘤内渗透分布的研究进展[J].化学进展,2016,28:1397-1405.
[14]LYER A K,KHALED G,FANG J,et al.Exploiting the enhanced permeability and retention effect for tumor targeting[J]. Drug Discovery Today,2006,11:812-818.
[15]SONVEAUX P,JORDAN B F,GALLEZ B,et al.Nitric oxide delivery to cancer:why and how[J].Eur J Cancer,2009,45:1352-1369.
[16]LEONG K W,D′AMORE P D,MARLETTA M,et al.Bioerodiblepoly anhydrides as drug-carrier matrices.II.Biocompati⁃bility and chemical reactivity[J].Journal of Biomedical Materials Research Part A,1986,20(1):51-64.
[17]MCKINLAY A C,MORRIS R E,HORCAJADA P,et al.BioMOFs:metal-organic frameworks for biological and medical applications[J].Angew Chem Int Ed,2010,49(36):6260-6266.
[18]FÉREY G,MELLOT-DRAZNIEKS C,SERRE C,et al.A chromium terephthalate-based solidwith unusually large pore volumes and surface area[J].Science,2005,309:2040-2042.
[19]HORCAJADA P,SERRE C,VALLET-REGI M,et al.Metal-organic frameworks as efficient materials fordrug delivery[J].Angew Chem Int Ed,2006,45:5974-5978.
[20]PARK J,YU MK,JEONG YY,et al.Antibiofouling amphiphilic polymer-coatedsuperparamagnetic iron oxide nanoparti⁃cles:synthesis,characterization,and use in cancer imaging in vivo[J].J Mater Chem,2009,19:6412-6417.
[21]BAUER S,SERRE C,DEVIC T,et al.High-throughput assisted rationalization of the formation of metal organic frame⁃works in the iron(III)aminoterephthalatesolvothermal system[J].Inorg Chem,2008,47:7568-7576.
[22]HORCAJADA P,SERRE C,MAURIN G,et al.Flexible porous metal-organic frameworks for a controlled drug delivery[J].J Am Chem Soc,2008,130:6774-6780.
[23]AN J,GEIB SJ,ROSI NL.Cation-triggered drug release from aporous zinc-adeninate metal-organic framework[J].J Am Chem Soc,2009,131:8376-8377.
[24]LI SD,HUANG L.Pharmcokinetics and biodistribution of nanoparticles[J].Mol Pharm,2008,5:496-504.
[25]REITER WJ,POTT KM,TAYLOR KML,et al.Nanoscale coordinationpolymers for platinum-based anticancer drug deliv⁃ery[J].J Am Chem Soc,2008,130:11584-11585.
[26]TAYLOR-PASHOW KML,DELLA ROCCA J,XIE Z,et al.Postsynthetic modifications of iron-carboxylate nanoscalemet⁃al-organic frameworks for imaging and drug delivery[J].J Am Chem Soc,2009,131:14261-14263.
[27]SUN Chunyi,QIN Cao,WANG Chungang,et al.Chiral nanoporous metal-organic frameworks with high porosity as materi⁃als for drug delivery[J].Advanced Materials,2011,23(47):5629-5632.
[28]SUN Chunyi,QIN Cao,WANG Xinlong,et al.ZeoliticImidazolate framework-8 as efficient pH-sensitive drug delivery ve⁃hicle[J].Dalton Trans,2012,41(23):6906-6909.
[29]常津,刘海峰,姚康德.医用纳米控释系统的研究进展[J].中国生物医学工程学报,2009,(4):423-431.
[30]MCKINlAYA C,MORRIS R E,HORCAJADA P,et al.BioMOFs:Metal-Organic Frameworks for Biologicaland Medical Applications[J].Angew Chem Int Ed,2010,49:6260-6266.
[31]ANOKHINAE V,JACOBSONA J.[Ni2O(l-Asp)(H2O)2]·4H2O:A homochiral 1D helical chain hybrid compound with ex⁃tended Ni−O−Ni bonding[J].J Am Chem Soc,2004,126:3044-3045.
[32]GOULD J A,JONESJ T A,BACSA J,et al.A homochiral three-dimensionalzinc aspartateframework that displays multi⁃ple coordination modes and geometries[J].Chem Commun,2010,46:2793-2795.
[33]ANTOLINI L,MARCOTRIGIANO G,MENABUE L,et al.Thermal,spectroscopic,magnetic,and structural properties of mixed-ligand complexes of copper(II)with L-aspartic acid and amines.Crystal and molecular structure of(L-aspartato)(imidazole)copper(II)dehydrate[J].Inorg Chem,1982,21:2263-2267.
[34]TAKAYAMAT,OHUCHIDA S,KOIKEY,et al.Structural analysis of cadmium-glycylglycine complexes studied by X-ray diffraction and high resolution 113Cd and 13C solid state NMR[J].Bull Chem Soc Jpn,1996,69:1579-1586.
[35]YAMAUCHI O,ODANI A,TAKANI M.Weak interactions and related functions of side chain groups[J].Chemlnform,2003,34:3411-3421.
[36]RABONE J,YUE Y F,CHONG S Y,et al.An adaptable peptide-based porous material[J].Science,2010,329:1053-1057.
[37]FERRARI R,BERNES S,DE BARBARINC R,et al.Interaction between glyglu and Ca2+,Pb2+,Cd2+and Zn2+in solid state and aqueous solution:Crystal structures of poly[aqua-1,2-κ-O-di[lead(gly-gluH)]bis(perchlorate)]and poly[bisgly⁃cylglutamic-cadmium(II)tetrahydrate][J].Inorg Chim Acta,2002,339:193-201.
[38]LEE H Y,KAMPF J W,PARK KS,et al.Covalent metal−peptide framework compounds that extend in one and two di⁃mensions[J].Cryst Growth Des,2008,8:296-303.
[39]SALGADO E N,RADFORD R J,TEZCAN F A.Metal-directed protein self-assembly[J].Acc Chem Res,2010,43:661-672.
[40]RADFORD R J,LAWRENZ M,NGUYEN P C,et al.Porous protein frameworks with unsaturated metal centers in sterical⁃ly encumbered coordination sites[J].Chem Commun,2011,47:313-315.
[41]GILLEN K,JENSEN R,DAVIDSON N.Binding of silver Ion by adenine and substituted adenines[J].J Am Chem Soc,1964,86:2792-2796.
[42]AN J,GEIB S J,ROSI N L.Cation-triggered drug release from a porous zinc−adeninate metal−organic frameworks[J].J Am Chem Soc,2009,131:8376-8377.
[43]WANG Haining,MENG Xing,WANG Xinlong,et al.Auxiliary ligand induced structural allomorphism in nanotubular mi⁃croporousmetal-organic frameworks based on discrete magnesium clusters[J].Dalton Trans,2012,41:2231-2233.
Research Progress of Metal Organic Frameworks in Drug Delivery
XU Yun,DING Fang,ZHU Shisheng,LIU Qiannan,YANG Peipei
(School of Chemistry and Materials Science,Huaibei Normal University,235000,Huaibei,Anhui,China)
Metal-organic frameworks(MOFs)have been attractedmuch attentionof researchers due totheir good stability,large surface area,easy to modify and their much application in the areas of gas adsorption,ca⁃talysis,optics,and biomedicine.Recent studies show that MOFs as a new drug delivery material,have the ad⁃vantages of high drug loading,biodegradability and controllability,which are used to transfer Bloven,5-FU,NO,and other drugs procainamide.MILs,NMOFs,and bio-MOFs are the important branches of MOFs.This paper focuses on the research progress of these MOFs materials in drug delivery.
metal-organic frameworks;drug delivery;research progress
O 06-1
A
2095-0691(2017)03-0024-06
2017-01-16
安徽省大学生创新计划资助项目(201610373044);安徽省高校省级自然科学基金重点资助项目(KJ2017A380)
徐 蕴(1981- ),女,河南永城人,副教授,博士,研究方向:功能配合物.

