丝瓜铜锌超氧化物歧化酶Cu/Zn-SOD基因家族的克隆与表达分析
朱海生,刘建汀,陈敏氡,李永平,王彬,张前荣,叶新如,林珲,温庆放
丝瓜铜锌超氧化物歧化酶基因家族的克隆与表达分析
朱海生,刘建汀,陈敏氡,李永平,王彬,张前荣,叶新如,林珲,温庆放
(福建省农业科学院作物研究所/福建省农业科学院蔬菜研究中心/福建省蔬菜工程技术研究中心,福州350013)
【目的】克隆丝瓜铜/锌超氧化物歧化酶基因家族,并分析其序列特征、表达情况及其在丝瓜褐变中的作用,为进一步揭示丝瓜褐变的发生机理提供科学依据,为丝瓜品种遗传改良奠定基础。【方法】通过转录组测序和RT-PCR方法获得丝瓜基因家族的cDNA序列,采用生物信息学方法分析氨基酸序列,利用荧光定量PCR技术研究基因家族在不同组织及褐变条件下的表达情况。采用氮蓝四唑(NBT)光还原法测定总超氧化物歧化酶(SOD)活性,采用福林-酚比色测定总酚含量。【结果】获得了3个丝瓜基因家族cDNA序列,依次命名为(GenBank登录号:KP178922)、(GenBank登录号:KX092445)和(GenBank登录号:KX092446)。全长758 bp,包含一个456 bp的开放读码框(ORF),编码152个氨基酸;全长799 bp,ORF为471 bp,编码157个氨基酸;全长1 011 bp,ORF为663 bp,编码221个氨基酸;编码的蛋白与甜瓜、南瓜、黄瓜同源蛋白的相似性均在90%以上。生物信息学分析表明3个基因编码的酶蛋白均无信号肽,无跨膜结构域,为亲水性稳定蛋白,Wolf Psort预测其亚细胞定位于细胞质。基因家族在根中的表达量最高,在花中表达量最低。在丝瓜采后储藏期间,和在丝瓜储藏初期表达量较采后当时(0 d)上调,后期表达量受到抑制;在丝瓜鲜切条件下,3个基因表达量在鲜切后较采后当时(0 h)总体呈下降趋势。相关性分析显示,在采后储藏和鲜切条件下,表达量均与SOD酶活性呈极显著性正相关,表达量均与SOD酶活性呈显著性正相关,SOD酶活性在鲜切条件下与总酚含量呈显著负相关,和在调控SOD酶活性方面起作重要作用,和的表达影响了SOD酶活性,并影响了丝瓜褐变进程。【结论】从丝瓜果肉中获得基因家族的3个,其中和在普通丝瓜果肉褐变过程中可能发挥着重要作用。
丝瓜;褐变;;表达分析;SOD活性
0 引言
【研究意义】丝瓜为葫芦科(Cucurbitaceae)丝瓜属(Mill.)一年生攀援藤本植物,起源于印度,主要分布于温带、热带和亚热带地区,在亚洲和拉丁美洲种植最为广泛,在中国各地均有大面积栽培,是中国重要的蔬菜之一[1-2]。丝瓜属约有8个种,只有普通丝瓜((L.)Roem.)和有棱丝瓜((L.)Roxb.)2种经过驯化作为栽培种推广[3],其中普通丝瓜在储藏、运输、加工和烹饪过程中果肉及汤汁容易产生褐变,大大降低了其贮藏加工性能,严重影响丝瓜产品的商品价值,造成巨大经济损失,因此了解丝瓜褐变机理并控制褐变的发生已成为丝瓜育种和采后的研究热点[4-6]。超氧化物歧化酶(superoxide dismutase,SOD)作为植物防御系统中的第一道防线,是有效清除活性氧的重要抗氧化酶,保护细胞免受氧化损伤[7-8],在维持细胞膜结构和功能的稳定性[9-10]、增强植物的抗逆性[11-12]、延缓果蔬衰老褐变[13]等方面有着重要的作用。因此,克隆丝瓜,分析其表达、SOD活性与丝瓜褐变的相关性,为进一步阐明丝瓜褐变机理提供科学依据,对丝瓜生产、贮运、加工和品种选育都具有重要意义。【前人研究进展】SOD酶是生物体内广泛存在的能清除细胞内有害活性氧的一类金属酶,是最先参与清除植物体内超氧因子自由基反应的酶类,在抗氧化酶系统中处于核心地位[10,14-16]。高等植物以Cu/Zn-SOD为主,是SOD中尤为重要的一类,占总SOD的90%[17-18]。研究表明,Cu/Zn-SOD与植物的抗旱、抗寒、耐盐碱等多种抗逆性关系密切[19-23]。SOD也是与果蔬酶促褐变相关的酶,对果蔬体内的酚类物质的氧化起抑制作用。严伶俐等[13]研究表明,荔枝的表达与果皮褐变密切相关。蒋娟等[24]认为,鲜切莲藕过程中Cu/Zn-SOD蛋白表达下降,莲藉清除自由基的能力减弱,引起褐变发生。莱阳梨果实中SOD等内源抗氧化酶活性提高,可以减少活性氧的积累及膜脂过氧化程度,维持膜的结构与功能,抑制果肉褐变[25-26]。Cu/Zn-SOD在生物体中存在广泛,目前已从棉花[27]、水稻[28]、玉米[29]、甘蔗[30]、白菜[31]、茶树[32]等多种植物中克隆获得了。【本研究切入点】目前,有关丝瓜果实褐变的生理和分子机理所知甚少。丝瓜基因家族的克隆、基因表达分析及其在丝瓜褐变中的作用等相关研究,目前未见报道。【拟解决的关键问题】本研究从丝瓜果肉克隆获得基因家族成员,分析其家族序列特征,研究表达模式、酶活性、总酚含量与丝瓜褐变的相关性,为深入研究丝瓜褐变机理奠定基础,为优质丝瓜品种选育提供支持。
1 材料与方法
试验于2015年10月至2016年2月在福建省农业科学院作物研究所进行。
1.1 试验材料
以‘闽丝3号’丝瓜为材料,不同组织试验选取‘闽丝3号’同一时期的根、茎、叶、花和果实;不同储藏时间试验是将‘闽丝3号’果实恒温(4±1)℃放置0、1、2、3和4 d后分别取样;鲜切处理试验是将‘闽丝3号’果实鲜切恒温(25±1)℃放置0、2、4、6和8 h后取样。
试验均设置3次重复,样品采集后用液氮速冻,贮藏在超低温冰箱(-80℃)中备用。
1.2 丝瓜基因家族的克隆
利用百泰克通用植物总RNA提取试剂盒提取丝瓜果肉总RNA,使用大连宝生物工程有限公司生产的MMLV反转录试剂盒合成cDNA第一条链。根据笔者课题组2015年对丝瓜果实转录组Illumina高通量深度测序的结果,搜索到基因家族3个基因全长,依据获得的基因序列信息来设计cDNA全长和开放阅读框(open read frame,ORF)引物(表1)。PCR扩增产物经1.0%琼脂糖电泳、纯化、回收后,与pMD18-T载体进行连接、转化,PCR检测后的阳性克隆进行测序。

表1 本研究中的引物
1.3 生物信息学分析
利用DNAMAN6.0 进行基因和氨基酸序列比对;进化树的构建采用Clustal W2软件和MEGA 4.0软件;序列处理在线工具包(SMS)(http://www.bio-soft.net/ sms/index.html);保守结构域分析采用SMART(http://smart.embl-heidelberg.de/);蛋白的一级结构分析采用ProtParam(http://web.expasy.org/protparam/)和ProtScale(http://web.expasy.org/protscale/)软件;翻译后蛋白修饰MotifScan(http://myhits.isb-sib.ch/ cgibin/motif_scan);亚细胞定位分析采用Wolf Psort Prediction软件(http://www.genscript.com/psort/wolf_ psort.html)。
1.4 丝瓜基因家族表达分析
利用Primer Express 3.0设计基因家族3个基因荧光定量PCR引物(表1),内参基因为本课题组克隆获得的丝瓜18S rRNA[33]。参照Power SYBR® Green PCR Master Mix(美国,ABI)说明书在ABI7500实时定量PCR仪上进行PCR反应。反应体系为25 μL:10 μL SYBR®Premix,4 μL cDNA模板,0.4 μL正、反向引物,0.4 μL Rox,加蒸馏水至25 μL。PCR反应程序为:95℃预变性30 s,95℃变性5 s,58℃退火30 s,40个循环。每个反应重复3次。反应完成后进行融解曲线和荧光值变化曲线分析,采用2-∆∆Ct法计算目的基因的相对表达情况。
1.5 丝瓜总酚和SOD活性的测定
采用氮蓝四唑(NBT)光还原法[34]测定SOD酶活性。丝瓜总酚采用笔者课题组建立的福林-酚比色法测定[35-36]。
2 结果
2.1 丝瓜基因家族的克隆
根据本课题组2015年对丝瓜果实转录组Illumina高通量深度测序的结果,搜索到基因家族3个基因全长,分别命名为(GenBank登录号为KP178922)、(GenBank登录号为KX092445)和(GenBank登录号为KX092446)。
设计序列全长引物和ORF引物,进行PCR扩增,分别得到约750 bp和460 bp(图1),测序结果表明,全长758 bp,ORF为456 bp,包含一个71 bp的5′非编码区和231 bp的3′非编码区。该基因序列与印度南瓜(KF831056.1)、中国南瓜(KF831053.1)、黄瓜(XM_011659851.1)和甜瓜(XM_008452515.2)等序列的同源性分别为93%、90%、88%和85%。
设计基序列全长引物和ORF引物,进行PCR 扩增,分别得到约800 bp和470 bp(图1),测序结果表明,全长799 bp,ORF为471 bp,包含一个197 bp的5′非编码区和131 bp的3′非编码区。该基因序列与甜瓜(XM_008443767.2)、黄瓜(XM_004147491.2)和梅(XM_008242310.1)等序列的同源性分别为88%、87%和80%。
设计基因序列全长引物和ORF引物,进行PCR 扩增,分别得到约1 000 bp和660 bp(图1),测序结果表明,全长1 011 bp,ORF为663 bp,包含一个76 bp的5′非编码区和272 bp的3′非编码区。该基因序列与甜瓜(XM_008467200.2)、黄瓜(XM_004145720.2)和枣(XM_016018106.1)等序列的同源性分别为85%、84%和83%。
、和3个基因之间平均同源性为51.07%。
2.2基因家族编码蛋白质的特性分析
2.2.1基因家族编码蛋白质的特性分析ORF编码152个氨基酸,理论分子量(Mw)为15.14 kD,等电点(pI)为5.644,pH 7.0时的带点荷数(ch)为-5.836;在构成该蛋白的20种氨基酸中,甘氨酸(Gly)含量最高(20.4%),缬氨酸(Vla)次之(7.9%),甲硫氨酸(Met)含量最低,为1.3%;就构成氨基酸的特性而言,该蛋白包含8个强碱性氨基酸(K、R),15个强酸性氨基酸(D、E),44个疏水氨基酸(A、I、L、F、W、V)和36个极性氨基酸(N、C、Q、S、T、Y),脂肪族指数(AI)为75.00,不稳定系数(II)为20.88;该蛋白的总平均疏水性(GRAVY)为-0.167,预测为亲水性蛋白。
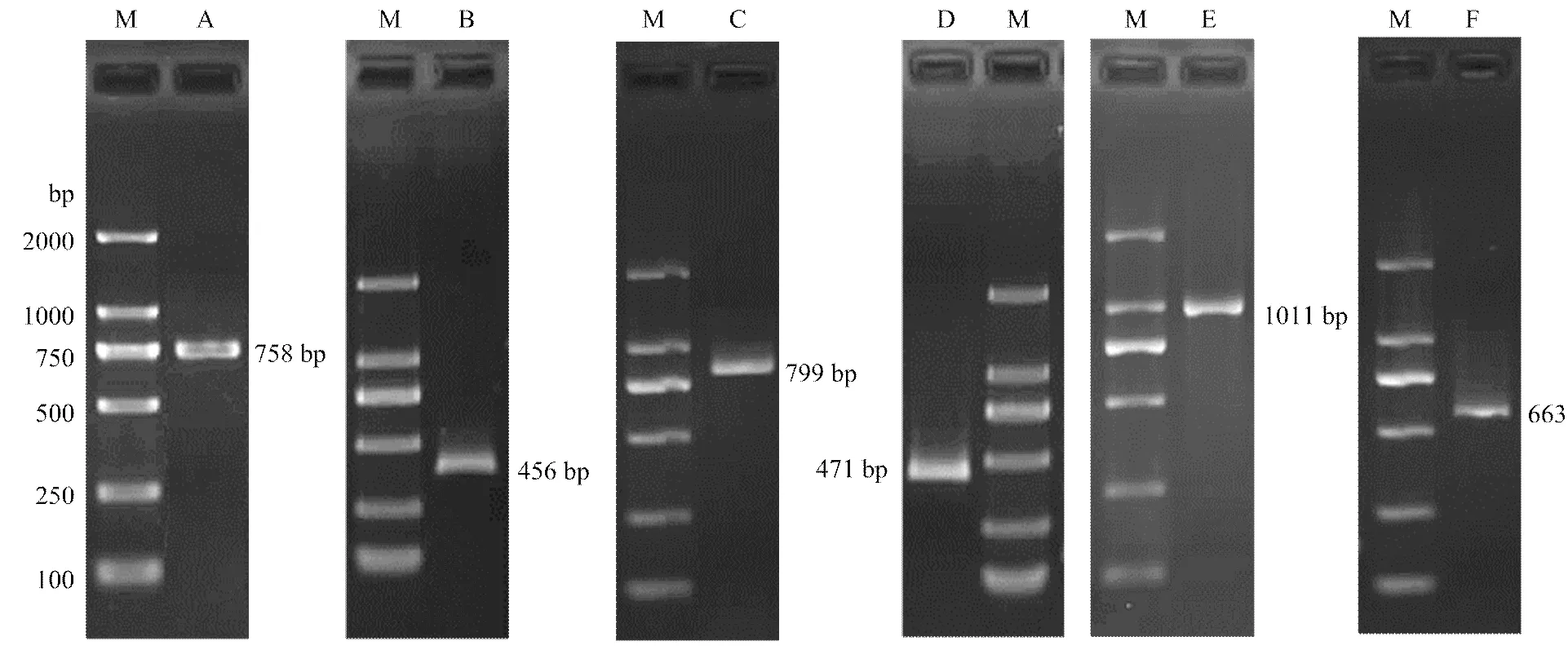
M:DL2000 marker;A:LcCu/Zn-SOD1基因全长;B:LcCu/Zn-SOD1基因ORF;C:LcCu/Zn-SOD2基因全长;D:LcCu/Zn-SOD2基因ORF;E:LcCu/Zn-SOD3基因全长;F:LcCu/Zn-SOD3基因ORF
Blastp搜索显示,LcCu/Zn-SOD1含有一个保守SOD的结构域(2—145位,E值为7.32e-57),属于Cu/Zn类SOD超家族。Motif Scan分析显示,43—53位为Cu/Zn-SOD信号序列1;137—148位为Cu/Zn-SOD信号序列2;9—14、32—37、55—60和137—142位为N-豆蔻酰化位点;87—90和97—100位为酪蛋白激酶II磷酸化位点;33—36和85—88位为N糖基化位点。采用SignalP分析表明,LcCu/Zn- SOD1不含信号肽序列。采用Wolf Psort预测表明,其亚细胞定位于细胞质基质的可能性最大。TMHMM显示,LcCu/Zn-SOD1属于非跨膜蛋白。LcCu/Zn-SOD1蛋白二级结构分析显示,序列中α螺旋、β转角和β折叠分别占41.7%、15.3%和36.1%。利用SWISS- MODEL对丝瓜LcCu/Zn-SOD1蛋白的三级结构进行在线预测,结果如图2-A所示。
2.2.2基因家族编码蛋白质的特性分析基因ORF编码157个氨基酸,理论分子量(Mw)为15.88 kD,等电点(pI)为7.159,pH 7.0时的带点荷数(ch)为0.517;在构成该蛋白的20种氨基酸中,甘氨酸(Gly)含量最高(17.8%),异亮氨酸(Ile)次之(8.3%),酪氨酸(Tyr)含量最低,为0.6%;就构成氨基酸的特性而言,该蛋白包含13个强碱性氨基酸(K、R),14个强酸性氨基酸(D、E),51个疏水氨基酸(A、I、L、F、W、V)和33个极性氨基酸(N、C、Q、S、T、Y),脂肪族指数(AI)为90.06,不稳定系数(II)为17.61;该蛋白的总平均疏水性(GRAVY)为-0.136,预测为亲水性蛋白。
Blastp搜索显示,LcCu/Zn-SOD2含有一个保守SOD的结构域(5—148位,E值为8.16e-61),属于Cu/Zn类SOD超家族。Motif Scan分析显示,46—56位为Cu/Zn-SOD信号序列1;140—151位为Cu/Zn-SOD信号序列2;12—17、39—44、58—63、87—92/140—145和152—157位为N-豆蔻酰化位点;11—14和100—103位为酪蛋白激酶II磷酸化位点;60—63位为N-糖基化位点。采用SignalP分析表明,LcCu/Zn-SOD2不含信号肽序列。采用Wolf Psort预测表明,其亚细胞定位于细胞质的可能性最大。TMHMM显示,LcCu/Zn-SOD2属于非跨膜蛋白。LcCu/Zn-SOD2蛋白二级结构分析显示,序列中α螺旋、β转角和β折叠分别占44.6%、42.7%和16.6%。利用SWISS-MODEL对丝瓜LcCu/Zn- SOD2蛋白的三级结构进行在线预测,结果如图2-B所示。
2.2.3基因家族编码蛋白质的特性分析基因ORF编码221个氨基酸,理论分子量(Mw)为22.41 kD,等电点(pI)为6.092,pH 7.0时的带点荷数(ch)为-5.302;在构成该蛋白的20种氨基酸中,丙氨酸(Ala)含量最高(12.7%),其次为甘氨酸(Gly)和亮氨酸(Leu)(均为10.9%);就构成氨基酸的特性而言,该蛋白包含12个强碱性氨基酸(K、R),19个强酸性氨基酸(D、E),84个疏水氨基酸(A、I、L、F、W、V)和54个极性氨基酸(N、C、Q、S、T、Y),脂肪族指数(AI)为93.62,不稳定系数(II)为24.01;该蛋白的总平均疏水性(GRAVY)为-0.061,预测为亲水性蛋白。
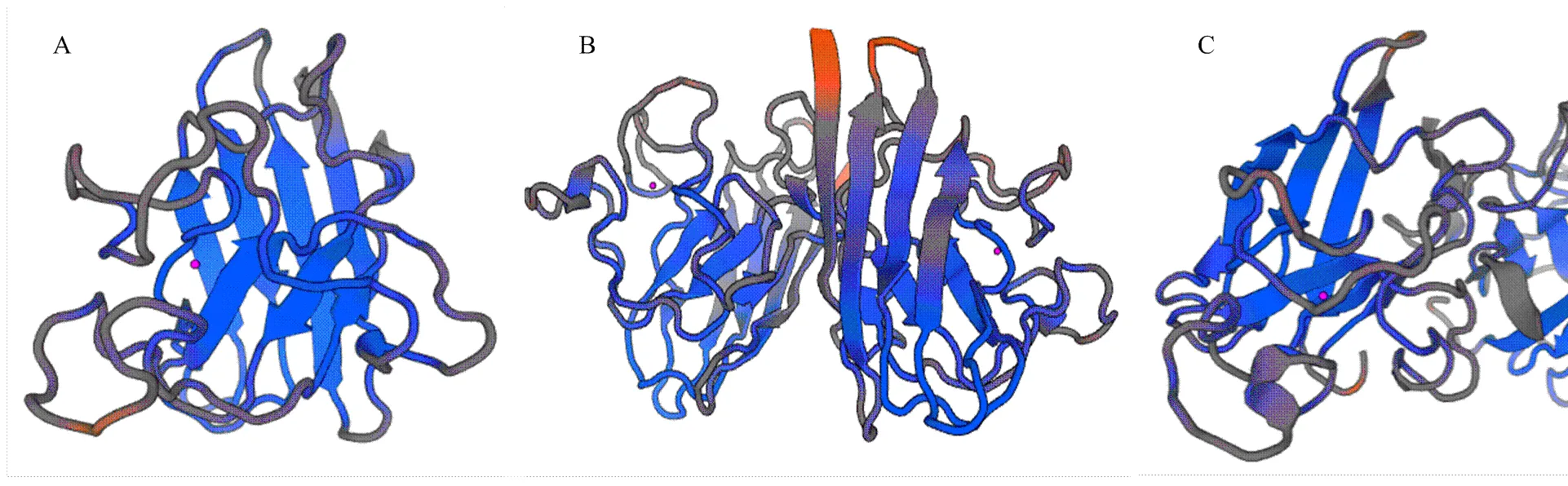
A: LcCu/Zn-SOD1蛋白的三级结构; B: LcCu/Zn-SOD2蛋白的三级结构; C: LcCu/Zn-SOD3蛋白的三级结构
Blastp搜索显示,LcCu/Zn-SOD3含有一个保守Cu/Zn-SOD的结构域(70—213位,E值为5.45e-60),属于Cu/Zn类SOD超家族。Motif Scan分析显示,111—121位为Cu/Zn SOD信号序列1;205—216位为Cu/Zn-SOD信号序列2;104—109、123—128、152—157、160—165和205—210位为N-豆蔻酰化位点;80—83、89—92和165—168位为酪蛋白激酶II磷酸化位点。采用SignalP分析表明,LcCu/Zn-SOD3不含信号肽序列。采用Wolf Psort预测表明,其亚细胞定位于细胞质的可能性最大。TMHMM显示,LcCu/Zn- SOD3属于非跨膜蛋白。LcCu/Zn-SOD3蛋白二级结构分析显示,序列中α螺旋、β转角和β折叠分别占55.2%、48.4%和12.7%。利用SWISS-MODEL对丝瓜LcCu/Zn-SOD3蛋白的三级结构进行在线预测,结果如图2-C所示。
2.3 LcCu/Zn-SOD蛋白的同源比对与进化分析
同源分析表明,LcCu/Zn-SOD1(AKN08991.1)与黄瓜(NP_001267697.1)、印度南瓜(AHF27437.1)、中国南瓜(AHF27434.1)、甜瓜(XP_008450736.1)和萝卜(XP 018435956.1)等蛋白的同源性为93%、92%、91%、91%和90%;LcCu/Zn-SOD2(APO14278.1)与黄瓜(XP_004147539.1)、甜瓜(XP_008441989.1)、白桦(AHX36945.1)和黄麻(OMO92598.1)等蛋白的同源性为92%、92%、87%和85%;LcCu/Zn-SOD3(APO14279.1)与甜瓜(XP_008465422.1)、黄瓜(XP_008441989.1)、枣(XP_015873592.1)和陆地棉(ABA00454.1)等蛋白的同源性为91%、90%、83%和79%,显示出较高的保守性。LcCu/Zn-SOD1、LcCu/Zn-SOD2和LcCu/Zn-SOD3三者平均同源性为50.15%。
进一步分析SOD蛋白亲缘关系(图3),结果表明,LcCu/Zn-SOD1与印度南瓜、中国南瓜、黄瓜、甜瓜等聚为一类,蛋白亲缘关系较近,与陆地棉等SOD蛋白亲缘关系较远;LcCu/Zn-SOD2与黄瓜、甜瓜等聚为一类,蛋白亲缘关系较近,与枣等SOD蛋白亲缘关系较远;LcCu/Zn-SOD3与甜瓜、黄瓜等聚为一类,蛋白亲缘关系较近,与麻风树等SOD蛋白亲缘关系较远。LcCu/Zn-SOD1、LcCu/Zn-SOD2和LcCu/Zn-SOD3三者都能和同为葫芦科的其他作物聚在一起,可见不同植物的SOD系统进化关系具有明显的种属特征。
2.4基因家族表达分析
2.4.1 不同组织中的表达 荧光定量PCR分析结果表明,、和在丝瓜根、茎、叶、花和果实中均有表达(图4),但表达量存在明显差异,在根中的表达丰度最高,其次为叶和果实,在茎和花的表达量较低。在果实中,表达量最高,表达量最低。
2.4.2 采后不同冷藏时间中的表达 利用荧光定量PCR分析在4℃冷藏1、2、3和4 d时基因家族表达情况(图5),3个基因表达模式存在一定差异,在采后前2 d的表达量逐渐上升,均比采后当时(0 d)高,并在采后2 d时表达量达到最大值,3 d后开始下降,但3 d时仍高于采后当时(0 d),4 d时表达量最低,且低于采后当时(0 d);随着储藏时间的增加表达量呈下降趋势,只是在2 d时略有回调;在采后1 d就达到高峰,之后呈下降趋势,且2、3和4 d时的表达量均低于采后当时(0 d)。总体表达量上,较高,较低。
随着采后储藏时间的增加,丝瓜出现褐变(图6),丝瓜总酚含量呈逐步上升趋势,在3 d时达到峰值,4 d时变化减缓,较3 d时有小幅下降(图7-A)。丝瓜中SOD酶活性总体变化趋势和的表达较为一致,在2 d时酶活性达到最高值,但SOD酶活性变化幅度较为平缓(图7-B)。相关性分析表明(表2),和表达量与SOD酶活性分别呈极显著正相关和显著正相关,表达量与SOD酶活性相关性不明显,SOD酶活性与总酚含量呈负相关。

图3 LcCu/Zn-SOD1、LcCu/Zn-SOD2和LcCu/Zn-SOD3 蛋白进化树
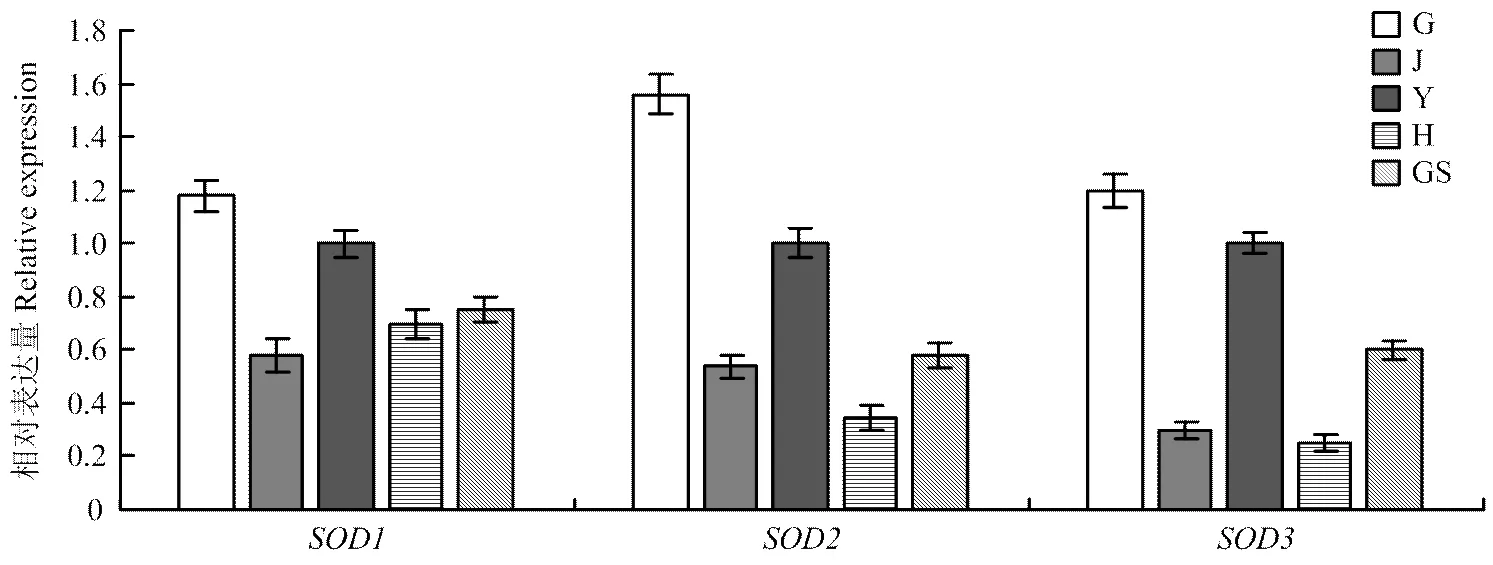
G:根;J:茎;Y:叶;H:花;GS:果实
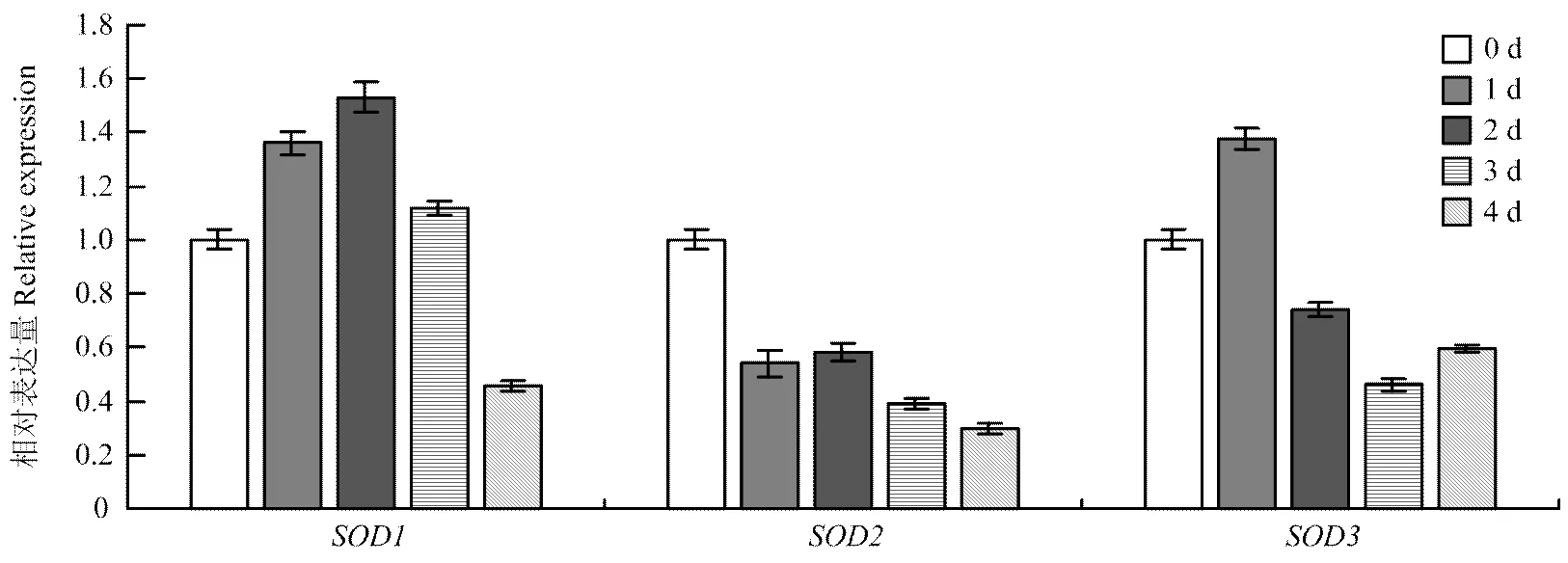
图5 采后不同时间LcCu/Zn-SOD基因家族的相对表达量

A:采后0 d;B:采后1 d;C:采后2 d;D:采后3 d;E:采后4 d
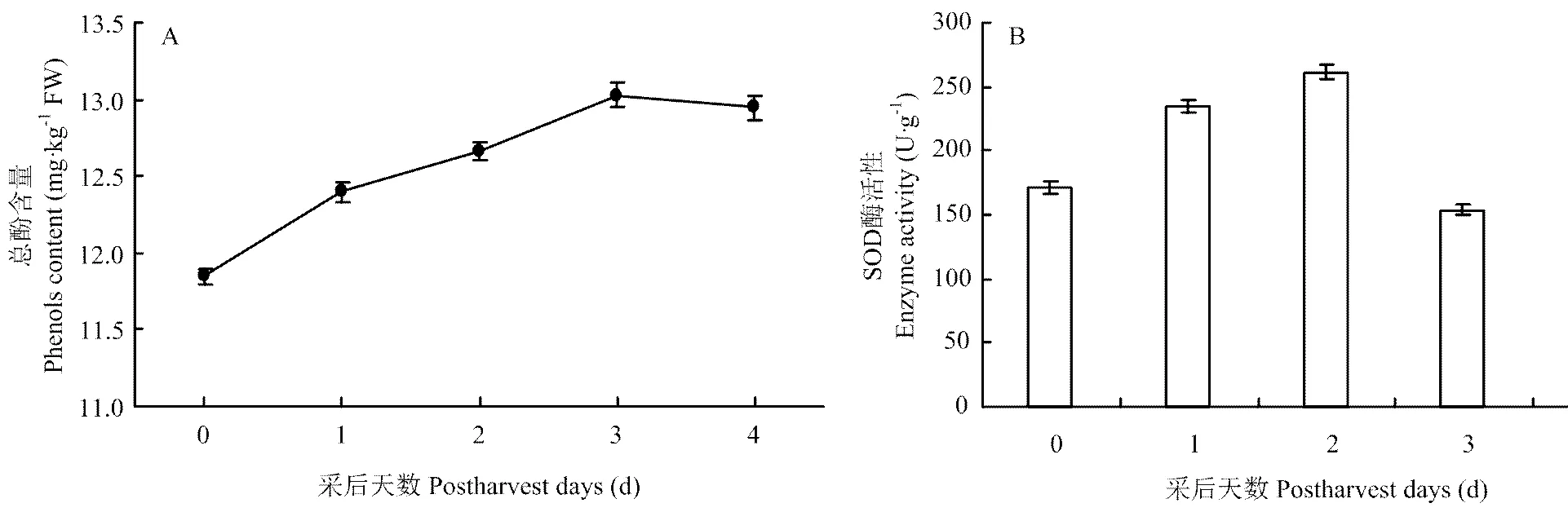
A:总酚变化情况;B:SOD酶活性变化情况 A: The changes of total phenols content; B: The changes of SOD activity
2.4.3 在鲜切丝瓜中的表达 丝瓜鲜切并常温放置2、4、6和8 h后分析基因家族表达情况(图8),在鲜切2 h时表达量上调,之后呈下降趋势;鲜切后表达量均低于采后当时(0 h),期间表达量有起伏;在鲜切2 h时表达量达到最低值,4 h时上升达到最高值,之后又逐渐下降。3个基因表达量在鲜切后总体呈下降趋势,只有和分别在鲜切2 h时和鲜切4 h时表达量高于采后当时(0 h)。

表2 采后不同储藏时间基因表达量、SOD酶活性和总酚含量相关性分析
*表示在0.05水平显著性差异,**表示在0.01水平极显著性差异。下同
*indicates significant difference at the 0.05 level,** indicates extremely significant difference at the 0.01 level. The same as below
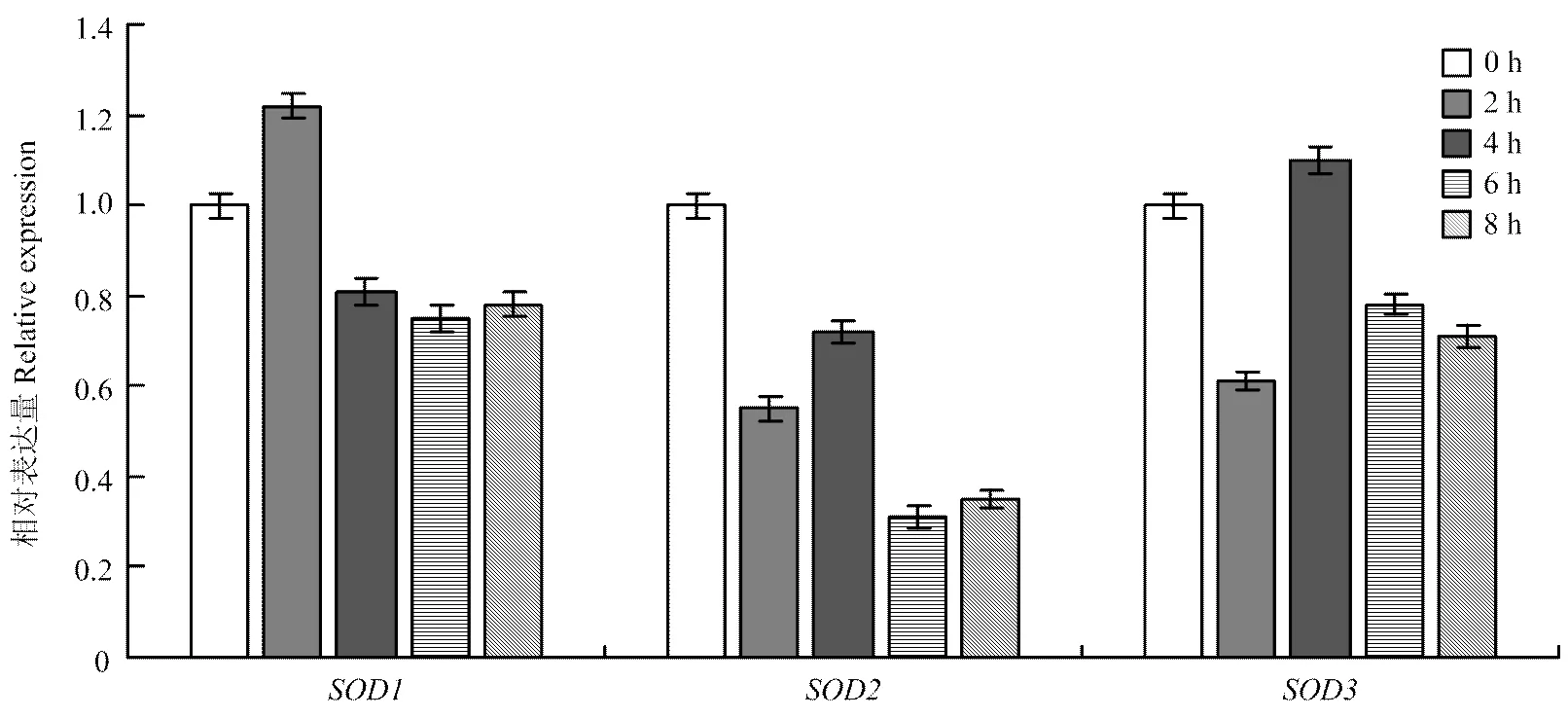
图8 鲜切处理下LcCu/Zn-SOD基因家族的相对表达量
丝瓜鲜切后,随着褐变的发生(图9),总酚含量逐渐上升趋势,在4 h达到峰值,4 h后变化减小,趋于稳定(图10-A)。SOD酶活性只有在鲜切2 h时高于采后当时(0 h),之后逐渐下降,且均低于采后当时(0 d)(图10-B)。相关性分析表明(表3),和表达量与SOD酶活性分别呈极显著正相关和显著正相关,表达量与SOD酶活性相关性不明显,SOD酶活性与总酚含量呈显著负相关。
A:采后0 h;B:采后2 h;C:采后4 h;D:采后6 h;E:采后8 h

表3 不同鲜切时间基因表达量、SOD酶活性和总酚含量相关性分析

A:总酚变化情况;B:SOD酶活性变化情况 A: The changes of total phenols content; B: The changes of SOD activity
3 讨论
是多基因家族,龙眼中发现12个[37];拟南芥中发现3个[38];Liu等[39]在芥菜型油菜中克隆到2个的cDNA片段;汤燕姗等[15]从水蜜桃胚性愈伤组织克隆到2个。本研究获得丝瓜3个,均具有完整的的阅读框(ORF),但在编码的氨基酸序列大小上有一定差异。生物学信息分析显示,三者编码的蛋白质均含有一个保守的SOD结构域,属于Cu/Zn类SOD超家族,各含有2个Cu/Zn-SOD信号序列,不含信号肽序列,属于亲水性、非跨膜蛋白。这些特征与其他植物Cu/Zn-SOD的序列组成和结构均有高度的相似性[7,19,40]。Wolf Psort预测其亚细胞定位于细胞质的可能性最大,这与前人得到主要定位于细胞质和叶绿体的结果一致[17]。同源性分析发现,不同来源Cu/Zn-SOD在氨基酸序列上具有较高同源性,其中丝瓜Cu/Zn-SOD蛋白与南瓜、甜瓜、黄瓜等葫芦科蔬菜蛋白的相似性均在90%以上,说明基因家族编码的蛋白具有较高的保守性[40-41]。
果蔬褐变与保护酶系统有关[25],SOD是植物体内非常重要的一类保护酶[42-43]。本研究中,丝瓜储藏期间褐变发生,总酚含量逐渐上升,和表达量分别在采后2 d和采后1 d达到峰值,SOD酶活性在2 d时也达到最大值,其原因可能是低温储藏初期导致丝瓜果肉内活性氧的大量积累,为维持正常的活性氧水平,和表达量上调;之后和表达量、SOD酶活性降低,推测采后长时间储藏产生的过量活性氧使丝瓜果实细胞结构受到不可逆转的损伤,褐变发生加剧。在鲜切后25℃条件下,丝瓜总酚含量逐渐上升,在4 h达到峰值,丝瓜褐变发生明显,3个基因表达量在鲜切后总体呈下降趋势,只有和分别在鲜切2 h时和鲜切4 h时表达量高于采后当时,SOD酶活性略有回调后逐渐下降,可能是丝瓜鲜切后,家族表达与酶活性下降,SOD清除活性氧能力逐渐减弱,导致植物体中活性氧的代谢失衡,积累的大量活性氧促进褐变发生。相关性分析显示,表达量均与SOD酶活性呈极显著正相关,表达量均与SOD酶活性呈显著正相关,而表达量与SOD酶活性相关性不明显,SOD酶活性在鲜切条件下与总酚含量呈显著负相关,暗示在鲜切及采后储藏条件下,和在调控SOD酶活性方面起作重要作用,和的表达影响了SOD酶活性,并影响了丝瓜褐变进程。已有的研究认为,活性氧活性的抑制和活性氧的清除是保护植物细胞膜系统的有效途径[44],积累过多的活性氧会使细胞膜过氧化,造成细胞膜结构破坏,致使膜系统中区室化功能丧失,多酚氧化酶与酚类物质接触而发生酶促褐变[45]。丝瓜果肉褐变可能是多种因素共同作用的结果,其与PPO等相关酶活性、酚类物质含量、细胞膜透性、膜脂过氧化以及丝瓜生理状态等有关,本研究为进一步阐明丝瓜褐变机理奠定了基础。
此外,SOD的表达是多种因子共同构成的一个复杂调控网络[37]。本研究发现,在丝瓜果实中,表达量在3个中最低,在鲜切及采后储藏条件下,表达模式与其他2个基因存在较大差异,表达与SOD酶活性之间相关性不明显,这可能与的复杂功能有关,不同基因家族成员功能不尽相同,丝瓜功能还有待进一步研究。
4 结论
本研究获得了3个丝瓜基因家族cDNA序列,分别命名为、和。全长758 bp,ORF为456 bp,编码152个氨基酸;全长799 bp,ORF为471 bp,编码157个氨基酸;全长1 011 bp,ORF为663 bp,编码221个氨基酸。3个基因编码的蛋白质均含有一个保守的SOD结构域,属于Cu/Zn类SOD超家族,各含有2个Cu/Zn-SOD信号序列,不含信号肽序列,属于亲水性、非跨膜蛋白,亚细胞定位于细胞质的可能性最大,编码的蛋白与南瓜、甜瓜、黄瓜等葫芦科蔬菜具有较高同源性。基因家族3个成员在丝瓜根中的表达量最高,在花中表达量最低。在鲜切及采后储藏条件下,基因家族基因表达、SOD活性、总酚与丝瓜褐变存在较高相关性。推测和在普通丝瓜果肉褐变过程中可能发挥着重要作用。
References
[1] 李程斌, 李恩, 郑艳, 施媚, 吴琼. 丝瓜藤和叶营养成分分析. 安徽师范大学学报(自然科学版), 2009, 32(1): 69-71.
LI C B, LI E, ZHENG Y, SHI M, WU Q. Towel gourd stem and leaf nutrient analysis., 2009, 32(1): 69-71.(in Chinese)
[2] 颜国纲, 郑振佳, 时新刚, 葛长军. 丝瓜的营养价值及其综合利用研究进展. 中国果菜, 2011(7): 35-36.
YAN G G, ZHENG Z J, SHI X G, GE C J. Towel gourd nutrition value and its comprehensive utilization., 2011(7): 35-36. (in Chinese)
[3] 娄丽娜, 刘哲, 苏小俊. 普通丝瓜耐褐变研究进展. 长江蔬菜, 2015(4): 1-4.
LOU L N, LIU Z, SU X J. Research progress of flesh browning resistance in luffa (L.)., 2015(4):1-4. (in Chinese)
[4] 王成, 王辉, 娄丽娜, 苏小俊. 普通丝瓜果肉褐变的鉴定方法. 江苏农业科学, 2012, 40(11): 137-138.
WANG C, WANG H, LOU L N,SU X J. Identification of luffa browning., 2012, 40(11): 137-138. (in Chinese)
[5] 黄树苹, 徐长城, 谈杰, 张敏, 王春丽, 陈霞, 甘莉, 谈太明. 不同影响因素下普通丝瓜果肉褐变度、多酚氧化酶活性及多酚质量比变化研究. 西南大学学报, 2015, 37(9): 31-36.
HUANG S P, XU C C, TAN J, ZHANG M, WANG C L, CHEN X, GAN L, TAN T M. Studies on the browning degree, polyphenol oxidase (PPO) activity and polyphenol content in fruit flesh of Luffa () influenced by different factors., 2015, 37(9): 31-36. (in Chinese)
[6] BUSTOS M C, MAZZOBRE M F, BUERA M P. Stabilization of refrigerated avocado pulp: effect ofandextracts on enzymatic browning., 2015, 61(1): 89-97.
[7] 曾秀存, 孙万仓, 孙佳, 许耀照, 方彦, 史鹏辉, 杨刚, 孔德晶, 武军艳, 刘自刚. 白菜型冬油菜铁超氧化物歧化酶(Fe-SOD)基因的克隆及表达分析. 中国农业科学, 2013, 46(21): 4603-4611.
ZENG X C, SUN W C, SUN J, XU Y Z, FANG Y, SHI P H, YANG G, KONG D J, WU J Y, LIU Z G. Cloning and expression analysis of Fe superoxide dismutase (Fe-SOD) gene from winter turnip rape (L)., 2013, 46(21): 4603-4611. (in Chinese)
[8] LEE S H, AHSAN N, LEE K W, KIM D H, LEE D G, KWAK S S, KWON S Y, KIM T H, LEE B. Simultaneous overexpression of both CuZn-superoxide dismutase and ascorbate peroxidase in transgenic tall fescue plants confers increased tolerance to a wide range of abiotic stresses., 2007(164): 1626-1638.
[9] ALLEN R D, WEBB R P, SCHAKE S A. Use of transgenic plants to study antioxidant defenses., 1997, 23(3): 473-479.
[10] ALSCHER R G, ERTURKN, HEATH L S. Role of superoxide dismutases (SODs) in controlling oxidative stress in plant., 2002, 53: 1331-1341.
[11] LAWRENCE V G, NICOLE T B, WU G H, LUO X M, LIU X J, MICHAEL L G, ALAN H. Superoxide dismutase: An all-purpose gene for agri-biotechnology., 2009, 24: 103-115.
[12] 臧洁, 余梅, 王先磊, 王荣富, 李娟, 吉虎, 徐凯, 鲁茂龙. 盐角草基因的克隆及耐盐性分析. 农业生物技术学报, 2013, 21(7): 847-854.
ZANG J,YU M, WANG X L, WANG R F, LI J, JI H, XI K, LU M L. Cloning and salt-tolerance analysis of thegeneD., 2013, 21(7): 847-854. (in Chinese)
[13] 严伶俐, 甘小迎, 韩冬梅, 吴振先. 荔枝果皮、、、的表达特性分析. 安徽农学通报, 2016, 22(7): 114-118.
YAN L L, GAN X Y, HAN D M, WU Z X. The expression ofgenes in.2016, 22(7): 114-118. (in Chinese)
[14] BUBLIY O A, LOESEHCHE V. Correlated responses to selection for stress resistance and longevity in a laboratory population of., 2005, 18(4): 789-803.
[15] 汤燕姗, 赖钟雄, 赖呈纯, 林玉玲. “台农甜蜜桃”胚性愈伤组织基因家族的克隆与序列分析. 热带作物学报, 2013, 34(10): 1925-1934.
TANG Y S, LAI Z X, LAI C C, LIN Y L. Cloning and sequence analysis ofgene family from the peach cultivar ‘Premier’ honey peach.2013, 34(10): 1925-1934. (in Chinese)
[16] 王星, 刘肖飞, 周宜君, 张根发. 植物基因表达调控的分子机制. 中国油料作物学报, 2014, 36(2): 275-280.
WANG X, LIU X F, ZHOU Y J, ZHANG G F.Molecular mechanism of expression and regulation ofgene in plant., 2014, 36(2): 275-280. (in Chinese)
[17] DU J F, ZENG Y Q, CHEN W, CUI J X, CHEN Q. Cloning, expression and functional analysis ofgene in swine., 2010, 32(10): 1037.
[18] 纪砚耘, 化文平, 王喆之. 丹参铜锌超氧化物歧化酶(Cu/Zn-SOD)基因的克隆与生物信息学分析. 陕西师范大学学报(自然科学版), 2011, 39(3): 56-60.
JI Y Y, HUA W P, WANG Z Z. Cloning and bioinformatics analysis of Cu/Zn/SOD gene fromBunge., 2011, 39(3): 56-60. (in Chinese)
[19] 陆燕元, 邓西平. 转入和基因对甘薯旱后复水的恢复作用. 西北农林科技大学学报, 2010, 38(1):67-74.
LU Y Y, DENG X P. Recovery effects of transferring bothandgenes in sweet potato under water stress., 2010, 38(1): 67-74. (in Chinese)
[20] 史艳梅, 王燃, 武明珠, 陈千思, 李锋, 魏春阳, 罗朝鹏, 杨军, 屈凌波, 林福呈. 烟草基因克隆及在低温弱光胁迫条件下的表达模式分析. 烟草科技, 2013(11): 73-77.
SHI Y M, WANG R, WU M Z, CHEN Q S, LI F, WEI C Y, LUO Z P, YANG J, QU L B, LIN F C. Cloning ofgene in tobacco and analysis of expression pattern of stresses induced by low temperature and weak light exposure., 2013(11): 73-77. (in Chinese)
[21] SONG F N, YANG C P, LIU M, LI G B. Effect of salt stress on activity of superoxide dismutase (SOD) inL., 2006(17): 13-16.
[22] HERNFINDEZ-NISTAL J, DOPICO B, LABRADOR E. Cold and salt stress regulates the expression and activity of a chickpea cytosolic Cu/Zn superoxide dismutase., 2002, 163(3): 507-514.
[23] KAYIHAN C, EYIDOGAN F, AFSAR N. Cu/Zn superoxide dismutase activity and respective gene expression during cold acclimation and freezing stress in barley cultivars., 2012, 56(4): 693-698.
[24] 蒋娟. 鲜切莲藕褐变的生理生化机制及蛋白表达差异研究[D]. 南京: 南京农业大学, 2011.
JIANG J. The physio-chemical mechanism and differential expressions of proteins for the browning of fresh-cut lotus root [D]. Nanjing: Nanjing Agriculture University, 2011. (in Chinese)
[25] 李文香, 周莎莎, 刘洁, 王丽娇, 刘树堂. 微真空贮藏条件下莱阳梨果实褐变的生理机制. 食品科学, 2013, 34(6): 266-270.
LI W X, ZHOU S S, LIU J, WANG L J, LIU S T. Browning mechanism of laiyang pears during micro-vacuum storage., 2013, 34(6): 266-270. (in Chinese)
[26] FAN M, Li W, HU X. Effect of micro-vacuum storage on active oxygen metabolism, internal browning and related enzyme activities in Laiyang pear (Rehd)., 2016, 72: 467-474.
[27] 胡根海, 喻树迅, 范术丽, 宋美珍. 编码棉花胞质铜锌超氧物歧化酶基因的克隆与表达分析. 中国农业科学, 2007, 40(8): 1602-1609.
HU G H, YU S X, FAN S L, SONG M Z. Cloning and expressing of a gene encoding cytosolic coppe/zinc superoxide dismutase in the upland cotton., 2007, 40(8): 1602-1609. (in Chinese)
[28] SUMIO K, KOZI A. Characteristic of amino acid sequences of chloroplast and cytoplast isozymes of Cu/Zn superoxide dismutase in spinach, rice and horsetail., 1990, 31: 99-112.
[29] Kernodle S, Scandalios J G. A comparison of the structure and function of the highly homologous maize antioxidant Cu/Zn superoxide dismutase genes SOD4 and SOD4A., 1996, 144: 317-328.
[30] 王盛, 张保青, 黄杏, 樊艳姣, 杨丽涛, 李杨瑞. 甘蔗的克隆和表达分析. 中国农业科学 2013, 46(15): 3277-3284.
WANG S, ZHANG B q, HUANG X, FAN Y J, YANG L T, LI Y R. Molecular cloning of sugarcane Cu/Zn superoxide dismutase () and its expression analysis., 2013, 46(15): 3277-3284. (in Chinese)
[31] CUI L J, HUANG Q, YAN B, WANG Y, QIAN Z Y, PAN J X, KAI G Y. Molecular cloning and expression analysis of agene () fromssp., 2015, 186(1): 306-311.
[32] ZHU X J, LI Q HQ, HU J Y, WANG M L, LI X H. Molecular cloning and characterization of spermine synthesis gene associated with cold tolerance in tea plant ()., 2015, 177(5): 1055-1068.
[33] 朱海生, 陈敏氡, 温庆放, 蓝新隆, 李永平, 王彬, 张前荣, 吴卫大化东. 丝瓜18S基因克隆及其作为内参基因的应用. 核农学报, 2016, 30(1): 35-41.
ZHU H S, CHEN M D, WEN Q F, LAN X L, LI Y P, WANG B, ZHANG Q R, WU W D. Cloning of 18Sgene fromand its application as an internal standard., 2016, 30(1): 35-41. (in Chinese)
[34] LIU J, WU Y, KANG J. Changes in reactive oxygen species production and antioxidant enzyme activity ofharvested at different stages of maturity., 2013, 93(9): 2201-2206.
[35] 朱海生, 庄尹宏, 刘建汀, 王彬,陈敏氡, 张前荣, 温庆放, 李大忠, 薛珠政. 丝瓜总酚提取和测定方法的优化. 福建农业学报, 2016, 31(11): 1204-1209.
ZHU H S, ZHUANG Y H, LIU J T, WANG B, CHEN M D, ZHANG Q R, WEN Q F, LI D Z, XUE Z Z. Extraction and determination of total phenol in luffa (Roem)., 2016, 31(11): 1204-1209. (in Chinese)
[36] 温文旭, 朱海生, 温庆放, 陈敏氡, 林碧英, 薛珠政. 超高效液相色谱法分析丝瓜酚类物质组分及其含量. 园艺学报, 2016, 43(7): 1391-1401.
WEN W X, ZHU H S, WEN Q F, CHEN M D, LIN B Y, XUE Z Z. Determination of polyphenols in luffa by ultra performance liquid chromatography., 2016, 43(7): 1391-1401. (in Chinese)
[37] LIN Y L, LAI Z X. Superoxide dismutase multigene family in longan somatic embryos: a comparison of,, andgene structure, splicing, phylogeny, and expression., 2013, 32(3): 595-615.
[38] KLIEBENSTEIN D J, GERSHENZON J, MITCHELLOLDS T. Comparative quantitative trait loci mapping of aliphatic, indolic and benzylic glucosinolate production inleaves and seeds., 2001, 159: 359-370.
[39] LIU J J, GOH C J, LOH C S, TAY E B H, PUA E C. Cloning of two cDNAs encoding Cu/Zn-superoxide dismutase (accession No. X95726, X95728) of mustard (L. Czern & Coss)., 1998, 116: 867.
[40] 章慧慧, 励勤荣. 超氧化物歧化酶的研究和应用现状. 农产品加工(学刊), 2007(8): 28-32.
ZHANG H H, LI Q R. Study on superoxide dismutase., 2007(8): 28-32. (in Chinese)
[41] 杨鸯鸯, 李云, 丁勇, 徐春雷, 张成桂, 刘英, 甘莉. 甘蓝型油菜和基因的克隆及菌核病菌诱导表达. 作物学报, 2009, 35(1): 7l-78.
YANG Y Y, LI Y, DING Y, XU C L, ZHANG C G, LIU Y, GAN L. Cloning of Cu/Zn-Superoxide dismutase ofand its induced expression by, 2009, 35(1): 7l-78. (in Chinese)
[42] QUE Y X, LIU J X, XU L P, GUO J R, CHEN R K. Molecular cloning and expression analysis of an Mn superoxide dismutase gene in sugarcane., 2012, 11(3): 552-560.
[43] RUBIO M C, BUSTOS-SANNMAMED P, CLEMENTE M R, BECANA M. Effects of salt stress on the expression of antioxidant genes and proteins in the model legume., 2009, 181(4): 851-859.
[44] ALSCHER R G, DONAHUE J L, CRAMER C L. Reactive oxygen species and antioxidants relationships in green cells., l997, 100: 224-233.
[45] 陈艺晖, 林河通, 林艺芬, 张居念, 赵云峰. 拟茎点霉侵染对龙眼果实采后果皮褐变和活性氧代谢的影响. 中国农业科学, 2011, 44(23): 4858-4866.
CHEN Y H, LIN H T, LIN Y F, ZHANG J N , ZHAO Y F. Effects ofChi infection on browning and active oxygen metabolism in pericarp of harvested longan fruits., 2011, 44(23): 4858-4866. (in Chinese)
(责任编辑 赵伶俐)
Cloning and Expression Analysis of Copper and Zinc Superoxide DismutaseGene Family from
ZHU HaiSheng, LIU JianTing, CHEN MinDong, LI YongPing, WANG Bin, ZHANG QianRong,YE XinRu, LIN Hui, WEN QingFang
(Crops Research Institute, Fujian Academy of Agricultural Sciences/Vegetable Research Center, Fujian Academy of Agricultural Sciences/Fujian Engineering Research Center for Vegetables, Fuzhou 350013)
【Objective】The aim of this study was to clone thegene family from, investigate their sequence characteristics and analyze their expression in luffa browning. These findings will provide a scientific basis for further revealing the mechanism of luffa browning and lay a practical foundation for the genetic improvement of luffa. 【Method】The cDNA sequences ofgene family were obtained by transcriptome sequencing and RT-PCR. The bioinformatics methods were used to analyze the putative amino acid sequence, and quantitative real-time PCR (qRT-PCR) method was used to study the expression ofgene family in different tissues and browning conditions. The superoxide dismutase enzyme activity was measured by NBT deoxidization method. The total phenols was measured by folin-cioncaleuc method. 【Result】Three cDNAs ofwere cloned from luffa fruit, in turn being named,and. The cDNA sequence ofwas 758 bp in length, containing a 456 bp opening reading frame(ORF), encoded a polypeptide of 152 amino acids. The cDNA sequence ofwas 799 bp in length, containing a 471 bp ORF, encoded a polypeptide of 157 amino acids. The cDNA sequence ofwas 1 011 bp in length, containing a 663 bp ORF, encoded a polypeptide of 221 amino acids. They shared over 90% identity with the homologous proteins from,and. The bioinformatics analysis showed that three proteins were hydrophilic protein without signal-peptide and transmembrane region, and the Wolf Psort protection indicated that they were located in the cytoplasm. The expression ofgene familywas the highest in root and the lowest in flower. During post-harvest storage, the expression ofandwas up-regulated in the early, and then decreased. The expression levels of three genes were overall down-regulated in fresh-cut luffa fruit. Correlation analysis showed that the expression level ofshowed a extremely significant positive correlation with SOD activity, and the expression level ofshowed a significant positive correlation with SOD activity during fresh-cut and post-harvest storage. SOD activity was significantly and negatively correlated with total phenols content during fresh-cut conditions.andplay an important role in regulating the activity of SOD, and the expression ofandmay influence the activity of SOD and the process of luffa browning.【Conclusion】Three cDNAs ofwere firstly obtained and characterized from luffa fruit,andmay play an important role in luffa browning process.
; browning;; expression analysis; activity of SOD
2017-04-17;接受日期:2017-06-16
福建省自然科学基金(2015J01118)、福建省属公益类科研院所基本科研专项(2017R1026-6)、福建省农业科学院创新团队PI项目(2016PI-40)、福建省农业科学院创新项目(2015QC-6、PC2017-7)
朱海生,E-mail:zhs0246@163.com。通信作者温庆放,E-mail:fjvrc@163.com

