ToMV外壳蛋白互作IP-L蛋白的亚细胞定位及表达分析
彭浩然,蒲运丹,张永至,薛杨,武改霞,青玲,孙现超
ToMV外壳蛋白互作IP-L蛋白的亚细胞定位及表达分析
彭浩然,蒲运丹,张永至,薛杨,武改霞,青玲,孙现超
(西南大学植物保护学院,重庆 400716)
【目的】前期研究显示ToMV外壳蛋白(coat protein,CP)可以与烟草蛋白L(CP-interacting protein-L,IP-L)相互作用,本研究旨在明确ToMV CP与IP-L的共定位情况、IP-L的组织表达和在ToMV侵染条件下烟草及其编码蛋白的表达变化情况,为进一步明确IP-L的功能提供依据。【方法】通过双酶切法从笔者实验室构建保存的pGBKT7-CP和pGADT7-IP-L重组载体上切下ToMV CP和IP-L目的片段,构建融合蛋白植物表达载体pPZP-IP-L-N-EGFP和pPZP-CP-N-DsRed及原核表达载体pEGX-IP-L。通过热激法将融合表达的植物表达载体转化至农杆菌EHA105,在烟草表皮细胞瞬时表达IP-L-N-EGFP和CP-N-DsRed,共聚焦荧光显微镜下观察IP-L和ToMV CP共定位情况。用实时荧光定量RT-PCR(qRT-PCR)分析在本氏烟各组织部位的表达量。原核表达载体pEGX-IP-L,转化原核表达菌BL21,优化GST-IP-L可溶性表达条件后大量表达该蛋白,用GST亲和层析法纯化获得可溶性GST-IP-L蛋白,免疫家兔制备多克隆抗体。ELISA测定抗体效价,Western印迹法明确抗体的特异性后,利用该抗体分析ToMV侵染条件下番茄IP-L蛋白表达情况,用qRT-PCR检测表达变化与蛋白水平是否一致。【结果】ToMV CP在本氏烟叶片表皮细胞的细胞质和细胞质膜以及叶绿体均有分布,而IP-L只在本氏烟叶片表皮细胞质膜表达,二者共定位在细胞质膜。在本氏烟叶片中特异高表达,显著高于茎、根和花中的相对表达量。在温度为30℃,IPTG诱导浓度为0.3 mmol·L-1条件下表达出大小为42.8 kD的可溶性GST-IP-L融合蛋白。纯化获得约4.2 mg可溶性蛋白,免疫家兔制备了效价为1/6400的多克隆抗体。Western印迹结果表明,该抗体可以与IP-L的原核产物特异性结合。在ToMV侵染本氏烟1、3、7 d后,Western印迹分析表明IP-L在叶片内表达量随接种时间呈明显上调趋势。qRT-PCR检测结果与Western印迹结果一致,显示在ToMV侵染本氏烟第7天后的叶片内表达量是健康对照的3倍多,差异达到显著水平。【结论】ToMV CP和IP-L共定位于本氏烟表皮细胞质膜,在本氏烟叶片内特异高表达。制备的IP-L多克隆抗体具有良好的免疫反应活性,可以用于IP-L表达量检测;ToMV侵染烟草可诱导及其编码蛋白表达量显著上调。
IP-L;亚细胞定位;表达;分析;番茄花叶病毒
0 引言
【研究意义】植物病毒作为一种专性寄生物,其生活史的完成必须依赖寄主。它侵染寄主后,在寄主细胞中进行病毒的脱壳、病毒基因组的复制及在寄主细胞间系统运动过程中,都有寄主成分参与其中[1-3]。因此,明确与病毒编码蛋白互作的寄主蛋白在寄主细胞中的定位、组织表达情况,并分析其在病毒侵染条件下的表达变化,对解析互作蛋白的功能及二者互作的生物学意义具有重要价值。【前人研究进展】番茄花叶病毒(,ToMV)是烟草花叶病毒属()的重要成员。其寄主包括茄科、十字花科、禾本科、藜科、豆科等许多植物,番茄也作为主要寄主受其危害[4]。ToMV引起的病毒病1909年在美国首次被报道,并已广泛分布于世界各国的番茄生产区,在中国各地番茄生产区也严重发生[5]。ToMV与同属的烟草花叶病毒(,TMV)血清学关系较近。ToMV曾被认为是TMV的一个株系,但研究发现二者在寄主范围和基因组序列方面存在一定的差异,自1971年将其作为单一病毒从TMV中分离出来。1996年,周雪平等[4]首次对中国番茄上发生的ToMV进行了系统的研究报道。至今,国内外研究者对ToMV生物学和分子生物学特性方面做了大量的研究,为防治该病毒引起的病害积累了丰富的资料[6-10]。在ToMV与寄主相互作用研究方面,已经发现烟草的RIO激酶、转录辅助活化因子MBF1和KELP与ToMV运动蛋白直接相互作用[11-13]。FUJISAKI等[14]在拟南芥中发现了一个与ToMV RNA结合的BTR1蛋白,该蛋白对病毒的复制有一定的调控作用。IP-L(interaction protein L)是从烟草cDNA文库中筛选出的与ToMV CP互作的寄主蛋白,其序列与普通烟中的一个未知功能的激发子应答蛋白(AB040409)同源性达到100%[15]。前期用酵母双杂交和GST-Pull down技术对ToMV CP和IP-L相互作用的位点分析发现,二者依靠各自的-螺旋区相互作用,IP-L N端的-螺旋区域(1—20位氨基酸)为二者相互作用所必需,并且明确ToMV CP中两个-螺旋区域(16—31位氨基酸、138—149位氨基酸)参与二者的相互作用,进一步的定点突变分析表明IPL中L9A、H12G和ToMV CP中N26A、T29A、N30A、N143A和T144A等突变会导致二者失去相互作用能力[16]。【本研究切入点】笔者课题组一直致力于植物病毒与寄主互作研究,前期已经发现并证实ToMV CP可以与普通烟草铁氧还蛋白I(ferredoxin I,Fdn-I)在体内外互作[17],并且用制备的Fdn-I证实ToMV侵染可导致普通烟中的Fdn-I蛋白表达明显下降[18]。IP-L作为与ToMV CP互作的寄主蛋白,其功能尚不明确。ToMV CP与IP-L互助定位在细胞何处?其表达是否有组织特异性?在病毒侵染条件下IP-L及其编码蛋白其表达量变化如何?这些问题的回答将有助于对其功能的解析。【拟解决的关键问题】分别将DsRed和GFP融合在ToMV CP与IP-L的C端,表达分析二者共定位情况;分析在本氏烟各组织的表达情况;构建番茄IP-L原核表达载体,表达并纯化制备可溶性蛋白,免疫家兔获得IP-L多克隆抗体,并用抗体分析ToMV侵染番茄对IP-L蛋白表达的影响,用实时荧光定量RT-PCR(qRT-PCR)检测表达变化与蛋白水平是否一致。
1 材料与方法
试验于2012—2016年在西南大学植物保护学院植物病毒研究室完成。
1.1 材料
1.1.1 菌株和质粒 原核表达菌株BL21和谷胱甘肽疏基转移酶(GST)融合表达载体pEGX-6p-1由笔者实验室长期保存;植物表达载体pPZP-RCS1和中间载体pSAT1-N-EGFP、pSAT1-N-DsRed由美国纽约州立大学石溪分校Vitaly教授馈赠;pGBKT7-CP和pGADT7-IP-L由笔者实验室构建保存;供试本氏烟()在温室育苗盆中播种,培养至4—6叶期备用。
1.1.2 试剂和引物 DNA纯化回收试剂盒和质粒取试剂盒购自天根生化科技(北京)有限公司;反转录试剂盒、高保真ExTaqTMDNA聚合酶、T4 DNA连接酶购自大连TaKaRa公司;T载体试剂盒和总RNA提取试剂盒购自普洛麦格(北京)生物技术有限公司;实时荧光试剂盒使用 QuantiNovaTMSYBR Green PCR Kit(QLAGEN,GER);限制性内切酶购自NEB公司;ToMV CP抗体由笔者实验室制备保存。
1.2 方法
1.2.1 荧光蛋白融合表达载体及原核表达载体的构建 用HⅠ和Ⅰ分别从pGBKT7-CP和pGADT7-IP-L载体上切下CP和IP-L,试剂盒纯化回收目的片段后,IP-L分别连接至相同双酶切的GFP融合表达载体中间载体pSAT1-N-EGFP和原核表达载体pEGX-6p-1上,CP连接至相同双酶切的pSAT1- N-DsRed,所有连接产物经大肠杆菌BL21转化挑取阳性单克隆由华大基因公司测序,成功的重组质粒分别命名为pSAT1-IP-L-N-EGFP、pSAT1-CP-N-DsRed和pEGX-IP-L。自pSAT1-IP-L-N-EGFP和pSAT1-CP- N-DsRed上,用I酶分别切下表达盒IP-L-N-EGFP和CP-N-DsRed,连接到经相同酶切的pPZP-RCS1载体上,在含有500 mg·L-1壮观霉素的LB平板培养,PCR鉴定筛选阳性克隆,并再次酶切鉴定,阳性克隆命名为pPZP-IP-L-N-EGFP和pPZP-CP-N-DsRed。
1.2.2 ToMV CP与IP-L在本氏烟表皮细胞的共定位分析 参考刘兆明等[19]方法将pPZP-IP-L-N-EGFP和pPZP-CP-N-DsRed以热击法分别转化到根癌土壤杆菌EHA105感受态细胞中。瞬时表达方法参 照Voinnet等[20]的方法:挑选单菌落接种于含500 mg·L-1壮观霉素的YEP液体培养基中摇菌12—16 h,缓冲液(10 mmol·L-1MgCl2;10 mmol·L-1MES以及0.1 mmol·L-1AS)重悬菌体至OD600为1.0,室温静置3 h。选取培养至4—6叶期健康的本氏烟幼苗,用灭菌注射器注射上述根癌土壤杆菌悬浮液。接种后的本氏烟置于25℃培养箱培养。72 h后,取下注射的本氏烟叶片,制作临时玻片,在激光扫描共聚焦显微镜下观察叶片注射孔附近IP-L-GFP定位情况。
1.2.3的组织表达分析 采用real-time PCR分析本氏烟不同组织的表达情况,用Eastep®Super总RNA提取试剂盒提取等量的开花期本氏烟根、茎、叶和花的总RNA,根据Prime-ScriptTMRT Reagent试剂盒方法合成cDNA,反应引物见表1。应用Bio-Rad CFX实时定量PCR仪器,每个样品设3次重复,Ct值取平均值。按照QuantiNovaTMSYBR Green PCR Kit使用说明进行,real-time PCR体系:2×Green PCR Master Mix 10 μL,上下游引物(10 μmol·L-1)各1 μL,cDNA 1 μL,ddH2O补齐至20 μL。反应条件:95℃3 min;95℃10 s,57℃ 30 s,72℃ 40 s,40个循环。利用2-△△CT法计算各个时间点对的相对表达量。

表1 本研究所用引物序列
1.2.4 GST-IP-L融合蛋白的大量表达及纯化 将上述阳性克隆接种于含100 µg·mL-1Ampicilin的2×YT液体培养基中,37℃摇床振荡过夜培养,4 000 r/min,4℃离心10 min收集菌体,用2×YT液体培养基重悬后,接种于5 L含100 µg·mL-1Ampicilin的2×YT液体培养基中,在30℃,0.3 mmol·L-1IPTG浓度下诱导3 h后离心收集菌体,用PBS缓冲液重悬菌体,超声破碎菌体细胞壁,用TritonX-100调整终浓度至1%。混匀液冰浴30 min后15 000 r/min,4℃离心30 min,上清液室温下自然通过亲和层析柱,裂解缓冲液洗柱后再以洗脱缓冲液(100 mmol·L-1Tris;6.15 g·L-1谷胱甘肽及2 mmol·L-1PMSF,pH 8.0)洗脱,Bradford法检测洗脱液中的蛋白浓度,取纯化产物进行聚丙烯酰胺凝胶电泳分析。
1.2.5 IP-L多克隆抗体的制备、效价测定和特异性检测 在大白兔双肩周围皮下和后大腿肌肉处,以多点注射的方式用纯化的GST-IP-L融合蛋白免疫大白兔,总共免疫6次,每次间隔7 d,每次免疫剂量约0.7 mg融合蛋白。最后一次注射7 d后一次性动脉采血,制备抗体,酶联免疫吸附实验测定其效价。分别将含pEGX-IP-L阳性单克隆和含pEGX6P-1载体的菌株表达总蛋白进行聚丙烯酰胺凝胶电泳后,转印至硝酸纤维素膜,用封闭液室温封闭过夜。然后以1﹕500的融合蛋白抗体作为一抗孵育2 h,经TBST(150 mmol·L-1NaCl;20 mmol·L-1Tris-HCl,pH 7.5;0.05% Tween 20)洗涤3次,辣根过氧化物酶标记的Anti-Rabbit(1/5 000)作为二抗常温孵育1 h,用PBST于脱色摇床上洗膜10 min,共3次。避光条件下,ECL(Amersham biosciences)显色,观察记录结果。
1.2.6 ToMV侵染对IP-L及其编码蛋白在叶片内表达影响分析 汁液摩擦接种ToMV于6叶期的本氏烟叶片。在接种后第1、3、7天,在接种叶位分别取250 mg的健康和ToMV接种本氏烟叶片两份样品,其中一份样品在0.4 mL蛋白提取缓冲液(250 mmol·L-1蔗糖;220 mmol·L-1Tris-HCl,pH 7.4;1 mmol·L-1MgCl2;50 mmol·L-1KCl;2 mmol·L-1PMSF;10 mmol·L-1-巯基乙醇)中研磨,4℃离心收集上清液,Bradford法[21]检测蛋白浓度,取等量总蛋白样品在两块独立的聚丙烯酰胺凝胶上进行电泳,然后分别转印硝酸纤维素膜,按照1.2.5中方法进行蛋白免疫印迹分析。以ToMV CP抗体为一抗检测ToMV侵染情况对比以GST-IP-L融合蛋白抗体作为一抗检测IP-L表达情况,试验重复3次。另一份样品按照1.2.3的方法进行表达的定量分析。
2 结果
2.1 ToMV CP与IP-L在本氏烟表皮细胞的共定位情况
ToMV CP与IP-L是在酵母细胞和体外直接相互作用的蛋白,理论上二者在植物细胞中也应该存在共定位情况。为了明确这一推论,分别构建了pPZP-IP- L-N-EGFP和pPZP-CP-N-DsRed两个植物表达载体,二者分别转化入农杆菌EHA105后,挑取菌落在YEP液体培养基中培养,菌悬液等量混合后,在本氏烟叶片中共表达。共聚焦荧光显微镜下观察,结果发现ToMV CP-N-DsRed表达量较高,在多数细胞中均能看到红色荧光,且在细胞的细胞质中均有分布,在细胞质膜亮度较高,叶绿体片层中也有表达,而IP-L-N-EGFP表达量相对较低,仅在少数细胞中能观察到绿色荧光,且IP-L-N-EGFP仅分布在细胞质膜部位,二者在细胞质膜共定位,两种荧光共同存在(图1)。
2.2的组织表达
为了明确是否存在组织特异表达,用qRT- PCR方法分析在本氏烟根、茎、叶和花组织中的表达量。结果显示(图2)在叶中特异高表达,相对表达量达到3.28,显著高于其在其他组织中的相对表达量(<0.05)。在根、茎和花中相对表达量极低,虽然在茎中的相对表达量大于根和叶,但是差异不显著。
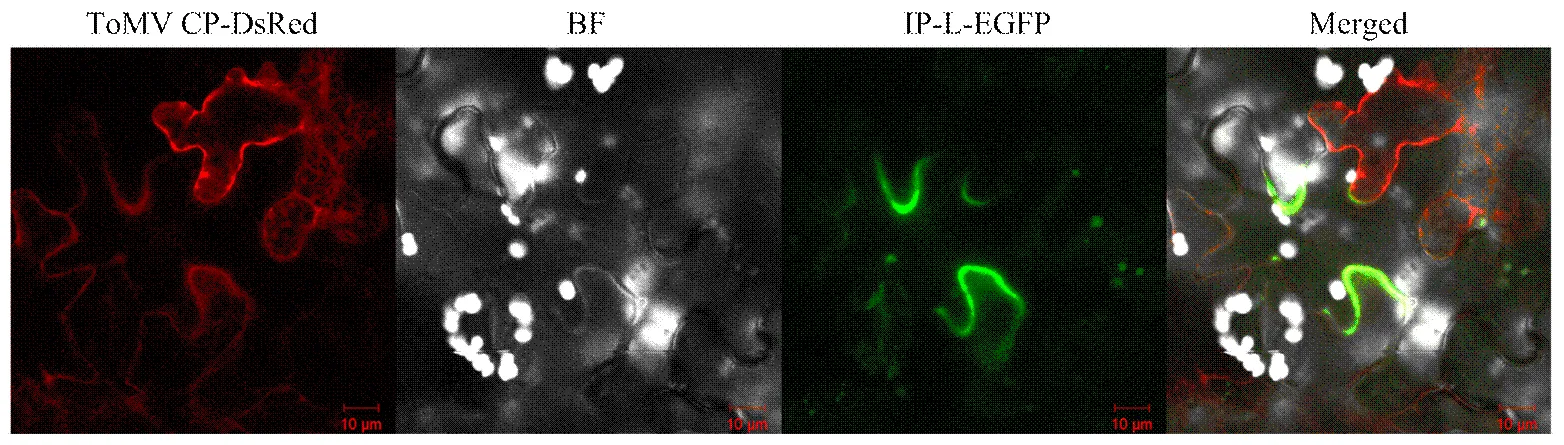
图1 ToMV CP与IP-L在本氏烟表皮细胞的共定位情况

图2 IP-L在不同本氏烟组织中的表达模式
2.3 IP-L原核表达载体构建及诱导表达
回收片段用HⅠ和Ⅰ双酶切并连接到载体pEGX-6p-1,成功的重组质粒命名为pEGX- IP-L。酶切电泳图及华大基因公司测序结果表明基因正确构建到载体pEGX-6p-1上,形成了GST-IP-L融合基因。将pEGX-IP-L质粒转化大肠杆菌BL21振荡培养至OD600为0.6—1.0时,加入终浓度为0.3 mmol·L-1的IPTG 30℃诱导表达。pGEX-6P-1空载体表达的GST蛋白的分子量为26 kD,IP-L蛋白预测的分子量为16.8 kD,融合蛋白GST-IP-L的分子量为42.8 kD。诱导菌体经处理后,12%聚丙烯酰胺凝胶电泳分析显示目的蛋白所处位置与预测蛋白大小一致,表明成功表达了GST-IP-L融合蛋白(42.8 kD,图3)。
2.4 GST-IP-L融合蛋白的纯化
在30℃,0.3 mmol·L-1IPTG条件下成功诱导表达融合蛋白GST-IP-L,经聚丙烯酰胺凝胶电泳检测后,发现可溶性融合蛋白的表达量比较高。经亲和层析纯化得到纯化的GST-IP-L融合蛋白,且条带大小(42.8 kD)与预期结果相符,纯化蛋白条带下边出现一个约26 kD大小的蛋白条带,推测是掉下来的GST标签蛋白(图4)。经Bradford法[21]检测,5 L的培养诱导菌液经纯化可获得可溶性蛋白约为4.2 mg。
2.5 抗血清的制备、效价测定和特异性检测
将分离的融合蛋白与福氏不完全佐剂等体积混合,乳化后作为抗原免疫家兔,第5次注射7 d后,测定血清效价为1/1 600,加强免疫1次,7 d后采血制备抗血清。以1/800、1/1 600、1/3 200、1 /6 400、1/12 800、1/25 600、1/51 200、1/102 400的浓度梯度酶联免疫吸附实验检测血清效价。检测结果显示待测组颜色浓度由高到低呈现明显的颜色梯度,阴性对照和底板无颜色反应,最终确定IP-L抗血清的效价为1/6 400。用获得的抗体检测分别表达GST-IP-L和GST的菌株BL21总蛋白,蛋白免疫印迹实验检测结果显示抗体可以特异识别IP-L原核表达产物GST-IP-L融合蛋白和GST蛋白(图5),表明IP-L抗血清具有良好的免疫反应性。
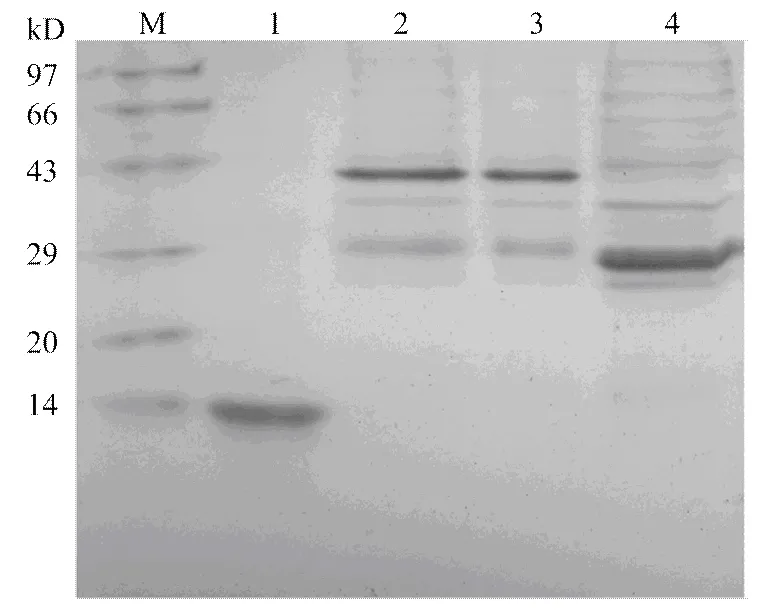
M:低分子量蛋白marker Low molecular weight marker;1:上样缓冲液 Loading buffer;2、3:含pEGX-IP-L大肠杆菌BL21表达总蛋白 Total protein expressed by E. coil BL21 containing pEGX-IP-L;4:含pEGX-6p-1对照大肠杆菌BL21表达总蛋白 Total protein expressed by E. coil BL21 containing pEGX-6p-1
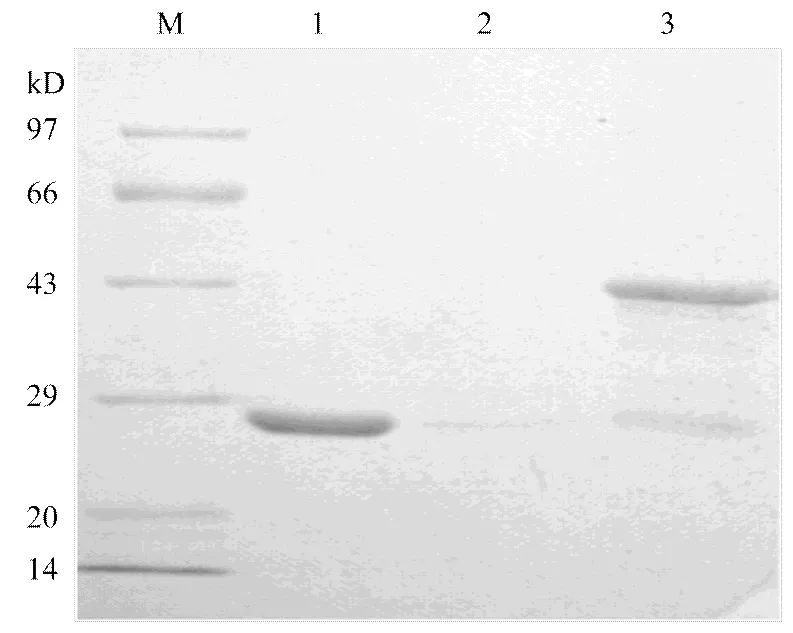
M:低分子量蛋白marker Low molecular weight marker;1:空白载体Empty vector group;2:上样缓冲液Loading buffer;3:纯化蛋白Purified fusion protein

M:低分子量蛋白marker Low molecular weight marker;1:表达GST-IP-L的菌株BL21总蛋白Total protein of BL21 expressed GST-IP-L;2:表达GST的菌株BL21总蛋白Total protein of BL21 expressed GST;3:GST-IP-L Western印迹检测Western blot of GST-IP-L; 4:GST Western印迹检测Western blot of GST
2.6 ToMV侵染对IP-L在本氏烟叶片内表达影响分析
为了探究ToMV侵染后本氏烟体内IP-L的变化情况,汁液摩擦接种6叶期的本氏烟叶片,分别在接种后第1、3和7天取样,分别提取接种叶位的健康本氏烟叶片和ToMV侵染的本氏烟叶片的总蛋白,12% SDS-PAGE电泳检测等量的总蛋白,转印后分别用ToMV CP抗体和获得的IP-L抗体Western blot分析ToMV的侵染和IP-L表达情况。结果显示,在接种后第1天健康植株叶片没病毒侵染,在接种叶检测到微量ToMV,叶片内的IP-L表达量与健康对照相比没有变化。在接种ToMV后的第3天和第7天,接种叶片中明显检测到ToMV积累,并且ToMV积累量随时间增加,同期,叶片内IP-L表达量随着病毒的积累量增加也明显提高(图6)。qRT-PCR结果显示(图7)表达量与其编码蛋白变化基本一致,在接种ToMV后第1天,在处理植株中的表达量低于健康对照,第3天表达量比第1天提高1倍,仍低于健康对照,但没有明显差异。在接种ToMV后第7天,表达量明显上升,达到健康对照的3倍,差异显著(<0.05)。
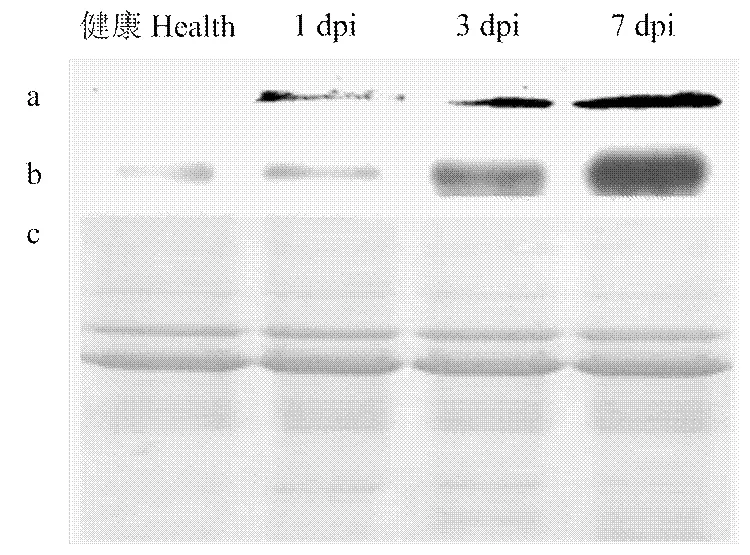
a:接种1、3、7 d后ToMV CP的Western印迹检测Western blot analysis of ToMV CP 1, 3 and 7 days after inoculation;b:接种1、3、7 d后IP-L的Western印迹检测Western blot analysis of IP-L 1, 3 and 7 days after inoculation;c:SDS-PAGE的上样量对照The loading quantity of sample of SDS-PAGE
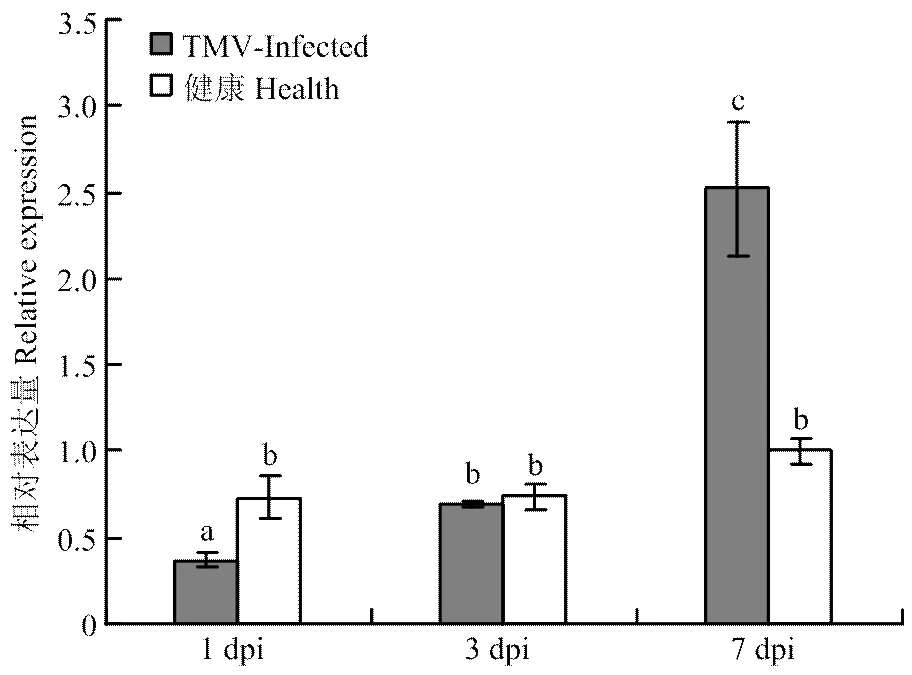
图7 实时荧光定量RT-PCR分析ToMV侵染本氏烟叶片IP-L表达量
3 讨论
CP是病毒粒子的结构亚基,是在病毒侵染过程中最早接触寄主植物并与寄主因子发生作用的病毒蛋白[22],也是的抗原表位所在[23]。除形成外壳保护病毒RNA外,CP还具有其他多种功能。大量的研究证实TMV的CP在病毒侵染寄主导致病毒病症状的过程中起重要作用[24-26]。因此,TMV的CP在被侵染细胞的细胞质各部位都有分布。本研究用DsRed标记的ToMV CP同样观察到红色荧光在细胞质的大量分布。IP-L是烟草内能与ToMV CP互作的蛋白,Zhang等[16]对本氏烟叶片的叶绿体及其组分的分级分离后进行SDS-PAGE和Western blot分析,确定IP-L是存在于叶绿体中的类囊体膜上,推测其可能与光合作用有关。本研究用EGFP标记的IP-L,只在细胞质膜上观察到绿色荧光存在,且在此处与ToMV CP共定位。造成这两种结果差异的原因可能是Zhang等根据预测只分析了叶绿体中IP-L的可能定位,未对整个细胞进行全面分析。由于IP-L在细胞质膜上表达量远远高于叶绿体中的类囊体膜上表达量,导致IP-L在叶绿体中的类囊体膜上表达量太低而无法观察到荧光。
本研究用qRT-PCR分析的组织表达情况,发现具有明显的组织表达特异性,在叶片中表达量最高,而在茎、根和花中表达量很低。Zhang等[16]根据IP-L定位于类囊体膜推测其可能与光合作用有关,笔者通过克隆的启动子,分析发现其启动子含有许多光应答元件,推测其为光效应启动子,IP-L在植物的表达可能受光调控[27]。而植物进行光合作用的部位主要是叶片,因此,在叶片中特异高表达。
Park等[28]发现了一个与PVX CP互作的蛋白NbPCIP1,该蛋白与IP-L氨基酸同源性达到89%,在本氏烟中,PVX侵染引起NbPCIP1 RNA表达量上调,且瞬时过量表达NbPCIP1有利于PVX的侵染移动,沉默NbPCIP1抑制PVX的侵染积累和移动。本研究发现,ToMV侵染本氏烟后,及其编码蛋白表达均上调,与IP-L同源蛋白NbPCIP1一致。近期,在笔者实验室的另一项研究中发现番茄在ToMV侵染后也呈现上升的变化趋势[29],这些对于病毒侵染响应明显的基因在通路中是否有相似或者相互作用也值得进一步研究。
4 结论
ToMV CP和IP-L共定位于本氏烟表皮细胞质膜。在本氏烟叶片内特异高表达。制备的IP-L多克隆抗体具有良好的免疫反应活性,可以用于IP-L表达量检测;ToMV侵染番茄可诱导及其编码蛋白表达量在接种后第7天显著上调。
References
[1] NIEHL A, HEINLEIN M. Cellular pathways for viral transport through plasmodesmata., 2011, 248(1): 75-99.
[2] LIU C, NELSON R S. The cell biology ofreplication and movement., 2013, 4(3): Article 12.
[3] NICAISE v. Crop immunity against viruses: outcomes and future challenges., 2014, 5: Article 660.
[4] 周雪平, 钱秀红, 刘勇, 薛朝阳, 李德葆. 侵染番茄的番茄花叶病毒的研究. 中国病毒学, 1996, 11(3): 268-276.
ZHOU X P, QIAN X H, LIU Y, XUE C Y, LI D B. Isolation and characterization offrom tomato., 1996, 11(3): 268-276. (in Chinese)
[5] 郑贵彬, 徐鹤林, 熊助功. 我国为害番茄的病毒种群与烟草花叶病毒 (TMV) 株系分化的初步鉴定. 中国病毒学, 1988, 3(1): 64-70.
ZHENG G B, XU H L, XIONG Z G. A preliminary study on the virus groups of tomato and strain differentiation of(TMV) in China., 1988, 3(1): 64-70. (in Chinese)
[6] 周雪平, 薛朝阳, 刘勇, 李德葆. 番茄花叶病毒番茄分离物与烟草花叶病毒蚕豆分离物生物学、血清学比较及PCR特异性检测. 植物病理学报, 1997, 27(1): 53-58.
ZHOU X P, XUE C Y, LIU Y, LI D B. Biology and serological comparison of ToMV tomato isoate and TMV broad bean isolate and specific detection with polymerase chain reaction., 1997, 27(1): 53-58. (in Chinese)
[7] 姜国勇, 杨仁崔. 番茄花叶病毒移动蛋白和番茄抗病基因Tm-2的互作诱导烟草转化体程序性细胞死亡. 微生物学报, 2005, 45(2): 301-304.
JIANG G Y, YANG R C. Tomato R proteinTm-2gene interacting with ToMV movement protein triggered programmed cell death in tobacco transformations., 2005, 45(2): 301-304. (in Chinese)
[8] YANG G, QIU B S, LIU X G, LI Y, WANG X F. Nonsense mutations of replicase and movement protein genes contribute to the attenuation of an avirulent., 2002, 87(2): 119-128.
[9] DOHI K, TAMAI A, MORI M. Insertion in the coding region of the movement protein improves stability of the plasmid encoding a tomato mosaic virus-based expression vector., 2008, 153(9): 1667-1675.
[10] HIRAI K, KUBOTA K, MOCHIZUKI T, TSUDA S, MESHI T. Antiviral RNA silencing is restricted to the marginal region of the dark green tissue in the mosaic leaves of-infected tobacco plants., 2008, 82(7): 3250-3260.
[11] YOSHIOKA K, MATSUSHITA Y, KASAHARA M, KONAGAYA K, NYUNOYA H. Interaction ofmovement protein with tobacco RIO kinase., 2004, 17(2): 223-229.
[12] MATSUSHITA Y, DEGUCHI M, YOUDA M, NISHIGUCHI M, NYUNOYA H. Themovement protein interacts with a putative transcriptional coactivator KELP., 2001, 12(1): 57-66.
[13] MATSUSHITA Y, MIYAKAWA O, DEGUCHI M, NISHIGUCHI M, NYUNOYA H. Cloning of a tobacco cDNA coding for a putative transcriptional coactivator MBF1 that interacts with the tomato mosaic virus movement protein., 2002, 53(373): 1531-1532.
[14] FUJISAKI K, ISHIKAWA M. Identification of anprotein that binds togenomic RNA and inhibits its multiplication., 2008, 380(2): 402-411.
[15] LI Y, WU M Y, SONG H H, HU X, QIU B S. Identification of a tobacco protein interacting withcoat protein and facilitating long-distance movement of virus., 2005, 150(10): 1993-2008.
[16] ZHANG C Z, LIU Y Y, SUN X C, QIAN W D, ZHANG D D, QIU B S. Characterization of a specific interaction between IP-L, a tobacco protein localized in the thylakoid membranes, andcoat protein., 2008, 374(2): 253-257.
[17] SUN X C, LI Y, SHI M D, ZHANG N, WU G X, LI T T, QING L, ZHOU C Y.binding and bimolecular fluorescence complementation assays suggest an interaction betweencoat protein and tobacco chloroplast ferredoxin I., 2013, 158(12): 2611-2615.
[18] 孙现超, 李勇, 周常勇, 青玲. 普通烟草铁氧还蛋白Ⅰ的原核表达、抗体制备及在ToMV侵染烟草体内表达分析. 中国农业科学,2010, 43(19): 3981-3987.
SUN X C, LI Y, ZHOU C Y, QING L. Prokaryotic expression of Fdn-I, preparation of rabbit anti-Fdn-I antibody and analysis of the Fdn-I levels in ToMV-infected tobacco leaves., 2010, 43(19): 3981-3987. (in Chinese)
[19] 刘兆明, 刘宗旨, 白庆武, 方荣祥. Agroinflltration在植物分子生物学研究中的应用. 生物工程学报, 2002, 18(4): 411-414.
LIU Z M, LIU Z Z, BAI Q W, FANG R X. Agroinfiltration, a useful technique in plant molecular biology research., 2002, 18(4): 411-414. (in Chinese)
[20] VOINNET O, PINTO Y M, BAULCOMBE D C. Suppression of gene silencing: a general strategy used by diverse DNA and RNA viruses of plants., 1999, 96(24): 14147-14152.
[21] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding., 1976, 72(1): 248-254.
[22] CALLAWAY A, GIESMAN-COOKMEYER D, GILLOCK E T, SIT T L, LOMMEL S A. The multifunctional capsid proteins of plant RNA viruses., 2001, 39: 419-460.
[23] VAN REGENMORTEL M H V. The antigenicity of., 1999, 354(1383): 559-568.
[24] OHNISHI J, HIRAI K, KANDA A, USUGI T, MESHI T, TSUDA S. The coat protein ofL11Y is associated with virus-induced chlorosis on infected tobacco plants., 2009, 75(4): 297-306.
[25] CULVER J N.assembly and disassembly: determinants in pathogenicity and resistance., 2002, 40(1): 287-308.
[26] BANERJEE N, WANG J Y, ZAITLIN M. A single nucleotide change in the coat protein gene ofis involved in the induction of severe chlorosis., 1995, 207(1): 234-239.
[27] 武改霞, 李婷婷, 孙现超. 与ToMV CP互作基因的启动子克隆分析//中国植物保护学会2011年学术年会论文集, 2001: 738.
WU G X, LI T T, SUN X C. Promoter cloning analysis of theinteraction with the ToMV CP interaction gene//, 2001: 738. (in Chinese)
[28] PARK M R, PARK S H, CHO S Y, KIM K H.protein, NbPCIP1, interacting withcoat protein plays a role as susceptible factor for viral infection., 2009, 386(2): 257-269.
[29] 潘琪, 刘旭旭, 彭浩然, 蒲运丹, 张永至, 叶思涵, 吴根土, 青玲, 孙现超. 番茄的克隆及表达分析. 中国农业科学, 2017, 50(15): 2936-2945.
PAN Q, LIU X X, PENG H R, PU Y D, ZHANG Y Z, YE S H, WU G T, QING L, SUN X C. Cloning, expression analysis of., 2017, 50(15): 2936-2945. (in Chinese)
(责任编辑 岳梅)
Subcellular localization and expression Analyses of IP-L Protein interacting with ToMV Coat Protein
PENG HaoRan, PU YunDan, ZHANG YongZhi, XUE Yang, WU GaiXia, QING Ling, SUN XianChao
(College of Plant Protection, Southwest University, Chongqing 400716)
【Objective】Previous studies showed that the coat protein (CP) of ToMV could interact with protein L (IP-L) in. The objectives of this study are to understand the collocation of ToMV CP and IP-L, investigate the expression ofin different tissues of, and investigate the IP-L expression in tomato leaves in response to ToMV infection.【Method】The ToMVandtarget fragments were isolated from the recombinant pGBKT7-CP and pGADT7-IP-L recombinant vectors by digestion with corresponded enzymes. Then the plant expression vectors pPZP-IP-L-N-EGFP and pPZP -CP-N-DsRed and prokaryotic expression vector pEGX-IP-L were constructed. The plant expression vectors were transformed intoEHA105 by heat shock method. The transient expression of ToMV CP and IP-L in tobacco epidermal cells was observed under the fluorescent microscope. Real-time quantitative RT-PCR (qRT-PCR) was used to analyze the expression level ofin different tobacco tissues. The recombinant plasmid pEGX-IP-L was transformed intoBL21 to express the soluble GST-IP-L protein in the optimized condition. GST-IP-L protein was purified with high-affinity GST resin to immunize rabbit for preparing anti-IP-L antibody in a rabbit. The title was determined by enzyme-linked immunosorbant assay (ELISA). The specificity of anti-IP-L antibody and the expression of IP-L in tobacco leaves infected by ToMV were detected by Western blot method and verified it by qRT-PCR.【Result】The ToMV CP was found in cell cytoplasm, cell membrane and chloroplasts, but IP-L only present in leaf epidermal cells membrane. They both co-localized in the plasma membrane. The relative expression ofin the tobacco leaves has the specific high expression, significantly higher than that in stem, root and flower. The soluble GST-IP-L protein with molecular weight 42.8 kD was successfully expressed inBL21 induced with 0.3 mmol·L-1IPTG at 30℃. About 4.2 mg fusion protein was purified and used to immunized rabbit. Anti-IP-L antibody with the title of 1/6 400 was obtained. Western blot analysis showed that the antibody could specially bind with IP-L. After the tobacco leaves were infected by ToMV for 1, 3 and 7 d, western blot analysis showed that IP-L was significantly up-regulated in leaves after 7 days of ToMV infection. qRT-PCR also got the same results, the expression level of IP-L was significantly (more than 200%) higher than that in healthy controls. 【Conclusion】The ToMV CP and IP-L were co-located in the plasma membrane of the tobacco epidermis cell.specifically expressed in the tobacco leaves at high level. The high title and specificity antibody of tomato’s IP-L were successfully achieved. The results of qRT-PCR and Western blot with the polyclonal antibody showed that the expression of IP-L in tobacco leaves was increased by the infection of ToMV.
IP-L; subcellular localization; expression; analysis;(ToMV)
2017-03-07;接受日期:2017-04-14
国家自然科学基金(31670148)、重庆市社会事业与民生保障创新专项(cstc2015shms-ztzx80012)、中央高校基本科研业务费专项资金(XDJK2016A009,2362015xk04)
彭浩然,E-mail:re4ever@163.com。通信作者孙现超,E-mail:sunxianchao@163.com

