eNOS参与铁过载诱导的血管内皮细胞线粒体损伤
何 欢,张泽宇,刘 丹,廖章萍,尹 东,何 明
(南昌大学 1. 药学院江西省基础药理学重点实验室、2. 第二附属医院江西省分子医学重点实验室,江西 南昌 330006)
eNOS参与铁过载诱导的血管内皮细胞线粒体损伤
何 欢1,张泽宇1,刘 丹1,廖章萍1,尹 东2,何 明1
(南昌大学 1. 药学院江西省基础药理学重点实验室、2. 第二附属医院江西省分子医学重点实验室,江西 南昌 330006)
目的探讨eNOS及ADMA/DDAHⅡ介导的铁过载对HUVECs细胞线粒体的损伤作用。方法常规培养HUVECs细胞,随机分为正常对照(Ctrl)组、右旋糖酐铁(Iron) 组、L-精氨酸(L-Arg)组。48 h后,MTT法检测细胞存活率;HPLC法检测ADMA含量及DDAHⅡ活性;Western blot法检测eNOS表达;比色法检测培养液LDH活性、NO含量、细胞MDA含量以及mPTP开放;流式细胞仪检测心肌细胞ROS含量、线粒体膜电位及细胞凋亡。结果Iron处理48 h后,HUVECs细胞存活率明显降低,培养液ADMA及LDH活性升高,NO含量减少;细胞eNOS表达下调、DDAHⅡ活性降低;MDA含量与ROS生成明显增加,线粒体膜电位减小,mPTP大量开放,细胞凋亡增加;ADMA生理性对抗剂L-Arg则可明显减弱Iron的上述损伤作用。结论eNOS参与铁过载诱导的HUVECs细胞线粒体损伤,ADMA/DDAHⅡ机制也可能发挥了作用。
铁过载;线粒体;ADMA;eNOS;DDAHⅡ;细胞凋亡
近年来,铁过载诱发细胞、组织损伤逐步引起人们的注意。研究发现,铁在体内具有很强的氧化活性,机体铁过载时可导致活性氧(reactive oxygen species, ROS)的产生[1-2]。血管内皮细胞对ROS极为敏感,是铁过载损伤的主要靶细胞之一[3]。血管内皮细胞产生非对称性二甲基精氨酸(asymmetric dimethylarginine, ADMA)与细胞内ROS生成互为因果,调控内皮细胞功能,与多种血管内皮功能失调性疾病高度相关,是一种心血管疾病危险因子[4]。ADMA在铁过载引起的血管内皮细胞损伤中的作用及其机制尚未见报道。本文选用人脐静脉血管内皮细胞(human umbilical vein endothelial cells, HUVECs),以梯度右旋糖酐铁(iron dextran)确认造成铁过载损伤,分别检测HUVECs细胞内ADMA含量、内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS) 表达、二甲基精氨酸二甲基氨基水解酶Ⅱ(dimethylarginine dimethylaminohydrolaseⅡ, DDAHⅡ)活性等及其相应的细胞线粒体功能;加用ADMA生理性对抗剂L-精氨酸(L-Arg)[5],探讨铁过载对HUVECs细胞线粒体的损伤作用及其机制。
1 材料与方法
1.1药品与试剂右旋糖酐铁(Iron)、右旋糖酐(Dex)、L-Arg:Sigma公司;eNOS、β-actin 抗体及相应二抗:Santa Cruz公司;蛋白提取试剂盒:北京普利来公司;胎牛血清、MEM培养基:Gibco BRL公司;ROS检测试剂盒、线粒体分离试剂盒:Sigma-Aldrich公司;线粒体膜电位检测试剂盒、细胞凋亡检测试剂盒:BD公司产品;增强化学发光印迹试剂、硝酸纤维素膜:Amersham, UK;MTT、HEPES、PMSF、亮肽素、丙烯酰胺、SDS、亚甲基双丙烯酰胺、过硫酸铵、TEMED、EDTA和DTT:Sigma公司;其他试剂均为分析纯。
1.2细胞系及培养HUVECs购自中国科学院细胞库。HUVECs细胞培养于含10% FBS的DMEM培养基中,置于37℃ CO2培养箱培养。细胞生长接近融合状态(70%~80%)时,备用。
1.3实验分组①正常对照(Ctrl)组:取正常培养HUVECs细胞,常规培养24 h;②Iron组:取正常培养HUVECs细胞,加入终浓度分别为30、15、7.5、3.75、1.875 μmol·L-1右旋糖酐铁,孵育24 h;③Dex组:取正常培养HUVECs细胞,加入终浓度分别为30、15、7.5、3.75、1.875 μmol·L-1右旋糖酐,孵育24 h;④L-Arg组:取正常培养HUVECs细胞,加入终浓度为7.5 μmol ·L-1右旋糖酐铁,以及终浓度为1 mmol ·L-1L-Arg孵育24 h。
1.4MTT比色法检测细胞存活率胰酶消化收集细胞,以每孔104个细胞接种96孔培养板。细胞融合达70%~80%后,弃培养基;加入MTT溶液(5 g·L-1溶于PBS)每孔20 μL,37℃孵育4 h;弃上清液,每孔加DMSO 150 μL,振荡10 min。酶联免疫检测仪在490 nm波长处测定其OD值。细胞存活率/% = (实验组光吸收值/对照组光吸收值) ×100%。1.5HPLC法检测细胞培养液ADMA含量[6]实验结束后,取细胞培养液0.5 mL,加5-磺基水杨酸沉淀蛋白,离心10 min后,取上清液上样,激发波长338 nm,发射波长425 nm检测ADMA含量。
1.6细胞DDAHⅡ活性测定[6]采用间接法检测。冰浴下将细胞裂解液分为2份,分别加入终浓度为500 μmol·L-1ADMA;一份立即加入30% 5-磺基水杨酸灭活DDAHⅡ;另一份37℃孵育2 h后,再加入30% 5-磺基水杨酸灭活DDAHⅡ。用HPLC法测定2份的ADMA水平,其ADMA差值反映DDAHⅡ活性。
1.7Westernblot法检测细胞eNOS表达实验结束后,按试剂盒方法提取细胞总蛋白;BCA 法蛋白定量后行SDS-PAGE电泳(12%分离胶);湿转PVDF膜、封闭;eNOS抗体( 1 ∶500) 或β-actin 抗体( 1 ∶500) 孵育,4℃过夜。洗膜后以1 ∶2 000二抗孵育1 h 后,ECL化学发光法检测。X线片扫描后,用Quantity One 图形分析软件分析,以β-actin 相应条带的密度标化相应组的eNOS条带密度。
1.8生化检测实验结束后,各组分别取培养液200 μL,Beckman生化自动分析仪测定乳酸脱氢酶(lactate dehydrogenase, LDH)活性;消化收集且反复冻融破碎细胞,离心后取上清液,按试剂盒说明书测定细胞内一氧化氮(nitric oxide, NO)及丙二醛(malondialdehyde, MDA)含量。
1.9流式细胞术测定细胞内ROS含量[7]实验结束后,4℃预冷PBS洗涤2~3次细胞;加入含0.02%乙二胺四乙酸(elhylene diamine tetraacetic acid, EDTA)的0.25%胰蛋白酶消化收集细胞,用10 μmol·L-1DCFH-DA溶液500 μL重悬细胞,37℃孵育30 min;800×g、5 min离心,弃上清,预冷PBS洗涤2~3次细胞,制成108·L-1的悬液,立即以488 nm为激发波长,以530 nm为发射波长行流式细胞仪检测,以不加DCFH-DA的1管为阴性对照。1.10流式细胞术测定细胞线粒体膜电位[7]实验结束后,4℃预冷磷酸盐缓冲液(phosphate buffer, PBS)洗涤2~3次细胞;加入含0.02% EDTA的0.25%胰蛋白酶消化收集细胞,用10 μmol·L-1JC-1溶液200 μL重悬细胞,37℃孵育20 min;800×g、5 min离心,弃上清,预冷PBS洗涤2~3次细胞,制成109·L-1的悬液,立即行流式细胞仪检测,分别以488 nm 为激发光波长,527 nm 和590 nm 为发射光波长测绿色和红色荧光强度,以各组红/绿荧光强度的比值反映线粒体膜电位水平。
1.11线粒体通透性转运孔(mitochondrialpermeabilitytransitionpore,mPTP)开放测定以线粒体肿胀实验揭示mPTP开放情况[8]。实验结束后,4℃预冷PBS洗涤2~3次细胞;按试剂盒说明书分离、纯化线粒体;线粒体蛋白终浓度为0.5 g·L-1,25℃、pH 7.4;1 min后加入150 μmol·L-1CaCl2,分光光度仪检测线粒体在520 nm处的吸光度(OD520) 在l min内的变化,持续检测20 min。
1.12细胞凋亡检测[8]采用AnnexinV/PI凋亡检测试剂盒及流式细胞仪检测。实验结束后,4℃预冷PBS洗涤2~3次细胞;用不含EDTA的胰蛋白酶消化、收集细胞;用预冷PBS洗2次后,用1×Binding buffer重悬细胞,细胞密度约为5×109·L-1;分别加入5 μL Annexin V-FITC和5 μL PI;重悬后,室温避光孵育15 min,加入500 μL Binding buffer,立即以激发光488 nm、发射光578 nm行流式细胞仪检测,各组阳性细胞百分率用于表示细胞凋亡状况。

2 结果
2.1右旋糖酐铁对HUVECs细胞存活率以及培养液LDH活性的影响MTT结果显示(Fig 1),经不同浓度右旋糖酐铁处理48 h后,细胞存活率降低、培养液LDH活性增加 (P<0.01),3.75~30 μmol·L-1区间呈明显的剂量依赖性;而同步进行的、对应浓度的右旋糖酐处理的HUVECs细胞存活率和培养液LDH活性均无改变(P>0.05),表明相应剂量的右旋糖酐铁造成的HUVECs细胞损伤,源于Fe2+毒性,与渗透压改变等因素无关。鉴于7.5 μmol·L-1位于右旋糖酐铁处理剂量区间中段,本文后续实验中凡涉及右旋糖酐铁处理的终浓度均为7.5 μmol·L-1。
2.2右旋糖酐铁损伤的HUVECs中eNOS蛋白表达改变Western blot 结果显示(Fig 2),与对照组相比,Iron组细胞eNOS蛋白表达明显下调(P<0.01);而1 mmol·L-1L-Arg可明显减弱右旋糖酐铁下调细胞eNOS表达的作用。
2.3右旋糖酐铁损伤的HUVECs中DDAHⅡ活性、MDA、ADMA、NO含量的改变如Tab 1所示,Iron组细胞DDAHⅡ活性明显降低,MDA 含量升高(P<0.01),培养液中ADMA含量明显增加(P<0.01),NO含量减少(P<0.01) ;而1 mmol ·L-1L-Arg可明显逆转右旋糖酐铁的相关作用。
**P<0.01vsprior dosage

Fig 2 Iron overload down-regulated eNOSexpression in HUVECs(±s, n=8)
**P<0.01vsControl;##P<0.01vsIron
2.4右旋糖酐铁损伤的HUVECs中ROS的变化如Fig 3所示,HUVECs经右旋糖酐铁处理后,ROS生成明显增加(P<0.01);而1 mmol ·L-1L-Arg处理后,细胞ROS生成明显降低(P<0.01),提示L-Arg可减轻铁过载引起的ROS爆发。

Fig 3 Iron overload induced ROSgeneration in HUVECs(±s, n=8)
**P<0.01vsControl;##P<0.01vsIron
2.5右旋糖酐铁损伤的HUVECs细胞线粒体膜电位的变化如Fig 4所示,HUVECs经右旋糖酐铁处理后,线体粒膜电位明显减小(P<0.01);而1 mmol·L-1L-Arg处理后,线粒体膜电位明显恢复(P<0.01),表明L-Arg可稳定线体粒膜电位。

Fig 4 Iron overload loss of mitochondriamembrane potential in HUVECs(±s, n=8)
**P<0.01vsControl;##P<0.01vsIron
2.6右旋糖酐铁对HUVECs细胞mPTP开放的影响如Fig 5所示,HUVECs经右旋糖酐铁处理后,其线体粒受到CaCl2刺激后极易肿胀(P<0.01),即线体粒的mPTP易于开放;而1 mmol·L-1L-Arg处理后,线粒体对CaCl2刺激明显耐受(P<0.01),表明L-Arg可使mPTP关闭。
2.7右旋糖酐铁对HUVECs细胞凋亡的影响如Fig 6所示,HUVECs经右旋糖酐铁处理后,其阳性细胞百分率明显高于对照组(P<0.01);与之相比,1 mmol·L-1L-Arg处理后,细胞凋亡率明显降低(P<0.01)。
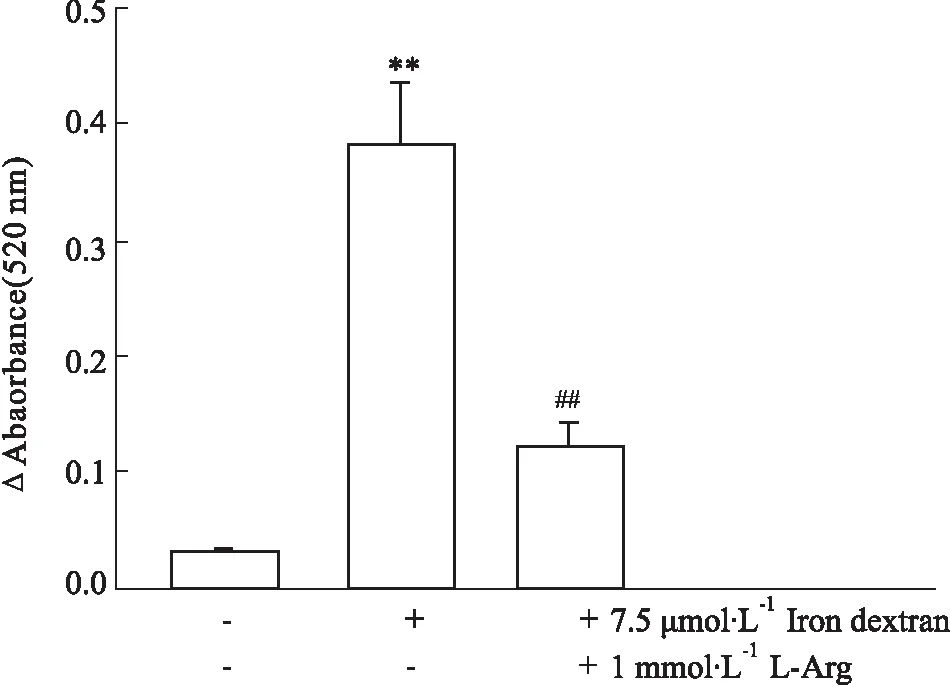
Fig 5 Iron overload opened mitochondrialpermeability transition pores in HUVECs (±s, n=8)
**P<0.01vsControl;##P<0.01vsIron
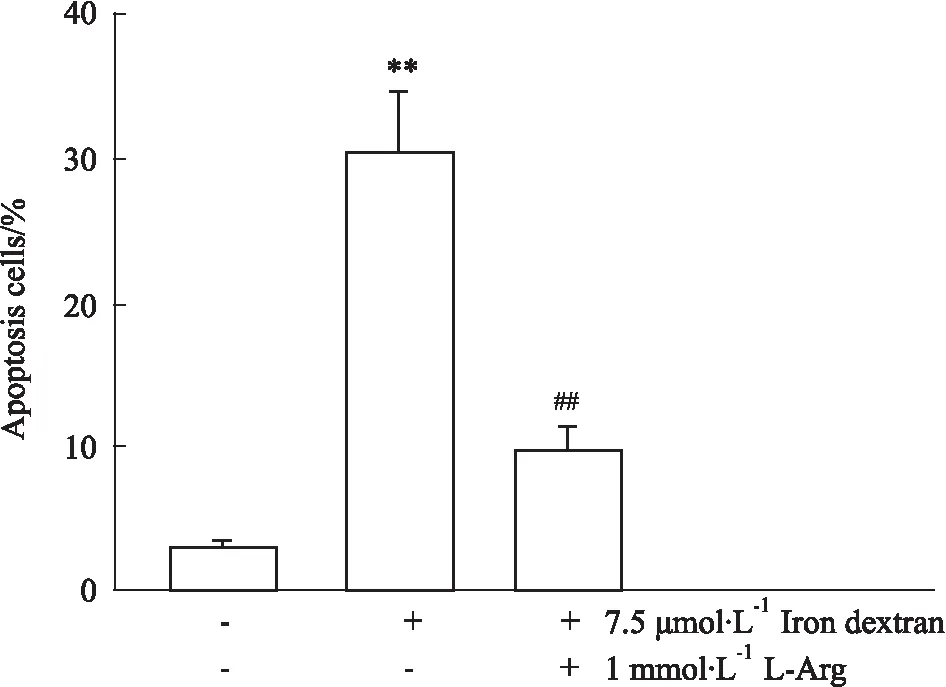
Fig 6 Iron overload induced apoptosis in HUVECs(±s, n=8)
**P<0.01vsControl;##P<0.01vsIron
3 讨论
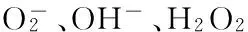
研究表明[4-6, 11],L-Arg与ADMA可竞争性抑制eNOS,影响NO生成,调控血管内皮细胞功能以及血管张力。ADMA由内皮细胞产生,被DDAHⅡ降解、失活。DDAHⅡ对细胞内ROS增加极为敏感而使活性降低,使得ADMA堆积。ADMA不仅与L-Arg竞争eNOS,使NO生成减少,影响内皮细胞功能以及血管张力,且可通过“NOS脱偶联”机制,即eNOS不能催化L-Arg的双电子氧化生成NO,反而产生超氧离子(更多ROS生成),而对DDAHⅡ产生更为强大的抑制,形成恶性循环,最终导致血管内皮细胞功能衰竭。本实验首次发现,7.5 μmol·L-1右旋糖酐铁处理24 h可使HUVECs细胞eNOS表达下调、DDAHⅡ活性降低、MDA含量增加,而培养液中ADMA含量明显增加、NO含量明显减少(由于未能检测p-eNOS变化,难以确认NO含量改变与eNOS表达下调间的因果关系);而用1 mmol·L-1L-Arg同步处理后,铁离子的上述作用明显减弱,表明铁过载造成的HUVECs细胞损伤与eNOS有关,也很可能有ADMA/DDAHⅡ的参与。
近年来发现,线粒体不仅控制细胞的能量代谢,而且在维持细胞钙稳态、调节细胞凋亡或坏死等过程中起着决定性作用[12]。某些触发因素使得部分线粒体产生、释放ROS,通过“活性氧引起的活性氧释放”(ROS-induced ROS-release, RIRR)机制,正反馈性诱发周边正常线粒体产生、释放大量的ROS,即导致ROS爆发;引起线粒体膜电位振荡,mPTP的开放,导致外膜破裂及线粒体不可逆损伤;随之基质肿胀,外膜破裂,细胞色素C等凋亡信号分子释放,导致细胞凋亡或死亡[3, 13]。本实验首次发现,7.5 μmol·L-1右旋糖酐铁处理48 h可使HUVECs细胞ROS生成明显增加,线粒体膜电位减小,mPTP的开放,细胞凋亡明显增加;而用1 mmol·L-1L-Arg同步处理后,铁离子的上述作用明显减弱,表明铁过载成的HUVECs细胞损伤与其线粒体功能衰竭有关。

Tab 1 Effects of iron dextran on intracellular MDA content, DDAHⅡ activity, and ADMA, NO content in cultured medium (±s, n=8)
**P<0.01vsControl;##P<0.01vsIron.
综上所述,铁过载可引起HUVECs细胞ROS形成,可能在eNOS以及ADMA/NO/ DDAHⅡ参与下,使得ROS恶性生成,进而激活RIRR机制,诱发mPTP过度开放,最终导致内皮细胞功能衰竭。
[1] Galaris D, Pantopoulos K. Oxidative stress and iron homeostasis: mechanistic and health aspects[J].CritRevClinLabSci, 2008,45(1):1-23.
[2] Liu D, He H, Yin D, et al. Mechanism of chronic dietary iron overloadinduced liver damage in mice[J].MolMedRep, 2013,7(4): 1173-9.
[3] Mak I T, Chmielinska J J, Nedelec L, et al. D-propranolol attenuates lysosomal iron accumulation and oxidative injury in endothelial cells[J].JPharmacolExpTher, 2006,317(2): 522-8.
[4] Siekmeier R, Grammer T, März W. Roles of oxidants, nitric oxide, and asymmetric dimethylarginine in endothelial function[J].JCardiovascPharmacolTher, 2008,13(1): 279-97.
[5] Mangoni A A. The emerging role of symmetric dimethylarginine in vascular disease[J].AdvClinChem, 2009,48:73-94.
[6] Yuan Q,Peng J,Liu S Y,et al.Inhibitory effect of resveratrol derivative BTM-0512 on high glucose-induced cell senescence involves dimethylaminohydrolase/asymmetric dimethylarginine pathway[J].ClinExpPharmacolPhysiol,2010,37(5-6): 630-5.
[7] 周 敏, 游嘉振, 何 欢, 等. Bcl-2介导的芹菜素抗心肌细胞缺氧/复氧损伤作用[J]. 中国药理学通报, 2015,31(1): 122-7.
[7] Zhou M, You J Z, He H, et al. Role of Bcl-2 signal pathway in apigenin preconditioning against cardiomyocytes anoxia/reoxygenation injury[J].ChinPharmacolBull, 2015,31(1): 122-7.
[8] 刘 丹, 彭易安, 刘卓琦, 等. Bcl-2/Bad/mPTP通路介导14-3-3γ对抗脂多糖所致心肌损伤[J]. 中国药理学通报, 2013,29(1): 48-52.
[8] Liu D, Peng Y A, Liu Z Q, et al. Bcl-2/Bad/mPTP pathway mediates 14-3-3γ protecting against LPS-induced myocardial injury[J].ChinPharmacolBull, 2013,29(1): 48-52.
[10] Lawen A, Lane D J. Mammalian iron homeostasis in health and disease: uptake, storage, transport, and molecular mechanisms of action[J].AntioxidRedoxSignal, 2013,18(18): 2473-507.
[11] 呼晓雷,周继朋,陈小平.AGXT2与ADMA代谢及心脑血管疾病的研究进展[J].中国药理学通报,2015,31(5):601-5.[11] Hu X L, Zhou J P, Chen X P. Role of AGXT2 in ADMA metabolism and the development of cardiovascular and cerebrovascular diseases[J].ChinPharmacolBull, 2015,31(5): 601-5.
[12] Levi S, Rovida E. The role of iron in mitochondrial function[J].BiochimBiophysActa, 2009,1790(7):629-36.
[13] Zinkevich N S, Gutterman D D. ROS-induced ROS release in vascular biology: redox-redox signaling[J].AmJPhysiolHeartCircPhysiol, 2011,301(3):H647-53.
MitochondrialdamageinducedbyironoverloadviaeNOSinvascularendothelialcells
HE Huan1, ZHANG Ze-yu1, LIU Dan1, LIAO Zhang-ping1, YIN Dong2, HE Ming1
(1.JiangxiProvincialKeyLabofBasicPharmacology,SchoolofPharmaceuticalScience,NanchangUniversity,Nanchang330006,China; 2.JiangxiProvincialKeyLabofMolecularMedicine,theSecondAffiliatedHospitaltoNanchangUniversity,Nanchang330006,China)
AimTo investigate the damage of mitochondria in HUVECs cells by iron overload and the role of ADMA/eNOS/DDAHⅡ in it.MethodsHUVECs cells were cultured and randomly divided into normal control (Ctrl) group, dextran iron (Iron) group and L-arginine (L-Arg) group. After 48 h, the survival rate of cells was detected by MTT assay; ADMA content and DDAHⅡactivity were measured by HPLC method; the expression of eNOS was determined by Western blot; LDH activity, MDA and NO content, and mitochondrial permeability transition pores(mPTP) openness were determined by colorimetric assay; ROS generation, mitochondrial membrane potential and apoptosis were determined by flow cytometry.ResultsAfter 48 h treatment with iron, the survival rate of HUVECs significantly decreased, while the activity of LDH in culture medium increased. The results showed that ADMA and MDA content significantly increased, NO content, DDAHⅡactivity, and the expression of eNOS markedly decreased, the generation of ROS was evidently elevated, mitochondrial membrane potential was lost apparently, mPTP openness was obvious, and the apoptosis of the HUVECs were worsened. However, as ADMA physiological antagonist, L-Arg significantly attenuated the above effects of iron.ConclusionIron overload could damage mitochondrial function by eNOS and induce the apoptosis of HUVECs, in which ADMA/DDAHⅡ mechanism may also be engaged.
iron overload; mitochondria; ADMA; eNOS; DDAH II; cell apoptosis
10.3969/j.issn.1001-1978.2017.10.025
A
:1001-1978(2017)10-1457-05
R329.24;R329.25;R543;R589.9;R591.1
时间:2017-9-5 9:26 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170905.0925.050.html
2017-06-06,
2017-08-10
国家自然科学基金资助项目(No 21467017)
何 欢(1988-),女,博士,讲师,研究方向:心血管损伤与保护,E-mail:hannahhe1988@hotmail.com; 尹 东(1956- ),女,硕士,教授,研究方向:细胞内信号通路传递,通讯作者,E-mail:dongyin24@126.com; 何 明(1956- ),男,博士,教授,博士生导师,研究方向:心血管损伤与保护,通讯作者,E-mail:jxhm56@163.com

