金雀异黄酮对三阴乳腺癌MDA-MB-231细胞凋亡及EGFR/PI3K/Akt通路的影响
韦立群,李婉婷,李 通,徐成飞,唐双意,甘嘉亮
(广西医科大学 1. 药学院、2. 第一附属医院结直肠肛门外科、3. 第一附属医院药学部,广西 南宁 530021)
金雀异黄酮对三阴乳腺癌MDA-MB-231细胞凋亡及EGFR/PI3K/Akt通路的影响
韦立群1,李婉婷1,李 通2,徐成飞2,唐双意3,甘嘉亮2
(广西医科大学 1. 药学院、2. 第一附属医院结直肠肛门外科、3. 第一附属医院药学部,广西 南宁 530021)
目的研究金雀异黄酮(genistein)诱导三阴性乳腺癌MDA-MB-231细胞凋亡及其机制。方法MTT法观察金雀异黄酮对乳腺癌MDA-MB-231细胞增殖的抑制作用;Hoechst 33258染色观察金雀异黄酮对MDA-MB-231细胞核凋亡形态学的影响;qRT-PCR法观察金雀异黄酮干预MDA-MB-231细胞36 h后,EGFR mRNA表达水平的变化;金雀异黄酮干预MDA-MB-231细胞36 h后,Western blot检测凋亡相关蛋白Bcl-2、Bax、caspase-3,EGFR、Akt、p-Akt蛋白的变化;Akt激活剂胰岛素(insulin)、金雀异黄酮单独及联合胰岛素干预乳腺癌MDA-MB-231细胞后,Western blot检测Akt和p-Akt蛋白表达量的变化。结果MTT结果显示,金雀异黄酮呈时间浓度依赖性抑制乳腺癌MDA-MB-231细胞增殖;Hoechst 33258染色结果显示,金雀异黄酮干预乳腺癌MDA-MB-231细胞36 h后细胞核呈现典型凋亡形态学改变;qRT-PCR结果显示,经金雀异黄酮干预MDA-MB-231细胞36 h后,EGFR的mRNA表达水平明显下降(P<0.01);Western blot结果显示金雀异黄酮干预乳腺癌MDA-MB-231细胞36 h后,与对照组对比,Bcl-2、EGFR、Akt、p-Akt蛋白表达水平明显下调(P<0.01),Bax、caspase-3蛋白表达水平明显上调(P<0.01),Akt激活剂胰岛素可以明显激活p-Akt(P<0.01),金雀异黄酮可以明显下调被激活的p-Akt(P<0.01)。结论金雀异黄酮能抑制三阴乳腺癌MDA-MB-231细胞生长并诱导其凋亡,其机制可能与抑制EGFR/PI3K/Akt信号通路有关。
金雀异黄酮;三阴乳腺癌;凋亡;增殖;人表皮生长因子受体;EGFR/PI3K/Akt信号通路
三阴乳腺癌是指雌激素受体( estrogen receptor,ER) 、孕激素受体( progesterone receptor,PR) 和人表皮生长因子受体2( human epidermal growth factor receptor-2,HER2) 表达均为阴性的乳腺癌,具有强侵袭力、高风险远处转移和预后不良等生物学特点,占所有乳腺癌的15%~23%[1-3]。治疗上与非三阴乳腺癌相比,无法采用内分泌治疗和分子靶向治疗等多种有效治疗手段,可见三阴乳腺癌非手术治疗手段单一。因此,临床医师期望有更多可选择的手段来丰富三阴乳腺癌的治疗。金雀异黄酮(genistein)又称染料木素,主要来源于豆类食物,其化学结构为 5,7,4′-三羟基异黄酮,与内源性雌激素雌二醇结构相似[4],具有广泛的生物活性。有研究报道,金雀异黄酮通过 p38MAPK通路促进骨髓间充质干细胞向成骨细胞分化[5]。成魁等[6]报道,金雀异黄酮具有一定的骨保护作用。在金雀异黄酮广泛的生物活性中抗癌活性最为明显,但其抗癌具体机制仍然不十分清楚。本课题拟用金雀异黄酮作用于高转移三阴乳腺癌细胞株MDA-MB-231,了解其对增殖及凋亡的影响,并探讨其可能机制,为开发植物雌激素抗癌提供理论依据。
1 材料与方法
1.1细胞与试剂人乳腺癌细胞MDA-MB-231由广西医科大学第一附属医院病理科冯振博课题组惠赠,该细胞株购自中国科学院上海细胞库。DMEM高糖培养基购自美国康宁公司;金雀异黄酮、胰岛素、噻唑蓝( MTT)、结晶紫和荧光染料 Hoechst 33258 购自美国 Sigma 公司;胎牛血清购自澳大利亚 Excellbio 公司;RNA提取试剂盒购自美国Invitrogen 公司;RNA 逆转录试剂盒购自美国Thermo Scientific公司;GAPDH、Bax、Bcl-2、EGFR抗体购自美国ABclonal 公司;Akt、p-Akt兔抗人多克隆抗体购自美国 Cell Signaling Technology 公司;0.25%胰酶、BCA蛋白浓度测定试剂盒、RIPA裂解液(强)、PMSF(100 nmol·L-1)、SDS PAGE凝胶配制试剂盒,购自中国碧云天生物技术有限公司。
1.2细胞培养及药品储存液配制人乳腺癌细胞MDA-MB-231用含10%胎牛血清高糖DMEM,于37℃、5% CO2饱和湿度下常规培养,每2~3 d传代1次。金雀异黄酮溶于DMSO配制成100 mmol·L-1储存液,-20℃ 保存,实验时用 10%胎牛血清的高糖DMEM培养基稀释成相应浓度(DMSO终体积分数不能超过0.1%)。
1.3MTT实验取对数生长期的MDA-MB-231细胞,以4×103/孔 接种于96孔板,培养12 h待细胞贴壁后,弃去培养上清液,加入配制好的终浓度为0、12.5、25、50、100、200 μmol·L-1的金雀异黄酮,每孔200 μL,每个浓度设5个复孔,分别培养24、36、48 h,每孔加入20 μL 5 g·L-1的MTT,孵育4 h后将孔里的液体吸出,加入150 μL的DMSO,于震荡器上避光震荡10 min,充分溶解结晶,在490 nm处用酶标仪测定各孔的吸光值(OD值)。细胞存活抑制率/%=(正常对照组A490 nm-给药组A490 nm)/正常对照组A490 nm×100%。
1.4Hoechst33258染色实验将对数期生长的MDA-MB-231细胞接种到内嵌有经过无菌处理的盖玻片的6孔板上,待细胞长至80%时,弃去培养基,加入含有不同浓度金雀异黄酮(0、25、50、100 μmol·L-1)的培养基,置于37℃、5% CO2培养箱继续培养36 h,弃去培养基,用PBS缓冲液洗3遍,加入多聚甲醛固定15 min后弃去,用PBS洗3遍;再用Hoechst 33258工作液室温避光染色20 min,弃去工作液,用 PBS洗3遍,再用抗荧光淬灭封片液封片,荧光显微镜观察拍照。
1.5qRT-PCR实验将对数生长期的MDA-MB-231细胞接种于培养瓶中,待细胞长至80%时,弃去培养基,加入含有不同浓度金雀异黄酮(0、25、50、100 μmol·L-1)的培养基,置于37℃、5% CO2培养箱继续培养36 h,弃去培养基,用PBS缓冲液洗3遍,用RNA提取试剂盒(Axygen)提取MDA-MB-231细胞总RNA,用核酸检测仪测总RNA 的含量和纯度,用Thermo逆转录试剂盒将1 μg 总RNA逆转录为 cDNA。用EGFR基因特异性引物进行实时荧光定量聚合酶链式反应(qRT-PCR),按说明书操作。反应步骤: 95℃ 10 min,95℃ 15 s,60℃ 1 min,共40个循环。以2-ΔΔCT表示基因的相对表达量。EGFR引物序列:上游为5′-CCTGGTCTGGAAGTACGCAG-3′,下游为5′-CGATGGACGGGATCTTAGGC-3′,内参基因GAPDH引物序列:上游为5′-GTCTTCACCACCATGGAGAAG-3′,下游为5′-GTTGTCATGGATGACCTTGGC-3′。
1.6Westernblot实验将对数生长期的MDA-MB-231细胞接种于培养瓶中,待细胞长至80%时,弃去培养基,加入含有不同浓度金雀异黄酮(0、25、50、100 μmol·L-1)的培养基,置于37℃、5% CO2培养箱继续培养36 h,弃去培养基,用PBS缓冲液洗3遍,加入细胞裂解液(RIPA ∶PMSF ∶Cocktail=100 ∶1 ∶2)冰上裂解30 min,12 000 r·min-1离心20 min,用BCA法检测蛋白浓度,加入上样蛋白缓存液,置于沸水中高温变性8 min,取100 μg蛋白质,经10% SDS-聚丙烯酰胺凝胶电泳分离后,转移至 PVDF膜上,室温下5% BSA封闭 40 min,一抗冰上孵育过夜,二抗室温孵育 60 min,最后用双色红外荧光扫描成像系统扫膜并采集图像。每组实验重复 3 次。

2 结果
2.1MTT法观察金雀异黄酮对乳腺癌MDA-MB-231细胞增殖的影响如Tab 1结果显示,随着金雀异黄酮浓度和时间的增加,对细胞存活的抑制作用逐渐增强。24、36、48 h 的 IC50值分别为(74.93± 1.35)、(63.82 ± 1.76)、(55.44±0.15)μmol·L-1。
2.2Hoechst33258染色观察金雀异黄酮对MDA-MB-231细胞凋亡的影响Fig 1染色结果显示,细胞对照组中为正常细胞,形态呈圆形,淡蓝色,细胞核被Hoechst着色;而经金雀异黄酮处理后的细胞,细胞出现明显的凋亡特征,可见早期凋亡细胞,细胞核染色质凝聚、固缩成明亮的月牙状、哑铃状或不规则圆形、椭圆形亮蓝白色亮光。随着药物浓度的增加,凋亡率明显增高(P<0.01),见Fig 2,表明 金雀异黄酮对 MDA-MB-231细胞凋亡有一定的诱导作用并且有浓度依赖性。

Tab 1 Effect of different concentrations ofgenistein on viability of MDA-MB-231 cells (±s,n=3)
**P<0.01vscontrol

Fig 1 Effect of genistein on morphologyin MDA-MB-231 cells(×200)
A: Control group; B:25 μmol·L-1genistein; C: 50 μmol·L-1genistein; D:100 μmol·L-1genistein
2.3qRT-PCR法观察金雀异黄酮对MDA-MB-231细胞EGFRmRNA表达的影响如Fig 3所示,不同浓度的金雀异黄酮(0、25、50、100 μmol·L-1)作用MDA-MB-231细胞36 h,与对照组相比,随着金雀异黄酮浓度升高,EGFR mRNA 表达量逐渐下降,并呈现量效趋势(P<0. 01)。提示金雀异黄酮诱导乳腺癌MDA-MB-231细胞凋亡可能和下调EGFR相关。
2.4金雀异黄酮对MDA-MB-231细胞凋亡相关蛋白表达的影响如Fig 4所示,与对照组相比,金雀异黄酮作用36 h,Bcl-2蛋白表达明显下调(P<0.01),Bax蛋白表达明显升高(P<0.01),caspase-3蛋白表达明显上调(P<0.01)。提示金雀异黄酮对促凋亡蛋白具有明显的诱导作用。

Fig 2 Effect of MDA-MB-231 cells treated bydifferent concentrations of genistein on cell apoptosis
**P<0.01vscontrol (0 μmol·L-1)
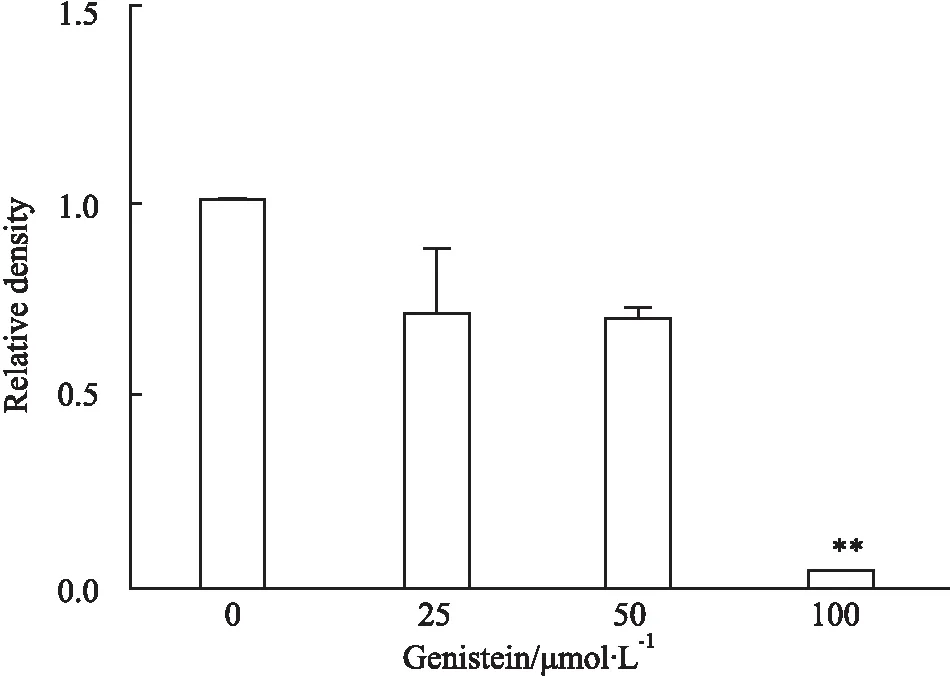
Fig 3 Effect of genistein on MDA-MB-231 cellEGFR mRNA expression
**P<0.01vscontrol(0 μmol·L-1).
2.5金雀异黄酮对MDA-MB-231细胞EGFR/PI3K/Akt通路蛋白的影响如Fig 5所示,与对照组相比,金雀异黄酮呈浓度依赖性抑制 EGFR、Akt、p-Akt蛋白的表达(P<0.01)。如Fig 6所示,与对照组相比,胰岛素(100 μg·L-1)可以激活上调p-Akt蛋白表达水平(P<0.01),在胰岛素基础上加入金雀异黄酮(100 μmol·L-1),可明显降低 Akt和p-Akt蛋白的表达强度(P<0.01),提示金雀异黄酮可以抑制EGFR/PI3K/Akt信号通路。
3 讨论
乳腺癌是女性最常见的癌症,2017年美国新发病例约为252 710例;在中国大陆,2015年新发病例达268 600例,可见世界范围内女性乳腺癌呈逐年上升趋势[7-8]。三阴乳腺癌是乳腺癌的一种特殊亚型,由于它对目前常用的成熟的内分泌治疗及针对HER2基因的分子靶向治疗均无效,其主要非手术治疗方法为全身化疗,但全身化疗常有不同程度的毒副作用,导致部分患者无法耐受或无法完成整个治疗周期。中医中药治疗癌症早有相关记载,无论是与化疗药合用还是单独用药,都具有减轻化疗药毒副作用、提高生活质量、治疗兼顾整体与个体化等优势[9-11]。

Fig 4 Effect of genistein on expression of apoptosis relatedproteins in MDA-MB-231 cells by Western blot
**P<0.01vscontrol(0 μmol·L-1)

Fig 5 Effect of genistein on expression of EGFR, Akt, p-Akt proteins in MDA-MB-231 cells by Western blot
**P<0.01vscontrol (0 μmol·L-1)

Fig 6 Effect of genistein on expression of Akt, p-Akt proteinsin MDA-MB-231 cells by Western blot
**P<0.01vscontrol
细胞凋亡又称为细胞程序性死亡,是指在自身或外界因素作用下,由细胞自身基因调控的一种主动的、有序性细胞死亡形式[12]。在肿瘤治疗中,诱导肿瘤细胞发生凋亡是许多化疗药物发挥抗肿瘤效应的重要机制之一。线粒体凋亡通路是主要的途径,Bax 是 Bcl-2 家族的促凋亡蛋白,细胞受到损伤时,大量的细胞内信号引起前凋亡蛋白 Bax 的活化,Bax 转位到线粒体表面,增加线粒体通透性,导致细胞色素 C 外漏,从而激活线粒体细胞凋亡途径,形成凋亡小体[13]。我们研究结果显示,金雀异黄酮可明显抑制乳腺癌细胞MDA-MB-231细胞增殖,诱导细胞大量发生凋亡,明显下调凋亡蛋白Bcl-2和上调Bax、caspase-3蛋白的表达水平,提示金雀异黄酮具有很强抗肿瘤生物活性,与文献报道一致[14-15]。研究显示,磷酯酰肌醇-3 激酶/蛋白激酶 B(PI3K/Akt)是细胞生长、代谢、凋亡等生物学行为的重要调节通路,有越来越多证据表明PI3K/Akt参与许多恶性肿瘤的发生和发展[16-17]。因此,抑制PI3K/Akt通路即可以抑制肿瘤的生长或发展。在我们的研究中,金雀异黄酮可以明显抑制Akt、p-Akt蛋白表达水平,使用其激活剂胰岛素(100 μg·L-1)尽管可以激活上调p-Akt蛋白表达水平,但加入金雀异黄酮(100 μmol·L-1)后,又会明显降低 Akt和p-Akt蛋白的表达强度,提示金雀异黄酮可以明显抑制PI3K/Akt通路的信号传导。
人表皮生长因子受体(epidermal growth factor receptor, EGFR)家族主要由EGFR、HER2、HER3 和 HER4等4个不同的受体酪氨酸激酶组成,是一种大分子跨膜糖蛋白。乳腺癌细胞MDA-MB-231细胞尽管不表达ER、PR、HER2等受体,但有EGFR表达[18]。现已证实,在人类多种恶性肿瘤组织和肿瘤细胞株中,存在着 EGFR表达和功能的异常[19]。一旦EGFR过度表达,下游信号传导增强,细胞增殖就会处于失控状态,从而导致细胞癌变。因此,EGFR被认为是抗肿瘤药物的分子靶点之一。我们的研究显示,金雀异黄酮明显下调乳腺癌细胞MDA-MB-231细胞基因和蛋白水平的EGFR表达,说明金雀异黄酮是可以抑制EGFR表达的,而PI3K/Akt是EGFR跨膜传递信号的其中一条下游通路,故我们推测EGFR/PI3K/Akt是金雀异黄酮发挥抗肿瘤作用的可能机制之一。事实上,在其他肿瘤治疗中,EGFR/PI3K/Akt已证实是抗肿瘤作用的机制之一[20-21]。
综上所述,本研究显示金雀异黄酮可诱导三阴乳腺癌MDA-MB-231细胞凋亡,其机制可能与抑制EGFR/PI3K/Akt信号转导通路有关,为开发金雀异黄酮治疗乳腺癌提供实验和理论参考。
(致谢:本实验于广西医科大学医学科学实验中心完成,感谢实验室老师和同学的指导和帮助!)
[1] 陈玉娟, 王晓东, 汪 静.三阴乳腺癌的特征及治疗现状[J].中国普外基础与临床杂志, 2012,19(9):1024-7.
[1] Chen Y J, Wang X D, Wang J. Characters and therapy of triple-negative breast cancer[J].ChinJBasesClinGeneralSurg, 2012,19(9):1024-7.
[2] 杨思福, 黄建瑾. 三阴乳腺癌临床特点及治疗进展[J].中国肿瘤, 2010,19(10):678-81.
[2] Yang S F, Huang J J.Clinical features and treatment progress in triple-negative breast cancer[J].ChinaCancer, 2010,19(10):678-81.
[3] Palma G, Frasci G, Chirico A, et al. Triple negative breast cancer: looking for the missing link between biology and treatments[J].Oncotarget, 2015,6(29):26560-74.
[4] 宋笑丹,马满玲. 金雀异黄素的药学研究进展及临床应用[J].沈阳药科大学学报, 2009(b07):127.
[4] Song X D, Ma M L.Pharmaceutical research progress and clinical application of genistein[J].JShenyangPharmUniv,2009(b07):127.
[5] 廖清船,肖洲生,秦艳芳, 等. 植物雌激素金雀异黄酮通过p38MAPK通路促进骨髓间充质干细胞向成骨细胞分化[J]. 中国药理学通报,2006,22(6):683-7.
[5] Liao Q C, Xiao Z S, Qin Y F, et al. Phytoestrogen genistein induces osteoblastic differentiation of mouse bone marrow-derived mesenchymal stem cells through p38 MAPK[J].ChinPharmacolBull, 2006,22(6):683-7.
[6] 成 魁, 陈克明, 葛宝丰,等. 淫羊藿苷与金雀异黄酮骨保护作用的比较研究[J]. 中国药理学通报, 2014,30(9):1315-9.
[6] Cheng K, Chen K M, Ge B F, et al. Effect of icariin and genistein on bone protection[J].ChinPharmacolBull, 2014,30(9):1315-9.
[7] Siegel R L, Miller K D, Jemal A. Cancer statistics, 2017[J].CACancerJClin, 2017,67(1):7-30.
[8] Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J].CACancerJClin, 2016,66(2):115-32.
[9] 卢雯平,徐兵和,姜翠红,等.中药对中晚期三阴乳腺癌的生存影响及中医治疗策略探讨[J].世界中医药, 2013,8(1):53-5.
[9] Lu W P, Xu B H, Jiang C H, et al. Effect of herbs on progress-free survival in clinical stage Ⅱ~Ⅳ triple negative breast cancer and strategy of traditional Chinese medicine[J].WorldChinMed, 2013,8(1):53-5.
[10] 周岱翰. 中医药治癌特色的表观遗传学基础[J].广州中医药大学学报, 2015,32(6):1120-2.
[10] Zhou D H. The epigenetic basis of traditional Chinese medicine in cancer[J].JGuangzhouUnivTraditChinMed, 2015,32(6):1120-2.
[11] 龚亚斌,折 哲,郑 桥,等. 中医药分阶段治疗肺癌的思路[J].世界中西医结合杂志,2015,10(3):409-12.
[11] Gong Y B, Zhe Z, Zheng Q, et al. Rational option on treating lung cancer-Chinese herbal medicine combined with other treatments by stages as one of comprehensive methods[J].WorldJIntegrTraditWesternMed, 2015,10(3):409-12.
[12] Zaman S, Wang R, Gandhi V. Targeting the apoptosis pathway in hematologic malignancies[J].LeukLymphoma, 2014,55(9):1980-92.
[13] 张 军, 谷 翔, 黄问银,等. GLP-1对AGEs诱导H9 C2心肌细胞凋亡的保护作用研究[J]. 中国药理学通报, 2017,33(1):120-6.
[13] Zhang J, Gu X, Huang W Y, et al. Protective effect of GLP-1 against AGEs-induced H9c2 myocardial cell apoptosis[J].ChinPharmacolBull,2017,33(1):120-6.
[14] Shafiee G, Saidijam M, Tavilani H, et al. Genistein induces apoptosis and inhibits proliferation of HT29 colon cancer cells [J].IntJMolCellMed, 2016,5(3):178-91.
[15] Zhao Q, Zhao M, Parris A B, et al. Genistein targets the cancerous inhibitor of PP2A to induce growth inhibition and apoptosis in breast cancer cells[J].IntJOncol, 2016,49(3):1203-10.
[16] Fang W L, Huang K H, Lan Y T, et al. Mutations in PI3K/AKT pathway genes and amplifications of PIK3CA are associated with patterns of recurrence in gastric cancers[J].Oncotarget, 2016,7(5):6201.
[17] Li B, Li J, Xu W W, et al. Suppression of esophageal tumor growth and chemoresistance by directly targeting the PI3K/AKT pathway[J].Oncotarget, 2014,5(22):11576-87.
[18] Subik K, Lee J F, Baxter L, et al. The expression patterns of ER, PR, HER2, CK5/6, EGFR, Ki-67 and AR by immunohistochemical analysis in breast cancer cell lines [J].BreastCancer(Auckl), 2010,4:35-41.
[19] 孙栋勋,蔡志毅. EGFR/PI3K/Akt 细胞信号传导通路与肿瘤[J].检验医学, 2014,29(7):768-73.
[19] Sun D X, Cai Z Y. EGFR/PI3K/Akt signaling pathway with tumor[J].LabMed, 2014,29(7):768-73.
[20] Suchowski K, Pöschinger T, Rehemtulla A, et al. Noninvasive bioluminescence imaging of AKT kinase activity in subcutaneous and orthotopic NSCLC xenografts: correlation of AKT activity with tumor growth kinetics[J].Neoplasia, 2017,19(4):310-20.
[21] Jeon Y J, Cho J H, Lee S Y, et al. Esculetin induces apoptosis through EGFR/PI3K/Akt signaling pathway and nucleophosmin relocalization [J].JCellBiochem, 2016,117(5):1210-21.
EffectsofgenisteinonapoptosisandEGFR/PI3K/Aktsignaltransductionpathwayintriple-negativebreastcancerMDA-MB-231cells
WEI Li-qun1, LI Wan-ting1, LI Tong2, XU Cheng-fei2,TANG Shuang-yi3, GAN Jia-liang2
(1.SchoolofPharmaceuticalScience; 2.DeptofColorectalandAnalSurgery,FirstAffiliatedHospital; 3.DeptofPharmacy,FirstAffiliatedHospital,GuangxiMedicalUniversity,Nanning530021,China)
AimTo investigate the effect of genistein on apoptosis in triple-negative breast cancer MDA-MB-231 cells and the underlying mechanisms.MethodsMTT assay was used to detect the inhibition rate on breast cancer MDA-MB-231 cells of genistein. Hoechst 33258 staining was applied to determine the effect of genistein on morphology of MDA-MB-231 cells. qRT-PCR was employed to detect the mRNA expression of EGFR in MDA-MB-231 cells. Western blot was utilized to determine the expression of Bcl-2, Bax, caspase-3, EGFR, Akt, and p-Akt. The expressions of Akt and p-Akt proteins in breast cancer MDA-MB-231 cells were detected after treated with Akt activator insulin, genistein and in combination with insulin.ResultsGenistein inhibited the viability of breast cancer MDA-MB-231 cells in a time-dependent manner. The results of Hoechst 33258 staining showed a typical apoptotic morphological changes of MDA-MB-231 cells after treatment of genistein for 36 h. qRT-PCR showed that the mRNA expression of EGFR in MDA-MB-231 cells decreased after treated with genistein for 36 h. The expression levels of Bcl-2, EGFR, Akt, p-Akt, ERK, p-ERK were significantly down-regulated(P<0.01) compared with control. While, the expression of Bax, caspase-3 was significantly up-regulated (P<0.01). It was observed that p-Akt was significantly activated after the treatment of Akt activator insulin (P<0.01), however, significantly down-regulated (P<0.01) when treated with genistein.ConclusionGenistein could inhibit the growth of triple-negative breast cancer MDA-MB-231 cells and induce apoptosis, which probably involves regulating EGFR/PI3K/Akt signaling pathway.
genistein; triple-negative breast cancer; apoptosis; proliferation; epidermal growth factor receptor; EGFR/PI3K/Akt signaling pathway
10.3969/j.issn.1001-1978.2017.10.010
A
:1001-1978(2017)10-1376-06
R284.1;R329.24;R329.25;R392.11;R737.9;R977.1
时间:2017-9-5 9:25 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170905.0925.020.html
2017-04-25,
2017-07-28
广西研究生教育创新计划项目(No YCSW2017110);广西高校科学技术研究项目(No 2013ZD015)
韦立群(1992-),女,硕士生,研究方向:临床药理学的基础与临床,E-mail:wwllqq1992@163.com; 唐双意(1975-),女,硕士,副主任药师,硕士生导师,研究方向:临床药理学的基础与临床,通讯作者,E-mail: tshy369@sina.com; 甘嘉亮(1972-),男,博士,主任医师,硕士生导师,研究方向:结直肠癌的基础与临床,通讯作者,E-mail: gjl259@126.com

