高温高压条件制备石榴皮鞣花酸的试验研究
, ,,,,
(枣庄学院生命科学学院,山东枣庄 277160)
高温高压条件制备石榴皮鞣花酸的试验研究
徐加喜,高迪,朱晓梅,郑丹丹,王京龙,张立华*
(枣庄学院生命科学学院,山东枣庄 277160)
目的:探索制备石榴皮鞣花酸新方法。方法:以高压蒸汽灭菌器为反应装置,分别研究了水解温度(压强)、水解时间和硫酸浓度(v/v)对鞣花酸得率的影响,并对工艺参数进行优化。结果:在最佳工艺条件:水解温度(压强)115 ℃(169 kPa)、水解时间2 h、硫酸浓度6%(v/v)时,鞣花酸得率最高达3.09%,与常压相比得率提高了25.10%。结论:高温高压条件下水解石榴皮单宁制备鞣花酸效率较高,为生产工艺的改进提供了技术依据。
石榴皮,鞣花酸,高温高压,水解,得率
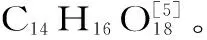
1 材料与方法
1.1材料与仪器
石榴 采自枣庄峄城石榴园,品种为大青皮,经专家鉴定为石榴科植物石榴的果实;甲醇、乙腈 色谱纯,天津市科密欧化学试剂有限公司;鞣花酸标准品 上海源叶生物科技有限公司;其他试剂 国产分析纯。
DHG-9053A电热恒温干燥箱 扬州鸿都电子有限公司;LK-2000A高速粉碎机 新昌县城关红利数控制造厂;KQ3200DE超声波清洗机 昆山超声仪器厂;TDL-40B低速台式大容量离心机 上海安亭科学仪器厂;YXQ-LS-7511高压蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;FA1104B精密电子天平 上海越平科学仪器有限公司;1260高效液相色谱仪 安捷伦科技有限公司。
1.2实验方法
1.2.1 鞣花酸的制备过程 石榴皮→粉碎→超声提取→乙醇热回流提取→水解反应→甲醇萃取→鞣花酸。
1.2.2 鞣花酸含量检测
1.2.2.1 色谱条件 色谱柱:BDS C18柱(150 mm×46 mm,5 μm);流动相:1.2%磷酸溶液∶乙腈=85∶15;检测波长:254 nm;流速:1.0 mL/min;柱温:25 ℃;进样量:20 μL[19]。
1.2.2.2 标准品溶液的制备 精密称取鞣花酸标准品25.00 mg,置于小烧杯中,用适量甲醇加热溶解,冷却至室温,甲醇定容至25 mL,摇匀,做标准品母液。
精密移取标准品母液0.50、1.00、1.50、2.00、3.00、3.50 mL于5 mL容量瓶中用甲醇定容至刻度,摇匀。按1.2.2.1项下色谱条件,分别取20 μL进样分析,制作标准曲线。
1.2.2.3 样品分析 在前期处理的基础上,将水解后的沉淀加入100 mL甲醇,65 ℃回流萃取3 h。取上清液定容至100 mL,经0.22 μm滤膜过滤,进样20 μL,依据色谱峰的保留时间定性,峰面积定量,根据标准曲线回归方程获得鞣花酸的质量浓度x。鞣花酸得率(W)的计算公式如下:
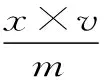
式中,x为待测鞣花酸的质量浓度,μg·mL-1;v为甲醇萃取液定容体积,mL;m为制备20 mL单宁提取液所需的石榴皮粉末的质量,μg;V1为提取的单宁提取液总体积,mL。
1.2.3 石榴皮单宁的提取 取新鲜石榴,手工剥皮水洗,经恒温干燥箱烘干(65 ℃),使用高速粉碎机粉碎,过60~80目筛,封装于保鲜袋中,4 ℃储存备用。
称取上述石榴皮粉末100.0 g,置于圆底烧瓶中,按料液比1∶10 (m/v)加入60%乙醇溶液,超声(300 W)提取30 min[20]后,80 ℃回流浸提2 h,冷却至室温,过滤得单宁提取液,量取总体积(V1)。4 ℃储藏备用。
1.2.4 单因素实验及方法 选定水解温度(压强)、水解时间、硫酸浓度三个因素作单因素实验,以鞣花酸得率为指标研究各因素对鞣花酸得率的影响。
1.2.4.1 水解温度(压强) 在水解时间1 h、体系硫酸浓度为5%(v/v)的条件下,取上述单宁提取液20 mL于50 mL锥形瓶中,以高压蒸汽灭菌器为反应装置,设置水解温度依次为:100 ℃(101 kPa)、105 ℃(121 kPa)、110 ℃(143 kPa)、115 ℃(169 kPa)、120 ℃(199 kPa),研究不同水解温度(压强)对鞣花酸得率影响。
1.2.4.2 水解时间 在水解温度为120 ℃,体系硫酸浓度为5%(v/v)的条件下,取上述单宁提取液20 mL于50 mL锥形瓶中,以高压蒸汽灭菌器为反应装置,设置水解时间依次为:0.5、1、1.5、2、2.5 h,研究不同水解时间对鞣花酸得率影响。
1.2.4.3 硫酸浓度 在水解时间2 h,水解温度为120 ℃的条件下,取上述单宁提取液20 mL于50 mL锥形瓶中,以高压蒸汽灭菌器为反应装置,设置体系硫酸浓度(v/v)依次为:2%、3%、4%、5%、6%。研究不同硫酸浓度对鞣花酸得率的影响。
1.2.5 正交优化实验 在单因素的基础上,选取水解温度(压强)、水解时间、硫酸浓度三个因素做三因素三水平正交优化,以鞣花酸得率为研究指标,确定最佳水解条件。具体因素水平见表1。

表1 正交实验因素水平表Table 1 Factor and the levels of orthogonal test
1.2.6 高压与常压水解方法
1.2.6.1 高压处理 在水解温度(压强)115 ℃(169 kPa),体系硫酸浓度为6%(v/v)的条件下,取上述单宁提取液20 mL于50 mL锥形瓶中,以高压蒸汽灭菌器为反应装置,设置水解时间依次为:1、2 h。
1.2.6.2 常压处理 在水解温度(压强)100 ℃(101 kPa),体系硫酸浓度为6%(v/v)的条件下,取上述单宁提取液20 mL于50 mL锥形瓶中,以恒温水浴锅为反应装置,设置水解时间依次为:1、2 h。
2 结果与分析
2.1高效液相色谱法测定鞣花酸得率
2.1.1 标准品、样品液相色谱分析 由图1、图2可知,鞣花酸在10.9 min左右出峰,且鞣花酸峰面积明显,出峰时间和分离效果较好,无拖尾现象。
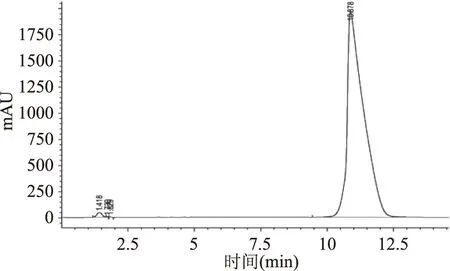
图1 标准品色谱图Fig.1 The chromatogram of standards
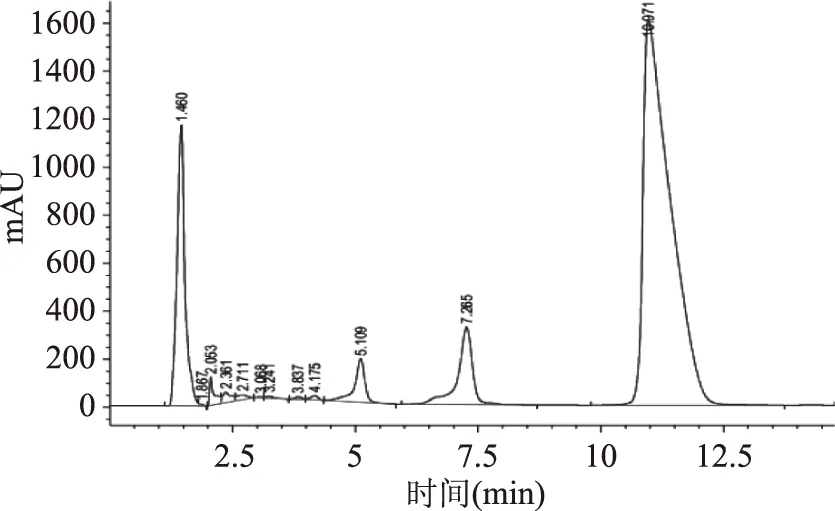
图2 样品色谱图Fig.2 The chromatograms of samples
2.1.2 标准曲线 以峰面积y为纵坐标,标准溶液质量浓度x为横坐标,绘制标准曲线(见图3),线性回归方程为y=194.42x-66.6,R2=0.9998,鞣花酸在100~700 μg·mL-1内呈现良好的线性关系。
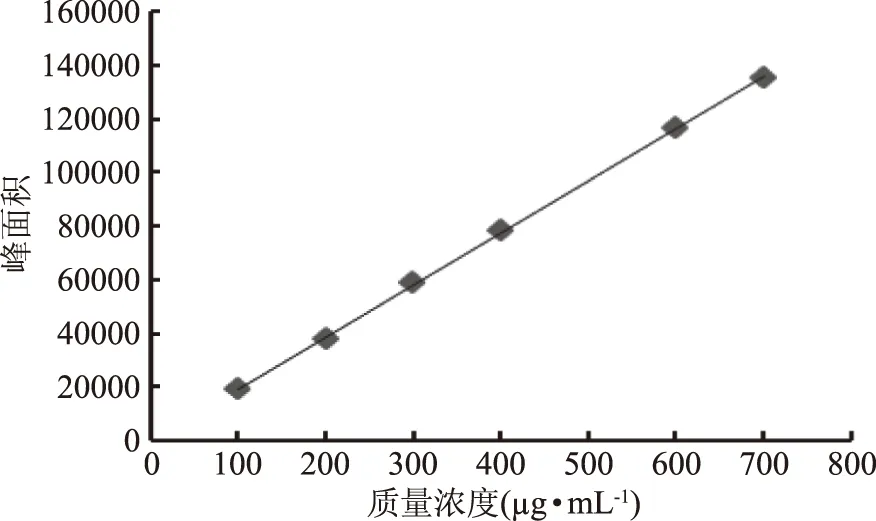
图3 鞣花酸标准品标准曲线Fig.3 Ellagic acid standard curve
2.2不同温度(压强)对鞣花酸得率的影响
水解温度是单宁水解反应的必要条件。由图4直观分析结果可知,在设备允许的安全温度范围内,水解温度在100~120 ℃之间,采用高压蒸汽灭菌器高压水解1 h,随着水解温度的升高、压强的增大,鞣花酸得率也逐渐升高,在120 ℃条件下鞣花酸的得率最高,为2.72%。这可能是因为随着温度的升高、压强的增大,由于二者的叠加效应,水的离子积常数会迅速增加,水中的H+和OH-浓度增加,接近弱酸或弱碱,使高温液态水自身具有酸、碱催化的功能[21-23],能加速鞣花单宁水解反应生成鞣花酸。此外加压可以提高反应物的浓度,从而提高水解反应速率[24]。
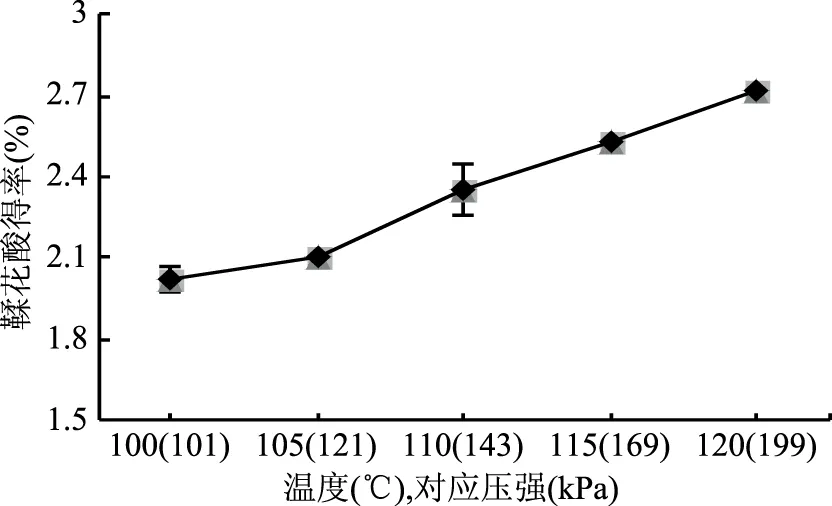
图4 不同温度对鞣花酸得率的影响Fig.4 Effect of different temperature on ellagic acid yield
2.3不同时间对鞣花酸得率的影响
由图5直观分析结果可知,提取时间从0.5~2.5 h,随着水解时间的增长,鞣花酸的得率先增大再减小,2 h时得率最高。大于2 h时,鞣花酸的得率降低,可能是鞣花酸在高温高压条件下被进一步降解,随着反应时间增加被降解的量也增加,最终使鞣花酸得率减少。
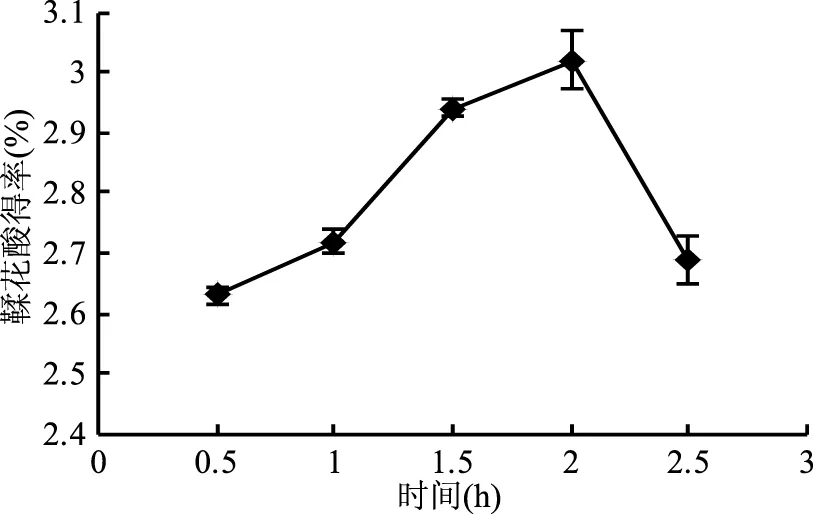
图5 不同时间对鞣花酸得率的影响Fig.5 Effect of different time on ellagic acid yield
2.4不同硫酸浓度对鞣花酸得率的影响
鞣花单宁在酸性条件下其分子中的葡萄糖基与三羟基苯甲酸之间的酯键断裂,发生水解反应,生成六羟基联苯甲酸,其分子内碳碳单键发生旋转,羟基和羧基酯化形成两分子内酯,最终生成鞣花酸[25]。由图6直观分析结果可知,硫酸的浓度对石榴皮鞣花酸的得率有影响,且硫酸浓度太低时水解过程进行不彻底。当硫酸的浓度由2%增加到4%时,鞣花酸得率则从1.87%提高到2.88%,增幅明显;而当硫酸的浓度超过4%时,鞣花单宁水解较充分,鞣花酸得率的增幅平缓。
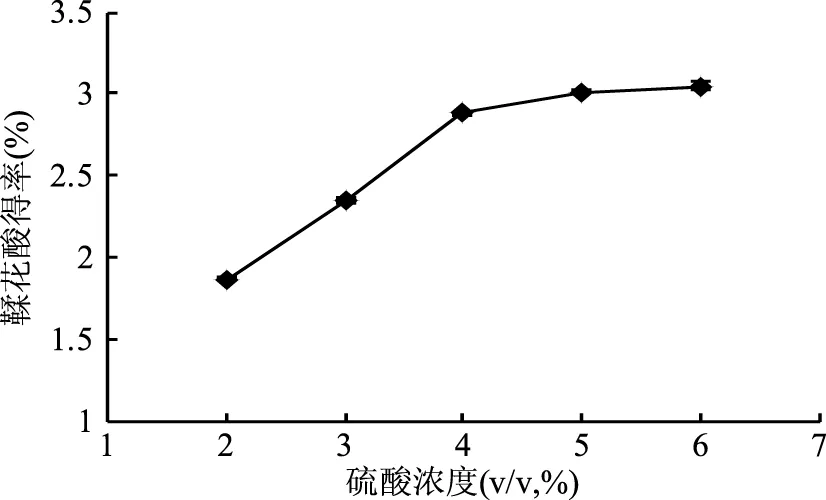
图6 不同硫酸浓度对鞣花酸得率的影响Fig.6 Effect of different acid concentration on ellagic acid yield
2.5正交实验结果
由表2直观分析结果可知,水解时间(B)对鞣花酸得率的影响最大。各因素对鞣花酸得率的影响顺序为:B>A>C,即水解时间>水解温度(压强)>硫酸浓度。最佳水解工艺为A2B2C3,即水解温度(压强)115 ℃(169 kPa)、水解时间2 h、硫酸浓度6%,鞣花酸的最高得率可达3.09%。
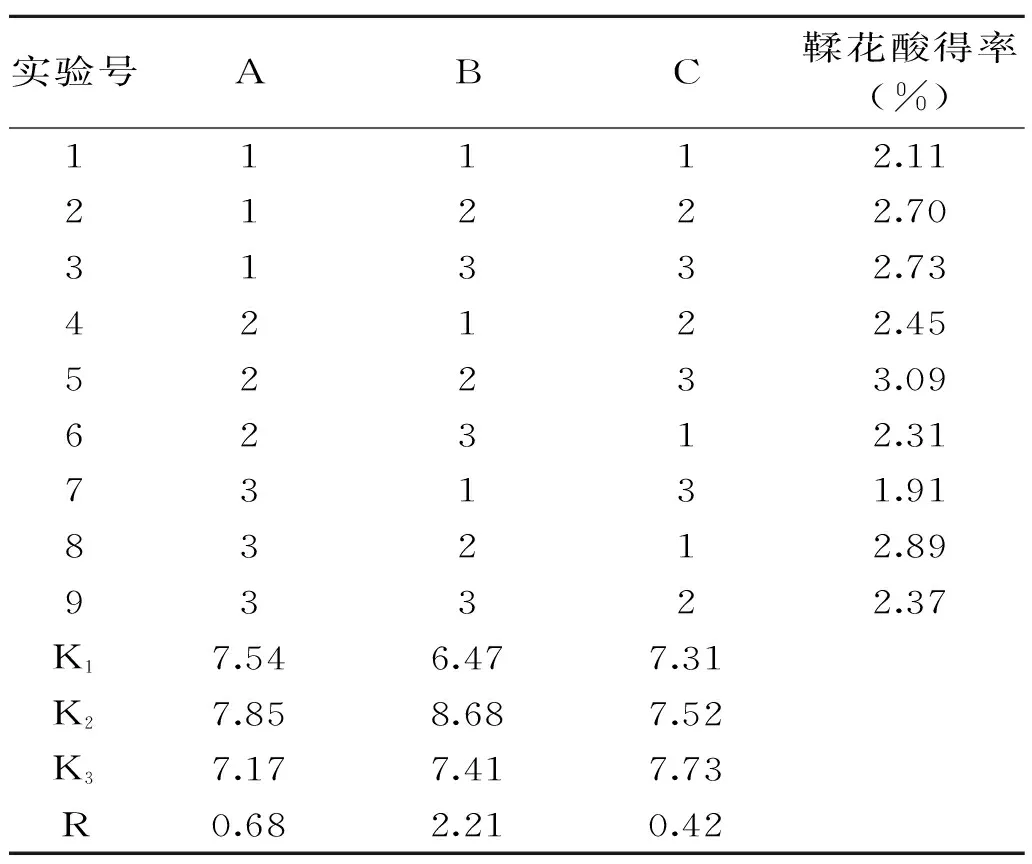
表2 正交实验结果 Table 2 The result of orthogonal experiment
2.6高压与常压条件下鞣花酸得率的比较
由图7直观分析结果可知,水解1 h时,高压、常压条件下鞣花酸得率分别为2.64%、2.27%。水解2 h时,高压处理所得鞣花酸得率为3.09%,与常压相比提高了25.10%。随着水解时间的延长,高压和常压处理所得鞣花酸的得率都呈上升趋势。但是,处理时间相同条件下,高压处理要比常压处理鞣花酸得率大,效率高。可能是因为反应体系压力增大,使得酸解液与样品中的有效成分接触的机会增大[26-27],从而快速达到反应终点的效果。
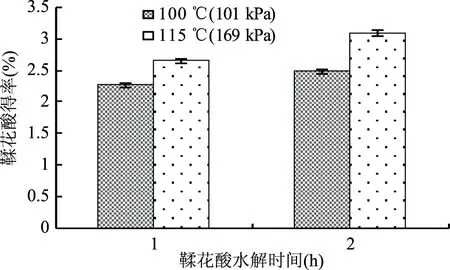
图7 高压与常压水解制备鞣花酸比较 Fig.7 Comparison of the preparation of ellagic acid by hydrolysis at high pressure and normal pressure
3 结论
采用高压蒸汽灭菌器为反应装置,在高温高压条件下制备石榴皮鞣花酸的最佳工艺条件为水解温度(压强)115 ℃(169 kPa)、水解时间2 h、硫酸浓度6%,鞣花酸得率最高可达3.09%,与常压相比得率提高了25.10%。高温高压条件下水解石榴皮单宁制备鞣花酸效率较高,为生产工艺的改进提供了技术依据。
[1]毕晓菲,李勇. 石榴化学成分及其保健功能的研究进展[J]. 现在农业科技,2012,20(2):42-45.
[2]刘安成,李慧,王亮生,等. 石榴类黄酮代谢产物的研究进展[J]. 植物学报,2011,46(2):129-137.
[3]冯立娟,陶吉寒,尹燕雷,等. 石榴功能物质鞣花酸研究进展[J]. 食品科学,2014,35(23):325-330.
[4] 张立华,郝兆祥,董业成. 石榴的功能成分及开发利用[J]. 山东农业科学,2015,47(10):133-138.
[5]李素琴,袁其朋,徐健梅. 鞣花酸的生理功能及工艺开发研究现状[J]. 天然产物研究与开发,2001,13(5):71-74.
[6]刘振平,陈祥贵,杨潇,等. RP-HPLC同时测定石榴皮提取物中的3种鞣质成分[J]. 中国中药志,2011,36(19):2645-2647.
[7]张目,朱少娟,严泽民,等. HPLC测定地榆中没食子酸和鞣花酸的含量[J]. 现代科学仪器,2009,127(5):69-70.
[8]饶夙,陈祥贵,刘振平,等. 鞣花酸和石榴皮多酚提取物抗氧化活性的比较[J]. 食品工业科技,2012,33(12):111-113.
[9]翟清波,李诚,王静,等. 植物多酚降血糖和降血脂作用研究进展[J]. 中国药房,2012(3):279-282.
[10]刘宇文. 鞣花酸的生产制备工艺研究[D]. 北京:北京化工大学,2015.
[11]金欣,王锋,姚岚,等. HPLC测定野老鹳草中没食子酸和鞣花酸的总量[J]. 中成药,2010,32(7):1172-1176.
[12]袁永兵,张兰珍,郭亚健,等. RP-HPLC法测定叶下珠中没食子酸、柯里拉京和鞣花酸的含量[J]. 北京中医药大学学报,2009,32(1):56-58.
[13]陆晶晶,丁轲,杨大进. 保健品功能因子鞣花酸研究进展[J]. 食品科学,2010,31(21):451-454.
[14]王静,周昕,王姝,等. 由五倍子制取鞣花酸[J]. 青岛化工学院学报:自然科学版,2002,23(3):8-11.
[15]Brunner G. Near critical and supercritical water. Part II:Oxidative processes[J]. Journal of Supercritical Fluids,2009,47(3):382-390.
[16]Li L,Chen P,Gloyna E F. Generalized kinetic model for wet oxidation of organic compounds[J]. AICh E Journal,1991,37(11):1687-1697.
[17]Koo M,Lee W K,Lee C H. New reactor system for supercritical water oxidation and its application on phenol destruction[J]. Chemical Engineering Science,1997,52(7):1201-1214.
[18]Bermejo M D,Bielsa I,Cocero M J. Experimental and theoretical study of the influence of pressure on SCWO[J]. AICh E Journal,2006,52(11):3958-3966.
[19]郭金彩. 高效液相色谱法测定鞣花酸含量[J]. 河北化工,2006,29(9):51-52.
[20]邸幼军,贾光锋. 超声强化提取石榴皮鞣花酸的工艺研究[J]. 现代生物医学进展,2010,10(19):3703-3705.
[21]Kus N S. Organic reactions in subcritical and supercritical water[J]. Tetrahedron,2012,68(4):949-958.
[22]Mendiola J A,Herrero M,Cifuentes A,et al. Use of compressed fluids for sample preparation:food applications[J]. Journal of Chromatography A,2007,1152(1-2):234-246.
[23]张迎杰. 单宁提纯及其酸催化水解反应动力学[D]. 杭州:浙江大学,2013.
[24]赵光明. 有机废水过热近临界水氧化理论与实验研究[D]. 太原:中北大学,2015.
[25]王妙飞,程庚金生,张道英,等. 水解法制取五倍子鞣花酸的研究[J]. 食品工业科技,2010,31(2):233-234.
[26]李森,王宽,宗鸣,等. 新技术在黄芪甲苷提取中的应用进展[J]. 中国药房,2011(43):4118-4120.
[27]刘春明,朱俊杰,张守勤,等. 高压技术提取朝鲜淫羊藿总黄酮的研究[J]. 中国中药杂志,2005(19):35-37.
Studyonpreparationofellagicacidfrompomegranatepeelbyhightemperatureandhighpressure
XUJia-xi,GAODi,ZHUXiao-mei,ZHENGDan-dan,WANGJing-long,ZHANGLi-hua*
(College of Life Sciences,Zaozhuang University,Zaozhuang 277160,China)
Objective:To explore a new method of preparation of pomegranate ellagic acid. Methods:The effect of hydrolysis temperature(pressure),hydrolysis time and sulfuric acid concentration(v/v)on ellagic acid yield were studied respectively with high pressure steam sterilizer as the reactor,and also the process parameters were optimized. Results:The highest ellagic acid yield was 3.09% under the optimum conditions of hydrolysis temperature(pressure)of 115 ℃(169 kPa),hydrolysis time of 2 h,sulfuric acid concentration of 5%(v/v),and was increased by 25.10% compared with the atmospheric pressure. Conclusion:Under the condition of high temperature and high pressure,granatanine extracten by hydrolysis method of preparation of ellagic acid efficiency was higher. It provided technical basis for the improvement of production process.
pomegranate peel;ellagic acid;high temperature and high pressure;hydrolysis;yield
2017-02-14
徐加喜(1996-),男,本科,研究方向:植物资源开发,E-mail:xujiaxi2014@163.com。
*通讯作者:张立华(1968-),男,博士,教授,研究方向:植物资源开发及采后生理,E-mail:chinazhanglh@163.com。
山东省重点研发计划(2016GSF202010);枣庄学院大学生创新训练计划项目(2017100)。
TS255.1
:B
:1002-0306(2017)17-0174-04
10.13386/j.issn1002-0306.2017.17.033
——“单宁”

