硫酸铅沉淀回收水中六价铬的行为研究
彭 浩,刘作华,陶长元
(1. 长江师范学院 化学化工学院,重庆 408102; 2. 重庆大学 化学化工学院,重庆 400030)
0 前 言
铬具有银白色金属光泽、延展性能良好、硬度大、熔点高、耐腐蚀等特性,常被用来制作装饰性镀层、防腐耐磨等材料[1]。因此,铬及其化合物在工业生产中有着极为广泛的应用[2]。
铬是动物和人体必需的微量元素之一,但是大量的铬进入环境会对人体、植物和动物产生很大的危害。随着工业的迅猛发展,铬污染也越来越严重,主要涉及冶金、化工、农业、医学等多个领域[2-5]。长期以来,含铬废水处理就是一个比较棘手的环境问题,是工业废水处理中一个重要的研究领域。在含铬废液中,铬主要以Cr(III)和Cr(VI)的形式存在,其中Cr(III)比Cr(VI)更加稳定,且毒性也相对较小。因此,主要的处理方式就是将Cr(VI)还原成Cr(III)后再进行后续处理。还原沉淀法就是一种最为传统的方法[6-8],该法具有工艺技术成熟、操作简单、设备投资低和运行费用低等优点,但该法会消耗大量还原剂、酸碱溶液,同时还会产生大量含铬污泥。吸附法则是利用吸附剂孔隙高、比表面积大、表面活性高等特性对六价铬进行处理,但该法只适用于低浓度含铬废水的处理[9-11]。离子交换树脂法是利用离子交换树脂中活性基团上的可交换离子,去除废水中的六价格离子,但树脂易被氧化和污染,对预处理要求较高[12-16]。电解法、膜分离法、生物法等皆被用来处理含铬废水。
本文根据硫酸铅与铬酸铅溶度积的差异,利用硫酸铅来沉淀六价铬离子。研究了反应温度、反应时间、溶液pH以及硫酸铅用量对六价铬沉淀率的影响。并分析了沉淀产物的结构以及相关反应机理,以期为六价铬的处理提供新的方法。
1 实验材料与方法
1.1 原料及仪器
主要原料:重铬酸钾(分析纯)、氢氧化钠(分析纯)、硫酸铅(分析纯),硫酸(分析纯),去离子水。
主要仪器:HH-6数显恒温水浴锅(国华电器有限公司);PHS-25数字酸度计(上海雷磁仪器厂),SHB-II循环水式多用真空泵(郑州长城科工贸有限公司);YSEI电热鼓风干燥箱(重庆市永生实验仪器厂),X射线荧光光谱分析仪(XRF-1800,Shimadzu),X射线粉末衍射仪分析仪(XRD-6000,Shimadzu)。
1.2 实验方法
称取一定质量的重铬酸钾固体和去离子水置于烧杯中,经搅拌溶解得到重铬酸钾溶液。用硫酸或氢氧化钠溶液调节重铬酸钾溶液pH到合适值后,向溶液中加入事先称量好的硫酸铅固体,然后将该烧杯置于恒温水浴锅中搅拌反应。反应结束后,进行真空过滤得到含铬沉淀和滤液。测定滤液中铬的含量,并计算铬的沉淀率(简称:沉铬率)。
滤液中铬离子含量采用硫酸亚铁铵氧化还原滴定法进行测定,铬的沉淀率按照下式进行计算:
(1)
式中,η为铬的沉淀率;C为溶液中铬的浓度,g/L;V为溶液的体积,L;C1为滤液中的铬的浓度,g/L;V1为滤液的体积,L。
2 结果与讨论
2.1 反应机理分析
铬酸铅是一种亮黄色单斜晶系晶体,不溶于水,其溶度积为2.8×10-13。因此,对于钒铬废液中富含的大量的六价铬,可以将其以铬酸铅的形式进行回收。钒铬废水中富含大量的硫酸根离子,为了在回收铬的同时不引入新的杂质,实验以硫酸铅作为沉淀剂来沉淀铬酸根离子。反应离子方程式如下所示:
2PbSO4+Cr2O72-+H2O→2PbCrO4+2SO42-+2H+
(2)
PbSO4+CrO42-→PbCrO4+SO42-
(3)
2.2 溶液pH值对沉铬率的影响
在Cr(VI)的水溶液中,存在着方程(3)所示的化学平衡。在酸性条件下,Cr(VI)主要以Cr2O72-的形式存在,而随着pH的增大,平衡逐渐向右移动,Cr(VI)主要以CrO42-的形式存在。
Cr2O72-+H2O→2CrO42-+2H+
(4)
实验研究了溶液初始pH对硫酸铅沉铬率的影响。实验反应温度为50℃,铬离子浓度为10 g/L,反应时间为60 min,溶液体积 40 mL,n(PbSO4)∶n(Cr)=1∶1。实验结果如图1所示。
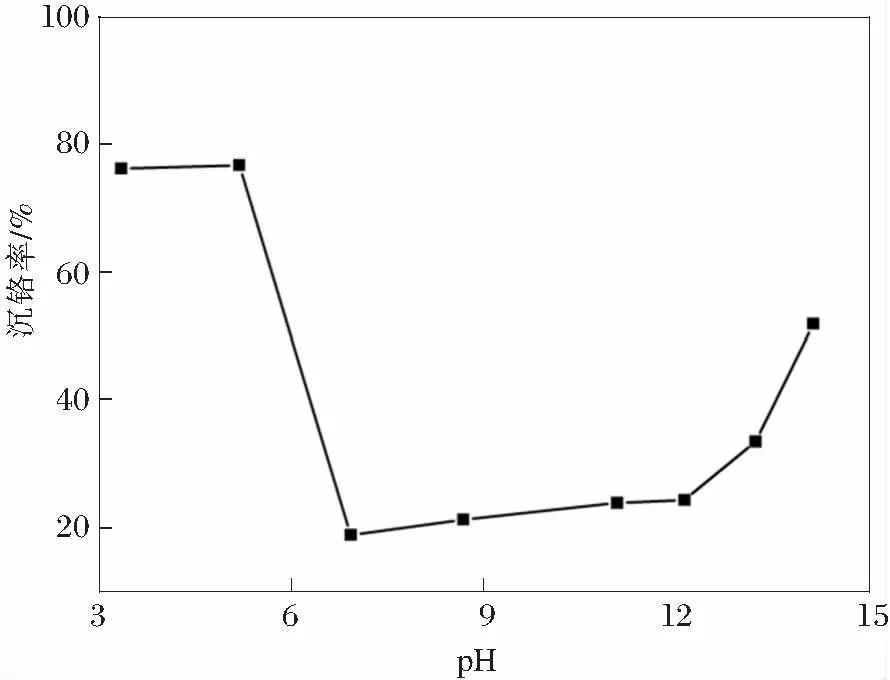
图1 溶液pH对沉铬率的影响
从图1中可以看到,沉铬率在酸性时高于碱性。当pH<6时,沉铬率为76.79%。当pH由5.18增大到6.92时,沉铬率由76.79%猛降至18.89%。随着pH的继续增大,沉铬率又缓慢增加,在pH=14.14时,沉铬率增加到51.90%。
另外,图1结果表明无论是酸性还是碱性,反应都未完全根据方程(2)或方程(3)进行,为了提高沉铬率,需要增加反应时硫酸铅的用量。
2.3 硫酸铅用量对沉铬率的影响
实验研究了硫酸铅用量对硫酸铅沉铬率的影响。实验反应温度为50℃,铬离子浓度为10 g/L,反应时间为60 min,溶液体积 40 mL,实验结果如图2所示。

图2 硫酸铅用量对沉铬率的影响
从图2中可以看到在酸性条件下,增大硫酸铅的用量对沉铬率影响不大,当n(PbSO4)/n(Cr)=1∶1增大到n(PbSO4)/n(Cr)=5∶1时,沉铬率只能提高7%~8%。
而在碱性条件下,随着硫酸铅用量的增加,沉铬率都有显著增加,特别是在pH=14.14,n(PbSO4)/n(Cr)=4∶1时,沉铬率达到99.89%,溶液中铬离子浓度由10 g/L降低到8 mg/L。且当n(PbSO4)/n(Cr)=5∶1时,沉铬率几乎达到100%(溶液中铬离子浓度太低,低于检测限)。因此选择n(PbSO4)/n(Cr)=5∶1作为硫酸铅沉铬的最佳比例。
2.4 反应温度对硫酸铅沉铬率的影响
温度是影响扩散过程的重要因素,反应时候,反应体系的扩散阻力越小,越有利于反应的进行。实验研究了反应温度对沉铬率的影响,实验结果如图3所示。反应时其他条件为:溶液初始pH=14.14,铬离子浓度为10 g/L,反应时间为60 min,溶液体积 40 mL,n(PbSO4)/n(Cr)= 5∶1。
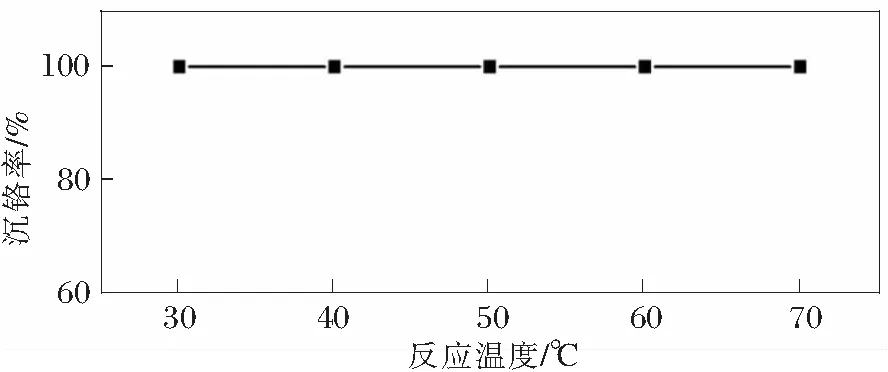
图3 反应温度对沉钒率的影响
从图3中可以看到,随着温度的增加,沉铬率几乎没变化,在温度为30℃时,沉铬率接近100%,说明反应温度在该反应过程中作用较小。在反应过程中,n(PbSO4)∶n(Cr)=5∶1,此时硫酸铅用量远远超过了实际反应所需化学计量比,弱化了其他因素对反应的影响。
2.5 反应时间对沉钒率的影响
反应时间是反应过程中的重要参数,工业上要求尽可能短的时间内产出尽可能多的产品,以产生更多的经济效益,图4揭示了反应时间对沉铬率的影响。实验时,溶液初始pH=14.14,铬离子浓度为10 g/L,溶液体积 40 mL,n(PbSO4)/n(Cr)=5∶1,反应温度30℃。
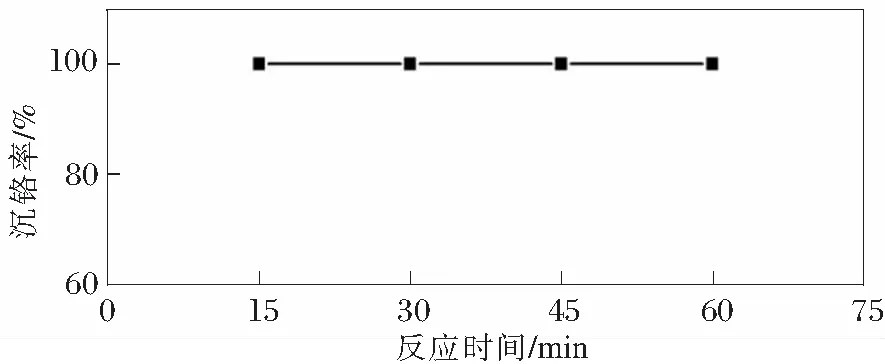
图4 反应时间对沉钒率的影响
从图4中可以看到,在反应时间为15 min时,沉铬率就几乎达到100%。随着反应时间的延长,由15 min延长至60 min时,沉铬率几乎没有增加,说明反应时间对反应的影响较小。
2.6 沉淀产物结构分析
从前文分析发现,在反应时,硫酸铅与Cr(VI)的反应并不是按照方程(2)或(3)进行的。为了弄清具体反应机理,采用XRD技术测试分析了沉淀产物的结构,结果如图5所示。
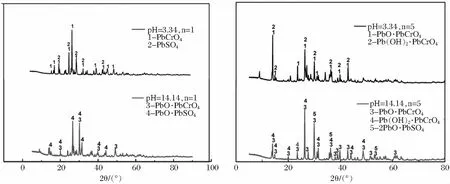
图5 沉淀XRD谱图
从图5中可以看到,在酸性条件(pH=3.34)和碱性条件(pH=14.14)下得到的沉淀皆为混合物。当n(PbSO4)/n(Cr)=1∶1时,沉淀中主要为PbCrO4,PbSO4以及少量PbO,增大硫酸铅用量,当n(PbSO4)/n(Cr)=5∶1时,沉淀中会出现新的物相Pb(OH)2。说明在整个反应过程中,部分硫酸铅与Cr(VI)反应生成PbCrO4,其余部分硫酸铅则与体系中其他成分发生反应或者与PbCrO4形成复合氧化物。反应生成的含铬沉淀可以作为原料制备含铬颜料。
将反应得到的滤液烘干后,采用XRF技术分析其元素组成。检测结果表明其中只含有O、S、K、Na(Na是调节溶液pH引入的),未检测到Pb元素,说明反应时加入的Pb全部进入到了沉淀中,不会残留在滤液中造成二次污染。且沉铬后的滤液为中性溶液,也方便处理。
3 结 论
1)硫酸铅可作为沉淀剂用于处理含Cr(VI)废水,且不会造成二次污染。且该沉淀可作为原料制备作含铬颜料。
2)溶液pH和硫酸铅用量对沉铬率影响较大,反应时间和反应温度影响较小。
3)在pH=14.14时,n(PbSO4)/n(Cr)=4∶1时,沉铬率达到99.89%,溶液中铬离子浓度由10 g/L降低到8 mg/L。且当n(PbSO4)/n(Cr)=5∶1时,沉铬率接近100%(溶液中铬离子浓度低于检测限)。

