10种热带富油微藻生物量、总脂含量及脂肪酸组成分析
王盛林,赵震宇,刘平怀
(海南大学 材料与化工学院,热带作物种质资源保护与开发利用教育部重点实验室,海口 570228)
10种热带富油微藻生物量、总脂含量及脂肪酸组成分析
王盛林,赵震宇,刘平怀
(海南大学 材料与化工学院,热带作物种质资源保护与开发利用教育部重点实验室,海口 570228)
微藻生物柴油是当前生物能源中最具发展潜力的一种新型能源,为更好地开发微藻生物柴油,筛选出适合制备生物柴油的富油微藻,以10种热带富油微藻为研究对象,对其生物量、总脂含量及脂肪酸组成进行分析。通过甲醇-氯仿(体积比为2∶1)称量法测定10种热带富油微藻中的总脂含量,将从微藻提取的油脂经过甲酯化反应后,采用气相色谱-质谱联用(GC-MS)分析油脂中脂肪酸组成及含量。结果表明,10种热带富油微藻中ChlorellavulgarisCJ15和Desmodesmussp. WC08更适合制备生物柴油。
富油微藻;生物柴油;生物量;总脂含量;脂肪酸组成
随着人们生活水平的提高,对能源的需求日益增加,发展可再生资源备受关注[1]。生物柴油的基本成分为脂肪酸甲酯,主要通过甘油三酯或游离脂肪酸与低等醇类反应而得,是一种生物质液体燃料,近年来已成为生物质能源研究中的热点[2-4]。早期大多以植物来源的油脂为原料生产生物柴油,其规模受到原料和成本的制约[5-6]。与其他产油作物相比,微藻具有繁殖速度快、生长周期短、不占用耕地且含油率高的特点,利用富油微藻作为生物柴油的原料可望显著提高生物柴油的产业规模,具有广阔前景[7]。
热带富油微藻是一种单细胞光合自养植物,在自然界分布广泛且种类和数量庞大,适应性强,易于大规模培养且生长非常迅速[8],油脂富含C16∶0、C18∶1、C18∶2和C18∶3[2]等脂肪酸,被认为是制备液体燃料的良好原料。
本研究对10种热带富油微藻进行管式培养,测定其生物量[9]。通过甲醇-氯仿(体积比2∶1)称量法对10种微藻中的总脂含量进行测定,将从微藻提取的油脂经过甲酯化反应后,采用气相色谱-质谱联用(GC-MS)分析藻油中脂肪酸组成及含量。筛选出适合制备生物柴油的富油微藻,为进一步大规模培养和应用奠定理论基础。
1 材料与方法
1.1 实验材料
1.1.1 藻种
9种分离自海南热带自然水体的藻种:MicractiniumreisseriC67 (C67),ScenedesmusecornisG2 (G2),Coelostrumreticulata11B7 (11B7),ChlorellavulgarisCJ15 (CJ15),ChlorellasorokinianaXS04 (XS04),Chlorellasp.1A10 (1A10),Desmodesmussp.WC08 (WC08),Ankistrodesmussp.CJ02 (CJ02),MonoraphidiumdybowskiiC29(C29);1种来自清华大学馈赠的藻种:ChlorellaprotothecoidesTH (TH)。其中海水藻包括:ChlorellavulgarisCJ15,Desmodesmussp. WC08和ChlorellasorokinianaXS04,其余藻种均为淡水藻。
1.1.2 试剂与仪器
BG11培养基,自制;海盐、氯仿、NaCl、NaOH、浓硫酸,分析纯;甲醇、正己烷,色谱纯。所有试剂均购自国药集团。
管式光反应器,TU-1810紫外-可见分光光度计(北京普析有限责任公司),-40℃冰箱,TDL-5型离心机(常州中捷有限公司),X0-5200DTD型超声清洗仪(南京先欧有限公司),HP6890/5973MSD型气相色谱-质谱联用仪(美国惠普公司)。
1.2 实验方法
1.2.1 微藻培养
微藻培养采用Zhao等[10]的方法,并进行一定的修正。培养基采用BG11配方(见表1),在管式光反应器中加入去离子水,培养体积800 mL,所有培养基121℃灭菌30 min。将藻种按照10%接种量接种于管式光反应器中。培养条件:室温培养,光强8 000~10 000 lx,空气流量0.5 L/min,海水藻添加海盐量1.5 g/L。采用12 h光照12 h避光的方式培养,培养期间,每天取样,采用TU-1810紫外-可见分光光度计测定藻液的A680,作生长曲线图,通过拟合分析得出比生长速率,培养7 d后,将藻液8 000 r/min 离心2 min,收集藻泥,于-40℃冷冻,随后将冷冻的藻泥置于冷冻干燥机中冻干,收集藻粉。生物量按下式计算:
生物量=藻粉质量/培养液体积
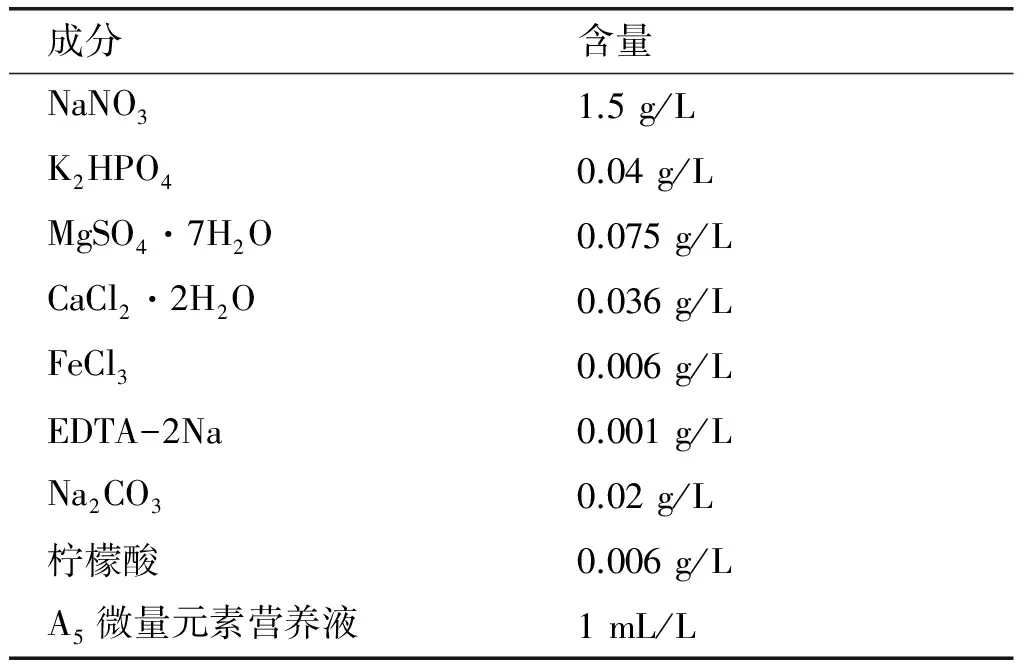
表1 BG11培养基成分及含量
注:A5微量元素营养液组成为2.86 g H3BO3,1.18 g MnCl2·4H2O,0.222 g ZnSO4·7H2O,0.39 g NaMoO4·2H2O,0.079 g CuSO4·5H2O,0.049 4 g CO(NO3)2·6H2O,溶于1 L 蒸馏水中。
1.2.2 总脂含量测定
称取藻粉约0.1 g(M),加入氯仿-甲醇(体积比为2∶1)混合液3 mL,超声提取15 min,然后离心分离,取上清液于洁净试管中,再在含有藻粉的试管中继续加入氯仿-甲醇(体积比为2∶1)混合液3 mL,重复之前的操作4~5次,最后合并上清液,并在含有上清液的试管中加入0.9%的NaCl溶液,静置1 d待溶液分层,取下层液体于已称质量(m1)的西林瓶中,置于通风橱中待氯仿挥干完全至恒重,称量西林瓶和藻油的总质量(m2),计算总脂含量(ω)。计算公式如下:
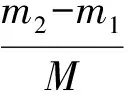
总脂产量=总脂含量×生物量
1.2.3 脂肪酸组成分析
取藻粉0.5 g,加入0.5 mol/L的NaOH-甲醇溶液5 mL,振荡混合10 min后加入1%硫酸-甲醇溶液8 mL,振荡混合10 min,再依次加入2 mL水和3 mL正己烷,离心收集上层溶液,重复萃取3~5次,合并上层溶液,待溶液挥发浓缩至1 mL左右用0.22 μm微孔滤膜过滤,置于气相色谱样品管中,封口待测。
用气相色谱-质谱联用仪测定脂肪酸组成及其含量。色谱条件:氢火焰离子化检测器(FID);石英毛细管柱HP-FFAP(30 m×0.25 mm,0.25 μm);程序升温从160℃开始,以6℃/min升到250℃,保持5 min;载气为He;柱流量1.0 mL/min;进样口温度250℃;分流比50∶1。质谱条件:EI源;电离电压70 eV;离子源温度230℃;扫描范围10~500 u;进样量1.0 μL。检索质谱图库,对藻油中脂肪酸进行定性,定量分析采用对各组分峰面积积分,计算出脂肪酸各组分占脂肪酸总量的百分比。
2 结果与讨论
2.1 10种热带富油微藻生长曲线、比生长速率及生物量
10种热带富油微藻生长曲线见图1,比生长速率及生物量见表2。

图1 10种热带富油微藻生长曲线
生长曲线反映了10种富油微藻的生长状态和生长趋势。图1结果显示,在接种后的2~4 d生长速率达到最大,进入对数生长期,5 d后生长缓慢,进入缓慢生长期。Desmodesmussp. WC08的A680在7 d内一直高于其他富油微藻,有可能受其色素的影响比较大。
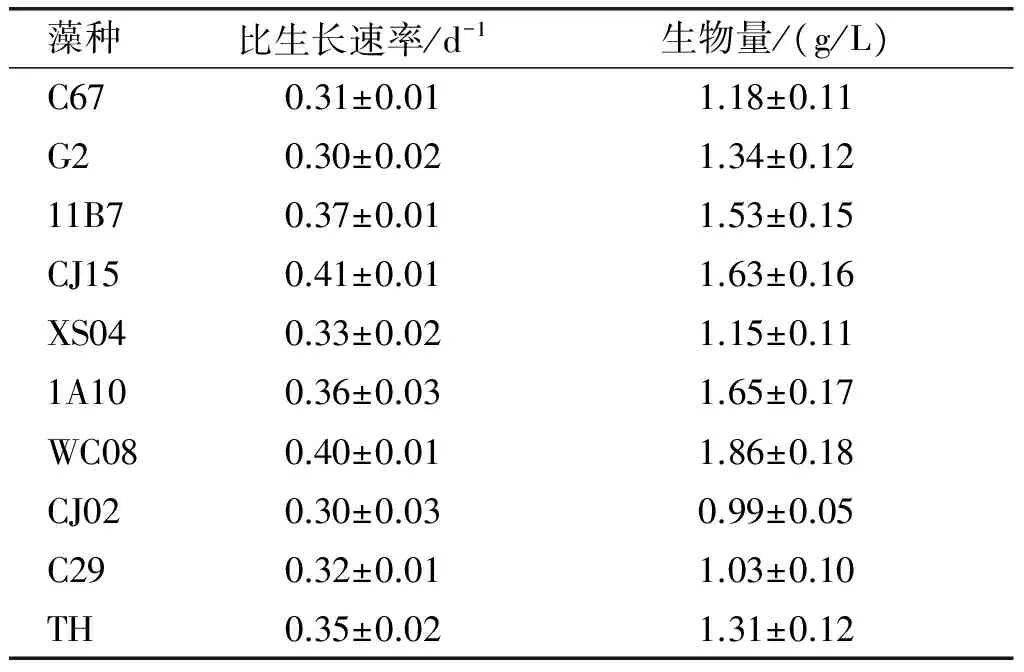
表2 10种热带富油微藻的比生长速率及生物量
由表2可以看出,10种富油微藻中除Ankistrodesmussp.CJ02外,其他富油微藻的生物量均在1.0~2.0 g/L之间,都适合高密度培养,而Desmodesmussp. WC08的生物量达(1.86±0.18)g/L,在10种富油微藻中更适合高密度培养。ChlorellaprotothecoidesTH在培养过程中有少量的贴壁现象,导致7 d 的A680有小幅度的降低。ChlorellavulgarisCJ15和Desmodesmussp. WC08的比生长速率分为(0.41±0.01)d-1和(0.40±0.01)d-1,两者比生长速率相差0.01 d-1,其他富油微藻的比生长速率均在0.3~0.4 d-1之间。与其他富油微藻相比,ChlorellavulgarisCJ15和Desmodesmussp. WC08的生长和繁殖能力比较强。
2.2 10种热带富油微藻的总脂含量及总脂产量
图2是10种热带富油微藻的总脂含量和总脂产量。
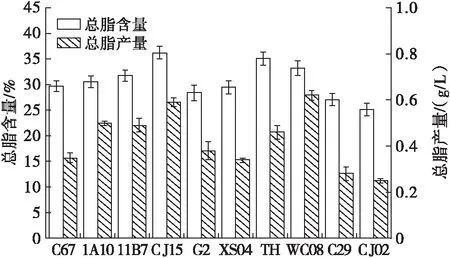
图2 10种热带富油微藻总脂含量及总脂产量
图2结果显示,ChlorellavulgarisCJ15和ChlorellaprotothecoidesTH两种微藻的总脂含量超过了35%,分别为(36.21±1.23)%和(35.18±1.31)%,Chlorellasp.1A10,Coelostrumreticulata11B7和Desmodesmussp. WC08的总脂含量在30%~35%之间,分别为(30.56±1.11)%,(31.77±1.22)%和(33.27±1.37)%,MicractiniumreisseriC67,ScenedesmusecornisG2,ChlorellasorokinianaXS04,MonoraphidiumdybowskiiC29和Ankistrodesmussp.CJ02的总脂含量在25%~30%之间。ChlorellavulgarisCJ15和Ankistrodesmussp.CJ02的总脂含量相差11.07个百分点,差距显著。ChlorellavulgarisCJ15和Desmodesmussp. WC08的总脂产量相对较高且水平相当,分别为(0.59±0.02)g/L和(0.62±0.02)g/L,Chlorellasp.1A10,Coelostrumreticulata11B7和ChlorellaprotothecoidesTH的总脂产量基本在同一水平,分别为(0.50±0.01)g/L、(0.49±0.03)g/L和(0.46±0.03)g/L,MicractiniumreisseriC67,ScenedesmusecornisG2和ChlorellasorokinianaXS04的总脂产量相差不大,分别为(0.35±0.02)g/L、(0.38±0.04)g/L和(0.34±0.01)g/L,Ankistrodesmussp. CJ02和MonoraphidiumdybowskiiC29的总脂产量在10种富油微藻中相对较低,分别为(0.25±0.01)g/L 和(0.28±0.03)g/L。从图2中还可以看出,ChlorellaprotothecoidesTH的总脂含量相对较高,但是总脂产量却不高,反而Desmodesmussp. WC08的总脂含量在10种富油微藻中不是最高,但是总脂产量相对较高,ChlorellavulgarisCJ15的总脂含量相对较高并且总脂产量与Desmodesmussp. WC08仅相差0.03 g/L,说明ChlorellavulgarisCJ15和Desmodesmussp. WC08均适合微藻油脂生产研究。
2.3 10种热带富油微藻的脂肪酸组成及含量
脂肪酸的组成是评价微藻油脂或生产微藻生物柴油时需要考虑的一个重要指标[11-12]。表3是10种热带富油微藻的脂肪酸组成及含量。
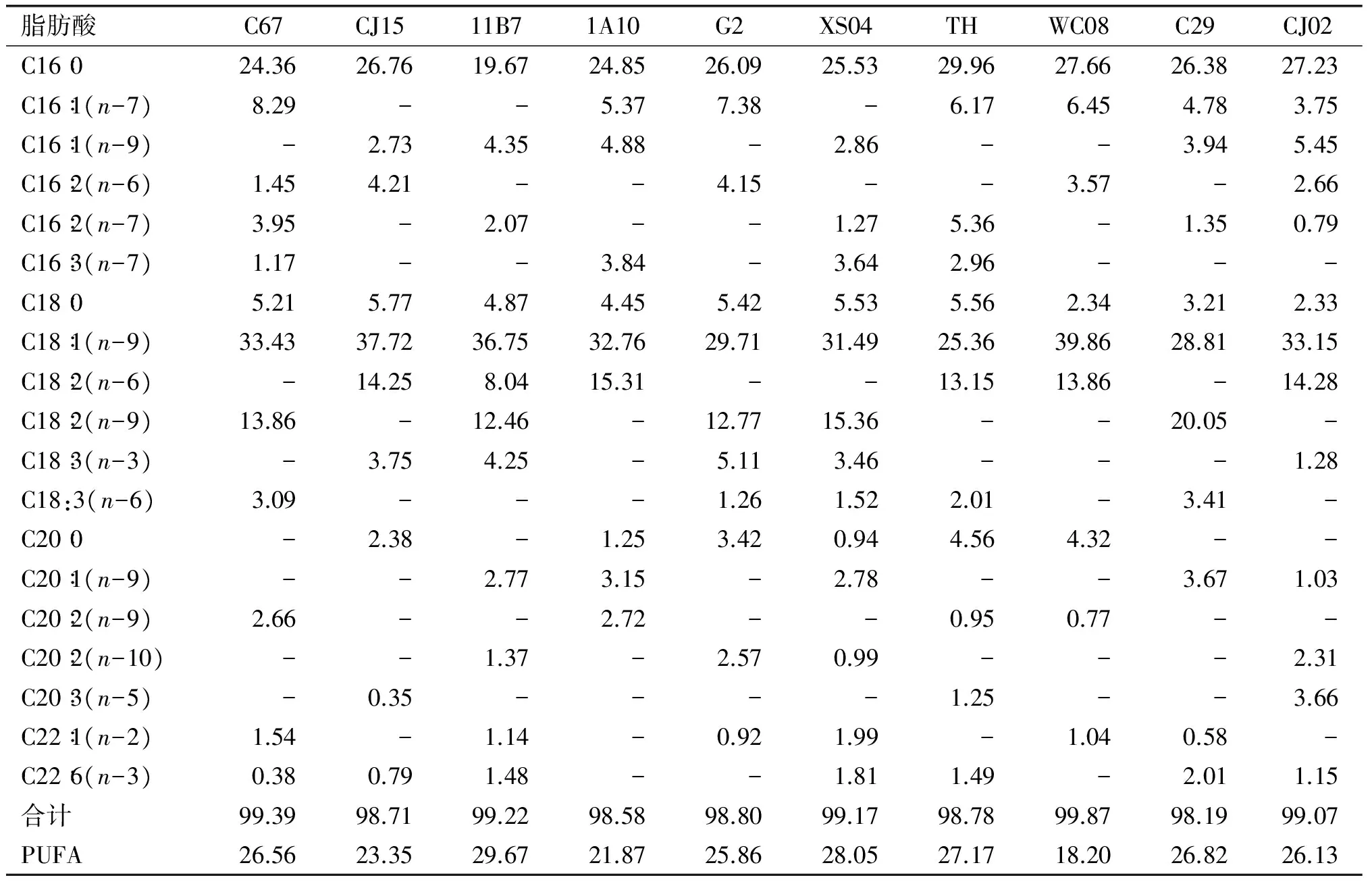
表3 10种热带富油微藻脂肪酸组成及含量 %
注:-表示未检出或含量很少。
由表3可以看出,每种热带富油微藻的脂肪酸组成都各有特点,所选的10种热带富油微藻中C16∶0、C18∶1(n-9)均高于其他脂肪酸含量,其中Desmodesmussp. WC08的C16∶0含量27.66%和C18∶1(n-9)含量39.86%。MicractiniumreisseriC67,Coelostrumreticulata11B7,ScenedesmusecornisG2,ChlorellasorokinianaXS04和MonoraphidiumdybowskiiC29这5种富油微藻含有较高的C18∶2(n-9),分别为13.86%、12.46%、12.77%、15.36%和20.05%。ChlorellavulgarisCJ15,Chlorellasp. 1A10,ChlorellaprotothecoidesTH,Desmodesmussp. WC08和Ankistrodesmussp.CJ02含有较高的C18∶2(n-6),达到14.25%、15.31%、13.15%、13.86%和14.28%。10种热带富油微藻中除Desmodesmussp. WC08外PUFA含量均在20%~30%之间,Desmodesmussp. WC08的PUFA含量为18.20%。一般单不饱和脂肪酸甲酯,特别是C18∶1比其他多不饱和脂肪酸甲酯更适合生物柴油的生产,因为含有较多C18∶1的生物柴油能更好的平衡燃料的点火性、燃烧热、冷滤点、抗氧化性、黏度和润滑性等特性[13-14]。所以,脂肪酸中具有较高的C18∶1含量对生产生物柴油更为有利。由表3还可以看出,ChlorellavulgarisCJ15,Coelostrumreticulata11B7和Desmodesmussp. WC08的C18∶1(n-9)含量为37.72%、36.75%、39.86%,明显高于其他富油微藻,含量超过35%,说明这3种藻均适合生产生物柴油。
3 结 论
研究通过对10种热带富油微藻进行管式培养,检测其生物量,根据生长曲线得出Desmodesmussp. WC08在10种富油微藻中更适合高密度培养且ChlorellavulgarisCJ15和Desmodesmussp. WC08的生长和繁殖能力强。利用甲醇-氯仿(体积比为2∶1)称量法测定总脂含量,并采用GC-MS分析所得藻油的脂肪酸组成及含量,确定了ChorellavulgarisCJ15和Desmodesmussp. WC08均适合微藻油脂生产研究,由脂肪酸分析得出ChlorellavulgarisCJ15,Coelostrumreticulata11B7和Desmodesmussp. WC08均有生产生物柴油的潜力,初步分析得出ChlorellavulgarisCJ15和Desmodesmussp. WC08更适合扩大培养和制备生物柴油,对于二者的产油代谢途径以及优化都有待进一步研究,以期为微藻产业化提供理论依据。
[1] SINGH J, GU S. Commercialization potential of microalgae for biofuels production[J]. Renew Sust Energ Rev, 2010, 14(9):2596-2610.
[2] HU Q A, SOMMERFELD M, JARVIS E, et al. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances[J]. Plant J, 2008, 54(4):621-639.
[3] 王一平, 翟怡, 张金利, 等. 生物柴油制备方法研究进展[J]. 化工进展, 2003, 22(1):8-12.
[4] 陈盈, 林金清. 酯交换反应制备生物柴油催化剂的研究进展[J]. 化学工程与装备, 2010(8):156-158.
[5] 郭卫军, 闵恩泽. 发展我国生物柴油的初探[J]. 石油学报(石油加工), 2003, 19(2):1-6.
[6] 闵恩泽. 以植物油为原料发展我国生物柴油炼油厂的探讨[J]. 石油学报(石油加工), 2005, 21(3):25-28.
[7] 郑洪立,张齐,马小琛,等.产生物柴油微藻培养研究进展[J].中国生物工程杂志,2009,29(3):110-116.
[8] 张宇, 王志成, 张玥,等. 微藻研究进展及产油的影响因素[J]. 黑龙江科学, 2013, 4(9):49-51.
[9] 刘娟妮, 胡萍, 姚领,等. 微藻培养中光生物反应器的研究进展[J]. 食品科学, 2006, 27(12):772-777.
[10] ZHAO Z Y, MA S S, LI A, et al. Effects of trophic modes, carbon sources, and salinity on the cell growth and lipid accumulation of tropic ocean oilgae strainDesmodesmussp. WC08[J]. Appl Biochem Biotechnol, 2016, 180(3):452-463.
[11] 罗文, 袁振宏, 廖翠萍,等. 生物柴油标准及质量评价[J]. 可再生能源, 2006(4):33-37.
[12] 王利兵, 于海燕, 贺晓辉,等. 生物柴油树种油脂脂肪酸组成对燃料特性的影响[J]. 燃料化学学报, 2012, 40(4):397-404.
[13] DANILOVIC′ B R, AVRAMOVIC′ J M, C′IRIC′ J T, et al. Production of biodiesel from microalgae[J]. Hem Ind, 2014, 68(2):213-232.
[14] ABOU-SHANAB R A I, HWANG J H, CHO Y, et al. Characterization of microalgal species isolated from fresh water bodies as a potential source for biodiesel production[J]. Appl Energ, 2011, 88(10):3300-3306.
Biomass,totallipidcontentandfattyacidcompositionoftentropicaloil-richmicroalgae
WANG Shenglin, ZHAO Zhenyu,LIU Pinghuai
(Key Laboratory of Protection and Development Utilization of Tropical Crop Germplasm Resources, Ministry of Education, Department of Materials and Chemical Engineering, Hainan University, Haikou 570228, China)
Currently, biodiesel has become one of the emerging energy which has the vast development potential. In order to develop the microalgae biodiesel and screen the potential biodiesel materials, biomass, total lipid content and fatty acid composition of ten tropical oil-rich microalgae were analyzed. The total lipid content was determined through methanol-chloroform (volume ratio 2∶1) gravimetric method. Gas chromatography-mass spectrometry (GC-MS) was used to analyze the fatty acid composition and content after methyl esterification reaction. The results showed thatChlorellavulgarisCJ15 andDesmodesmussp. WC08 were more suitable for biodiesel production among ten tropical oil-rich microalgae.
oil-rich microalgae; biodiesel; biomass; total lipid content; fatty acid composition
2016-11-11;
:2017-03-04
国家科技型中小企业技术创新基金项目(13C26244604892);海南省产学研一体化项目(CXY20150034);海南省中药现代化科技专项(ZY201327);国家科技支撑计划项目(2011BAD14B01)
王盛林(1993),男,硕士研究生,研究方向为微藻及其代谢产物开发(E-mail)1454379982@qq.com。
刘平怀,教授(E-mail)pinghuailiu@aliyun.com。
Q949;TQ642
:A
1003-7969(2017)08-0093-05
生物工程

