氯沙坦对慢性心力衰竭患者外周血内皮祖细胞的影响研究
陈菊明,左 琦,宋艳玲,麦华德,纪新博,王雅纯,林芸芸,顾申红
·论著·
氯沙坦对慢性心力衰竭患者外周血内皮祖细胞的影响研究
陈菊明1,左 琦2,宋艳玲1,麦华德1,纪新博1,王雅纯1,林芸芸1,顾申红1
目的探讨氯沙坦对慢性心力衰竭患者外周血内皮祖细胞(EPCs)的影响。方法选取2015年3月—2016年3月海南医学院第一附属医院心内科收治的慢性心力衰竭患者30例,采集患者外周血10 ml,体外培养EPCs。将体外培养的EPCs随机分为A组,B组和C组,每组10份。A组不做任何处理,B组采用氯沙坦10 μmol/L进行处理,C组采用氯沙坦10 μmol/L+磷脂酰肌醇3-激酶(PI3K)抑制剂10 μmol/L进行处理。比较3组EPCs培养12 h、24 h、36 h、48 h、72 h 535nm波长下光密度值(OD535),穿膜细胞数,苏氨酸蛋白激酶(Akt)及内皮型一氧化氮合酶(eNOS)蛋白表达量。结果时间与方法在OD535上存在交互作用(P<0.05);时间在OD535上主效应显著(P<0.05);方法在OD535上主效应显著(P<0.05);B组EPCs 12 h、24 h、36 h、48 h、72 h OD535高于A组、C组(P<0.05)。B组EPCs穿膜细胞数多于A组、C组(P<0.05)。B组EPCs的Akt和eNOS蛋白表达量高于A、C组(P<0.05)。结论氯沙坦可有效促进慢性心力衰竭患者外周血EPCs增殖和迁移,改善内皮细胞功能,其可能通过调节PI3K/Akt/eNOS信号通路而发挥作用。
心力衰竭;氯沙坦;内皮祖细胞
内皮祖细胞(EPCs)可参与血管生成,在缺血性疾病、血管创伤后愈合、预防血管狭窄中具有较好的应用前景[1]。研究表明,EPCs是反映慢性心力衰竭的生物标志物,因此提高EPCs的释放可有效改善慢性心力衰竭患者心功能[2]。研究表明,血管紧张素Ⅱ受体拮抗剂(ARBs)具有调节EPCs的作用[3]。氯沙坦是ARBs类药物,可减轻左心室肥厚,抑制心肌细胞增生,延迟或逆转心肌重构,改善左心室功能,同时可增加慢性心力衰竭患者外周血EPCs,改善血管内皮细胞功能。近年来,临床有关EPCs与慢性心力衰竭的关系研究报道逐渐增多[4-5]。本研究旨在探讨氯沙坦对慢性心力衰竭患者外周血EPCs的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2015年3月—2016年3月海南医学院第一附属医院心内科收治的慢性心力衰竭患者30例,均符合第8版《内科学》中的慢性心力衰竭诊断标准。排除标准:(1)合并肝、肾功能不全者;(2)存在恶性肿瘤者;(3)妊娠期或哺乳期妇女。本研究经医院医学伦理委员会审核批准,患者及其家属均签署知情同意书。
1.2 药物与实验试剂 氯沙坦(商品名:科素亚;生产厂家:杭州默沙东制药有限公司;批准文号:20161105;规格:50 mg/片);PI3K抑制剂(商品名:NVP-BEZ235;生产厂家:美国Selleck公司;批准文号:20160324)。M-199培养基、胎牛血清、胰蛋白酶、青霉素和链霉素双抗购自美国Gibco公司;兔抗人一抗(抗苏氨酸蛋白激酶、抗内皮型一氧化氮合酶)、辣根过氧化物酶标记的羊抗兔二抗、增强化学发光法(ECL)显色试剂盒购自美国Santa Cruz公司;噻唑蓝购自美国Sigma公司。
1.3 方法
1.3.1 EPCs培养 采集30例患者外周血10 ml,采用Ficoll密度梯度离心法收集外周血单个核细胞;将单个核细胞接种于人纤维连结蛋白包被的6孔培养板中,每孔加入M-199培养液(10%胎牛血清+100 U/ml链霉素+100 U/ml青霉素)1 ml;置于37 ℃,5%CO2的培养箱中培养,隔天更换培养液。
1.3.2 分组 将体外培养的EPCs随机分为3组,空白组(A组,n=10):不经任何处理;氯沙坦组(B组,n=10):采用氯沙坦10 μmol/L处理;磷脂酰肌醇3-激酶(PI3K)抑制剂组(C组,n=10):采用氯沙坦10 μmol/L+PI3K抑制剂10 μmol/L处理。
1.4 观察指标 (1)EPCs增殖情况:将3组EPCs接种于人纤维连结蛋白包被的96孔培养板中,每孔加入M-199培养液(10%胎牛血清+100 U/ml链霉素+100 μg/ml青霉素)1 ml及血管内皮生长因子(VEGF)50 ng/ml;置于37 ℃,5% CO2培养箱中培养,3 d后更换培养液,后每隔2 d更换1次;待EPCs铺满80%以上后加入噻唑蓝10 μl,置于培养箱孵育4 h,吸弃培养液上清,加入二甲基亚砜(DMSO)100 μl,振摇10 min,采用美国Bio-Rad公司生产的iMark680型全自动酶标仪于535 nm波长下测定各孔培养12 h、24 h、36 h、48 h、72 h光密度值(OD)。(2)EPCs迁移情况:将3组EPCs细胞悬浮于培养液200 μl,后接种于Boyden chamber,下室加入培养液600 μl+VEGF 50 ng/ml+基质细胞趋化因子-1(SDF-1)100 ng/ml;培养24 h后取出滤膜,刮去上室未迁移细胞,用10%甲醇固定,Giemsa染色,随机选取6个显微视野(×200)计数迁移到底层的细胞数目。(3)EPCs苏氨酸蛋白激酶(Akt)和内皮型一氧化氮合酶(eNOS)蛋白表达量:采用RIPA裂解液裂解3组EPCs,离心提取细胞总蛋白,二喹啉甲酸(BCA)法测定蛋白浓度;等量总蛋白上样,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后转至硝酸纤维素膜上;用5%脱脂奶粉的TBS-T室温封闭1 h,加入Akt(1∶500),eNOS(1∶500)一抗4 ℃孵育过夜,加入辣根过氧化物酶标记的羊抗兔(1∶20 000)二抗孵育1 h,TBS-T漂洗3次,ECL显色,使用Bio-Rad扫描分析,并计算目的蛋白相对表达量〔蛋白相对表达量=OD目的蛋白/OD内参(β-actin)〕。上述检测均进行5次,检测结果取平均值。
2 结果
2.1EPCs增殖 时间与方法在OD535上存在交互作用(P<0.05);时间在OD535上主效应显著(P<0.05);方法在OD535上主效应显著(P<0.05);B组EPCs12h、24h、36h、48h、72hOD535高于A组、C组,差异有统计学意义(P<0.05,见表1、图1)。
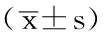
Table1ComparisonofOD535ofEPCsamongthethreegroupsatdifferenttimepoints

组别份数12h24h36h48h72hA组100.22±0.02a0.47±0.04a0.91±0.03a1.15±0.04a1.28±0.03aB组100.50±0.060.84±0.041.53±0.061.84±0.052.02±0.06C组100.25±0.03a0.57±0.05a0.88±0.06a1.26±0.05a1.37±0.05aF值F时间=69.641,F组间=41.317,F交互=23.656P值P时间<0.001,P组间<0.001,P交互<0.001
注:与B组比较,aP<0.05
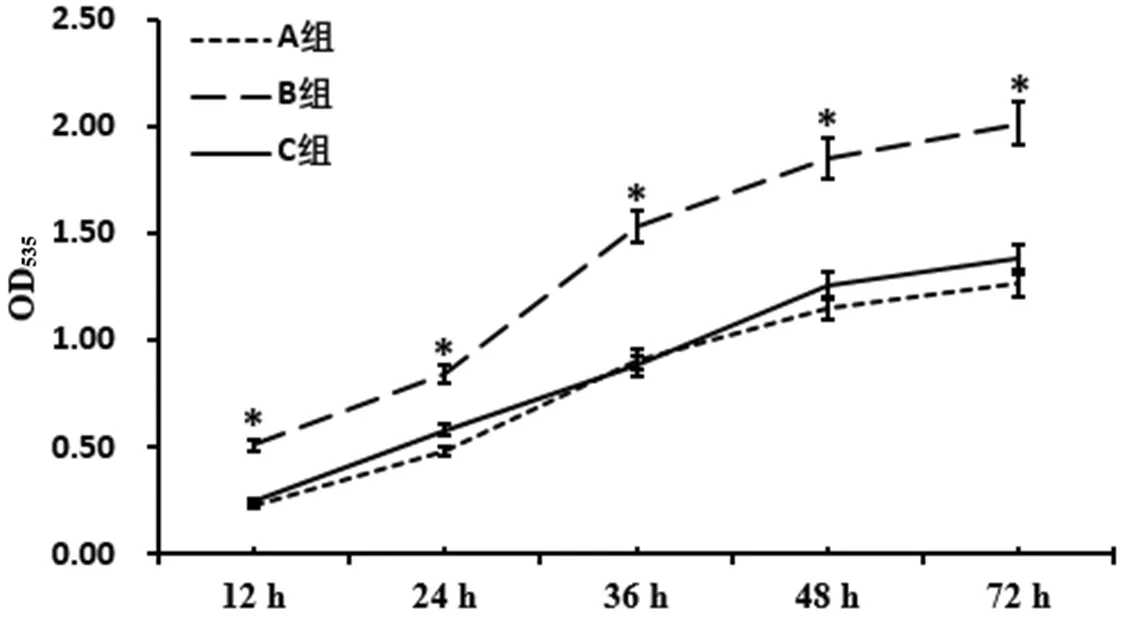
注:OD=光密度值
图1 3组EPCs不同时间点OD535
Figure1 OD535of EPCs of the three groups at different time points
2.2 EPCs迁移 A组EPCs穿膜细胞数为(15.5±1.7)个,B组EPCs穿膜细胞数为(33.8±2.9)个,C组EPCs穿膜细胞数为(17.5±2.0)个。3组EPCs穿膜细胞数比较,差异有统计学意义(F=197.580,P<0.05);B组EPCs穿膜细胞数多于A组、C组,差异有统计学意义(t值分别为25.625、22.825,P<0.05,见图2)。
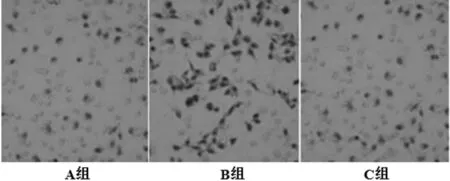
图2 3组EPCs穿膜情况(Giemsa染色,×200)
2.3 Akt和eNOS蛋白表达量 3组EPCs的Akt和eNOS蛋白表达量比较,差异有统计学意义(P<0.05);B组EPCs的Akt和eNOS蛋白表达量高于A、C组,差异有统计学意义(P<0.05,见表2、图3)。
Table2ComparisonofproteinexpressionsofAktandeNOSproteinamongthethreegroups
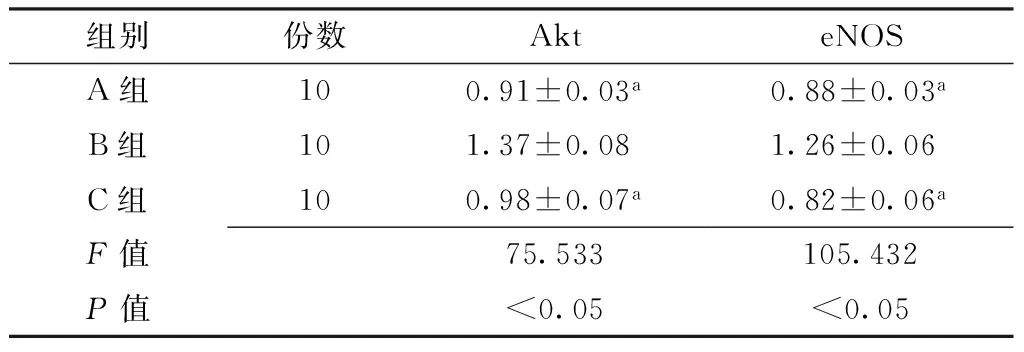
组别份数AkteNOSA组100.91±0.03a0.88±0.03aB组101.37±0.081.26±0.06C组100.98±0.07a0.82±0.06aF值75.533105.432P值<0.05<0.05
注:与B组比较,aP<0.05;Akt=苏氨酸蛋白激酶,eNOS=内皮型一氧化氮合酶

注:Akt=苏氨酸蛋白激酶,eNOS=内皮型一氧化氮合酶
图3 3组Akt和eNOS蛋白表达情况
Figure3 Protein expressions of Akt and eNOS of the three groups
3 讨论
EPCs是血管内皮细胞的前体细胞,可通过动员、迁移、归巢和分化4步骤而修复内皮细胞功能损伤,减少氧化应激或细胞凋亡。1997年ASAHARA等[6]证明外周血中存在能分化为血管内皮细胞的前体细胞,并将其命名为血管EPCs。新生血管中约25%内皮细胞由EPCs分化而来,且其可在损伤部位黏附、聚集、增殖、分化形成新的血管内皮细胞[7-9]。因此,EPCs具有修复内皮细胞功能,促进内皮细胞分化、血管再生,延缓动脉粥样硬化形成的作用[4]。另外,EPCs还能抑制氧化应激,促进一氧化氮(NO)生成,可在缺血或肾素-血管紧张素-醛固酮系统(RAAS)激活状态下增强内皮细胞功能,进而保护心肌细胞[10-11]。
慢性心力衰竭患者常伴有RAAS和内皮细胞功能损伤,临床常采用ARBs类药物治疗。研究表明,ARBs通过抑制RAAS而有效阻断血管紧张素Ⅱ受体活性,降低心血管疾病发生率、病死率和致残率[12]。MATSUURA等[13]研究表明,ARBs可有效阻断血管紧张素Ⅱ介导的氧化应激、炎性反应和胰岛素抵抗等对EPCs的影响。
YAO等[14]研究表明,氯沙坦可促进EPCs增殖、迁移。本研究结果显示,B组EPCs 12 h、24 h、36 h、48 h、72 h OD535高于A组、C组,EPCs穿膜细胞数多于A组、C组,提示氯沙坦可促进慢性心力衰竭患者外周血EPCs增殖和迁移。CHEN等[15]研究表明,激活PI3K/Akt/eNOS信号通路可提高小鼠外周血EPSs增殖、迁移和新生血管分化能力。本研究结果显示,B组EPCs的Akt和eNOS蛋白表达量高于A组、C组,提示氯沙坦可提高慢性心力衰竭患者外周血EPCs的Akt和eNOS蛋白表达量,其可能通过调节PI3K/Akt/eNOS信号通路而发挥作用。
综上所述,氯沙坦可促进慢性心力衰竭患者外周血EPCs的增殖和迁移,可改善内皮细胞功能,有一定的临床参考价值。但本研究仍处于EPCs研究的初级阶段,有待进一步深入研究,今后研究方向为EPCs在冠心病、脑出血、高血压等疾病治疗中的应用效果。
作者贡献:陈菊明进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;左琦、宋艳玲、麦华德、纪新博、王雅纯、林芸芸进行实验实施、评估、资料收集;顾申红进行质量控制及审校。
本文无利益冲突。
[1]曹政,杨勇,吴瑞霞,等.替米沙坦通过磷脂酰肌醇-3-激酶/丝苏氨酸蛋白激酶途径改善内皮祖细胞的功能活性[J].中国动脉硬化杂志,2012,20(12):1083-1087.
[2]赵子粼,许顶立,郭志刚,等.内皮祖细胞对心肌梗死后心力衰竭患者心功能及心肌能量消耗的影响[J].临床心血管病杂志,2011,27(7):526-530.DOI:10.3969/j.issn.1001-1439.2011.07.013.
[3]SUZUKI R,FUKUDA N,KATAKAWA M,et al.血管紧张素受体拮抗剂对原发性高血压患者受损的内皮祖细胞功能的作用[J].中华高血压杂志,2014,22(8):798.DOI:10.16439/j.cnki.1673-7245.2014.08.027.
[4]MOISEEVA O M,KARELKINA E V,MOROSHKIN V S,et al.The study of circulating endothelial precursor cells in patients with chronic heart failure[J].Kardiologiia,2011,51(12):36-42.
[5]LIU H,LIU X,WEI X,et al.Losartan,an angiotensin Ⅱ type 1 receptor blocker,ameliorates cerebral ischemia-reperfusion injury via PI3K/Akt-mediated eNOS phosphorylation[J].Brain Res Bull,2012,89(1/2):65-70.DOI:10.1016/j.brainresbull.2012.06.010.
[6]ASAHARA T,MUROHARA T,SULLIVAN A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275(5302):964-967.
[7]龚如.内皮祖细胞在缺血性脑血管疾病治疗中的研究进展[J].国际神经病学神经外科学杂志,2014,41(2):130-133.
[8]张清,王普之,何国厚,等.内皮祖细胞在缺血性脑血管病防治中的研究进展[J].疑难病杂志,2014,13(11):1207-1209.DOI:10.3969/j.issn.1671-6450.2014.11.037.
[9]漆秦,方汉军,李锋华,等.内皮祖细胞移植对盐敏感性高血压大鼠心肌重构的影响研究[J].实用心脑肺血管病杂志,2016,24(8):9-15.DOI:10.3969/j.issn.1008-5971.2016.08.003.
[10]承燕,胡若愚,江时森,等.心力衰竭患者循环内皮祖细胞水平的Meta分析[J].东南大学学报(医学版),2012,31(4):406-410.DOI:10.3969/j.issn.1671-6264.2012.04.005.
[11]DENBURG J A,VAN EEDEN S F.Bone marrow progenitors in inflammation and repair:new vistas in respiratory biology and pathophysiology[J].Eur Respir J,2006,27(3):441-445.DOI:10.1183/09031936.06.00000706.
[12]ENDTMANN C,EBRAHIMIAN T,CZECH T,et al.Angiotensin II impairs endothelial progenitor cell number and function in vitro and in vivo:implications for vascular regeneration[J].Hypertension,2011,58(3):394-403.DOI:10.1161/HYPERTENSIONAHA.110.169193.
[13]MATSUURA K,HAGIWARA N.The pleiotropic effects of ARB in vascular endothelial progenitor cells[J].Curr Vasc Pharmacol,2011,9(2):153-157.
[14]YAO E H,FUKUDA N,MATSUMOTO T,et al.Losartan improves the impaired function of endothelial progenitor cells in hypertension via an antioxidant effect[J].Hypertens Res,2007,30(11):1119-1128.DOI:10.1291/hypres.30.1119.
[15]CHEN J,CHEN J,CHEN S,et al.Transfusion of CXCR4-primed endothelial progenitor cells reduces cerebral ischemic damage and promotes repair in db/db diabetic mice[J].PLoS One,2012,7(11):e50105.DOI:10.1371/journal.pone.0050105.
(本文编辑:李洁晨)
ImpactofLosartanonPeripheralBloodEndothelialProgenitorCellsinPatientswithChronicHeartFailure
CHENJu-ming1,ZUOQi2,SONGYan-ling1,MAIHua-de1,JIXin-bo1,WANGYa-chun1,LINYun-yun1,GUShen-hong1
1.DepartmentofGerontology,theFirstAffiliatedHospitalofHainanMedicalCollege,Haikou570102,China2.DepartmentofCardiology,theFirstAffiliatedHospitalofHainanMedicalCollege,Haikou570102,China
Correspondingauthor:GUShen-hong,E-mail:1574063710@qq.com
ObjectiveTo investigate the impact of losartan on peripheral blood endothelial progenitor cells in patients with chronic heart failure.MethodsFrom March 2015 to March 2016,a total of 30 patients with chronic heart failure were selected in the Department of Cardiology,the First Affiliated Hospital of Hainan Medical College,10 ml peripheral blood was collected from each case and endothelial progenitor cells were cultured in vitro.Cultured endothelial progenitor cells were divided into A group,B group and C group,each of 10 samples.Endothelial progenitor cells of A group did not
any intervention,endothelial progenitor cells of B group received losartan(10 μmol/L),while endothelial progenitor cells of B group received losartan(10 μmol/L)combined with PI3K inhibitor(10 μmol/L).OD535of endothelial progenitor cells after 12 hours,24 hours,36 hours,48 hours and 72 hours of culture,number of transmembrane cells,protein expressions of Akt and eNOS were compared among the three groups.ResultsThere was interaction between time and method in OD535of endothelial progenitor cells(P<0.05);main effects of time and method were significant in OD535of endothelial progenitor cells(P<0.05);OD535of endothelial progenitor cells of B group was statistically significantly higher than that of A group and C group after 12 hours,24 hours,36 hours,48 hours and 72 hours of culture,respectively(P<0.05).Number of transmembrane cells of B group was statistically significantly more than that of A group and C group,respectively(P<0.05).Protein expressions of Akt and eNOS of B group were statistically significantly higher than those of A group and C group(P<0.05).ConclusionLosartan can effectively promote the proliferation and migration of peripheral blood endothelial progenitor cells in patients with chronic heart failure,is helpful to improve the endothelial cell function,losartan may play a role through adjusting PI3K/Akt/eNOS signal pathway.
Heart failure;Losartan;Endothelial progenitor cells
海南省自然科学基金项目(814355);国家自然科学基金资助项目(81560054)
顾申红,E-mail:1574063710@qq.com
R 541.6
A
10.3969/j.issn.1008-5971.2017.08.010
2017-04-03;
2017-07-26)
1.570102海南省海口市,海南医学院第一附属医院老年病科
2.570102海南省海口市,海南医学院第一附属医院心内科
陈菊明,左琦,宋艳玲,等.氯沙坦对慢性心力衰竭患者外周血内皮祖细胞的影响研究[J].实用心脑肺血管病杂志,2017,25(8):41-44.[www.syxnf.net]
CHEN J M,ZUO Q,SONG Y L,et al.Impact of losartan on peripheral blood endothelial progenitor cells in patients with chronic heart failure[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2017,25(8):41-44.

