云南省部分地区种公猪精液携带繁殖障碍性病毒调查研究
赵 谦,王 蕾,査星琴,杨贵树,尹革芬*
(1.云南农业大学动物科学技术学院,云南昆明 650201;2.楚雄州动物疫病预防控制中心,云南楚雄 675000)
云南省部分地区种公猪精液携带繁殖障碍性病毒调查研究
赵 谦1,王 蕾2,査星琴1,杨贵树1,尹革芬1*
(1.云南农业大学动物科学技术学院,云南昆明 650201;2.楚雄州动物疫病预防控制中心,云南楚雄 675000)
为了解云南省部分地区规模化猪场种公猪精液繁殖障碍病毒性病原的感染状况,应用PCR对2014年—2016年间云南省部分地区规模化猪场212份种公猪精液进行了猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪伪狂犬病病毒(PRV)、猪圆环病毒2型(PCV2)和猪细小病毒(PPV)5种与猪繁殖障碍有关的病原检测。结果表明,PPRSV阳性率为7.08%,CSFV阳性率为3.77%,PCV2阳性率为6.60%,PRV阳性率为3.30%,没有检测出PPV,PRRSV和PCV2的感染率呈上升趋势,其他疫病保持相对平稳态势。所有的混合感染样品中,均检测出了PRRSV,其中PRRSV和PCV2的混合感染最为常见。结果提示,控制猪场疫病发生的关键是控制PRRSV和PCV2的流行,有必要加强对种猪群的疫病病毒检测,推行种猪场主要疫病的控制与净化工作。
种公猪;精液;繁殖障碍,病原调查
近年来,随着农牧业飞速发展和生猪养殖业的不断扩大,优良种猪跨地区交易频繁,促进了生猪生产的良种化发展,使猪场的生产效率和经济效益得到了很大的提高[1]。然而,生猪频繁的交易、疫苗和各类抗生素及药物的滥用,使得生猪疫病的流行与发病日益严重化、复杂化。种猪引进的同时,也增加了传染性疾病传播的风险[2]。特别是一些病毒性疾病能够通过种公猪精液进行垂直传播[3],不仅能够引起母猪繁殖障碍,对猪场造成巨大的经济损失,而且严重制约了生猪养殖业的健康发展。种公猪在感染某些疫病后可在其精液中检测到相应病原(如寄生虫、细菌、病毒、支原体等),带毒公猪通过交配将病原传给母猪,感染后的妊娠母猪经胎盘屏障对胎儿造成垂直传播,产下带毒仔猪,从而感染健康猪群[4-5]。目前能够引起母猪繁殖障碍性病毒主要有猪繁殖与呼吸综合征病毒(Porcinereproductive and respiratory syndrome viruse,PRRSV)、猪瘟病毒(Classical swine fever virus,CSFV)、猪伪狂犬病病毒(Pseudorabies virus,PRV)、猪圆环病毒2型(Porcine circovirus type 2,PCV2)、猪细小病毒(Porcine parvovirus,PPV)[6]。
为了解云南省部分地区规模猪场种公猪精液携带相关病原的感染状况,本研究拟通过分子生物学方法,针对CSFV、PRRSV、PRV、PCV2、PPV 5种病毒进行分子生物学检测,建立一套能够安全、有效的检测公猪精液带毒的诊断技术,确定主要的公猪精液传播性病毒性疫病,为预防和控制猪场繁殖障碍性疫病的发生提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 样品来源 精液样品采集自2014年—2016年间云南部分地区种猪场,共计212份,其中2014年采集48份,2015年采集116份,2016年采集48份。将精液反复冻融3次后,4℃、10 000 r/min离心10 min,弃沉淀,上清保存于液氮中备用。
1.1.2 试剂 RNAiso Plus Total RNA (批号:D9108B),宝生物工程(大连)有限公司产品;Bioteke 细胞/组织基因组DNA提取试剂盒(批号:DP1901),百泰克生物技术有限公司产品;RI Enzyme Mix、2×ES Reaction Mix、2×TransTaqHiFiPCR Super Mix,北京全式金生物技术有限公司产品;异丙醇、750 mL/L乙醇、琼脂粉、TAE缓冲液、双蒸水、氯仿等,云南农业大学动物医学实验教学中心预防兽医学实验室提供。
1.2 方法
1.2.1 引物合成 参照相关序列使用Primer premier 5.0软件设计所用引物,并在BLAST上进行比对后送上海生工生物工程技术服务有限公司合成,引物储存浓度为100 μmol/L,引物工作浓度为0.2 μmol/L(表1)。
1.2.2 核酸提取
1.2.2.1 RNA提取 取200 μL样品上清,加1 000 μL RNAiso Plus,4℃静置5 min,加入1/5 RNAiso Plus体积量的氯仿,室温静置5 min,12 000 r/min离心15 min,将上清转移至新的离心管中,加入与上清等体积的异丙醇,室温静置10 min,12 000 r/min离心10 min,弃上清留沉淀,向沉淀中加入1 mL 750 mL/L乙醇清洗沉淀,12 000 r/min离心5 min,弃上清留沉淀,RNA干燥后溶解于适量DEPC处理水中,立即进行反转录。
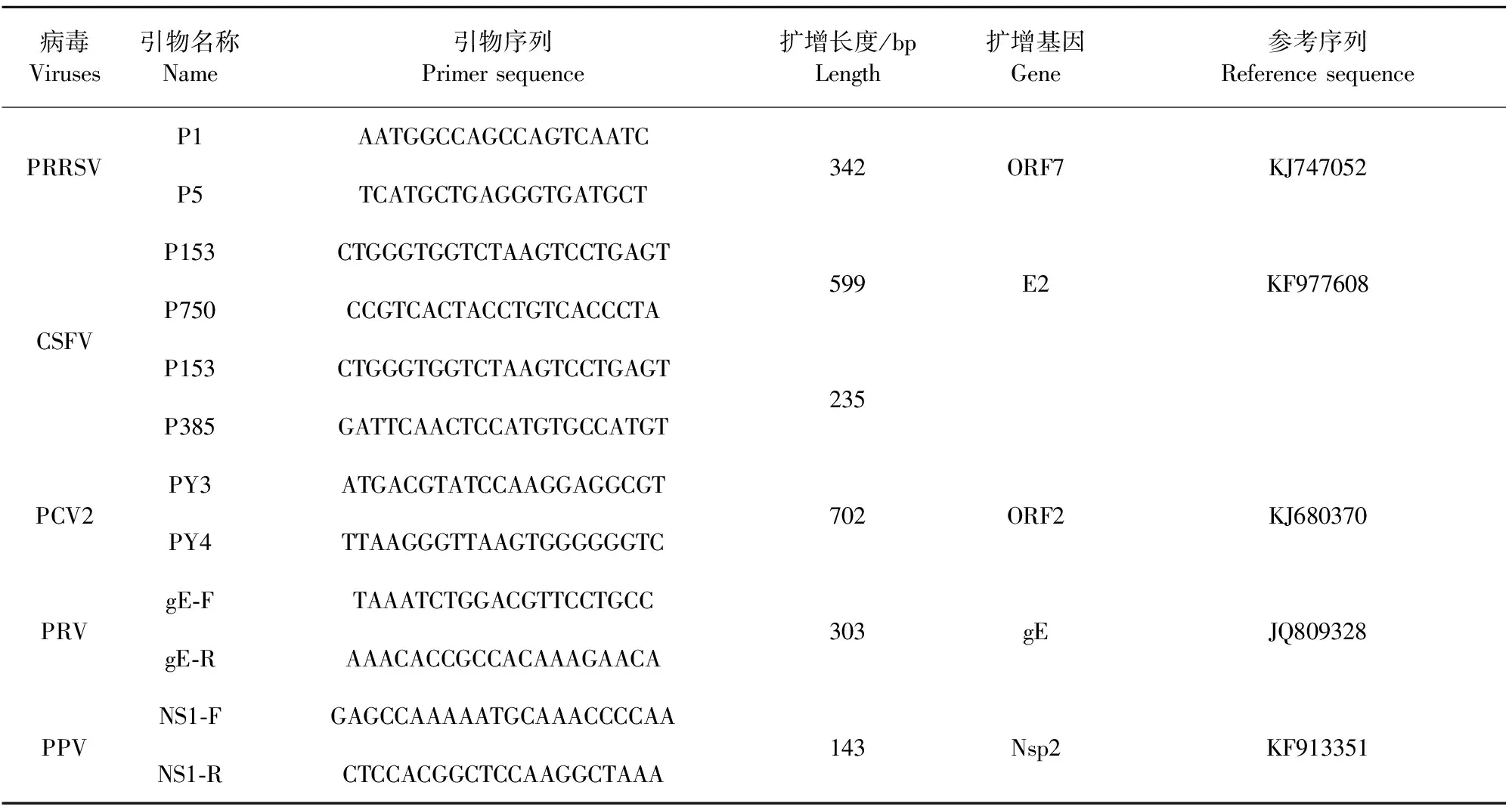
表1 引物序列
1.2.2.2 DNA提取 取200 μL样品上清,使用裂解液样品释放出基因组DNA,然后蛋白沉淀液沉淀去除蛋白,最后纯净的基因组DNA通过异丙醇沉淀并重溶解于DNA溶解液,DNA提取过程严格按照厂家说明书要求进行,提取的DNA保存于-20℃。
1.2.3 目的基因片段扩增
1.2.3.1 PRRSV和CSFV RT-PCR检测 将上述提取出来的样品RNA利用特异性引物对其进行RT-PCR扩增,反转录体系如下:2×ES Reaction Mix(含10×RT buffer,dNTPs) 5 μL,Easy ScriptTMⅡ RT/RI Emzyme Mix(含Rnase Inhibitor,反转录酶)0.5 μL,下游引物1 μL,模板RNA 3.5 μL,反应体系为10 μL。将配制好的体系置于42℃反应30 min,之后85℃反应5 min。反转录产物置于4℃保存备用。PCR扩增体系为:Mix(含10×PCR buffer,dNTPs,TransTaq酶) 12.5 μL,ddH2O 10.5 μL,上游引物和下游引物各0.5 μL,反转录产物(cDNA)1 μL,总反应体系为25 μL。PRRSV扩增反应条件为:94 ℃ 3 min ;94 ℃ 1 min, 65 ℃1 min, 72 ℃ 1 min,40 个循环;72 ℃ 5 min 。 CSFV第一轮扩增反应条件为:94℃ 5 min;94℃ 30 s,53℃ 45 s,72℃ 50 s,34个循环;72℃ 5 min。将所得到的第一轮产物稀释300倍后,进行第二轮扩增,反应条件为:94℃ 5 min;94℃ 40 s,56℃ 40 s,72℃ 40 s,34个循环;72℃ 5 min。取10 μL PCR扩增产物配制成体系后加样到15 g/L琼脂糖凝胶(含2 g/L EB)孔中,并在120 V电压下进行30 min的电泳,在凝胶成像系统上观察结果,并拍照。
1.2.3.2 PCV2、PRV和PPV 的PCR检测 将上述提取出来的样品DNA利用特异性引物对其进行PCR扩增,PCR扩增体系为:Mix(含10×PCR buffer,dNTPs,TransTaq酶) 12.5 μL,dH2O 10.5 μL,上、下游引物各0.5 μL,DNA 1 μL,总反应体系为25 μL。PCV2扩增反应条件为:94℃ 5 min;94℃ 30 s, 60℃40 s ,72℃ 40 s,35次循环;72℃ 7 min。 PRV扩增反应条件为:94℃ 5 min;94℃ 30 s,59℃ 35 s,72℃ 40 s,35个循环;72℃ 5 min。PPV扩增反应条件为:94℃ 5 min;94℃ 1 min,60℃ 1 min , 72℃ 1 min,30次循环;72 ℃ 7 min。取10 μL PCR扩增产物配制成体系后加样到15 g/L琼脂糖凝胶(含2 g/L EB)孔中,并在120 V电压下进行30 min的电泳,在凝胶成像系统上观察结果,并拍照。
2 结果
2.1 PRRSV的PCR检测结果
利用特异性引物及对应的PCR检测方法对采集到的212份精液进行PRRSV检测,并通过琼脂糖凝胶电泳对PCR产物进行鉴定。PRRSV的电泳结果同预期目的片段342 bp大小相符,表明部分精液样品中PRRSV检测呈阳性(图1)。在212份样品中,其中15份样品检测为PPRSV阳性,阳性率为7.08%(15/212)。
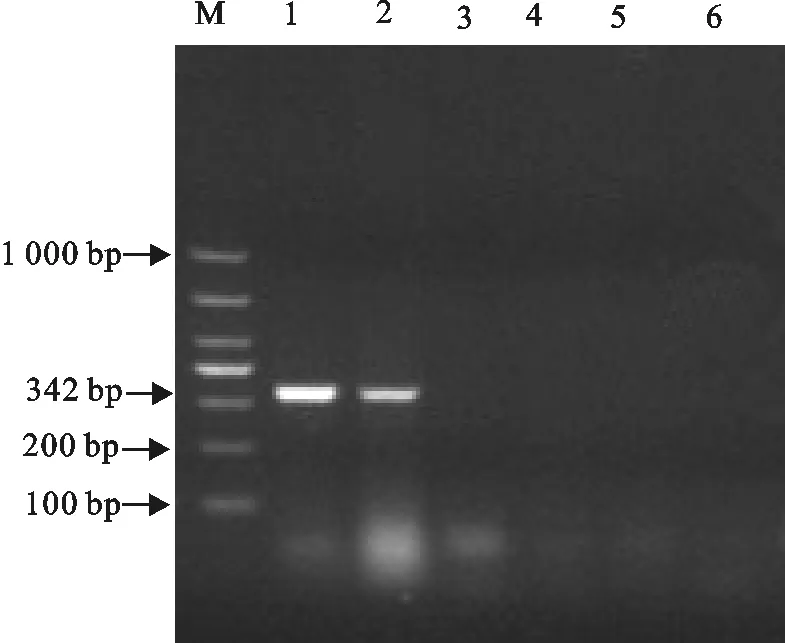
1~5.样品;6.阴性对照;M.DNA 标准DL 1 000
1-5.Samples;6.Negative control;M.DNA Marker DL 1 000
图1 PRRSV的PCR检测
Fig.1 PRRSV detection by PCR
2.2 CSFV的PCR检测结果
利用特异性引物及对应的PCR检测方法对采集到的212份精液进行CSFV检测,并通过琼脂糖凝胶电泳对PCR产物进行鉴定。CSFV的电泳结果同预期目的片段235 bp大小相符,结果表明部分精液样品中CSFV检测呈阳性(图2)。在212份样品中,其中8份样品检测为CFSV阳性,阳性率为3.77%(8/212)。
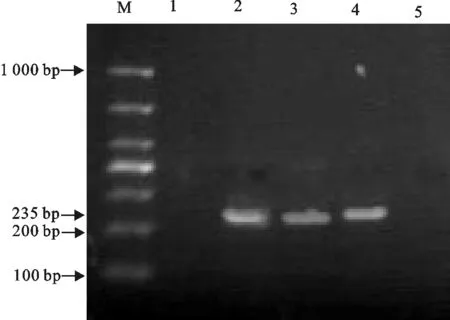
1.阴性对照;2~5.样品;M.DNA标准DL 1 000
1.Negative control;2-5.Samples;M.DNA Marker DL 1 000
图2 CSFV的PCR检测
Fig.2 CSFV detection by PCR
2.3 PCV2的PCR检测结果
利用特异性引物及对应的PCR检测方法对采集到的212份精液进行PCV2检测,并通过琼脂糖凝胶电泳对PCR产物进行鉴定。PCV2的电泳结果同预期目的片段702 bp大小相符,表明部分精液样品中PCV2检测呈阳性(图3)。在212份样品中,其中7份样品检测为PCV2阳性,阳性率为6.60%(14/212)。
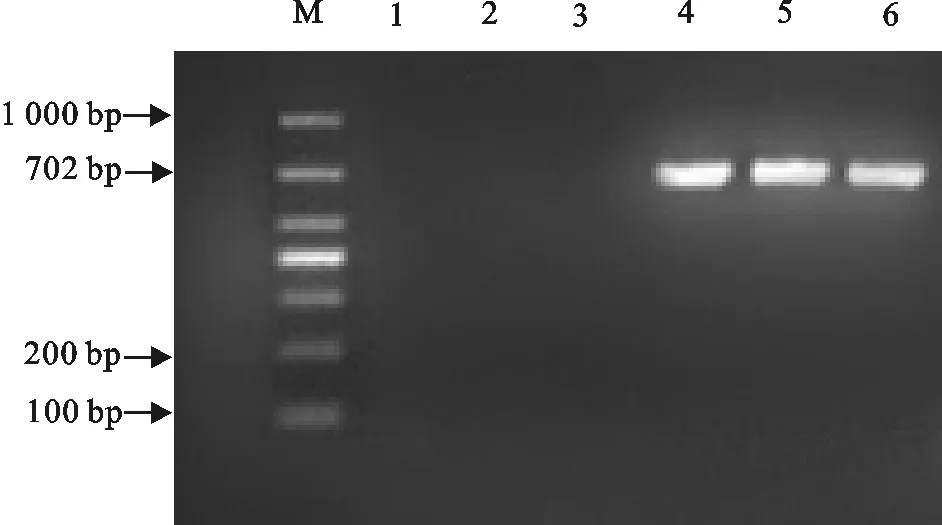
1.阴性对照;2~6.样品;M.DNA标准DL 1 000
1.Negative control;2-6.Samples;M.DNA Marker DL 1 000
图3 PCV2的PCR检测
Fig.3 PCV2 detection by PCR
2.4 PRV的PCR检测结果
利用特异性引物及对应的PCR检测方法对采集到的212份精液进行PRV检测,并通过琼脂糖凝胶电泳对PRV产物进行鉴定。PRV的电泳结果同预期目的片段303 bp大小相符,由此可以初步判定对应精液中PRV检测阳性(图4)。在212份样品中,其中7份样品检测为PRV阳性,阳性率为3.30%(7/212)。
2.5 PPV的PCR检测结果
利用特异性引物及对应的PCR检测方法对采集到的212份精液进行PPV和JEV检测,并通过琼脂糖凝胶电泳对PCR产物进行鉴定。结果显示,没有出现与预期目的条带相符的条带,表明精液样品中没有检测出PPV阳性,阳性率均为0。
2.6 不同年份送检样品病原阳性统计结果
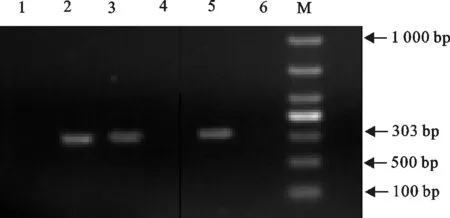
1.阴性对照;2~6.样品;M.DNA 标准DL 1 000
1.Negative control;2-6.Samples;M.DNA Marker DL 1 000
图4 PRV的PCR检测
Fig.4 PRV detection by PCR
共检测的精液样品212份中,2014年共检测样品48份,检出阳性6份,其中CSFV阳性4份,阳性率8.33%;PRV阳性1份,阳性率为2.08%;PCV2阳性1份,阳性率为2.08%,PRRSV和PPV均未检出。2015年共检测样品116份,检出阳性15份,其中PRRSV阳性7份,阳性率6.0%;CSFV阳性3份,阳性率2.6%;PRV阳性3份,阳性率2.6%;PCV2阳性2份,阳性率为1.7%;PPV未检出。2016年共检测样品48份,检出阳性23份,其中PRRSV阳性8份,阳性率16.7%;CSFV阳性1份,阳性率2.1%;PRV阳性3份,阳性率6.3%;PCV2阳性11份,阳性率为23.0%;PPV未检出(表2)。
2.7 阳性病例中混合感染病例统计结果
2014年—2016年间,共检出36份精液样品呈阳性,其中6份精液样品检出两种病毒、1份精液样品中检出3种病毒,混合感染率为19.44%;2014年共检测出阳性样品6份,未发现混合感染;2015年共检出阳性样品11份,其中PRRSV和CSFV混合感染样品共有1份,混合感染率为9.09%;PRRSV和PRV混合感染样品共有1份,混合感染率为9.09%;PRRSV和PCV2混合感染样品共有2份,混合感染率为18.20%。2016年共检出阳性样品19份,PRRSV和PCV2混合感染样品共有2份,混合感染率为10.53%;PRRSV、CSFV和PCV2混合感染样品共有1份,混合感染率为5.26%(表3)。
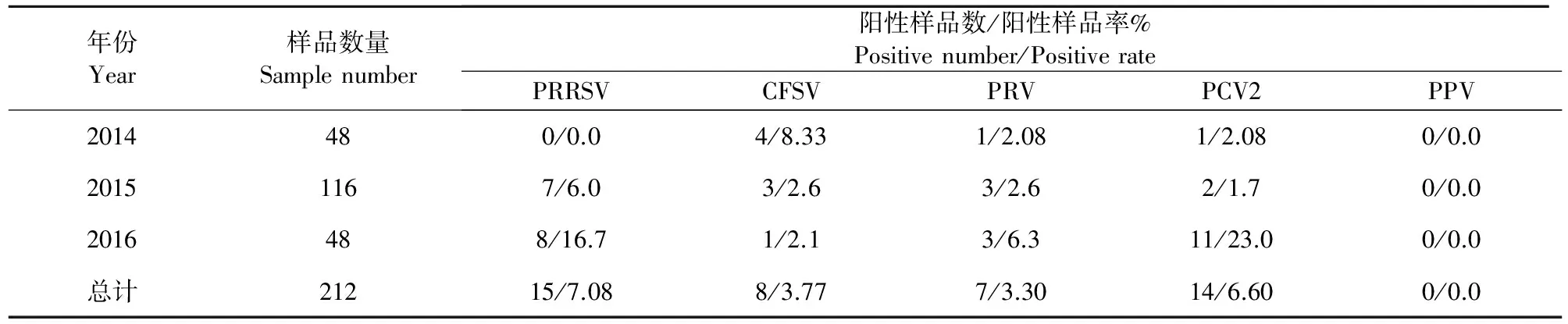
表2 2013年—2015年阳性病例统计表
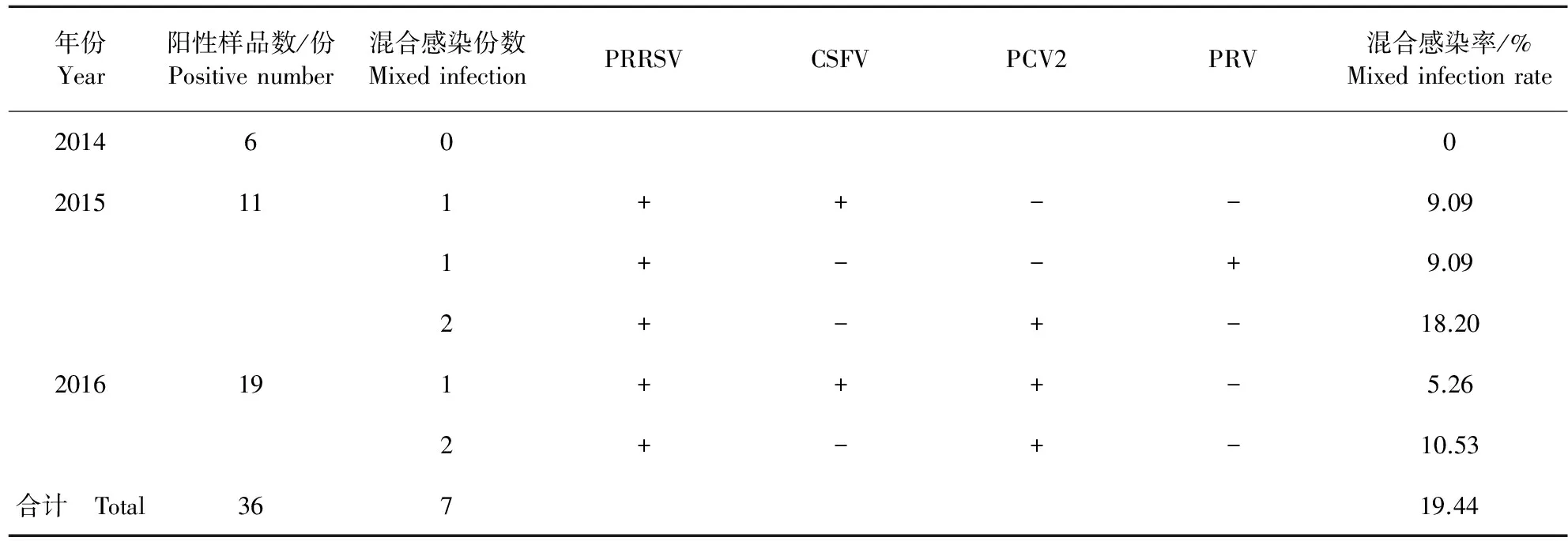
表3 阳性病例中混合感染病例
3 讨论
在实际生产应用中,通过引进优良种公猪或种公猪精液不仅是猪种改良的重要手段,而且也是提高猪场生产效率的重要方式[7]。然而,引进种公猪或者种公猪精液的过程中,也增加了动物疫病的传播。尤其是一些能够引起繁殖障碍的病毒性疾病,已经成为困扰养猪业健康发展的关键问题。目前很多研究已经开始关注种公猪精液携带病毒可能给规模化猪场带来的风险,针对精液携带病毒的情况进行了调查。其中张志等[8]针对山东种公猪精液的调查结果表明,公猪精液携带病原现象较为严重,35份精液样品的PRRSV检出率为29.6% ,CSFV的检出率为11.4%,PCV2的检出率为14.3%,PRV的检出率为2.9%。相对于山东的调查结果,来自广西的数据显示[6],广西种公猪精液带毒现象更为严重,5种主要的猪繁殖障碍性病毒性病原均有检出,248份精液样品检出PRRSV阳性率为48.39%,CSFV的阳性率为16.94%,PCV2的阳性率3.23%,PRV的阳性率5.24%,PPV的阳性率42.34%。本研究针对来自云南不同猪场的212份精液进行的5种主要繁殖障碍性病原检测结果显示,PRRSV、CFSV、PRV、PCV2的阳性检出率分别为7.08%、3.77%、3.30、6.60%,暂时未见猪PPV的检出。同其他研究一样,PRRSV的检出率最高。本研究在2014年—2016年间对相同猪场进行了3年的持续性检测,结果表明2014年间,CSFV的检出率最高,共检出8份,达到8.33%;PRV和PCV2阳性率均为2.08%,而PRRSV和PPV均未检出。2015年间,PRRSV检出阳性7份,阳性率6.0%;CSFV阳性3份次,阳性率2.6%;PRV阳性3份,阳性率2.6%;PCV2阳性2份,阳性率为1.7%;PPV未检出。2016年共检测样品48份,检出阳性23份次,其中PRRSV阳性8份,阳性率16.7%;CSFV阳性1份,阳性率2.1%;PRV阳性3份,阳性率6.3%;PCV2阳性11份,阳性率为23.0%;PPV未检出。结果提示,云南省种公猪精液也存在携带多种繁殖障碍性病毒的情况,相对于其他地区,云南省种公猪精液病原检出率相对较低;2014年—2015年间,PRRSV和PCV2的感染率呈逐年上升趋势,而其他疫病保持平稳态势,控制猪场疫病发生的关键,首先是控制PRRSV和PCV2的流行趋势。
随着规模化养猪水平的提高,猪繁殖障碍性疫病在临床上发生了新变化,隐性感染和亚临床病例显著上升,持续性和混合感染在猪群中较为普遍,临床症状日趋复杂[9]。本研究在2014年—2016年间,共检测出36份阳性样品,混合感染样品共有7份,混合感染样品占阳性样品数的19.44%,和吴永刚等[10]调查结果相似;其中2014年未发现混合感染;2015年发现PRRSV和PCV2混合感染率为9.09%,PRRSV和PRV混合感染率为9.09%;PRRSV和PCV2混合感染率为18.20%。2016年PRRSV和PCV2混合混合感染率为10.53%;PRRSV、CSFV和PCV2混合感染感染率为5.26%。结果提示,所有的混合感染样品中,均检测出了PRRSV,其中PRRSV和PCV2的混合感染最为常见。两种病毒均能够抑制宿主免疫,增加其他病原体感染机会,造成免疫失败,导致混合感染的程度逐年提高[11-12]。
总之,云南省部分地区的种公猪精液存在携带多种繁殖障碍性病毒病原的情况,尽管检测阳性率相对较低,但是PRRSV和PCV2的感染率呈逐年上升趋势,多种病毒混合感染日趋复杂。因此,在当前猪病防控的严峻形势下,有必要加强对种猪群的疫病检测,推行种猪场主要疫病的控制与净化工作势在必行。
[1] Uladzimir U K,Hans J N.Pathogenesis and prevention of placental and placental trans placental porcine reproductive and respiratory syndrome virus infection[J].Vet Res,2013,44(1):95.
[2] 王 雪.四川省部分地区公猪精液中蓝耳病病毒带毒情况与蓝耳病抗体相关性分析[D].四川成都:四川农业大学,2013.
[3] Lim S I,Song J Y,Kim J,et al.Safety of classical swine fever virus vaccine strain LOM in pregnant sows and their offspring[J].Vaccine,2016,34(17):2021-2026.
[4] 李海全,王 雪,徐志文.四川部分地区公猪精液中猪癌病毒分子流行病学调查叫[J].四川畜牧兽医,2013(10):33-34.
[5] 姜佳佳,李美珍,覃绍敏,等,种公猪精液中与繁殖障碍有关的5种垂直传播病毒的检测[J].黑龙江畜牧兽医,2016(4):102-104.
[6] 黄 夏,陈义祥,覃芳芸,等,公猪精液CSFV、PRRSV、PCV2、PRV和PPV的PCR检测[J].广西农业科学,2008,39(2):236-239.
[7] 张锁宇,王爱国,王 胜,等.猪主要繁殖性状的遗传参数估计[J].中国畜牧杂志,2013,49(23):1-5.
[8] 张 志,刘 爽,张燕霞,等,猪精液中五种病毒的初步检测[J].动物医学进展,2012,33(7):112-115.
[9] 何后军,陆承平,罗咏梅,PCR检测临床病例中PCV-2、PRRSV和CSFV的混合感染[J].中国兽医学报, 2010,30(2):177-179.
[10] 吴永刚.四川省部分地区公猪精液六种病毒性疾病的分子检测[D].四川成都:四川农业大学,2014.
[11] Li Y,Shyu D L,Shang P,et al.Mutations in a highly conserved motif of nsp1β protein attenuate the innate immune suppression function of porcine reproductive and respiratory syndrome virus[J].J Virol,2016,90(7):3584-3599.
[12] Richmond O,Cecere T E,Erdogan E,et al.PD-L1 expression is increased in monocyte derived dendritic cells in response to porcine circovirus type 2 and porcine reproductive and respiratory syndrome virus infections[J].Vet Immunol Immunopathol,2015,168(1-2):24-29.
InvestigationonPorcinePeproductiveVirusesfromBoarSemeninYunnanProvince
ZHAO Qian1, WANG Lei2, ZHA Xing-qin1, YANG Gui-shu1,YIN Ge-fen1
(1.CollegeofAnimalScienceandTechnology,YunnanAgriculturalUniversity,Kunming,Yunnan,650201,China; 2.AnimalDiseasePreventionandControlCenterofChuxiong,Chuxiong,Yunnan,675000,China)
In order to investigate the viral infection situations in some areas in Yunnan province,the detection of five production related viruses from 212 boar semen by polymerase chain reaction (PCR) was performed,including porcine repeproductive and respiratory syndrome virus (PRRSV),classic swine fever virus (CSFV),pseudorabies virus (PRV),porcine circovirus type virus Ⅱ(PCV2) and porcine parvovirus (PPV).The results showed that the PPRSV positive rate is 7.08%;the CSFV positive rate is 3.77%;the PCV2 positive rate is 6.60% and the PRV positive rate is 3.30%,while no PPV positive semen was detected.The rates of PRRSV and PCV infection increased year by year,and the infection rates for the other two viruses have been relatively stable.The PRRSV were detected from all the multiplex infection samples.Among them,the mixed infection of PRRSV and PCV2 is most common.Our data implied that controlling PRRSV and PCV2 is the key to prevent swine diseases.It is necessary to strengthen the disease detection for breeding herd and to purify the main breeding pig farm.
boar;semen;reproductive disorder;pathogenic investigation
2017-01-06
云南省应用基础研究重点项目(2016FA018);国家自然科学基金项目(31560705)
赵 谦(1992-),男,云南大理人,硕士研究生,主要从事动物传染病及分子流行病学研究。*
S852.852.651;S858.28
:A
:1007-5038(2017)09-0037-06

