MTS法与仪器MIC法检测耐碳青霉烯类肺炎克雷伯菌对替加环素敏感性的差异
张丽琴, 刘 聪, 肖九长, 邹淑慧
(赣州市人民医院, 江西 赣州 341000)
MTS法与仪器MIC法检测耐碳青霉烯类肺炎克雷伯菌对替加环素敏感性的差异
张丽琴, 刘 聪, 肖九长, 邹淑慧
(赣州市人民医院, 江西 赣州 341000)
目的了解耐碳青霉烯类肺炎克雷伯菌(CRKP)临床分布特点,分析菌株产酶情况及验证替加环素的体外抗菌活性。方法分析某院2015年1—12月临床患者送检标本中分离的53株CRKP的药敏结果,对目标菌株进行改良Hodge试验检测碳青霉烯酶,同时采用EDTA协同试验检测金属β-内酰胺酶,使用MIC测试条(MTS)确认仪器MIC法中替加环素药敏结果。结果53株CRKP科室分布主要为重症监护病房(ICU)14株,占26.42%,烧伤科13株(24.53%);标本来源主要为痰23株(43.40%),创面分泌物15株(28.30%);年龄分布主要为≥60岁患者,检出35株(66.04%)。CRKP对替加环素的敏感率最高(96.2%)。经改良Hodge试验确认有48株产碳青霉烯酶,阳性率90.6%,同时15株产金属β-内酰胺酶。仪器MIC法判读为替加环素耐药的菌株经MTS法验证后均应判读为敏感。结论该院CRKP主要产碳青霉烯酶,其中部分菌株可产2类不同的β-内酰胺酶;替加环素在药敏试验中对CRKP具有良好的抗菌活性,经仪器MIC法检测为替加环素耐药的菌株须进行MTS法确认。
肺炎克雷伯菌; 碳青霉烯类; 改良Hodge试验; EDTA协同试验; 替加环素MTS法; 耐药性
[Chin J Infect Control,2017,16(9):845-848,869]
全国细菌耐药监测网数据显示,肺炎克雷伯菌的临床分离率仅次于大肠埃希菌,但肺炎克雷伯菌对碳青霉烯类抗生素的耐药率远高于大肠埃希菌,已由2014年的6.4%上升为2015年的7.6%,给临床抗感染治疗带来越来越多的困难与挑战。因此,了解耐碳青霉烯类肺炎克雷伯菌的临床分布及产碳青霉烯酶的现状,对于医院感染控制和流行病学调查具有重要意义。
1 材料与方法
1.1 菌株来源 某院2015年1—12月临床患者送检标本中分离的53株耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistantKlebsiellapneumoniae,CRKP),已剔除同一患者相同部位检出的重复菌株。
1.2 仪器与试剂 法国梅里埃公司生产的Vitek 2 Compact全自动微生物鉴定药敏分析系统及配套的GN、AST-GN16卡;血平板、MH平板购自广州迪景公司;厄他培南纸片为英国Oxoid公司产品;EDTA协同试验所需的IP/IPI条为法国梅里埃公司产品;替加环素MTS条为意大利Liofilchem公司产品。
1.3 方法
1.3.1 改良Hodge试验 按照美国临床实验室标准化协会(CLSI)M100-S24进行[1],将0.5麦氏单位的大肠埃希菌ATCC 25922用生理盐水稀释10倍后涂布于MH平板,中间贴厄他培南(10 μg)纸片,用接种环挑取受试菌自纸片外缘向平板边缘划线接种,35℃孵育过夜,次日,厄他培南抑菌圈处出现矢状生长者为产碳青霉烯酶的待检菌。
1.3.2 EDTA协同试验 采用IP/IPI试条进行协同试验[2]。试条两端含有梯度浓度抗生素,其中一端含亚胺培南(IP),另一端含亚胺培南加EDTA(IPI),将试条一面标有MIC刻度向上贴于涂布有待测菌株的MH平板上,同时做阳性和阴性对照。结果判读:IPI处的MIC小于或等于IP处MIC 3个倍比稀释度时(或比值≥8),可确证该菌株产金属β-内酰胺酶。
1.3.3 替加环素MTS法 将0.5麦氏单位的菌液涂布于MH平板上,室温放置至表面干后,将MTS试条标有刻度一面朝上贴在平板表面,35 ℃孵育过夜,次日读取结果时,应当在80%抑菌处读取MIC值,即通过肉眼观察判断明显抑菌点,而忽略可能蔓延到终点周围的菌斑或细小的微菌落。判读标准参照美国食品药品监督管理局(FDA)的标准及文献[3],MIC≤2 μg/mL为敏感、4 μg/mL为中介、≥8 μg/mL为耐药。
1.4 质控菌株 质控菌株为大肠埃希菌ATCC 25922、肺炎克雷伯菌 ATCC 700603,均购自卫生部临床检验中心。产IMP-1和VIM-2金属酶的铜绿假单胞菌为阳性对照菌株,由上海复旦大学附属华山医院惠赠。
2 结果
2.1 CRKP分布情况 53株CRKP科室分布为重症监护病房(ICU)14株,占26.42%,烧伤科13株(24.53%),新生儿科、呼吸科、泌尿外科等其他科室共检出26株(49.06%);标本来源分布主要为痰23株(43.40%),创面分泌物15株(28.30%),血、尿、腹腔积液等标本共检出15株(28.30%);年龄分布主要为≥60岁患者,检出35株(66.04%),<60岁18株(33.96%)。
2.2 CRKP药敏情况 53株CRKP除对替加环素的敏感率为96.2%外,仅对阿米卡星、左氧氟沙星的敏感率为35.8%、28.3%,对其他常见抗菌药物的敏感率均<25%。详见表1。
表153株CRKP对常见抗菌药物的药敏结果(%)
Table1Antimicrobial susceptibility testing results of 53 CRKP(%)
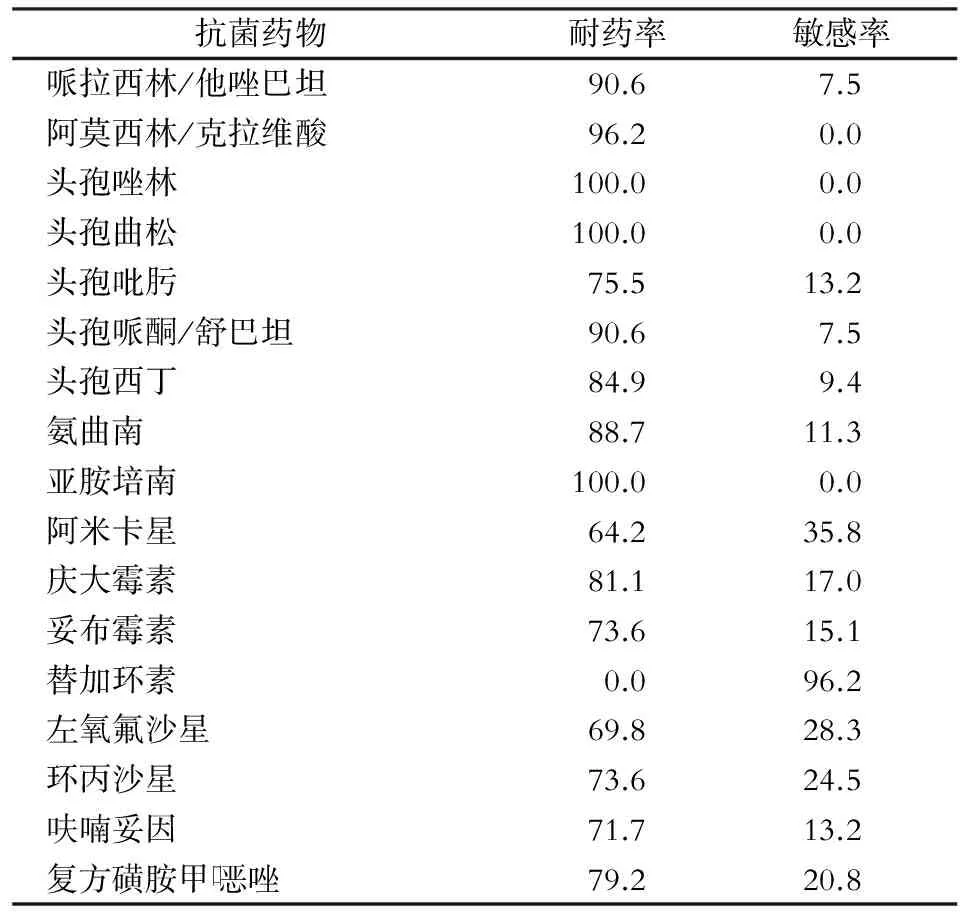
抗菌药物耐药率敏感率哌拉西林/他唑巴坦90.67.5阿莫西林/克拉维酸96.20.0头孢唑林100.00.0头孢曲松100.00.0头孢吡肟75.513.2头孢哌酮/舒巴坦90.67.5头孢西丁84.99.4氨曲南88.711.3亚胺培南100.00.0阿米卡星64.235.8庆大霉素81.117.0妥布霉素73.615.1替加环素0.096.2左氧氟沙星69.828.3环丙沙星73.624.5呋喃妥因71.713.2复方磺胺甲口恶唑79.220.8
注:中介未列出
2.3 改良Hodge试验、EDTA协同试验及替加环素MTS法结果 53株CRKP经改良Hodge试验有48株产碳青霉烯酶,阳性率90.6%,同时进行EDTA协同试验发现15株产金属β-内酰胺酶。使用MTS法对53株经仪器GN-16卡检测的CRKP的替加环素(TGC)进行验证后发现,仪器MIC法报告TGC敏感株的符合率为100%(35/35),中介在内的非敏感株的符合率仅11.1%(2/18),TGC耐药株经MTS条确认其MIC值均≤2 μg/mL,应判读为敏感。详见表2。
3 讨论
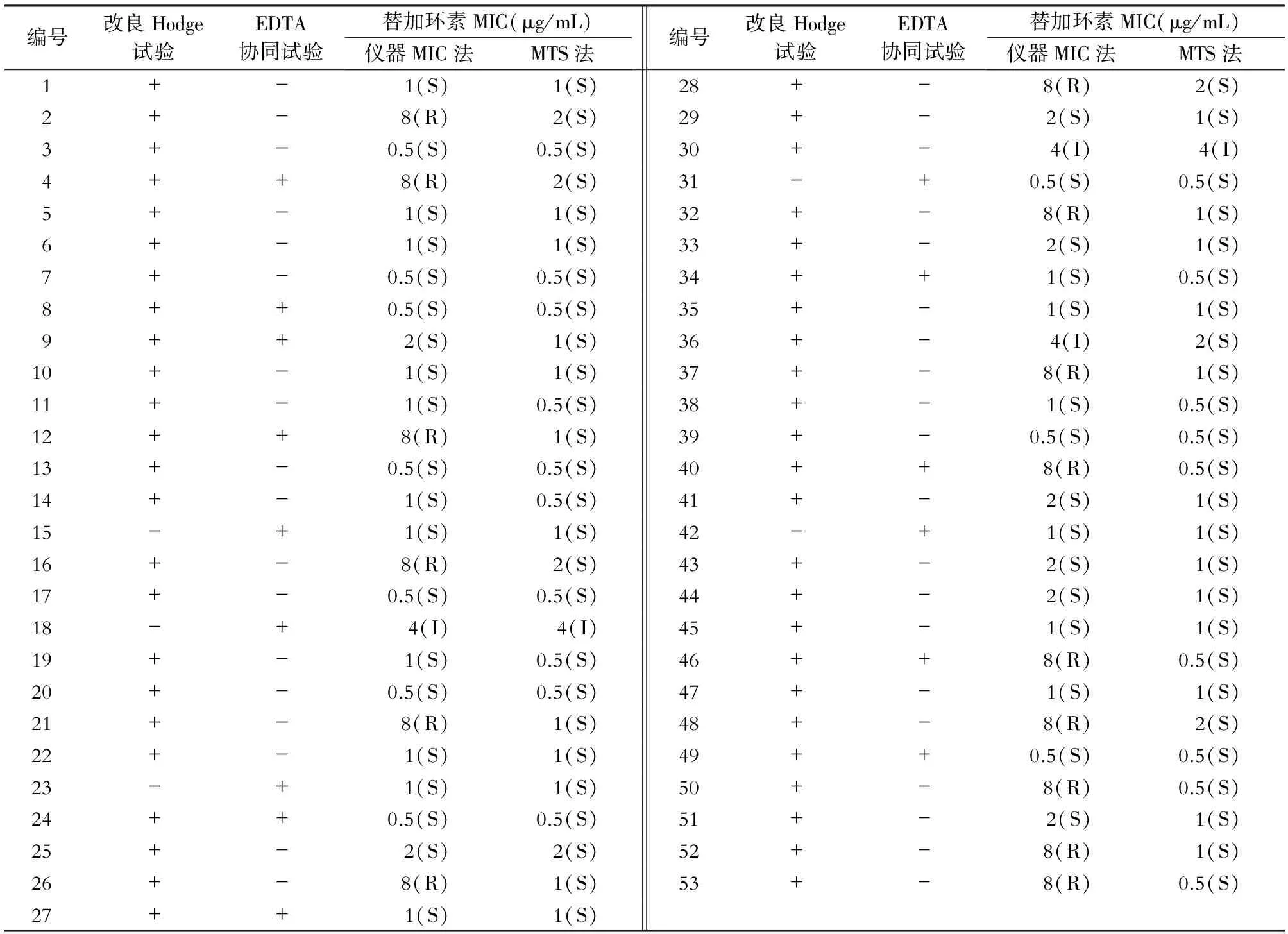
表2 53株CRKP的改良Hodge试验、EDTA协同试验及替加环素药敏结果
近年来,随着治疗严重感染的碳青霉烯类抗生素的临床使用不断增加,使细菌逐渐获得了耐药性,导致CRKP的检出率不断上升。本文报道的CRKP标本来源主要来自60岁以上的老年人,以ICU和烧伤科为主,与文献[4-5]报道的CRKP感染的危险因素一致。尤其注意烧伤科创面分泌物中CRKP的大量检出,提示医院感染的可能性,为防范烧伤科CRKP感染暴发,医院感染管理部门和烧伤科应引起重视,进一步加强CRKP的筛查和监测,做好接触隔离等一系列防控措施。研究结果表明替加环素是药敏试验结果中敏感率最高的抗菌药物,临床医生可根据药敏结果采用联合用药方案治疗多重耐药菌,其疗效优于单药治疗[6-7]。
大量研究[8-10]表明产碳青霉烯酶是肺炎克雷伯菌对碳青霉烯类抗生素耐药的主要机制之一。以肺炎克雷伯菌为代表的肠杆菌科细菌鉴定出的各种碳青霉烯酶分属于Ambler分类中的A类、B类和D类β-内酰胺酶。KPC酶这一最常见的碳青霉烯酶是目前最具临床意义的A类β-内酰胺酶;VIM、IMP和NDM为最常见的3类B类金属β-内酰胺酶。CLSI推荐改良Hodge试验作为怀疑产碳青霉烯酶肠杆菌科的确证试验对KPC型碳青霉烯酶的检测敏感性和特异性均>90%[1],这点在本研究中再次得到确认。5株CRKP表型阴性,但其EDTA协同试验阳性,提示产金属β-内酰胺酶为该菌株水解碳青霉烯类抗生素的耐药机制;另有10株CRKP在改良Hodge试验阳性的同时EDTA协同试验也为阳性,提示同时产两类以上β-内酰胺酶的CRKP不在少数。当然,此次研究仅针对表型进行筛查,具体的基因型仍需进一步深入研究。另外鉴于这些由质粒介导的碳青霉烯酶极易在不同菌种中横向传播,造成碳青霉烯耐药性的扩散。因此,临床微生物实验室应进一步提升能力建设,提高CRKP等多重耐药菌的检测水平,配合医院感染管理部门加强抗菌药物临床合理应用的监管,避免抗菌药物滥用和过度使用,从而有效延缓细菌耐药性的发生。
CLSI推荐采用肉汤稀释法作为检测替加环素体外药物敏感性的金标准。MTS法与肉汤稀释法相关性最好,Vitek-2 GN16卡检测结果高于肉汤稀释法[11-13],一致性较低。不同检测方法对替加环素药敏结果存在差异[14-17]。文中GN16药敏卡检测CRKP对替加环素敏感性结果的差异高于何翠娥等[18]的报道,尽管如此,仍可作为常规方法检测肺炎克雷伯菌对替加环素的敏感性,而MTS条价格昂贵,不适用于临床常规检测。针对文中替加环素非敏感株的符合率低这一现象,除可能与本次试验非敏感株样本数量较少有关外,一方面可能与肺炎克雷伯菌黏稠的菌落不易调配合适的药敏浓度有一定的关系;另一方面仪器采用光电比浊法进行MIC的检测,会存在拖尾现象,容易将S误报为I或R。通过此次MTS法与GN16药敏卡符合性的验证得出日常工作中出现替加环素中介或耐药的菌株时,必须使用MTS法进行确认,特别在对待CRKP等多重耐药或泛耐药菌时,更应该注重替加环素药敏结果的真实性,以确保临床在治疗多重耐药菌或泛耐药菌的抗菌药物选择上获得重要支持。
[1] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing[S]. CLSI, 2014, M100-S24.
[2] 陈东科.实用临床微生物学检验与图谱[M].北京:人民卫生出版社, 2011.
[3] 王辉, 倪语星, 陈民钧, 等. 新型甘氨酰环素类抗菌药物替加环素的体外药敏试验操作规程[J].中华检验医学杂志, 2009, 32(11):1208-1213.
[4] 王爱, 康京花, 段丽丽, 等.医院内泛耐药肺炎克雷伯菌定植及感染风险因素调查与控制[J].中国急救复苏与灾害医学杂志, 2012, 7(10): 929-932.
[5] 刘婧娴, 俞静, 陈峰, 等.产KPC酶肺炎克雷伯菌的检测及传播途径初探[J].中华临床感染病杂志, 2015, 8(4):306-310.
[6] 郑昌成, 朱小玉, 汤宝林, 等.替加环素为基础的联合方案治疗33例泛耐药革兰阴性杆菌感染血液病患者的临床研究[J].中华血液学杂志, 2015, 36(9):785-787.
[7] 周洋, 黄河, 张家洪.替加环素联合头孢哌酮舒巴坦治疗多重耐药鲍曼不动杆菌肺炎的疗效观察[J].实用医学杂志, 2015, 31(5):816-818.
[8] 赵晓杰, 邓丽华, 施德仕, 等.碳青霉烯类耐药肺炎克雷伯菌分子流行病学和耐药基因分析[J].国际检验医学杂志, 2015, 36(11):1530-1532.
[9] 安军, 蔡挺, 张顺.耐碳青霉烯类大肠埃希菌和肺炎克雷伯杆菌多重耐药研究进展[J].现代实用医学, 2011, 23(3): 359-360.
[10] 靳颖, 王俊妨, 刘冀琴, 等.产KPC酶肺炎克雷伯菌9株的药敏试验结果分析[J].中国感染与化疗杂志, 2015, 15(3): 257-259.
[11] 张冀霞, 赵春江, 刘文云, 等.替加环素对鲍曼不动杆菌和肺炎克雷伯菌体外抗菌活性检测的影响因素和方法学评估[J].中华检验医学杂志, 2013, 36(7): 604-609.
[12] Bradford PA, Petersen PJ, Young M, et al. Tigecycline MIC testing by broth dilution requires use of fresh medium or addition of the biocatalytic oxygen-reducing reagent oxyrase to standardize the test method[J]. Antimicrob Agents and Chemother, 2005, 49(9): 3903-3909.
[13] Casal M, Rodríguez F, Johnson B, et al. Influence of testing methodology on the tigecycline activity profile against presumably tigecycline-non-susceptibleAcinetobacterspp.[J]. J Antimicrob Chemother, 2009, 64(1): 69-72.
[14] Zarkotou O, Pournaras S, Altouvas G, et al. Comparative evaluationof tigecycline susceptibility testing methods for expanded-spectrum cephalosporin-and carbapenem-resistant gram-negative pathogens[J]. J Clin Microbiol, 2012, 50(11): 3747-3750.
[15] Liu JW, Ko WC, Huang CH, et al. Agreement assessment of tigecycline susceptibilities determined by the disk diffusion and broth microdilution methods among commonly encountered resistant bacterial isolates: results from the Tigecycline In Vitro Surveillance in Taiwan (TIST) study, 2008 to 2010[J]. Antimicrob Agents and Chemother, 2012, 56(3): 1414-1417.
[16] Huang TD, Berhin C, Bogaerts P, et al. In vitro susceptibility of multidrug-resistant Enterobacteriaceae clinical isolates to tigecycline[J]. J Antimicrob Chemother, 2012, 67(11): 2696-2699.
[17] 闫少珍, 宋玥, 陈中举, 等.4种方法检测替加环素对鲍曼不动杆菌和肠杆菌科细菌体外药敏结果分析[J].中华微生物学和免疫学杂志, 2014, 34(11):859-862.
[18] 何翠娥, 胡祎明.鲍曼不动杆菌及肺炎克雷伯菌对替加环素体外药敏试验方法评价[J].临床检验杂志, 2013, 31(3):168-170.
(本文编辑:熊辛睿、陈玉华)
Differenceinsusceptibilityofcarbapenem-resistantKlebsiellapneumoniaetotigecyclinedetectedbyMTSandinstrumentalMICassay
ZHANGLi-qin,LIUCong,XIAOJiu-chang,ZOUShu-hui
(GanzhouPeople’sHospital,Ganzhou341000,China)
ObjectiveTo explore clinical distribution characteristics of carbapenem-resistantKlebsiellapneumoniae(CRKP), analyze enzyme production of strains and verify the in vitro antimicrobial activity of tigecycline.MethodsAntimicrobial susceptibility testing results of 53 strains of CRKP isolated from clinical specimens of patients in a hospital from January to December 2015 were analyzed, carbapenemase production of target strains was detected by modified Hodge test, metallo-β-lactamase was detected by EDTA synergy test, minimum inhibitory concentration(MIC) of tigecycline susceptibility testing result detected by instrument was confirmed by MIC test strip(MTS method).Results53 CRKP strains were mainly isolated from patients in intensive care unit (n=14, 26.42%) and burn unit(n=13, 24.53%); sputum(n=23, 43.40%) and wound secretion(n=15, 28.30%) were the main specimen sources; isolation rate of CRKB was highest in the elderly≥60 years old, 35 strains(66.04%)of CRKP were isolated. CRKP was most sensitive to tigecycline(96.2%). The modified Hodge test showed that 48 strains(90.6%) produced carbapenemases and 15 strains produced metallo-β-lactamase. MICs of tigecycline-resistant strains detected by instrument were all confirmed as susceptibility by MTS.ConclusionCRKP mainly produce carbapenems in this hospital, some strains can produce two types of different β-lactamases; antimicrobial susceptibility testing showed that tigecycline has good antimicrobial activity against CRKP, tigecycline-resistant strains detected by instrument must be confirmed by MTS method.
Klebsiellapneumoniae; carbapenem; modified Hodge test; EDTA synergy test; tigecycline MTS method; drug resistance
2016-07-25
张丽琴(1981-),女(汉族),江西省赣州市人,副主任技师,主要从事微生物鉴定及耐药机制研究。
邹淑慧 E-mail:364235529@qq.com
10.3969/j.issn.1671-9638.2017.09.013
R378.2
A
1671-9638(2017)09-0845-05

