经直肠超声术前评估直肠癌累及直肠系膜筋膜
刘小银,刘广健*,周智洋,孟晓春,文艳玲,余俊丽,陈 瑶,程文捷,覃 斯,曹 飞,张文静,蒋清凌,王仪敏
(1.中山大学附属第六医院超声科,2.放射科,广东 广州 510655)
经直肠超声术前评估直肠癌累及直肠系膜筋膜
刘小银1,刘广健1*,周智洋2,孟晓春2,文艳玲1,余俊丽1,陈 瑶1,程文捷1,覃 斯1,曹 飞1,张文静1,蒋清凌1,王仪敏1
(1.中山大学附属第六医院超声科,2.放射科,广东 广州 510655)
目的探讨经直肠超声(ERUS)术前评估直肠癌累及直肠系膜筋膜(MRF)的价值。方法44例直肠癌患者术前均接受ERUS检查,其中18例接受新辅助放化疗,26例未接受;所有患者于接受ERUS检查后1周内行全直肠系膜切除手术(TME)。以术后病理诊断环周切缘(CRM)的结果为金标准,判断ERUS术前评估直肠癌累及MRF的诊断效能。结果44例患者中,术后病理诊断T1期2例,T2期17例,T3期25例;CRM阳性2例,CRM阴性42例。低位直肠癌16例,中位直肠癌28例。肿瘤位于前壁和前侧壁26例,后壁和后侧壁13例,累及肠壁全周5例。ERUS对术前接受和未接受新辅助放化疗的患者诊断准确率分别为83.33%(15/18)和92.31%(24/26);肿物位于前壁和前侧壁时,诊断准确率为80.77%(21/26),而肿物位于后壁和后侧壁时为100%(13/13);对于低位和中位直肠癌,诊断准确率分别为75.00%(12/16)和96.43%(27/28);总准确率为88.64%(39/44)。结论ERUS是术前评估直肠癌是否累及MRF的有效辅助检查方法。
超声检查;经直肠;直肠肿瘤;直肠系膜筋膜
直肠癌是常见的恶性肿瘤之一,近年来发病率不断上升[1]。全直肠系膜切除术(total mesorectal excision, TME)和新辅助放化疗的应用,可显著降低患者的局部复发率[2]。直肠系膜筋膜(mesorectal fascia, MRF)是TME的重要解剖标志,且MRF是否受到肿瘤侵犯是影响局部复发率的重要因素。术前行放化疗是进展期直肠癌的标准治疗方案,但有研究[3]认为对于MRF未受累且能接受手术的低风险患者,可行TME手术而无需行放化疗。因此,术前对MRF受累情况的准确评估是决定治疗方案的重要因素。MRI是评估MRF的最佳检查手段[3],但MRI易受直肠周围邻近器官及直肠系膜内脂肪的影响,难以清晰显示直肠前壁的MRF[4]。经直肠超声(endorectal ultrasonography, ERUS)可清楚显示直肠壁及其周围组织结构,尤其是直肠前壁及其周围邻近的器官,并可清楚地判断肿瘤与周围器官(前列腺和精囊腺/子宫和阴道)的关系。本研究旨在探讨ERUS在术前评估直肠癌累及MRF的应用价值,为治疗提供指导依据。
1 资料与方法
1.1一般资料 收集2014年11月—2015年12月间于本院就诊的直肠癌患者44例,男28例,女16例,年龄28~89岁,平均(58.9±13.6)岁。其中18例术前接受新辅助放化疗,26例未接受。入选标准:①电子肠镜下活检组织病理确诊为直肠癌;②所有患者均在术前接受ERUS,且检查后1周内行TME治疗;③直肠癌均为中低位(病灶距肛缘距离≤10 cm)。排除标准:肿瘤位置过高、肠腔狭窄或肠道准备欠佳等原因所致ERUS成像质量无法达到评估要求者。
1.2仪器与方法 采用Pro Focus 2202超声仪(Brüel&Kjae公司,丹麦),经直肠双平面探头,探头型号8848,频率4~12 MHz;经直肠3D成像探头,探头型号2052,频率4~16 MHz。检查前1~2 h予以清洁灌肠,检查时嘱患者左侧卧位,双膝屈曲90°,充分暴露肛门。先行肛门指检,初步判断直肠肿物位置后行耦合剂保留灌肠,将探头缓慢置入直肠进行观察,探头置入长度约120 mm,机械指数0.7。缓慢转动探头,直至清晰显示直肠肿物及其周围组织结构。所有患者均使用经直肠双平面探头和经直肠3D成像探头先后进行扫查,并储存3D图像进行分析。应用二维超声观察并记录直肠肿物的大小、形态、回声、距肛缘的距离,肿瘤侵犯直肠壁的位置、范围、肠壁浸润深度、肠周淋巴结及MRF受累情况,随后采用彩色及频谱多普勒超声检测并记录直肠病变血流信息。
1.3图像分析 所有ERUS图像均由1名高年资和1名低年资医师采用盲法共同协商分析。术前ERUS诊断MRF阳性的标准:环周扫查直肠,直肠周围系膜脂肪与盆壁脂肪之间的强回声界面即为MRF;测量肿瘤最外缘、癌结节或转移淋巴结与MRF的最短距离,当距离≤1 mm时为阳性。直肠癌环周切缘(circumferential resection margin, CRM)为直肠肿瘤与周边切缘之间的最短距离,术后病理诊断CRM阳性的标准:镜下可见肿瘤组织、癌结节或转移淋巴结与周边切缘的最短距离≤1 mm。术后诊断CRM阳性即认为MRF受累阳性。
1.4统计学分析 以术后病理诊断CRM结果为金标准,将ERUS结果与术后病理结果对照,计算ERUS术前诊断MRF是否受累的准确率、特异度、敏感度、阳性预测值及阴性预测值。
2 结果
44例直肠癌患者中,术后病理诊断T1期2例,T2期17例,T3期25例(图1、2)。CRM阳性2例,均为中位T3期直肠癌,其中1例肿瘤位于直肠前壁,术前接受放化疗,另1例肿瘤累及直肠全周,术前未接受放化疗;CRM阴性42例,其中低位直肠癌16例,中位直肠癌26例;肿瘤位于前壁和前侧壁25例,后壁和后侧壁13例,累及肠壁全周4例,17例术前接受放化疗,25例未接受。
ERUS对直肠癌累及MRF的诊断效能见表1。ERUS对于术前接受和未接受新辅助放化疗的患者,诊断准确率分别为83.33%(15/18)和92.31%(24/26);肿物位于前壁和前侧壁时,诊断准确率为80.77%(21/26),而肿物位于后壁和后侧壁时为100%(13/13);对于低位和中位直肠癌,诊断准确率为75.00%(12/16)和96.43%(27/28);总准确率为88.64%(39/44)。

表1 ERUS对不同位置及术前是否接受放化疗直肠癌MRF受累的诊断效能[%(例)]
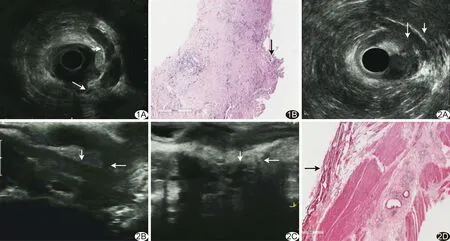
图1 患者男,47岁,直肠癌T3期,术前诊断MRF受累 A.3D声像图示MRF为包裹直肠系膜的亮线(短箭),肿瘤与MRF的距离 <1 mm(长箭), MRF受累; B.病理图 CRM阳性(箭;HE,×20) 图2 患者女,45岁,直肠癌T2期,术前诊断MRF受累 A、B.直肠3D环扫探头(A)与直肠线阵探头(B)扫查图像示新辅助放化疗前MRF受累(长箭),肿瘤与前方阴道(短箭)分界不清; C.新辅助放化疗后肿瘤退缩,MRF阴性(长箭),与阴道(短箭)分界清晰; D.病理图(HE,×25)示CRM环周切缘未见癌细胞累及(箭)
3 讨论
MRF是指包裹在直肠周围系膜外的一层结缔组织,内含脂肪、直肠上下动静脉、淋巴管、淋巴结及支配直肠的神经等组织。近年来,Heald等[5]提出的TME已成为直肠癌的标准术式,该术式沿直肠系膜外的盆筋膜环绕剥离直肠系膜及直肠,术后将整个直肠肿瘤及直肠系膜沿冠状位连续切片,观察其周边切缘是否有肿瘤侵犯,因此本研究中影像学显示的MRF等同于术后病理评估的CRM。
2016年欧洲肿瘤内科会议提出术前评估直肠癌是否累及MRF至关重要,对于MRF阴性的T1~T2期及T3早期的直肠癌,可直接行TME手术;而对于MRF阳性的T3期直肠癌,则需术前先行放化疗[6]。研究[7]发现,MRF是否受累不仅是指导治疗的重要因素,也是影响直肠癌术后局部复发、总生存期及无病生存期的重要预测因子,术前影像学评估直肠癌MRF阴性者的局部复发率远远低于阳性者,5年总生存率和无病生存率高于阳性者。因此,术前利用影像学检查评估MRF十分必要。MRI是评估直肠癌是否累及MRF的常用影像学检查方法。研究[8]发现,MRI判断MRF是否受累的敏感度为94%,特异度为85%。Peschaud等[9]研究发现,对于直肠下1/3段的前壁肿物,MRI的诊断准确率为63%,提示对于低位直肠癌,尤其是位于前壁的直肠癌,MRI的诊断准确率较低。ERUS可清楚地显示肠壁层次结构及其周围邻近的组织和器官,已被广泛应用于直肠癌的T分期[10],有研究[11]采用ERUS观察及评估直肠周围系膜及MRF的边界。本研究采用双平面探头及3D成像探头,能清楚显示直肠中下段的直肠系膜及MRF,对于诊断MRF是否受累的总准确率为88.64%(39/44)。
由于直肠前方系膜较薄,双侧及后方系膜较厚,且直肠前方与前列腺、精囊腺或子宫、阴道等重要器官相毗邻[12],导致直肠前壁肿瘤行TME手术时存在困难,且术后泌尿及生殖功能障碍发生率明显增加,尤其是性功能障碍及尿潴留显著增多[13]。因此,对于直肠前壁肿瘤,术前评估其与前方MRF及邻近器官的关系尤为重要。本研究中ERUS对26例直肠前壁肿物和13例直肠后壁肿物的MRF诊断准确率分别为80.77%(21/26)和100%(13/13),这是由于直肠前方脂肪组织和MRF较薄,不易判断肿瘤与MRF的关系,因此直肠前壁肿物MRF的诊断准确率低于直肠后壁肿物。
进展期直肠癌术前常采用新辅助放化疗使肿瘤缩小甚至降低分期后再行TME手术,可明显提高保肛率,减少局部复发率,提高生活质量,改善预后[14-15]。本研究中,ERUS对18例术前接受新辅助放化疗与26例未接受的患者诊断准确率为83.33%(15/18)和92.31%(24/26)。由于放化疗后易引起肠壁水肿及纤维化,ERUS难以判断纤维化组织与MRF的关系,导致对术前行新辅助放化疗的直肠癌诊断的分期过高,从而使诊断准确率下降[16]。
ERUS评估MRF仍存在一定的局限性:①依赖检查者的经验及技术;②对于直肠上段MRF较难显示;③易受肠腔狭窄及肠内容物较多因素干扰无法进行评估。因此ERUS只有通过采用新技术,与MRI等其他检查相结合,才能为临床提供全面可靠的诊治依据。
[1] Cho EY, Kim SH, Yoon JH, et al. Apparent diffusion coefficient for discriminating metastatic from non-metastatic lymph nodes in primary rectal cancer. Eur J Radiol, 2013,82(11):e662-668.
[2] Martling AL, Holm T, Rutqvist LE, et al. Effect of a surgical training program on outcome of rectal cancer in the County of stockholm. Lancet, 2000,356 (9224):93-96.
[3] Frasson M, Garcia-Granero E, Roda D, et al. Preoperative chemoradiation may not always be needed for patients with T3 and T2N+ rectal cancer. Cancer, 2011,117(14):3118-3125.
[4] Kim YW, Kim NK, Min BS, et al.A prospective comparison study for predicting circumferential resection margin between preoperative MRI and whole mount sections in mid-rectal cancer: Significance of different scan planes. Eur J Surg Oncol, 2008,34(6):648-654.
[5] Heald RJ, Husband EM, Ryall RD. The mesorectum in rectal cancer surgery-the clue to pelvic recurrence? Br J Surg, 1982,69(10):613-616.
[6] European Society for Medical Oncology (ESMO), Clinical Practice Guidelines in Oncology for rectal cancer. v.1.2016.
[7] Taylor FG, Quirke P, Heald RJ,et al. Preoperative magnetic resonance imaging assessment of circumferential resection margin predicts disease-free survival and local recurrence: 5-year follow-up results of the MERCURY study. J Clin Oncol, 2014,32(1):34-43.
[8] Kim YW, ChaSW, Pyo J, et al. factors related to preoperative assessment of the circumferential resection margin and the extent of mesorectal invasion by magnetic resonance imaging in rectal cancer: A prospective comparison study. World J Surg, 2009,33(9):1952-1960.
[9] Peschaud F, Cuenod CA, Benoist S, et al.Accuracy of magnetic resonance imaging in rectal cancer depends on location of the tumor. Dis Colon Rectum, 2005,48(8):1603-1609.
[10] 刘小银,刘广健,周智洋,等.经直肠超声与体部线圈磁共振检查对直肠癌T分期的比较研究.中国医学影像技术,2015,31(3):420-424.
[11] Phang PT, Gollub MJ, Loh BD, et al.Accuracy of endorectal ultrasound for measurement of the closest predicted radial mesorectal margin for rectal cancer. Dis Colon Rectum, 2012,55(1):59-64.
[12] 李文睿,周乐群,张卫光.直肠系膜临床解剖学的研究与进展.中国组织工程研究,2016,20(7):1051-1056.
[13] Moszkowicz D, Alsaid B, Bessede T, et al. Where does pelvic nerve injury occur during rectal surgery for cancer? Colorectal Dis, 2011,13(12):1326-1334.
[14] Lee JW, Lee JH, Kim JG, et al. Comparison between preoperative and postoperative concurrent chemoradiotherapy for rectal cancer: An institutional analysis. Radiat Oncol J, 2013,31(3):155-161.
[15] Belluco C, Forlin M, Olivieri M, et al. Long-term outcome of rectal cancer with clinically (EUS/MRI) metastatic mesorectal lymph nodes treated by neoadjuvant chemoradiation: Role of organ preservation strategies in relation to pathologic response. Ann Surg Oncol, 2016,23(13):4302-4309.
[16] De Jong EA, Ten Berge JC, Dwarkasing RS, et al.The accuracy of MRI, endorectal ultrasonography, and computed tomography in predicting the response of locally advanced rectal cancer after preoperative therapy: A metaanalysis.Surgery, 2016,159(3):688-699.
Endorectal ultrasound in evaluation on mesorectal fascia invasion in preoperative rectal cancer
LIU Xiaoyin1, LIU Guangjian1*, ZHOU Zhiyang2, MENG Xiaochun2, WEN Yanling1, YU Junli1, CHEN Yao1, CHENG Wenjie1, QIN Si1, CAO Fei1, ZHANG Wenjing1, JIANG Qingling1, WANG Yimin1
(1.Department of Medical Ultrasonics, 2.Department of Radiology, the Sixth Affiliated Hospital of Sun Yat-Sen University, Guangzhou 510655, China)
ObjectiveTo evaluate the value of endorectal ultrasonography (ERUS) in assessment of mesorectal fascia (MRF) invasion in rectal cancer.MethodsData of 44 patients who accepted preoperative ERUS and total mesorectal excision surgery within a week were retrospective analyzed. There were 18 patients who accepted preoperative neoadjuvant chemotherapy and 26 patients didn't acceped. Taking the pathological diagnosis of circumferential resection margin (CRM) as the "gold standard", the diagnostic efficiency of ERUS for the MRF invasion in rectal cancer was evaluated.ResultsThe final pathological T staging was T1 in 2 cases, T2 in 17 cases and T3 in 25 cases. There were 2 cases of CRM positive results, and 42 cases of CRM negative results. With regard to the location of tumor, there were 16 cases located in low, and 28 cases in mid rectum. There were 26 cases located in anterior or antero-lateral wall of rectum, 13 cases in posterior or postero-lateral wall, and 5 cases with a circle of rectum. The diagnostic accuracy were 83.33% (15/18) and 92.31% (24/26) for cases of accepting and not accepting the preoperative neoadjuvant chemotherapy; 80.77% (21/26) for cases located in anterior or antero-lateral wall, and 100% (13/13) for cases located in posterior or postero-lateral wall; 75.00% (12/16) and 96.43% (27/28) for low position and mid position tumors. The total diagnostic accuracy was 88.64% (39/44).ConclusionERUS can be an effective method in preoperative assessment of the MRF invasion in rectal cancer.
Ultrasonography; Endorectal; Rectal neoplasmas; Mesorectal fascia
刘小银(1983—),女,湖南邵阳人,硕士,医师。研究方向:腹部超声诊断。E-mail: lxyinstar04@126.com
刘广健,中山大学附属第六医院超声科,510655。E-mail: liugj@mail.sysu.edu.cn
2017-02-22 [
] 2017-05-23
10.13929/j.1003-3289.201702091
R735.37; R445.1
A
1003-3289(2017)09-1357-05

