2015年欧洲心脏病学会关于感染性心内膜炎治疗指南解读
梁峰 胡大一 沈珠军 方全
指南解读
2015年欧洲心脏病学会关于感染性心内膜炎治疗指南解读
梁峰 胡大一 沈珠军 方全
心内膜炎; 感染; 指南; 抗菌疗法; 心脏手术
感染性心内膜炎(IE)是一种致死性疾病,虽然其治疗获得进展,但仍然导致很高的死亡率和各种严重并发症。之前由于该病发病率低,缺乏随机试验而仅有有限数量的荟萃分析,IE的指南基本上基于专家意见。2009年欧洲心脏病学会(ESC)关于IE预防、诊断和治疗指南,推出各种创新理念,包括极高危患者预防性抗生素的限制使用、关注医疗相关IE以及手术最佳时机的确定。但是多种进展要求ESC更新原来的指南,大系列的IE文章发表,包括手术治疗的第一项随机研究;影像诊断的重要进展,尤其核素显像领域;与以前不同指南的巨大差异。另外最近多种新指南确立并强调“心内膜炎团队”,即需要一种多科协作治疗方法。
该指南工作组的主要目的是提供明确和简洁的建议,帮助医务人员进行临床决策制订。这些推荐通过对现有文献全面回顾,达成专家共识。但是强调,无论如何指南不可能无视医务工作者对每一例个体患者合适准确的判断决策,以及合适和(或)必要时与患者和监护者的沟通协商,同时医务工作人员有责任验证药物和器械使用的原则和规定。本文解读2015年ESC关于IE治疗的指南。
1 抗生素治疗:原则和方法
1.1 总体原则 IE的成功治疗取决于抗生素对微生物的根除,手术清除感染物和引流脓肿有助于根除微生物,自身防御抵抗力几乎无用。这可解释为何杀菌方案较抑菌治疗更有效,动物实验和人体结果均相同。氨基糖苷类与细菌胞壁抑制剂(如β内酰胺类和糖肽类抗生素)具有协同杀菌作用,有助于缩短治疗时间(如口腔链球菌),以及根除致病微生物(如肠球菌)。药物杀菌的一个主要障碍是细菌耐药性。耐药微生物并非难治(药物仍然容易抑制其生长),但其可逃避药物杀死并会在治疗停止后恢复生长。缓慢生长和休眠的微生物对多数抗生素药物(某种程度除利福平)显示耐药表型。其出现在赘生物和人工瓣膜上,如人工瓣膜性心内膜炎(PVE),提示需要延长治疗时间(6周)以便充分清除瓣膜的感染。携带突变基因的某些细菌,会在活动生长期或静止期(休眠期)耐药。对耐药微生物治疗,杀菌药物联合优于单药治疗。PVE的药物治疗(至少6周)应该较自身瓣膜性心内膜炎(NVE)(2~6周)时间更长,但其他相似,例外的是葡萄球菌感染的PVE,治疗方案应包括利福平,条件是菌株敏感。
抗菌药物治疗期间需要人工瓣膜置换的NVE患者,术后抗菌治疗方案应该按NVE推荐方案,而非PVE。无论NVE还是PVE,治疗持续时间依据有效抗菌治疗的第一天(初始血培养阳性病例血培养转阴性),而非手术日期。如果瓣膜培养阳性,只能重新开始一次新的疗程,抗菌素选择依据最新复苏菌株的敏感性。
现代治疗推荐中六项重要因素值得考虑:①氨基糖苷类抗生素的适应证和使用方式发生了变化,由于未显示临床益处,而且增加肾毒性,不再推荐用于葡萄球菌感染的NVE。但当适用于其他临床情况,氨基糖苷类抗生素应给予每日一次剂量,以减少肾毒性。②一旦菌血症消除,利福平应仅用于异体物感染,如有效抗生素使用3~5 d后的PVE。支持该建议的依据是与利福平联合的抗菌治疗对浮游或复制细菌可能产生相互拮抗效应,但对生物瓣上的休眠细菌具有协同作用并预防利福平耐药突变菌。③达托霉素和磷霉素推荐用于治疗葡萄球菌性心内膜炎,奈替米星治疗青霉素敏感的口腔和消化链球菌;但是该指南考虑其他替代治疗,因为在所有欧洲国家无销售。但当需要达托霉素治疗,必须给予高剂量(≥10 mg/kg,1次/d),并联合第2种抗生素以增加活性,同时避免耐药形成。④这些指南仅依据已发表的心内膜炎患者(如无心内膜炎资料则依据菌血症)临床试验和队列研究的抗生素有效性资料,多数情况未考虑实验性心内膜炎资料。⑤仍然使用美国临床和实验室标准协会最低抑菌浓度(minimum inhibitory concentration,MIC)界限值,而非欧盟药敏试验标准委员会的标准值,因为多数心内膜炎研究资料使用前者。⑥虽然对大多数抗生素治疗获得共识,但对葡萄球菌IE的最佳治疗和经验性治疗仍然存在争议。
1.2 青霉素敏感口腔链球菌和牛链球菌组 对敏感链球菌(青霉素MIC≤0.125 mg/L)的标准推荐方案治疗,治愈率预计将>95%。青霉素G(1200~1800万U/d静脉滴注,分4~6次给药或持续给药)、阿莫西林(100~200 mg·kg-1·d-1静脉滴注,分4~6次给药,或同等剂量氨苄青霉素)、头孢曲松(2 g/d静脉滴注或肌内注射,单次给药)对NVE的标准治疗为4周(ⅠB),而对PVE的标准治疗为6周,优先考虑用于>65岁的患者、肾功能或第八对颅神经功能受损患者。无并发症的NVE病例,如果敏感链球菌和肾功能正常,青霉素、阿莫西林、头孢曲松可联合庆大霉素(3 mg·kg-1·d-1静脉滴注或肌内注射,单次给药)或奈替米星(4~5 mg·kg-1·d-1静脉滴注,单次给药)进行2周的标准治疗(ⅠB)。头孢曲松钠单独或联合每日一次的庆大霉素或奈替米星,特别方便用于门诊治疗。如果对β内酰胺类过敏,不能进行脱敏治疗的患者,应使用万古霉素(30 mg·kg-1·d-1静脉滴注,2次给药),NVE 推荐治疗4周(ⅠC),PVE患者推荐治疗6周。替考拉宁建议为替代治疗,但需要负荷剂量(6 mg·kg-1·12 h-1使用3 d),随后6~10 mg·kg-1·d-1给药。负荷剂量非常重要,因为药物与血清蛋白结合率高(≥98%)并缓慢渗透入赘生物。但是对链球菌和肠球菌IE的疗效评价仅有有限的回顾性研究资料。万古霉素通常剂量不应超过2 g/d。指南解读中所有推荐均未阐述儿童用药剂量,但均不应超过成人剂量。
1.3 青霉素耐药口腔链球菌和牛链球菌组 青霉素耐药口腔链球菌分为中等耐药(MIC 0.25~2 mg/L)和完全耐药(MIC≥4 mg/L)。但是某些指南定义为MIC>0.5 mg/L为完全耐药。这种耐药链球菌数量越来越多,大量菌株收藏资料报道>30%的中等和完全青霉素耐药轻型链球菌和口腔链球菌。相反,>99%消化链球菌仍然对青霉素敏感。对青霉素中等耐药的菌株,青霉素G(2400万U/d静脉滴注,分4~6次给药或持续给药)、阿莫西林(200 mg·kg-1·d-1静脉滴注,分4~6次给药,或同等剂量氨苄青霉素)或头孢曲松(2 g/d静脉滴注或肌内注射,单次给药)推荐治疗 4周,联合庆大霉素(3 mg·kg-1·d-1静脉滴注或肌内注射,单次给药)2周,为NVE的标准治疗(ⅠB);而PVE标准治疗为青霉素G或阿莫西林或头孢曲松治疗6周,联合庆大霉素2周。青霉素中等耐药并对β内酰胺类抗生素过敏患者,万古霉素(30 mg·kg-1·d-1静脉滴注,2次给药)推荐治疗 4 周,联合庆大霉素(3 mg·kg-1·d-1静脉滴注或肌内注射,单次给药)2周,为NVE的标准治疗(ⅠB);而PVE标准治疗为万古霉素治疗6周,联合庆大霉素2周。
青霉素耐药的链球菌IE的治疗指南依据回顾性系列研究。汇总其中四项研究,78%(47/60)的患者用青霉素或头孢曲松钠治疗,多数联合氨基糖苷类抗生素,部分单独使用克林霉素或氨基糖苷类,多数青霉素MIC为≥1 mg/L。83%的患者治愈,10%的患者死亡。死亡与耐药性无关,但与患者本身因素有关。PVE和NVE治疗效果相似。因此青霉素耐药和敏感口腔链球菌的抗菌治疗大致相似。但是,青霉素耐药病例必须给予氨基糖苷类抗生素至少2周,不推荐短期治疗方案。高度耐药菌株(MIC≥4 mg/L)经验极少,但是这种情况可能首选万古霉素(联合氨基糖苷类抗生素)。达托霉素的经验非常有限。
1.4 肺炎链球菌和β溶血性链球菌(A、B、C和G组) 自从抗生素引入临床后肺炎链球菌IE变得非常罕见。多达30%的病例与脑膜炎有关,青霉素耐药病例需要特别考虑。青霉素敏感菌株(MIC≤0.06 mg/L)的治疗与口腔链球菌相似,而2周短期治疗例外,但未经正式研究证实。尽管部分协作组学者对耐药菌株推荐高剂量头孢菌素(如头孢噻肟或头孢曲松钠)或万古霉素,但对不合并脑膜炎的青霉素中等耐药(MIC 0.125~2 mg/L)和完全耐药菌株(MIC≥4 mg/L)治疗也同样。合并脑膜炎的病例必须避免使用青霉素,因为其向脑脊液的渗透性差,应根据抗生素敏感性更换为头孢曲松或头孢噻肟钠单药,或联合万古霉素。
链球菌A、B、C或G组IE相对罕见,包括咽峡炎链球菌群(星状链球菌、咽峡炎链球菌、中间链球菌)。链球菌A组全部对β内酰胺类敏感(MIC≤0.12 mg/L),但其他血清群可能显示某种程度的耐药。链球菌B组IE过去与围产期相关,但现在发生于其他成年人,尤其是老年人。链球菌B、C、G组和咽峡炎链球菌产生脓肿,因此可能需要手术辅助治疗。链球菌B组PVE死亡率极高,推荐心脏手术治疗。除了不推荐短期治疗外,抗生素治疗与口腔链球菌相似,应给予庆大霉素2周。
1.5 颗粒链球菌属和乏养菌属(原营养变异链球菌) 颗粒链球菌属和乏养菌属IE的慢性长期病程中,可导致较大赘生物(>10 mm),可能由于诊断和治疗的延误,并发症和瓣膜置换(约50%)的发生率较高。抗生素推荐包括青霉素G、头孢曲松或万古霉素治疗6周,至少开始2周联合氨基糖苷类抗生素。
1.6 金黄色葡萄球菌和凝固酶阴性葡萄球菌 甲氧西林敏感葡萄球菌NVE患者,(氟)氯唑西林或苯唑西林(12 g/d静脉滴注,分4~6次给药)推荐治疗4~6周,不推荐联合庆大霉素(ⅠB);对金黄色葡萄球菌的替代治疗为复方磺胺甲恶唑(磺胺甲基异恶唑4800 mg/d和甲氧苄氨嘧啶960 mg/d,分4~6剂静脉滴注,1周静滴加5周口服)联合克林霉素(1800 mg/d静脉滴注,分3剂,治疗1周)(ⅡbC)。甲氧西林敏感葡萄球菌PVE患者,(氟)氯唑西林或苯唑西林(12 g/d静脉滴注,分4~6次给药)联合利福平(900~1200 mg静脉滴注或口服,分2或3剂给药)治疗持续≥6周,同时联合庆大霉素(3 mg·kg-1·d-1静脉滴注或肌注,分 1或 2 剂给药)治疗2周,为标准治疗(ⅠB);部分专家建议(氟)氯唑西林或苯唑西林和庆大霉素使用3~5 d后开始使用利福平,而庆大霉素可每日单剂量给予以降低其肾毒性。
青霉素过敏患者(稳定的患者可以尝试青霉素脱敏)或耐甲氧西林葡萄球菌NVE患者,万古霉素(30~60 mg·kg-1·d-1静脉滴注,分 2~3 次给药)治疗4~6周(ⅠB);青霉素过敏,但甲氧西林敏感而非过敏的心内膜炎患者推荐头孢菌素类抗生素(头孢唑啉6 g/d或头孢噻肟6 g/d静脉滴注,分3次给药)治疗4~6周。替代治疗为达托霉素(10 mg·kg-1·d-1静脉滴注,每日1次)治疗4~6周(ⅡaC),部分专家建议联合氯唑西林(2 g/4 h静脉滴注)或磷霉素(2 g/6 h静脉滴注),以增加抗菌活性和避免耐药形成。对金黄色葡萄球菌的替代治疗为复方磺胺甲恶唑(磺胺甲基异恶唑4800 mg/d和甲氧苄氨嘧啶960 mg/d,分4~6剂静脉滴注,1周静滴加5周口服)联合克林霉素(1800 mg/d静脉滴注,分3次给药,治疗 1周)(ⅡbC)。
青霉素过敏患者(稳定的患者可以尝试青霉素脱敏)或耐甲氧西林葡萄球菌PVE患者,万古霉素(30~60 mg·kg-1·d-1静脉滴注,分 2~3 次给药)联合利福平(900~1200 mg静脉滴注或口服,分2或3剂给药)治疗持续≥6周,同时联合庆大霉素(3 mg·kg-1·d-1静脉滴注或肌注,分 1或 2 剂给药)2周,为标准治疗(ⅠB);部分专家建议万古霉素和庆大霉素使用3~5 d后开始使用利福平,庆大霉素可每日单剂量给予以降低肾毒性。青霉素过敏,甲氧西林敏感而非过敏反应的患者可推荐头孢菌素类抗生素(头孢唑啉6 g/d或头孢噻肟6 g/d静脉滴注,分3次给药)联合利福平治疗6周,同时联合庆大霉素2周。
金黄色葡萄球菌导致急性和破坏性IE,而凝固酶阴性葡萄球菌(CoNS)导致更长期的瓣膜感染(除里昂葡萄球菌和部分头葡萄球菌病例)。显然,葡萄球菌感染的NVE不再推荐联合氨基糖苷类抗生素,由于增加肾毒性。无并发症的甲氧西林敏感金黄色葡萄球菌感染的右侧自体瓣膜IE推荐短期(2周)和口服治疗,但这些方案不能用于左心系统IE。甲氧西林敏感金黄色葡萄球菌IE,如果青霉素过敏,稳定的患者可尝试青霉素脱敏;由于万古霉素效果不如β内酰胺类抗生素故不应给予。β内酰胺类抗生素不能使用时,如果达托霉素可用则可选择并联合另一种有效的抗葡萄球菌药物,以增加抗菌活性并避免耐药产生。某些专家推荐高剂量复方新诺明和克林霉素联合作为金黄色葡萄球菌IE的一种替代治疗。里昂葡萄球菌通常对甲氧西林敏感,可用氯唑西林治疗。
金黄色葡萄球菌感染的PVE死亡率风险非常高(>45%),常常需要早期瓣膜置换。与NVE的其他差别包括:总体疗程长,需联合使用氨基糖苷类抗生素,以及菌血症一旦消除则有效抗生素治疗3~5 d后加用利福平。支持这一推荐的理论基础是利福平与抗生素联合治疗浮游或复制细菌具有拮抗作用,但对生物瓣膜上的休眠菌具有协同作用;在异物感染模型、假肢矫形和人工血管感染临床方面证实该作用。虽然证据级别低,但对葡萄球菌感染PVE的治疗中,联合利福平已成为临床实践的标准治疗,尽管治疗可能导致微生物耐药性、肝毒性和药物间相互作用。
1.7 甲氧西林和万古霉素耐药的葡萄球菌 耐甲氧西林金黄色葡萄球菌(MRSA)产生低亲和力青霉素结合蛋白2a(PBP2a),导致对大多数β内酰胺类抗生素交叉耐药。MRSA通常对多种抗生素耐药,以致于只有万古霉素与达托霉素治疗重症感染。但是万古霉素中介耐药金黄色葡萄球菌(MIC 4~8 mg/L)和异质性万古霉素中介耐药金黄色葡萄球菌(MIC≤2 mg/L,但有亚群在较高的万古霉素浓度下生长)在世界范围的出现,导致IE治疗的失败。而且近年来万古霉素高度耐药的某些菌株从感染患者获得分离,需要新的治疗方法。另外1996-2011年发表的系统文献回顾和荟萃分析显示,对万古霉素敏感菌株(MIC≤2 mg/L)的MRSA菌血症患者,万古霉素MIC较高(≥1.5 mg/L)则导致较高的死亡率。达托霉素是一种脂肽类抗生素,批准用于金黄色葡萄球菌菌血症和右心IE。金黄色葡萄球菌和CoNS感染性心内膜炎的队列研究显示,达托霉素至少和万古霉素一样有效。两项高万古霉素MICs(>1 mg/L)MRSA的菌血症队列研究发现,达托霉素较万古霉素产生更好的预后(包括生存)。重要的是,达托霉素需要给予合适的剂量,以及联合其他抗生素以避免IE患者进一步耐药的产生。因此,达托霉素应大剂量给予(≥10 mg/kg);并且多数专家推荐,联合β内酰胺类或磷霉素用于NVE患者[β内酰胺类(以及可能磷霉素)降低细菌表面正电荷而增加达托霉素的膜结合],联合庆大霉素和利福平用于PVE患者。
其他方法包括磷霉素联合亚胺培南,PBP2a亲和力比较好的新型β内酰胺类如头孢洛林,奎奴普丁-达福普汀联合和不联合β内酰胺类,β内酰胺类+恶唑烷酮(利奈唑胺),β内酰胺类抗生素联合万古霉素和高剂量的复方新诺明、克林霉素。这种病例需确保有一位感染科专家协同治疗。
1.8 肠球菌属 β内酰胺类和庆大霉素敏感菌株:阿莫西林(200 mg·kg-1·d-1静脉滴注,分 4~6 次给药,或同等剂量的氨苄青霉素)治疗4~6周,联合庆大霉素(3 mg·kg-1·d-1静脉滴注或肌注,单剂给药)2~6周(部分专家推荐庆大霉素仅给药2周为ⅡaB类推荐),为ⅠB类推荐;但对症状>3周或PVE的患者推荐阿莫西林或氨苄青霉素治疗6周联合庆大霉素2~6周或2周。氨苄青霉素(200 mg·kg-1·d-1静脉滴注,分4~6次给药)联合头孢曲松钠(4 g/d静脉滴注或肌注,分2剂给药),持续治疗6周(ⅠB);该联合用药对有和无HLAR的粪肠球菌菌株有效,是HLAR粪肠球菌IE的联合选择,但对屎肠球菌无效。万古霉素(30 mg·kg-1·d-1静脉滴注,分 2剂给药)联合庆大霉素(3 mg·kg-1·d-1静脉滴注或肌注,单剂给药)治疗6周(ⅠC)。
对庆大霉素高水平耐药(MIC>500 mg/L)推荐:如果对链霉素敏感,使用链霉素替代庆大霉素,剂量为15 mg·kg-1·d-1分两等分剂量给药。β内酰胺类耐药推荐:①如果是由于β内酰胺酶的产生,用氨苄西林/舒巴坦替代氨苄西林,或用阿莫西林克拉维酸替代阿莫西林;②如果由于PBP5变异,使用万古霉素为基础的治疗方案。对氨基糖苷类、β内酰胺类和万古霉素多种药物耐药推荐的替代方案为:①达托霉素10 mg·kg-1·d-1联合氨苄西林200 mg·kg-1·d-1静脉滴注,分 4~6 剂给药;②利奈唑胺2×600 mg/d静脉滴注或口服,持续≥8周(ⅡaC)(监测血液学毒性);③喹奴普丁-达福普汀3×7.5 mg·kg-1·d-1持续使用≥8 周,喹奴普丁-达福普汀对粪肠球菌无效;④对于其他联合用药(达托霉素联合厄他培南或头孢洛林),请感染病专家会诊。
肠球菌IE主要由粪肠球菌导致(占90%的病例),比较罕见的是屎肠球菌(占5%的病例)或其他。以致于出现两个主要问题:首先,肠球菌对抗生素杀灭高度耐药,感染消除需要两种细胞壁抑制剂联合(氨苄青霉素加头孢曲松钠,抑制互补的青霉素结合蛋白而协同)或一种细胞壁抑制剂与氨基糖苷类抗生素联合长时间(达6周)使用协同杀菌;其次,其可能对多种药物耐药,包括氨基糖苷类[高水平氨基糖苷类耐药,high-level aminoglycoside resistance(HLAR)]、β 内酰胺类(通过青霉素结合蛋白5修饰,有时β内酰胺酶)和万古霉素。
青霉素完全敏感菌株(青霉素MIC≤8 mg/L)用青霉素G或氨苄青霉素(或阿莫西林)联合庆大霉素。氨苄青霉素(或阿莫西林)可能首选,由于MICs低2~4倍。常见的情况是粪肠球菌和屎肠球菌对庆大霉素均耐药。如果氨基糖苷类MIC>500 mg/L(HLAR)则导致与细菌细胞壁抑制剂的协同杀菌作用消失,此时不应使用氨基糖苷类。这种情况链霉素可能仍然具有活性,并为一种良好选择。
近年来有两项重要进展。第一,多数粪肠球菌IE队列研究显示(包括数百例患者的研究),对非HLAR粪肠球菌IE,氨苄青霉素加头孢曲松钠与氨苄青霉素加庆大霉素同样有效,其无肾毒性更安全;另外也是治疗HLAR粪肠球菌IE的联合用药选择。其次,庆大霉素每日总量可以每日单剂给予,而非迄今推荐的二或三等份剂量给药,非HLAR粪肠球菌IE的疗程可由4~6周安全地缩短至2周,将肾毒性发生率降至极低水平。
β内酰胺类和万古霉素耐药主要见于屎肠球菌。由于双重耐药罕见,β内酰胺类用于万古霉素耐药菌株,反之亦然。奎奴普丁-达福普汀(对粪肠球菌无效)、利奈唑胺、达托霉素(联合氨苄青霉素、厄他培南或头孢洛林)报道的耐药结果差异大。不过这些情况需要一位感染疾病专家指导。
1.9 革兰阴性菌
1.9.1 HACEK相关菌种 HACEK革兰阴性杆菌是苛养菌,实验室应注意考虑这些细菌的感染,可能需要专家研究探讨。由于其生长缓慢,所以标准的MIC试验可能很难解释。某些HACEK组杆菌产生β内酰胺酶,所以氨苄青霉素不再是一线药物选择。相反,其对头孢曲松、其他第三代头孢菌素和氟喹诺酮类药物敏感,标准治疗是NVE头孢曲松2 g/d持续4周,而PVE持续6周。如果其不产β内酰胺酶,氨苄西林(12 g/d静脉滴注,分4或6剂给药)联合庆大霉素(3 mg·kg-1·d-1分 2或 3剂给药)持续4~6周为一种治疗选择。环丙沙星400 mg/8~12 h静脉滴注或750 mg/12 h口服是一种未充分验证的替代治疗。
1.9.2 非HACEK菌种 国际心内膜炎合作组织(international collaboration on endocarditis,ICE)报道,IE病例中1.8%为非HACEK革兰阴性菌。推荐治疗为早期手术,以及β内酰胺类和氨基糖苷类联合用药长时间(至少6周)杀菌治疗,有时另加氟喹诺酮类或复方新诺明。体外杀菌实验和抗生素血清浓度监测可能有用。由于其罕见以及病情严重性,此种临床情况应进行心内膜炎团队讨论或与感染病专家讨论。
1.10 血培养阴性感染性心内膜炎(BCNIE) 血培养阴性感染性心内膜炎的主要原因总结于其他文章。治疗选择如表1。推荐与心内膜炎团队中的一位感染病专家讨论。
1.11 真菌 PVE、静脉注射吸毒者IE和免疫功能低下的患者真菌非常常见。念珠菌和曲霉菌占主导,后者导致BCNIE。死亡率非常高(>50%),治疗需要抗真菌药联合手术瓣膜置换治疗。念珠菌IE的抗真菌治疗包括两性霉素B脂质体(或其他脂质配方)联合或不联合高剂量氟胞嘧啶或一种棘白菌素;对曲霉菌伏立康唑是选择的药物,某些专家推荐加用一种棘白菌素或两性霉素B。推荐口服抑制性唑类药物长期治疗(念珠菌用氟康唑而曲霉菌用伏立康唑),有时推荐终身治疗。推荐与心内膜团队的一位感染病专家讨论。
1.12 经验性治疗 IE的治疗应尽早开始。抗生素治疗前应每间隔30 min抽取3份血培养。经验性治疗最初的选择基于多种考虑:①患者以前是否接受过抗生素治疗。②感染是否累及到自身瓣膜或人工瓣膜;如果累及,明确瓣膜手术进行的具体时间(早期还是晚期PVE)。③感染的地点(社区、医院或非医院医疗保健相关的IE)和当地流行病学知识,尤其抗生素耐药和特异性血培养阴性病原菌(如表1)。④氯唑西林/头孢唑啉较其他β内酰胺类治疗死亡率低,包括阿莫西林-克拉维酸或氨苄西林/舒巴坦,以及万古霉素经验性治疗甲氧西林敏感金黄色葡萄球菌菌血症或心内膜炎。
急性患者经验性治疗建议的方案总结如表2。NVE和晚期PVE的治疗方案应覆盖葡萄球菌、链球菌和肠球菌;早期PVE或医疗相关IE的治疗方案应覆盖耐甲氧西林葡萄球菌、肠球菌,以及最好包括非HACEK革兰阴性菌。一旦病原体确定(通常<48 h),抗生素治疗必须符合其药敏情况。
1.13 门诊静脉抗生素治疗(OPAT)IE 一旦重症感染的相关并发症(如瓣周脓肿、急性心力衰竭、感染性栓塞和中风)得到控制,使用门诊静脉抗生素治疗以巩固抗菌治疗。抗生素治疗过程可以分为两个不同的阶段:第一,重症期(最初治疗2周)。该期间OPAT受限制。第二阶段,持续治疗期(2周治疗后)。此时OPAT可能合适。当考虑OPAT治疗IE时,核心问题如下。
确定OPAT感染性心内膜炎的适用性标准如下。重症期(0~2周):并发症发生于该期,此阶段首选住院治疗,如果是口腔链球菌、牛链球菌(其他病原体推荐与感染科专家讨论)、自身瓣膜(晚期PVE推荐与感染科专家讨论)、病情稳定、无并发症患者考虑OPAT。持续治疗期(2周后):如果药物治疗稳定考虑OPAT,如果出现心力衰竭、相关超声心动图特征、神经系统体征或肾损伤则不考虑OPAT。OPAT必需的关键要素为:培训患者和医务人员,定期出院后评估(护士每天评估1次,主管医生每周评估1或2次,最好为心内膜炎团队医生,必要时全科医生每周巡查患者一次),优选医生指导的方案,而非家中输液模式。

表1 血培养阴性感染性心内膜炎的抗生素治疗
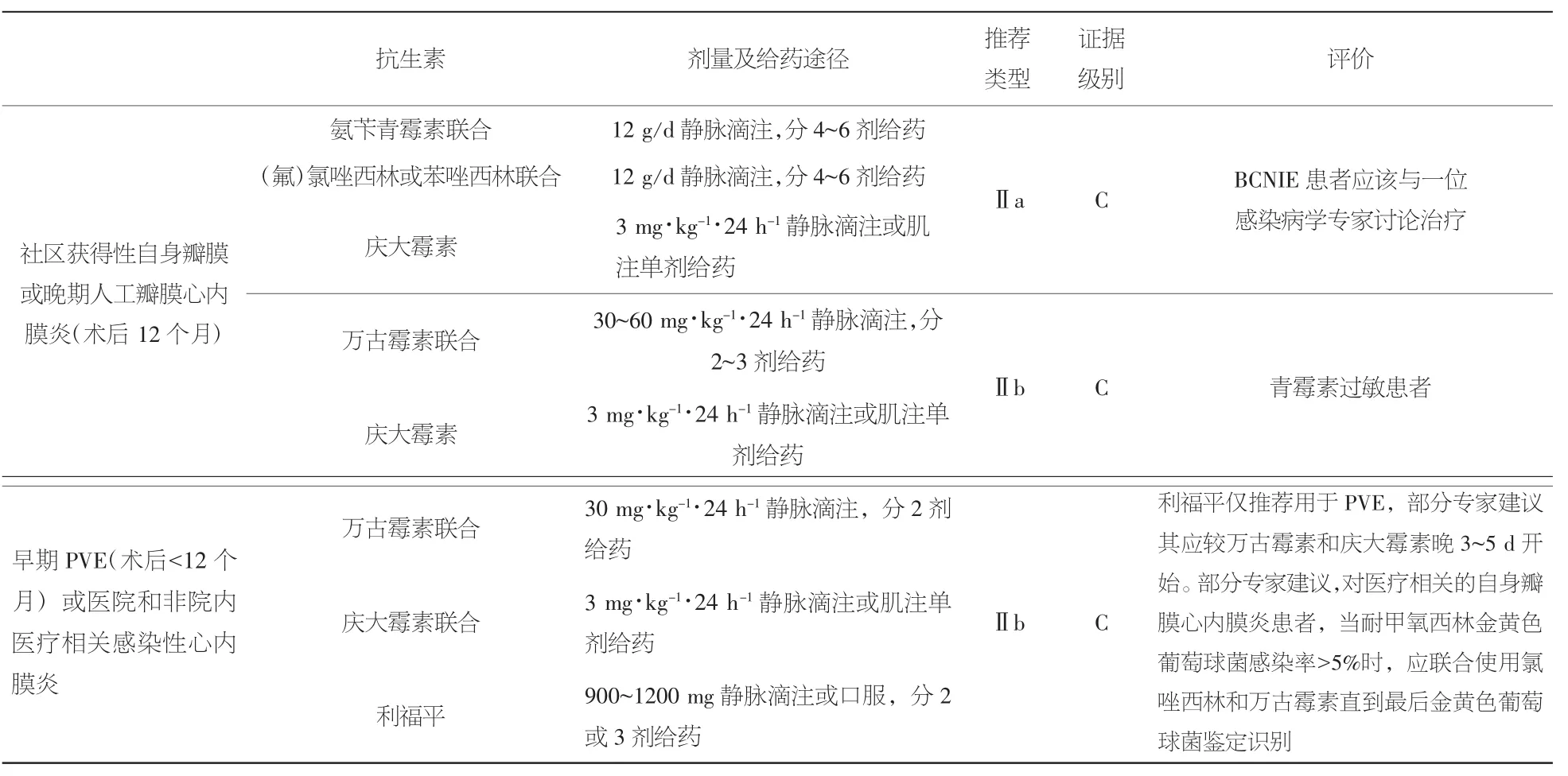
表2 感染性心内膜炎急性严重患者经验性治疗的最初抗生素治疗方案(病原体确定前)
2 手术治疗:原则和方法
2.1 手术风险评估 几乎没有研究专门评价IE患者手术风险计分的适用性。虽然EuroSCOREⅡ经常使用,但其主要是为冠脉旁路移植和瓣膜手术开发和验证的。开发的IE手术特定风险计分系统:①来自胸外科协会数据资料的13 617例患者;②De Feo等单中心440患者的另外一项NVE风险计分系统。一项146例患者的研究,比较了这些现代计分系统对IE手术后死亡率和并发症发病率的预测效果。虽然EuroSCOREⅡ可预测死亡率和术后并发症的发病率(尤其卒中),但胸外科协会心内膜炎计分系统和De Feo计分系统可更好预测活动性IE手术死亡率。但是这些应用由于患者数量少而受到限制。与既往研究相似,术前使用正性肌力药物或主动脉内球囊反搏、既往冠脉旁路移植术,以及肾功能衰竭需要透析,均为手术和长期死亡的独立预测因素。
最后,虽然没有一项完美的手术风险计分系统,但是手术风险的术前评价是至关重要的。尽管IE的理论适应证明确,但临床实际应用很大程度上依赖于患者的临床状况、伴发病及手术风险。
2.2 术前和围手术期管理 冠状动脉造影:依据ESC瓣膜性心脏病治疗指南,>40岁的男性、绝经后女性、具有至少一项心血管风险因素的患者和既往冠心病患者,推荐冠状动脉造影。例外的情况是导管检查时主动脉瓣赘生物可能发生脱落或需要急诊手术。发生这些情况时,对血流动力学稳定的患者进行高分辨率CT检查能够排除有意义的冠状动脉疾病。
心脏外感染:一旦导致IE的原发病灶明确,手术前必须根除,除非瓣膜手术紧急。但无论如何,抗生素治疗结束前应根除原发感染灶。
术中超声心动图:术中经食管超声心动图(TOE)对确定感染的确切部位和范围、指导手术以及评价结果十分有用,并有助于术后早期随访。
2.3 手术方法和技术 手术的两个主要目的是完全切除感染组织和心脏形态学重建,包括受累瓣膜的修复和置换。只要感染局限于瓣尖或瓣叶,可使用任何方法修复或置换瓣膜。应尽可能修复瓣膜,尤其是IE累及二尖瓣或三尖瓣并无严重损害者。单一瓣尖或瓣膜穿孔,可以使用未处理或戊二醛处理的自体或牛心包补片修复。单一或多个断裂的腱索可用聚四氟乙烯新腱索置换。单一瓣膜更广泛的损害或脓肿并不一定为瓣膜修复的禁忌证。然而,为了评价剩余瓣膜组织是否足够结实可获得持久修复,清创后术中的瓣膜评价是至关重要的。需要补片才能恢复良好功能的瓣膜,无论心包、三尖瓣自体移植物或翻转二尖瓣补片,依据术后IE复发和二尖瓣返流情况,由经验丰富术者进行时术后效果不差。为了避免局部感染失控复杂病例的瓣周漏,应该彻底切除感染和坏死的组织,随后进行瓣膜置换或相应缺损的修补,以确保瓣膜稳固。
机械和生物瓣膜具有相似的手术死亡率,因此指南写作组并未支持哪一种人工瓣膜,但推荐对每一患者和不同临床情况进行个体化选择。人工材料使用应尽量少。小的脓肿可直接缝合,但较大的孔洞应引流至心包或血循环系统。
由经验丰富团队进行二尖瓣IE手术,80%患者可获得成功的瓣膜修复,但是非专业中心不可能获得此种结果。如果不合并心力衰竭同时抗生素治疗感染得到明显控制,手术可以延期。但是最近报道早期手术修复率达61%~80%,改善了住院和长期生存率。术中应通过TOE评价残余二尖瓣返流。二尖瓣环下、二尖瓣环或瓣环上组织缺损最好用自体或牛心包修补,但如果需要则随后使用人工瓣膜以确保瓣环重建或加固。技术的选择取决于病变或组织缺损的垂直延伸。有人建议使用二尖瓣同种移植物或肺动脉自体移植物(RossⅡ手术)修复,但是由于可用性差以及手术技术困难其应用受到限制,效果并不完全一致。
对于主动脉瓣IE,机械或生物主动脉瓣置换是选择的技术。但是技术水平高的中心,多达33%患者能够实现IE主动脉瓣的修复。而该领域主动脉瓣修复的经验仍然非常有限,而且无证据显示瓣膜修复较置换可改善预后。由于生物天然的相容性,建议使用冷冻或消毒的同种移植体,以降低持续或反复感染的风险,尤其瓣环脓肿。多数学术机构的专家意见和标准策略建议,同种移植物较人工瓣膜更优选,尤其主动脉根部脓肿。但是如果需要环形脓肿彻底清创,依据术后持续或复发感染和生存情况评价,人工机械瓣膜和异种移植物的效果相似。PVE或广泛主动脉根部破坏导致主动脉心室连续性中断的患者,可能优先选用同种移植物或无支架异种移植物。主动脉同种移植物的二尖瓣前叶可有效用于流出道的重建。对于广泛双瓣膜IE,建议主动脉-二尖瓣整套同种移植物为手术的选择。经验丰富的术者,Ross手术可用于儿童或青少年以促进生长或用于年轻成人以利于持久耐用。个别特殊病例反复手术不能根除持续或复发性PVE,可以考虑心脏移植。
2.4 术后并发症 术后治疗应遵循瓣膜手术后的通常推荐,但也应考虑IE的特性。术后随访应特别谨慎,多数系列研究显示急性IE进行急诊或亚急诊手术患者的院内死亡率为10%~20%,术后并发症风险高。最常见的并发症是严重凝血功能障碍需凝血因子治疗,出血或心包填塞而需再次开胸探查,急性肾功能衰竭需透析治疗,卒中、低心排血量综合征、肺炎、主动脉根部脓肿根治性切除术后房室传导阻滞需要起搏器植入。术前心电图显示左束支传导阻滞预示术后需要永久性心脏起搏器。当患者不能渡过手术,死亡原因常是多因素的。
Interpretation of 2015 ESC Guidelines for the management of infective endocarditis
Endocarditis; Infection; Guidelines; Antimicrobial therapy; Cardiac surgery
北京市卫生系统高层次卫生技术人才培养项目资助(项目编号:2009-3-68)
102600 北京市,首都医科大学大兴教学医院心内科(梁峰);北京大学人民医院心脏中心(胡大一);中国协和医科大学北京协和医院心内科(沈珠军、方全)
方全,E-mail:fangquan@gmail.com
10.3969/j.issn.1672-5301.2017.04.004
R542.4+1
A
1672-5301(2017)04-0302-08
2016-10-29)

