微小核糖核酸592对神经胶质瘤细胞株U251细胞凋亡影响的机制
吉文玉 蔡宁 杨思培
微小核糖核酸592对神经胶质瘤细胞株U251细胞凋亡影响的机制
吉文玉 蔡宁 杨思培
目的 探讨微小核糖核酸592(miR-592)对神经胶质瘤细胞株U251凋亡的影响。方法 首先通过定量聚合酶链反应(PCR)分析miR-592在28份神经胶质瘤与其临近癌旁组织中的表达水平;随后向U251细胞转染miR-592的拟合物,并通过流式细胞技术分析miR-592过表达对U251细胞凋亡的影响;通过生物信息学分析找到miR-592的潜在靶分子,并通过荧光素酶双报告实验以及蛋白免疫印迹法等进行验证;进一步转染U251细胞Runx2的下调siRNA,绘制细胞的生长曲线,检测U251细胞的凋亡率。结果 对28份神经胶质瘤组织和正常组织的定量PCR分析发现,miR-592在肿瘤组织中明显低表达; miR-592过表达能明显抑制U251细胞的生长;流式细胞分析显示,miR-592显著促进U251细胞凋亡:对照组晚期凋亡率为(7.2±0.68)%,而转染miR-592组晚期凋亡率为(17.47±1.45)%;荧光素酶双报告实验以及蛋白免疫印迹法实验发现miR-592直接靶向Runx2的3’-UTR来抑制Runx2蛋白的表达水平。结论 miR-592通过直接靶向Runx2来诱导神经胶质瘤细胞凋亡,进而抑制细胞生长。
神经胶质瘤 U251 miR-592 凋亡 Runx2
神经胶质瘤是最为常见的原发性中枢神经系统肿瘤。50%~60%的脑部恶性肿瘤都是胶质瘤[1]。对神经胶质瘤现有的治疗策略主要是手术治疗、放射治疗、化学治疗或其他方式的辅助性治疗[2-4]。然而,高转移率和对放化疗的耐受性使得胶质瘤的预后效果都很差[5-7]。我们的研究发现,微小核糖核酸592(miR-592)在胶质瘤组织中相对于癌旁组织明显表达降低。为了进一步探究miR-592在胶质瘤细胞中作用机制,本研究应用miR-592 mimics上调miR-592在胶质瘤细胞中U251中的表达水平,探讨其对胶质瘤细胞生长和凋亡的影响,并进一步通过实验寻找miR-592的靶分子。
1 材料与方法
1.1 实验材料
胶质瘤细胞U251细胞为苏州医科大学附属第二医院中心实验室自有,28份神经胶质瘤和癌旁组织为苏州医科大学附属第二医院自2012年4月~2015年7月所收集神经胶质瘤样本,均经病理检查证实,且已经过患者或家属知情同意。RPMI-1640培养基和FBS为美国Gibco公司产品,噻唑蓝、二甲基亚砜(DMSO)为美国Sigma公司产品,Runx2单克隆抗体购自于Abcam公司,荧光素酶检测试剂盒购自于Promega公司,酶标检测仪为德国MD公司产品,Lipofectamine 2000、Trizol为美国Invitrogen公司产品,miR-592 mimics和siRNA购自于上海吉凯基因公司,miR-592和Runx2定量检测试剂盒为德国QIAGEN公司产品。实时定量聚合酶链反应试剂盒为美国ABI产品,流式细胞仪为美国BD公司产品,PI和Annexin V凋亡染色试剂盒也为美国BD公司产品,其他相关质粒为实验室自有。
1.2 方法
1.2.1 细胞培养 人胶质瘤细胞U251以10%的胎牛血清RPMI-1640或DMEM培养基,在37 ℃、5%CO2、相对湿度为90%的培养箱中培养;用0.25%的胰酶消化,每2 d换液传代。
1.2.2 细胞增殖实验(噻唑蓝) 以每孔10 000个细胞接种于96孔板中,每组设3个复孔;细胞贴壁后向细胞转染100 nmol/L的miR-592 mimics或者Runx2的siRNA,以随机序列的mimic作为实验对照,Runx2的siRNA序列为Runx2 siRNA:5′-GCACGCUAUUAAAUCCAAATT-3′;12 h后进行第1次检测,每孔加入5 g/L的噻唑蓝液20 μl,继续培养到4 h后去掉培养基,加入DMSO 150 μl,用酶标仪在490 nm检测吸光值;分别于转染后12、24、36和48 h测定吸光度(A)值;根据测得的A值绘制生长曲线。
1.2.3 RNA提取及实时定量聚合酶链反应(qRT-PCR) 所有样本用液氮在研钵中研磨,用TRzol提取总RNA,并通过酶标仪测RNA浓度,A260/A280为1.8~2.0;将RNA样本稀释成2 ng/μl,按照说明书配置成15 μl的逆转录体系进行逆转;取其中2 μl作为模板配置成20 μl体系进行定量PCR验证;反应条件为95 ℃ 10 min预变性,95 ℃ 15 s→60 ℃ 30 s进行40个循环,反应结束后得到各个标本和内参GAPDH的Ct 值。计算公式为ΔCt=Ct-CtGAPDH,ΔΔCt=ΔCt(T)-ΔCt(N),相对表达计算公式为2-ΔΔCt。定量引物均购自QIAGEN公司, 序列为Runx2上游引物:5′-GACCAGTCTTACCCCTCCTACC-3′,Runx2下游引物:5′-CTGCCTGGCTCTTCTTACTGAG-3′;GAPDH上游引物:5′-GAGAGACCCCACTTGCTGCCA-3′,GAPDH下游引物:5′-CTCACACTGCCCCTCCCTGGT-3′。
1.2.4 流式细胞技术 以每孔10 000个细胞接种于96孔板中,每组设3个复孔;向细胞转染100 nmol/L的miR-592 mimics或100 nmol/L的Runx2 siRNA,以随机的mimic作为实验对照,序列如前所述;48 h后用胰酶消化制成单细胞悬液,PBS洗涤3次;按说明书操作进行PI/Annexin V染色细胞,避光染色20 min,流式细胞仪检测各组细胞的凋亡率,实验重复3次,每次3个复孔。采用FlowJo软件进行分析。
1.2.5 蛋白免疫印迹实验 加入200 μl RIPA 缓冲液冰上20 min裂解细胞;加入50 μl 5X SDS-PAGE上洋缓冲液,煮沸10 min后进行SDS-PAGE转膜,10%BSA溶液封闭,加入稀释好的抗体工作液,4 ℃过夜孵育,TBST洗膜3次;再加入HRP标记的抗人IgG二抗,TBST洗膜3次后加上化学发光底物,于暗室内压片、曝光、显影和定影。
1.2.6 荧光素酶双报告实验 以每孔2.0×105个293T细胞接种于24孔板;培养24 h后用lipofectamine2000将报告质粒和miR-592 过表达质粒共转染于293T细胞,并同步共转入pRL-TK作为对照质粒,用量分别为报告质粒0.4 μg,miR-592过表达质粒0.4 μg,pRL-TK质粒0.05 μg;转染后6 h换完全培养基,48 h后去上清,用PBS洗涤而得干净的上清,随后用lysis buffer冰上裂解细胞,收集上清用于荧光素酶活性检测(试剂盒购自于Promega)。计算方法为荧光素酶活性=萤火虫荧光素酶读值/海肾荧光读值。
1.2.7 裸鼠肿瘤模型建立 购买8周龄的BALB/c (nu/nu)裸鼠(上海斯莱克),随机分成3组,每组各5只;分别皮下接种miR-592稳定表达的U251细胞、Runx2 siRNA稳定表达的U251细胞(细胞系均由上海吉凯基因公司制备),以正常U251细胞作为对照,细胞接种量均为6.0×106/只;于接种后每隔5 d游标卡尺测定肿瘤大小,以1/3×长径×短径2计算肿瘤体积,并于接种后第50 d处死小鼠,绘制肿瘤生长曲线。
1.2.8 统计学处理
2 结 果
2.1 miR-592促进U251细胞凋亡
定量PCR分析显示miR-592在神经胶质瘤组织中的相对表达水平明显下降(图1)。过表达miR-592能明显抑制U251细胞生长。流式细胞实验对U251细胞的凋亡率检测显示miR-592能显著上调细胞凋亡率(图1,表1)。
2.2 Runx2是miR-592在U251细胞中的直接靶分子 生物信息学分析发现miR-592能直接靶向Runx2的3’-UTR。荧光素酶双报告实验也显示miR-592显著抑制带有Runx2的3’-UTR的荧光素酶的活性(图2)。定量PCR分析显示Runx2的相对表达在肿瘤组织中明显上调(图2)。western blot的方法显示miR-592抑制Runx2的蛋白水平(图2)。

表1 各组U251细胞凋亡率,%)
注:与对照组比较,*P<0.01

图1 miR⁃592促进U251细胞凋亡 A为miR⁃592在肿瘤和癌旁组织中的表达水平;B为转染mimics后miR⁃592的表达水平;C为MTT检测U251细胞生长;D为流式细胞仪检测miR⁃592过表达后U251细胞周期
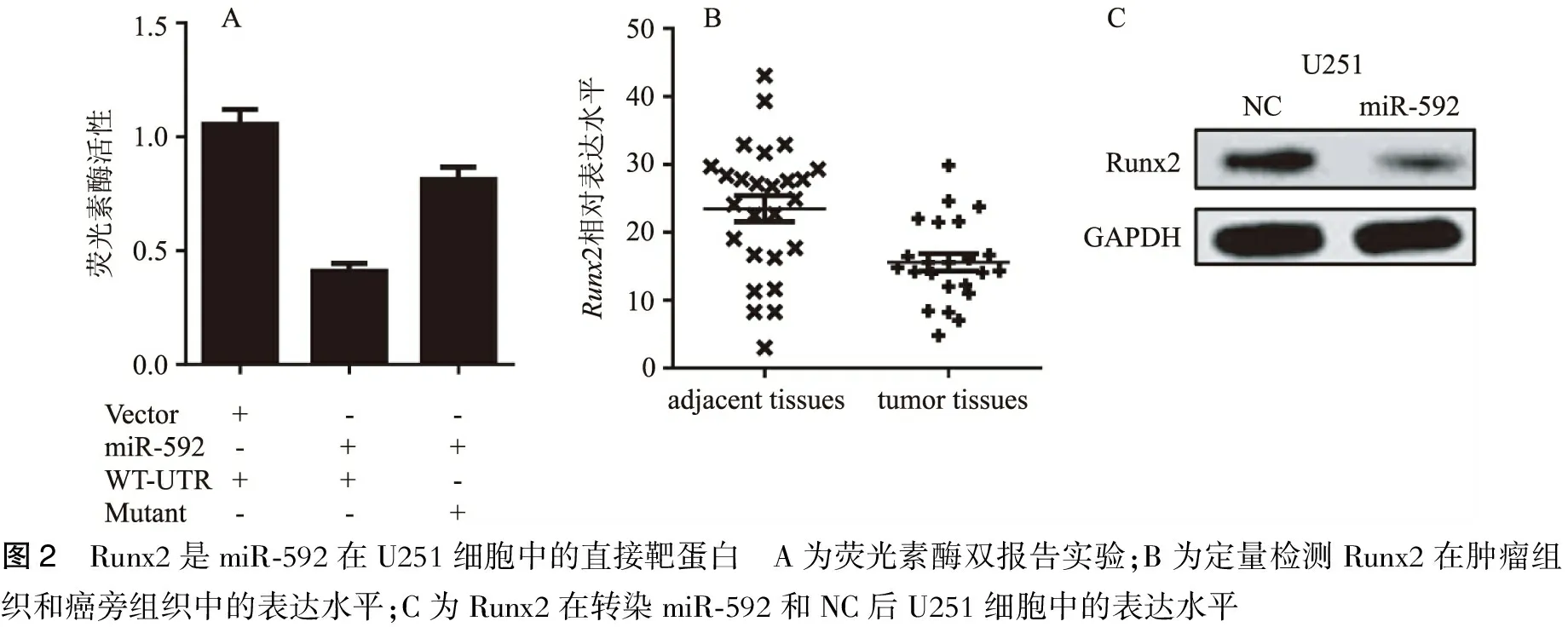
图2 Runx2是miR⁃592在U251细胞中的直接靶蛋白 A为荧光素酶双报告实验;B为定量检测Runx2在肿瘤组织和癌旁组织中的表达水平;C为Runx2在转染miR⁃592和NC后U251细胞中的表达水平
2.3 下调Runx2表达水平抑制U251细胞生长并促进细胞凋亡 显示转染了Runx2 siRNA的细胞生长明显较对照组慢(图3)。流式细胞技术检测显示,Runx2下调表达上调U251细胞的凋亡率(图3和表2)。
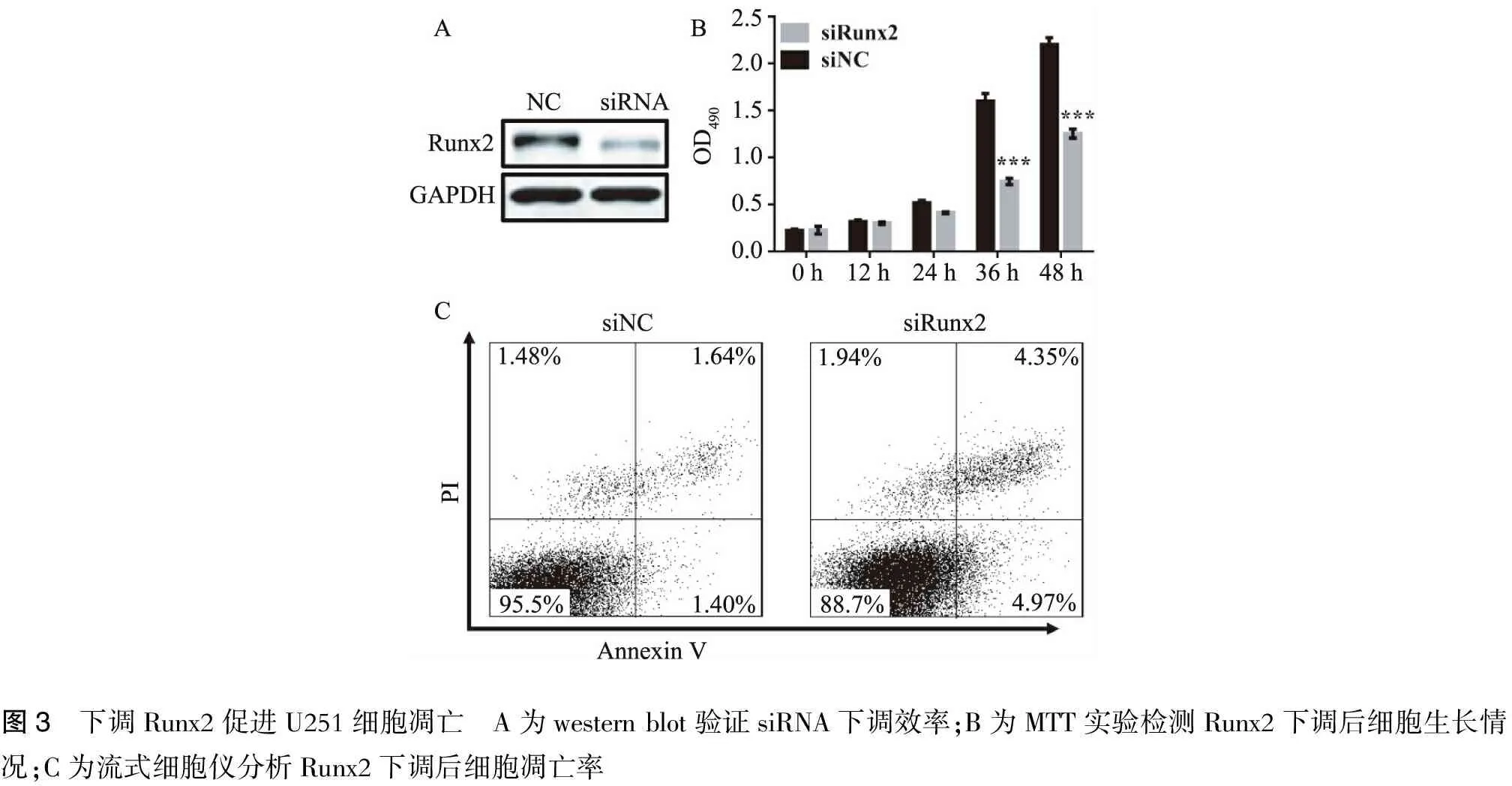
图3 下调Runx2促进U251细胞凋亡 A为westernblot验证siRNA下调效率;B为MTT实验检测Runx2下调后细胞生长情况;C为流式细胞仪分析Runx2下调后细胞凋亡率

表2 转染siRunx2的U251细胞的凋亡率,%)
注:与对照组比较,*P<0.05
2.4 miR-592通过靶向Runx2调控U251的肿瘤的生长 通过绘制肿瘤的生长曲线发现,miR-592过表达明显抑制肿瘤的生长(图4)。Runx2的下调表达也明显抑制肿瘤的生长(图4)。

图4 miR⁃592靶向Runx2抑制U251肿瘤的生长
3 讨 论
microRNA是一类长度约为22个碱基的非编码RNA。虽然microRNA在哺乳动物细胞中的总体数量很少,但是它们却调节了大约30%的基因。microRNA通过靶向目的分子的3’-UTR来调节mRNA的水平,从而进一步调节蛋白的表达水平[8-9]。诸多文献报道指出microRNA在肿瘤的发生发展过程中起着各种各样非常重要的作用[10-13]。本研究发现,miR-592在神经胶质瘤组织中的表达显著下调。合成miR-592的mimics并转染U251细胞来过表达miR-592,MTT实验结果显示过表达miR-592显著抑制细胞生长。流式细胞术检测表明,过表达miR-592上调U251细胞的凋亡率。这些结果表明,miR-592在神经胶质瘤细胞中发挥着肿瘤抑制基因的功能。
Runx2是Runt相关转录因子家族的重要成员[14],它可以形成核心结合因子(CBF)复合物结合到DNA序列上,从而达到对基因表达的调控作用[15]。越来越多的研究表明Runx2在包括胶质瘤在内的多种肿瘤中都有表达。Runx2的高表达能促进肿瘤的生长、转移和浸润[16],而下调Runx2的表达又可以抑制肿瘤的生长和发生发展[17]。这些结果表明Runx2发挥着肿瘤抑制因子的功能。应用荧光素酶双报告实验发现,miR-592能直接和Runx2的UTR结合。在肿瘤组织中Runx2的表达也明显上调,western blot实验结果也显示过表达miR-592的U251细胞的Runx2的表达水平明显下调。以上结果表明,Runx2是miR-592在U251细胞中的直接靶分子。
为了进一步研究Runx2是否是miR-592在U251细胞中的功能性靶分子,本研究通过siRNA特异性的沉默Runx2的表达。MTT实验结果表明,下调Runx2显著抑制U251细胞的生长,其凋亡水平也明显上调。这个结果表明,Runx2是miR-592在U251细胞中的功能性靶蛋白。
综上所述,miR-592通过直接靶向Runx2促进凋亡来抑制U251细胞生长。
[1] Shipman L.Glioma:tumour cell teamwork[J].Nature reviews Cancer,2015,16(1): 2.doi:10.1038/nrc.
[2] Furnari FB,Fenton T,Bachoo RM,et al.Malignant astrocytic glioma:genetics,biology,and paths to treatment[J].Genes Dev,2007,21(21):2683-2710.
[3] 郝俊海,杨军.神经胶质瘤相关长链非编码RNA的研究进展[J].中华神经外科杂志,2016,32(1):1001-2346.
[4] 王伟民.重视神经胶质瘤手术治疗的方法研究[J].中华神经外科杂志,2008,24(4):312-313.
[5] Castro MG,Lowenstein PR.NEURO-ONCOLOGY the long and winding road-gene therapy for glioma[J].Nat Rev Neurol,2013,9(11):609-610.
[6] Hashizume R,Andor N,Ihara Y,et al.Pharmacologic inhibition of histone demethylation as a therapy for pediatric brainstem glioma[J].Nat Med,2014,20(12):1394-1396.
[7] Reardon DA,Wen PY.GLIOMA IN 2014 unravelling tumour heterogeneity -implications for therapy[J].Nat Rev Clin Oncol,2015,12(2):69-70.
[8] Iorio MV,Croce CM.MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. A comprehensive review[J].EMBO Mol Med,2012,4(3):143-159.
[9] Wang C,Ji B,Cheng B,et al.Neuroprotection of microRNA in neurological disorders(Review)[J].Biomedical reportsdoi:10.3892/br,2014,2(5):611-619.
[10]Dadiani M,Bossel BN,Paluch SS,et al.Tumor evolution inferred by patterns of microRNA expression through the course of disease,therapy,and recurrence in breast cancer[J].Clin Cancer Res,2016,14(5):132-135.
[11]Gong XE,Zhou WJ,Chai YQ,et al.MicroRNA-induced cascaded and catalytic self-assembly of DNA nanostructures for enzyme-free and sensitive fluorescence detection of microRNA from tumor cells[J].Chemical Communications,2016,52(12):2501-2504.
[12]Kuninty PR,Schnittert J,Storm G,et al.MicroRNA targeting to modulate tumor microenvironment[J].Frontiers in oncology,2016,6(3):doi:10.3389/fonc,2016.00003.
[13]Zhang LY,Yang CS,Varelas X,et al.Altered RNA editing in 3 UTR perturbs microRNA-mediated regulation of oncogenes and tumor-suppressors[J].Sci Rep,2016,6(2):32-34.
[14]Vladimirova V,Waha A,Luckerath K,et al.Runx2 is expressed in human glioma cells and mediates the expression of galectin-3[J].J Neurosci Res,2008,86(11):2450-2461.
[15]Niu DF,Kondo T,Nakazawa T,et al.Transcription factor Runx2 is a regulator of epithelial-mesenchymal transition and invasion in thyroid carcinomas[J].Laboratory Investigation,2012,92(8):1181-1190.
[16]Takahashi T.Overexpression of Runx2 and MKP-1 stimulates transdifferentiation of 3T3-L1 preadipocytes into bone-forming osteoblasts in vitro[J].Calcif Tissue Int,2011,88(4):336-347.
[17]Wang W,Chen B,Zou RL,et al.Codonolactone, a sesquiterpene lactone isolated from Chloranthus henryi Hemsl, inhibits breast cancer cell invasion, migration and metastasis by downregulating the transcriptional activity of Runx2[J].Int J Oncol,2014,45(5):1891-1900.
(2016-11-13收稿)
The miR-592 suppresses U251 cell apoptosis by targeting Runx2
JiWenyu,CaiNing,YangSipei.
DeapartmentofFirstPediatricSurgery,TheFirstAffiliatedHospitalofXinjiangMedicalUniversity,Wulumuqi830054
Objective To investigate the effect of miR-592 on U251 cell apoptosis in the Glioma.Methods The expression of miR-592 was analyzed by quantitative PCR in Glioma tissues from patients. Next, U251 cells were transfected with miR-592 mimics and then the growth of cells was detected by MTT assay. To extensively explore the direct target of miR-592 in glioma, dual-luciferase reporter assay and western blot assay were performed to confirm that Runx2 is the direct target of miR-592 in U251 cells. In order to test whether Runx2 was the functional target of miR-592, the cell growth curve was determined by down-regulating the level of Runx2. Moreover, the apoptosis of U251 was also detected after Runx2 knocking down.Results The expression of miR-592 was significantly reduced in glioma tissues. Over-expression miR-592 remarkably increased the apoptotic rate of U251 cells. Dual-luciferase reporter assay indicated that Runx2 was the direct target of miR-592 in U251 cells. Suppressed expression of Runx2 by siRNA prominently suppressed U251 cell growth and induced the cell apoptotic rate.Conclusion miR-592 suppressed the growth and promoted the apoptotic rate of U251 cells by targeting Runx2.
Glioma MicroRNA miR-592 U251 Apoptotic rate
830054 乌鲁木齐,新疆医科大学第一附属医院儿外一科(吉文玉);新疆维吾尔自治区中医医院神经外科(蔡宁);苏州医科大学附属第二医院神经内科(杨思培)
R739.41
A
1007-0478(2017)04-0319-05
10.3969/j.issn.1007-0478.2017.04.010

