群体和单细胞微囊藻对短期温度变化的生理响应
付小丽 向 蓉 董聪聪 张红波 施军琼 吴忠兴
(西南大学三峡库区生态环境教育部重点实验室, 重庆市三峡库区植物生态与资源重点实验室, 重庆 400715)
群体和单细胞微囊藻对短期温度变化的生理响应
付小丽 向 蓉 董聪聪 张红波 施军琼 吴忠兴
(西南大学三峡库区生态环境教育部重点实验室, 重庆市三峡库区植物生态与资源重点实验室, 重庆 400715)
为了探索短期温度变化对群体微囊藻和单细胞微囊藻的影响, 在室内受控模拟条件下研究了在10℃、25℃和35℃三个温度梯度下, 群体和单细胞微囊藻对短期温度变化的生理响应。研究表明: 与对照组25℃相比, 在10℃培养下, 微囊藻叶绿素浓度显著降低, SOD活性和死亡率均显著增加。与群体微囊藻相比, 在10℃下单细胞微囊藻叶绿素浓度显著下降, Fv/Fm下降, SOD活性显著增加。在35℃培养下, 单细胞微囊藻叶绿素浓度上升, 死亡率和SOD活性增加, 而群体微囊藻则呈现出叶绿素浓度和死亡率降低, CAT活性增加。结果表明短期的温度变化影响了群体和单细胞微囊藻生理机制, 与单细胞微囊藻相比, 群体更能适应短期的温度胁迫, 导致其更具优势。
群体和单细胞微囊藻; 温度; 生理响应; 蓝藻水华
近年来, 由于湖泊、河流的氮、磷含量增加,加剧了水体富营养化过程, 引起蓝藻水华的大量暴发并打破了水生生态系统的平衡[1]。蓝藻水华的发生, 不仅影响了水生生态系统, 也影响了人类的健康[2,3]。在众多报道的蓝藻水华种类中, 微囊藻是最常见的水华蓝藻之一, 其分布广泛, 持续时间长,且一些种类产生的微囊藻毒素引起了许多的生态环境和人类健康问题[4—7], 因此, 对微囊藻水华的研究已成为国内外研究热点之一[8,9]。温度是影响生物生长发育的重要因子, 研究表明, 水华季节演替主要依赖温度、光照等物理条件[10,11]。目前, 人们已经把温度作为监测和预报水华的一个关键因素[12]。在许多淡水微囊藻的研究中, 温度历来作为一个重要的环境因子[13]。微囊藻的生长和光合作用受到各种不同的环境因子的影响, 其中温度是最重要的影响因子之一[14]。已研究表明, 在一定范围内温度的上升, 可以促进微囊藻的生长, 但超过35℃微囊藻的生长和光合作用就会受到抑制[25,29],因此, 研究温度的变化对微藻的影响有着重要的理论和实际意义。
在自然环境条件下微囊藻主要是以群体形式存在, 然而, 当其分离到实验室培养, 群体微囊藻往往解聚为单细胞的形式[15]。目前对微囊藻的生理研究主要以实验室培养的单细胞微囊藻为材料, 因而不能很好反映自然条件下微囊藻的生理生化特征。研究已表明在群体微囊藻解聚的过程中可能引起其生理生化指标及其抗性的改变, 且群体微囊藻在光合作用和抵御不利条件均表现出与单细胞微囊藻不同的特性[16,17]。然而, 群体和单细胞微囊藻对温度的响应并未见报道。因此, 本研究比较了群体微囊藻和单体微囊藻在短期不同温度培养下的生理生化响应, 旨在探究不同形态大小微囊藻对短期不同温度的响应机制, 为阐明微囊藻水华的形成及发生机制提供实验依据。
1 材料与方法
1.1 藻株来源和培养
实验选用藻种来源于中科院水生生物研究所淡水藻种库(FACHB-collection), 各藻株的相关特征信息如表 1所示。藻株的培养条件为: 光强25 μE/ (m2·s), 温度(25±1)℃, 光周期12h:12h。当藻株生长到对数期时, 藻液经离心后, 获得对数期藻细胞, 然后加入新鲜的BG11培养液, 置温度为10℃、25℃和35℃下, 持续培养48h, 其中25℃为对照组。每个处理实验设3个平行。

表 1 实验中所用铜绿微囊藻藻株信息Tab. 1 Information on Microcystis aeruginosa in this study
1.2 叶绿素含量和可溶性蛋白的测定
叶绿素用80%丙酮于4℃抽提24h, 离心后, 上清液用分光光度计测定663 nm的光吸收值, 通过公式Chl.a (mg/L)=12.19×A663计算得到叶绿素含量。总的可溶性的蛋白含量采用考马斯亮蓝结合法测定[18], 以小牛血清蛋白作为标准。
1.3 最大光化学效率(Fv/Fm)分析
用浮游植物荧光分析仪(PHYTO-PAM, Waltz公司, 德国)测定藻细胞的最大光化学效率, 测定方法参照Maxwell等[19]方法。
1.4 抗氧化物酶活性的测定
过氧化氢酶(Catalase, CAT)的活性根据Aebi[20]所描述的方法测定。计算公式为CAT=(Am–As)/(0.1* V*1*Cp), Am指最大吸光度, As指样品吸光度, V指提取酶液总体积mL, Cp指蛋白质浓度mg/mL。
超氧化物歧化酶(Superoxide dismutase, SOD)活性根据Dhindsa等[21]光化还原氧化法进行测定。酶活性采用SOD=[(Amax–A560)/Amax]/0.5公式计算。
1.5 细胞死亡率
所有样品经FDA (Fluorescein diacetate)染色后,用流式细胞仪(Epics Altra Coulter, Beckman, USA)对细胞活性进行检测。群体微囊藻的处理及FCM测定步骤见Wu等[16]方法, 其中FCM激发光为488 nm,检测荧光为505—545 nm[22]。
1.6 数据统计
所有实验设置3个平行, 数据处理和分析均在SPSS 16.0中进行, 采用方差分析和多重比较(LSD)进行统计分析, P<0.05为显著性差异, P<0.01为极显著差异。作图引入“对比值”, 对比值=(实验组–对照组)/对照组×100%, 所得数据采用EXCEL及Orgin8.6进行图表的绘制。
2 结果
2.1 不同温度下群体和单细胞微囊藻叶绿素含量变化
与对照组25℃相比, 在10℃条件下处理48h后,微囊藻叶绿素浓度均下降。单细胞微囊藻7806、905和942的Chl.a含量随温度下降显著(P<0.05,图 1), 分别减少了32.8%、25.9%和35.7%; 小群体微囊藻907和909的Chl.a含量分别降低了40%和44.9%, 下降显著(P<0.01); 大群体微囊藻938的Chl.a含量则减少了7.1%; 与群体微囊藻相比, 单细胞微囊藻叶绿素浓度显著下降(P<0.01)。在35℃条件下处理48h后, 微囊藻叶绿素浓度变化有差异, 单细胞微囊藻7806、905和942的Chl.a含量随温度升高而分别增加了20%、20.1%和48.4%; 小群体群体微囊藻907和909随温度升高分别降低了11.8%和9.4%, 而大群体微囊藻938则降低了32.1%。与单细胞微囊藻相比, 群体微囊藻叶绿素浓度显著降低(P<0.01)。

图 1 群体和单细胞微囊藻的叶绿素含量对比值
2.2 不同温度下群体和单细胞微囊藻最大光合效率(Fv/Fm)的变化
不同温度培养48h后, 通过比较微囊藻的最大光合效率(Fv/Fm)表明: 10℃时, 单细胞微囊藻7806、942和905分别下降了8.7%, 12.8%和43.6%;小群体微囊藻907和909分别上升9.0%和9.1%, 大群体微囊藻938下降23.5%; 与小群体微囊藻相比, 单细胞和大群体微囊藻显著降低(P<0.01, 图 2)。35℃时, 单细胞微囊藻7806、942和905分别上升8.7%, 下降8.5%和上升2.6%; 小群体微囊藻907和909分别上升22.7%, 上升5.5%, 而大群体则下降17.6%, 与单细胞和大群体微囊藻相比, 小群体微囊藻显著增加(P<0.05)。
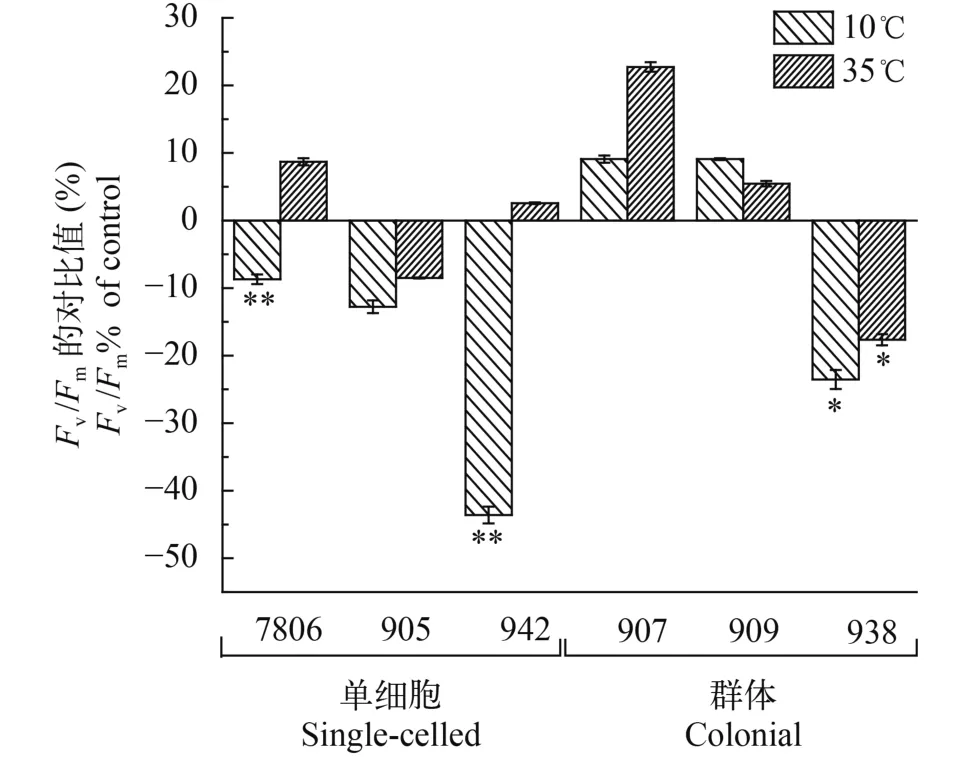
图 2 群体和单细胞微囊藻的Fv/Fm对比值
2.3 群体和单细胞微囊藻的抗氧化酶活性的变化
对群体和单细胞微囊藻的超氧化物歧化酶(SOD)和过氧化氢酶(CAT)分析表明, 群体微囊藻和单细胞微囊藻在应对短期温度变化方面有明显的差异。如上图 3a所示, 10℃时, SOD酶活性在微囊藻中表现为显著增加(P<0.01)。单细胞微囊藻7806、942和905分别上升了3.8倍, 4.6倍及1.6倍, 小群体微囊藻907和909分别上升8.9倍和1.3倍, 大群体938上升2.9倍, 单细胞与群体之间与群体之间差异显著(P<0.01)。35℃时, 单细胞微囊藻7806、942和905分别下降78%, 上升30.6%及下降68.2%,小群体微囊藻907和909分别下降55.4%, 56%, 大群体938下降54.3%(图 3a), 单细胞与群体之间差异显著(P<0.01)。
如上图 3b所示, 通过对微囊藻的CAT酶活性比较分析表明, 微囊藻CAT对短期不同温度也有不同的变化趋势: 10℃时, 单细胞微囊藻7806、942和905分别下降67%, 下降35%, 上升115%, 小群体微囊藻907和909分别下降16.1%, 上升118%, 大群体938下降13.7%; 单细胞和群体均上升显著(P<0.05);单细胞与群体之间差异显著(P<0.01)。35℃时, 单细胞微囊藻7806、942和905分别上升87%, 上升27.7%, 下降38.2%; 小群体微囊藻907和909分别上升110%和上升99%, 大群体上升8.3%; 群体较单细胞上升幅度大(图 3b)。单细胞与群体907、909差异显著(P<0.05)与群体938、差异极显著(P<0.01)。

图 3 群体和单细胞微囊藻的SOD和CAT对比值
2.4 群体和单细胞微囊藻细胞死亡率的变化
如表 2所示, 处理48h后, 死亡率均有上升, 10℃死亡率最高, 而25℃和35℃死亡率低。与单细胞微囊藻相比, 群体较单细胞死亡率低, 差异显著(P<0.05)。
3 讨论
3.1 不同温度对两种形态微囊藻叶绿素含量的影响
微囊藻的生长和光合作用受到各种不同的环境因子的影响, 其中温度是最重要的影响因子之一[13]。铜绿微囊藻喜好高温, 在30—35℃时生长最佳, 在水温30℃条件时细胞密度最大, 而温度低于20℃时生长明显受抑制[12]。本实验结果表明(图 1):在10℃时, 微囊藻叶绿素含量呈下降趋势。单细胞和小群体显著下降, 大群体不显著下降, 群体和单细胞呈现出差异显著, 说明实验温度对微囊藻单细胞和群体都有影响, 且对单细胞的影响更大。微囊藻群体的形态随季节而变化, 它们在秋季或是冬季能以营养状态的形式集积在底泥中, 俗称为“越冬体”[23]。在10℃条件下形成的大群体可能就是微囊藻的越冬体, 以此来抵御不利条件, 在条件适宜的时候就会恢复到原来的代谢活力。此结果与前人的研究结果一致。在35℃时, 微囊藻叶绿素含量有所变化, 单细胞微囊藻叶绿素含量均上升, 而小群体微囊藻叶绿素含量显著下降, 大群体不显著下降(图 1), 群体和单细胞大部分差异显著。单细胞叶绿素的上升, 则暗示了短期高温并不影响单细胞微囊藻生长和繁殖。刘玉生等[24]的研究表明: 在35℃时, 铜绿微囊藻生长达到最大增殖后, 马上开始沉淀, 绿色消退, 溶液呈乳白色。铜绿微囊藻对温度的适应范围较广, 在15—40℃温度内铜绿微囊藻均可生长, 当温度达到45℃时, 铜绿微囊藻停止生长并逐渐死亡[25]。
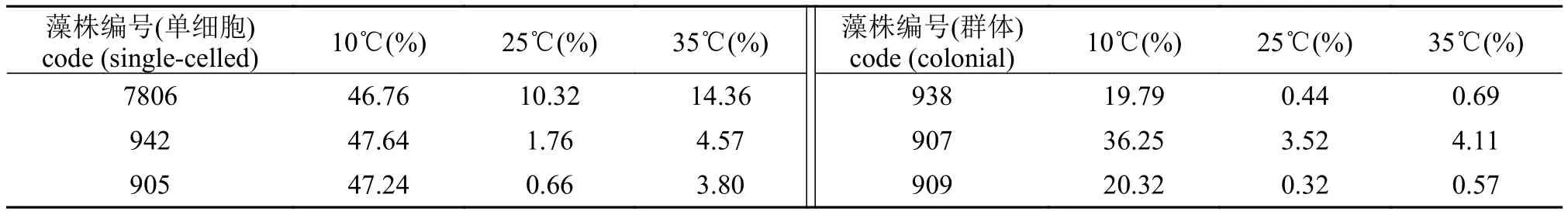
表 2 温度对群体和单细胞微囊藻细胞死亡率的影响Tab. 2 The effects of different temperatures on the mortality rates (%) of colonial and single-celled Microcystis
3.2 不同温度对两种形态微囊藻PSII的影响
温度是影响蓝藻生长的重要环境因子, 影响藻细胞的酶活性及生长代谢速率。黄仿等[26]研究了热胁迫对等鞭藻的作用机制, 结果表明热胁迫能导致Fv/Fm、Fv/2的值明显下降, 说明PSII中心电子传递受阻。微囊藻光合作用对高温比较敏感, 高温可使类囊体膜的结构发生变化[27], 本研究发现: 在10℃时, 6种微囊藻的Fv/Fm中, 单细胞和大群体下降, 单细胞与大群体之间差异显著(图 2)。Fv/Fm值下降说明微囊藻受到低温胁迫, 在一定温度范围内,温度较低时, 细胞膜的运输和呼吸代谢功能都会受到影响[28]。为了应对胁迫微囊藻可能通过降低代谢活动以维持群体机体活动抵御不良环境。在35℃时, 微囊藻大部分呈上升趋势, 单细胞和小群体上升, 大群体呈下降趋势, 单细胞与大部分群体差异显著(图 2)。Sayed和El-shahed[29]的研究中表明: 当温度为25—35℃, 小球藻(Chlorella vulgaris)的Fv/Fm、Fv/2值均随温度的升高而增大, 在35—40℃时达到最大随后开始下降。Fv/Fm值随试验温度的升高而增加, 说明温度升高对微囊藻的PSII电子传递起到促了进作用, 而高温也可能对光和系统的酶活性起到抑制作用, 出现不同程度的下降, 亦或高温对类囊体膜结构有损伤, 具体原因还需要进一步研究证实。单细胞和小群体的荧光值上升, 表明了其电子传递受到促进, 能量消耗增加, 不利于其长期的生长和繁殖[24]。
3.3 两种形态微囊藻对不同温度的响应
3.4 不同温度对两种形态微囊藻存活率的变化
本研究对群体和单细胞微囊藻的存活率进行了比较(表 2), 发现短期不同温度处理后, 微囊藻细胞的存活率仍然较高, 群体和单细胞之间差异显著;在35℃下微囊藻活力并未被破坏或抑制, 进一步证实了微囊藻能耐受较高的温度。与单细胞相比, 大小群体微囊藻细胞表现出较低的死亡率, 其原因可能是由于群体微囊藻能产生大量的SOD和CAT来清除高温造成的损伤, 亦或是群体微囊藻, 特别是大群体通过降低自身代谢活性来应对短期高温。水华发生与微囊藻细胞在水体表层的聚集有很大的关系。通过自身的浮力, 来获取光能, 得到充足的营养盐, 使得它们在与其他藻类竞争时具有明显的优势[31,32]。Yamamoto等[33]通过实际湖泊调查认为, 大群体在水华形成过程中起着非常重要的作用。在大量聚集的情况下形成群体形态更易于使其保持漂浮状态, 从而造成水华暴发。在本实验中,在面对不同温度变化时, 群体表现出一定的优势。这也与野外观测相符。
综上所述, 微囊藻能耐受较高的温度, 单细胞微囊藻的叶绿素更耐高温, 群体高温死亡率低, 较单细胞有更大的生存优势, 这种优势与水华生消可能具有一定的相关性, 水华发生是一个复杂的动态过程, 并不是单一因素的效应, 还需进一步的研究。
[1]Gucht K V, Vandekerckhvoe T, Vloeomans N, et al. Characterization of bacterial communities in four freshwater lakes differing in nutrient load and food web structure [J]. FEMS Microbiology Ecology, 2005, 53(2): 205—220
[2]Zhang Y, Huang J H, Qi L. Links between algae biomass and nutrients in a eutrophic shallow lake [J]. Journal of Tianjin University, 2014, 47(1): 36—41 [张亚, 黄津辉,戚蓝. 浅水富营养水库中藻类生物量与营养盐的关系.天津大学学报, 2014, 47(1): 36—41]
[3]Dong J, Gao Y N, Li G B. A review: responses of phytoplankton communities to eutrophication and climate warming in freshwater lakes [J]. Acta Hydrobiologica Sinica, 2016, 40(3): 615—623 [董静, 高云霓, 李根宝. 淡水湖泊浮游藻类对富营养化和气候变暖的响应. 水生生物学报, 2016, 40(3): 615—623]
[4]Sivonen K. Cyanobacterial toxins and toxin production [J]. Phycologia, 1996, 35(6): 12—24
[5]Codd G A. Cyanobacterial toxins, the perception of water quality, and the prioritization of eutrophication control [J]. Ecological Engineering, 2000, 16(1): 51—60
[6]Chen Y W, Qin B Q, Teubner K, et al. Long-term dynamics of phytoplankton assemblages: Microcystis-domination in Lake Taihu, a large shallow lake in China [J]. Journal of Plankton Research, 2003, 25(4): 445—453
[7]Jiang H B, Qiu B S. Photosynthetic adaptation of a bloom-forming cyanobacterium Microcystis aeruginosa (Cyanophyceae) to prolonged UV-B exposure [J]. Journal of Phycology, 2005, 41(5): 983—992
[8]Karadžić V, Subakov-Simić G, Krizmanić J, et al. Phytoplankton and eutrophication development in the water supply reservoirs Garaši and Bukulja (Serbia) [J]. Desalination, 2010, 255(1/2/3): 93—96
[9]El Ghazali I, Saqrane S, Carvalho A P, et al. Effects of the microcystin profile of a cyanobacterial bloom on growth and toxin accumulation in common carp Cyprinus carpio larvae [J]. Journal of Fish Biology, 2010, 76(6): 1415—1430
[10]Soares M C S, Rocha M I A, Marinho M M, et al. Changes in species composition during annual cyanobacterial dominance in a tropical reservoir: physical factors, nutrients and grazing effects [J]. Aquatic Microbial Ecology, 2009, 57(2): 137—149
[11]Ding F F, Huang H Z, Chen J F, et al. Studies on the growth and the uptake of phosphorus of Microcystis aeruginosa in different ratios of inorganic phosphorous and organic phosphorous forms [J]. Journal of Hydroecology, 2010, 3(3): 32—36 [丁飞飞, 黄鹤忠, 陈金凤, 等. 不同磷源及其配比对铜绿微囊藻生长和摄磷效应的影响. 水生态学杂志, 2010, 3(3): 32—36]
[12]Zhang Q T, Wang X H, Lin C, et al. Effects of temperature and illumination on the cell proliferation of Microcystis aeruginosa [J]. Journal of Tianjin University of Science and Technology, 2011, 26(2): 24—27 [张青田, 王新华, 林超, 等. 温度和光照对铜绿微囊藻生长的影响. 天津科技大学学报, 2011, 26(2): 24—27]
[13]Wilson S, Blake C, berges J A, et al. Environmental tolerances of free-living coralline algae: implications for European marine conservation [J]. Biological Conservation, 2004, 120(2): 283—293
[14]Wen X G, Gong H M, Lu C M. Heat stress induces an inhibition of energy transfer from phycobilisomes to photosystem II but not to photosystem I in a cyanobacterium Spirulina platensis [J]. Plant Physiology and Biochemistry, 2005, 43(4): 389—395
[15]Reynolds C S, Walsby A E. Water-Blooms [J]. Biological Reviews, 1975, 50(4): 437—481
[16]Wu Z X, Gan, N Q, Huang Q, et al. Response of microcystis to copper stress: Do phenotypes of Microcystis make a difference in stress tolerance [J]? Environmental Pollution, 2007, 147(2): 324—330
[17]Wu Z X, Song L R, Li R H. Different tolerances and responses to low temperature and darkness between waterbloom forming cyanobacterium Microcystis and a green alga Scenedesmus [J]. Hydrobiologia, 2008, 596(1): 47—55
[18]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72(s1—2): 248—254
[19]Maxwell K, Johnson G N. Chlorophyll fluorescence—a practical guide [J]. Journal of Experimental Botany, 2000, 51(345): 659—668
[20]Aebi H. Catalase in vitro [J]. Methods in Enzymology, 1984, 105(3): 121—126
[21]Dhindsa R S, Matowe W. Drought tolerance in two mosses: correlated with enzymatic defence against lipid peroxidation [J]. Journal of Experimental Botany, 1981, 32(1): 79—91
[22]Endo H, Nakayama J, Hayashi T. Application of flow cytometry to environmental control in marine aquaculture [J]. Materials Science and Engineering C, 2000, 12(1): 83—88
[23]Kong F X, Song L R. Research on Process and Environmental Characteristics about Water-blooms Cyanobacteria [M]. Beijing: Science Press. 2011, 72 [孔繁翔, 宋立荣. 蓝藻水华形成过程及其环境特征研究. 北京: 科学出社. 2011, 72]
[24]Liu Y S, Han M, Liang Z B, et al. Influence of light intensity, temperature and nutrients on the growth of Microcystis in water of Dianchi Lake [J]. Research of Environmental Sciences, 1995, 8(6): 7—11 [刘玉生, 韩梅, 梁占彬, 等. 光照、温度和营养盐对滇池微囊藻生长的影响.环境科学研究, 1995, 8(6): 7—11]
[25]Chen J Z, Liu Z L, Li X M, et al. Effects of temperature, pH, Nnitrogen and phosphorus on growth of Microcystis aeruginosa [J]. Oceanologia et Limnologia Sinica, 2010, 41(5): 714—718 [陈建中, 刘志礼, 李晓明, 等. 温度、pH和氮、磷含量对铜绿微囊藻(Mcrocystis aeruginosa)生长的影响. 海洋与湖沼, 2010, 41(5): 714—718]
[26]Huang F, Wu B K. Mechanistic studies of heat effects on Isochrysis galbana by in vivo modulated chlorophyll fluorescence [J]. Journal of Guangxi Normal University (Natural Science Edition), 1995, 13(2): 72—76 [黄仿, 武宝开. 热胁对球等鞭金藻作用机制的叶绿素荧光的研究. 广西师范大学学报(自然科学版), 1995, 13(2): 72—76]
[27]Morgan-Kiss R, Ivanov A G, Williams J, et al. Differential thermal effects on the energy distribution between photosystem II and photosystem I in thylakoid membranes of a psychrophilic and mesophilic alga [J]. Biochimica et Biophysica Acta, 2002, 1561(2): 251—265
[28]Zhang M, Zeng B, Wang M S, et al. The temperature elevation suppresses the light energy utilization and growth of Chlolorella pyrenoidosa under high light intensity conditions [J]. Acta Ecologica Sinica, 2007, 27(2): 662—667 [张曼, 曾波, 王明书, 等. 温度升高对高光强环境下蛋白核小球藻光能利用和生长的阻抑效应. 生态学报, 2007, 27(2): 662—667]
[29]Sayed O H, El-shahed A M. Growth, photosynthesis and circadian patterns in Chlorellavulgaris (Chlorophyta) in response to growth temperature [J]. Algoi, 2000, 21(3): 283—290
[30]Li J, Ou D Y, Song L R, et al. Decline of Microcystis aeruginosa FACHB-905 under four stress conditions [J]. Journal of Lake Sciences, 2008, 20(5): 549—555 [李杰,欧丹云, 宋立荣, 等. 微囊藻衰亡过程研究—四种模拟胁迫条件下微囊藻的衰亡生理. 湖泊科学, 2008, 20(5): 549—555]
[31]Oliver R L, Ganf G G. Freshwater Blooms [M]. The Ecology of Cyanobacteria. Netherlands: Springer. 2000, 149—194
[32]Bonnet M P, Poulin M. Numerical modeling of the planktonic succession in a nutrient-rich reservoir: environmental and physiological factors leading to Microcystis aeruginosa dominance [J]. Ecological Model, 2002, 156(2—3): 93—112
[33]Yamamoto Y, Shiah F K, Chen Y L. Importance of large colony formation in bloom-forming cyanobacteria to dominate in eutrophic ponds [J]. Annales de Limnologie-International Journal of Limnology, 2011, 47(2): 167—173
THE PHYSIOLOGICAL RESPONSE OF COLONIAL AND SINGLE-CELLED FORM OF MICROCYSTIS TO SHORT-TERM TEMPERATURE CHANGES
FU Xiao-Li, XIANG Rong, DONG Cong-Cong, ZHANG Hong-Bo, SHI Jun-Qiong and WU Zhong-Xing
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region (Ministry of Education), Chongqing Key Laboratory of Plant Ecology and Resources Research in Three Gorges Reservoir Region, Southwest University, Chongqing 400715, China)
To investigate the effect of short-term temperature changes on the colonial and single-cell Microcysis forms, physiological responses were determined after it was cultured at 10℃, 25℃, and 35℃. The results demonstrated that a decline in chlorophyll-a and an increase in superoxide dismutase (SOD) and mortality rates were found when Microcystis was cultured at 10℃ when compared to those cultured at 25℃. Significant decreases in chlorophyll-a and Fv/Fmwere observed in the Microcystis single-cell form in contrast to the colonial form, while SOD activity significantly increased when Microcystis was inoculated at 10℃. After culturing at 35℃, chlorophyll-a, mortality rate, and SOD levels significantly increased in single-cell Microcystis, however, a significant decrease in chlorophyll-a and mortality rates and a significant increase in catalase activity was found in colonial Microcystis. The results suggested that short-term temperature stress could affect physiological mechanisms in colonial and single-cell Microcystis. However, colonial Microcystis showed more advantages in adapting to short-term temperature stress than the single-cell form.
Colonial and single-celled Microcysis; Temperature; Physiological response; Cyanobacterial bloom
Q178.1
A
1000-3207(2017)05-1091-06
10.7541/2017.136
2016-10-31;
2017-02-14
中央高校基本业务费专项资金(XDJK2016C111); 西南大学博士基金(SWU110065)资助 [Supported by the Fundamental Research Funds for the Central Universities (XDJK2016C111); Doctoral Found Project of China SWU (SWU110065)]
付小丽(1989—), 女, 甘肃庆阳人; 硕士研究生; 主要从事藻类生理学研究。E-mail: FUxlxd@163.com
吴忠兴(1975—), 男, 教授; 主要从事藻类生理生态及分子系统性学研究。E-mail: wuzhx@swu.edu.cn
- 水生生物学报的其它文章
- 剩余污泥资源化利用新工艺研究进展
- 草鱼野生与选育群体线粒体DNA控制区D-loop遗传变异分析
- 在患CyHV-2病的异育银鲫肠道黏膜中胆固醇、胆汁酸代谢通路基因的差异表达
- 黄颡鱼20β-羟基类固醇脱氢酶Ⅰ和Ⅱ基因特征分析和表达模式研究
- 池蝶蚌β-连环蛋白基因cDNA的克隆及表达特征分析
- MOLECULAR CLONING, CHARACTERIZATION, AND EXPRESSION ANALYSIS OF TWO ISOFORMS OF ANTI-LIPOPOLYSACCHARIDE FACTOR FROM THE ORIENTAL RIVER PRAWN, MACROBRACHIUM NIPPONENSE

