医学科研设计方法概论
沈 宁,胡良平,2*
(1.军事医学科学院生物医学统计学咨询中心,北京 100850;2.世界中医药学会联合会临床科研统计学专业委员会,北京 100029*通信作者:胡良平,E-mail:lphu812@sina.com)
科研方法专题
医学科研设计方法概论
沈 宁1,胡良平1,2*
(1.军事医学科学院生物医学统计学咨询中心,北京 100850;2.世界中医药学会联合会临床科研统计学专业委员会,北京 100029
*通信作者:胡良平,E-mail:lphu812@sina.com)
本文目的是介绍医学科研设计方法中的几个关键性内容,为实际科研工作者进行医学科研提供基本思路。首先,归纳和总结出医学科研课题的五大类,即非临床试验研究课题、临床试验研究课题、观察性研究课题、文献研究课题和真实世界研究课题。其次,呈现出医学科研设计架构,即由“设计方案”“实施方案”和“结题方案”三个主方案组成,它们又可被细分为六个子方案。第三,介绍了临床试验研究注册方面的内容,涉及到何为临床试验研究注册及其意义和具体的注册方法。
医学研究;临床试验;调查研究;科研设计;设计方案
1 医学科研课题种类
当今世界,人类所开展的科学研究非常之多,所涉猎的领域和范围非常之广,很难用简短的语言将其全部囊括进去。但是,按研究的手段或课题的类型去划分医学科研课题,特别是临床科研课题(特指以“人”为受试对象或调查对象的科研课题),不外乎以下几大类。
1.1 非临床试验研究课题
所谓“非临床试验”是指不以“人”为受试对象的医学试验。在医学研究领域,人们首先是在“动物或样品或离体器官或细胞”上开展试验研究。当发现某种医学处理(包括药物或治疗方案或手术方式等)对生物体的安全性不构成威胁且对某种疾病疗效较好时,经过医学伦理学论证后,才谨慎地过渡到人体试验。医学上几乎所有的基础性试验都属于“非临床试验”,它为后期可能开展的临床试验研究提供必要的基础和初步证据。这类科研课题在现实科研中是非常多的,涉及的范围十分宽泛。
1.2 临床试验研究课题
即研究者通过设定某些特定的环境或条件,按一定的操作规程和质量控制手段,实施某些特定的处理,从而发现已经呈现出来的现象或揭示事物内在的固有和变化的规律,或者制造或加工出具有某种功能或作用的物件,如药物、仪器设备等。结合医学科研的实际情况,临床试验性研究课题又可细分为以下四种情形。情形一:不同治疗方案或手术方式对某种疾病的疗效与安全性评价的临床试验研究课题,如“高频振动治疗急性呼吸困难综合征”“持续正压通气治疗阻塞性睡眠呼吸暂停的比较研究”。情形二:不同药物或医疗器械或医疗设备对某种疾病的疗效与安全性评价的临床试验研究课题,如“黄体酮治疗重度脑外伤的临床试验研究”“多奈哌齐治疗阿尔茨海默病的激越症状”。情形三:新药物或新医疗器械或新医疗设备对某种疾病的疗效与安全性评价的临床试验研究课题。情形四:仿制药与参比药的一致性和生物等效性及疗效与安全性评价的临床试验研究课题。
1.3 观察性研究课题
即研究者通过谋划某些希望了解或探究的内容、事物或现象,按一定的操作规程和质量控制手段去调查或采访或观察或测量,以期获得必要的信息或资料,再通过对其的整理、归纳、分析与提炼,得出对所关心的事物或现象的认识和评价。结合临床科研的实际情况,临床调查研究课题又可细分为以下三种情形。情形一:某种疾病发病率基础数据的调查研究,如“美国儿童肥胖的发病率”“严重感染的非洲儿童服用液体丸后的死亡率研究”。情形二:社会或公众普遍关心的与某些医学事件的调查研究,如“癌症诊断后自杀及心血管疾病死亡研究”“药物治疗注意缺陷多动障碍和犯罪”。情形三:筛查易导致某些疾病发生的危险因素的探索性研究,如“儿童和成人肥胖与心血管疾病风险因素的关系”“谷物蛋白的摄入、人类白细胞抗原水平对儿童罹患乳糜泻风险的影响”。
1.4 文献研究课题
即基于文献资料,对已发表的多项同类研究课题进行归纳、整合、总结、分析和推理,期望得出关于所探究问题的一个基于“更大样本量、集成更多信息”且在更大范围内具有“高度概括性、重现性和可信性结论”的一类研究课题。“系统评价”是此类课题的“广义通用名称”,而“meta分析”则是此类课题的“狭义通用名称”。
1.5 真实世界研究课题
即采用类似于“观察性研究”的手法,但没有系统完善的“调查设计方案”的指导,仅对与研究者关心的与某些事物或现象有关且自然产生或发生的过程或结果进行记录、描述、呈现、总结、分析和推理,得出近乎关于“总体”的结果和结论。近年来,关于“大数据”的研究热潮或许是此类研究课题的“代名词”。例如:组学大数据的质量控制与临床应用标准化研究,生物大数据表述索引、搜索与存储访问关键技术研发,心血管疾病大数据平台的构建和应用研究,恶性肿瘤大数据处理分析与应用研究等。
2 医学科研设计架构
2.1 概述
上述五大类医学科研课题中的任何一类,一旦“立题”获得了批准,课题负责单位和负责人就需要承担起高质量完成课题的重任。然而,任何一个重大重点医学科研课题通常都不可能由一个单位里的少数科研人员独立完成,而是需要由多个科研单位里的多位科研人员通力合作。于是,问题就来了:多个科研单位如何分工合作?多位科研人员如何充分发挥各自的专业特长?由谁来指挥、协调和监管整个科研进程和质量?类似的疑问还有很多。这些问题集中起来实际上就是如下的几个关键性问题:如何按质按量完成课题的任务;如何使科研产出远远大于科研投入;如何使科研成果经得起时间和实践的检验。前述问题的答案是:制订出科学完善、系统全面、经济可靠、精准高效的临床科研设计方案;制订出标准的操作规程和实时精准的质量控制策略;制订出实时精准收集、管理、分析和呈现临床试验数据和结果的策略。
2.2 医学科研设计整体架构
一个完整的医学科研课题科研设计方案由三个主方案组成,每个主方案又由两个子方案组成。三个主方案分别为:“设计方案”“实施方案”和“结题方案”。
“设计方案”由“课题框架设计方案”与“课题技术设计方案”两个子方案组成;“实施方案”由“标准操作规程方案”与“实时精准质控方案”两个子方案组成;而“结题方案”由“数据收集管理呈现方案”与“数据分析报告呈现方案”两个子方案组成。医学科研设计整体架构见图1。
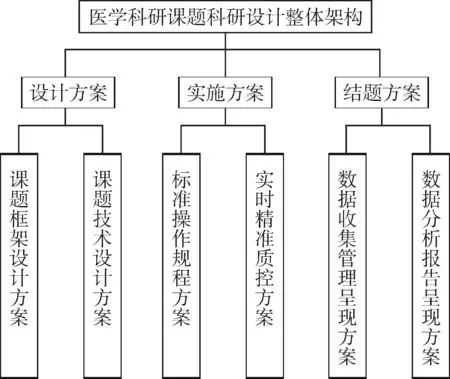
图1 医学科研设计整体架构
除了上述提及的三个主方案和六个子方案外,还需要配有若干个必要的附件,帮助说明课题设计方案中的关键技术性内容是与其匹配的“必要的附件”。包括“样本含量估计”“随机抽样与分组”“试验记录与记录表格”“病例报告表与调查表”“课题数据库”和“统计分析计划”。见图2。
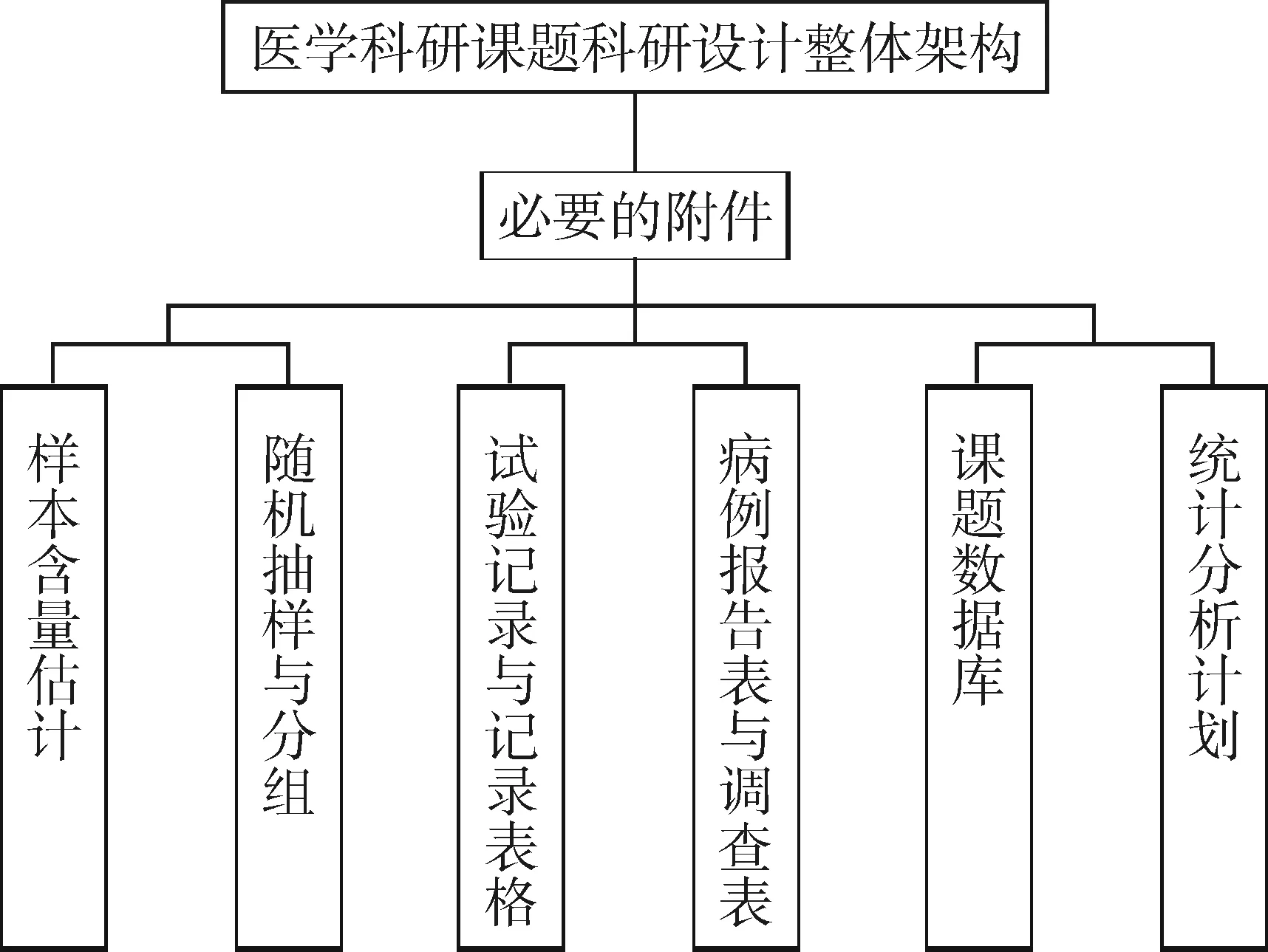
图2 课题设计方案必要的附件
2.3 课题框架设计方案架构
2.3.1 课题框架设计方案架构图
课题框架设计方案由K个分题设计方案组成。一个重大或重点课题往往都需要分解成若干个分课题,每个分课题也需要有相应的课题框架设计方案。课题框架设计方案架构见图3。
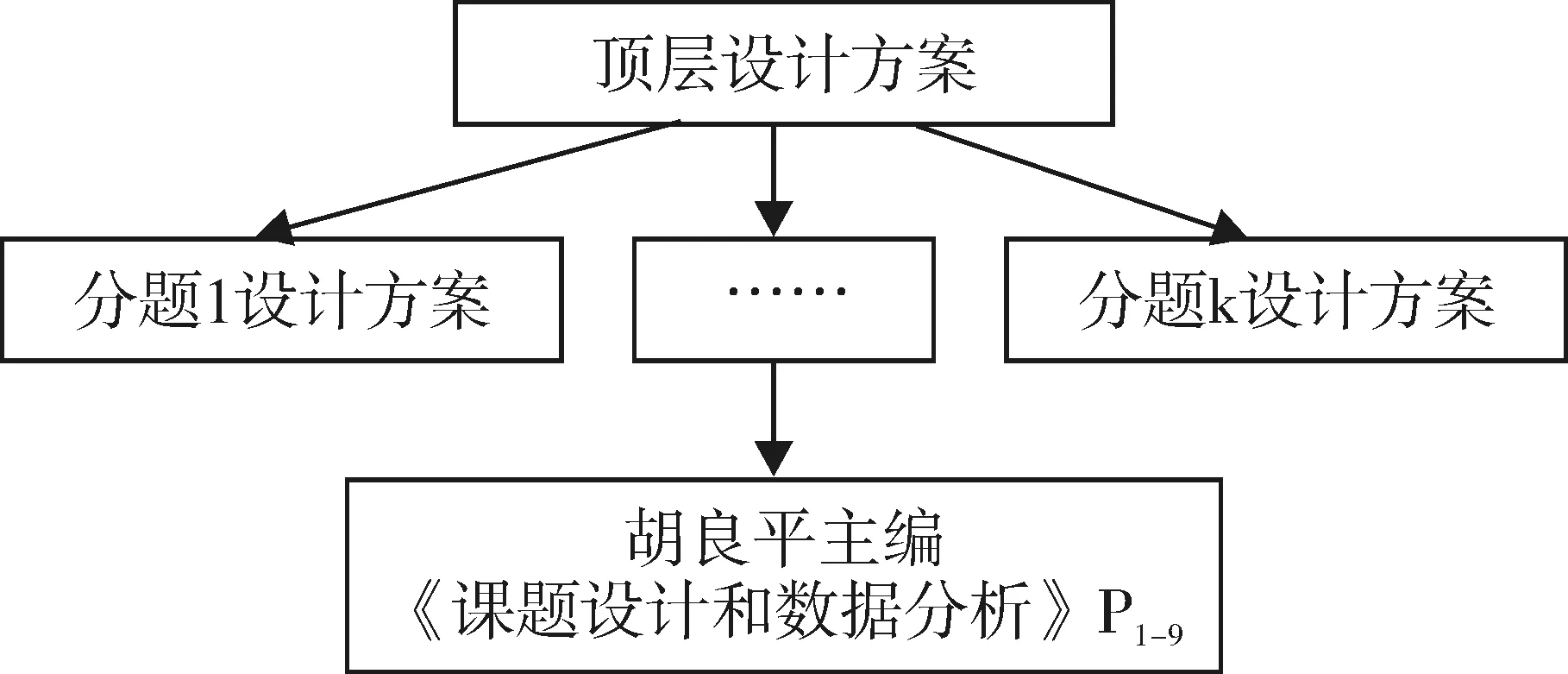
图3 课题框架设计方案
2.3.2 课题框架设计方案的主要内容
课题框架设计方案就是一个从宏观角度介绍与该总课题有关的文件或材料,即顶层设计方案。制订出课题框架设计方案的意义在于:无论是课题管理者、执行者和参与者,看完此材料,对该课题就有了一个全面的了解和把握。因此,在开展具体的课题研究之前,必需制订出课题框架设计方案。
课题框架设计必须为课题研究提供充足的“物质基础”,涉及任务(课题来源、规模、研究目标、研究内容和技术路线等)、投入(人、物、财、时间)和产出(人才、专利、成果、论文)。其中,“财”指“课题经费预算”,即课题经费是如何分配的、分别使用在什么用途上。课题框架设计方案的主要内容由以下五个部分组成:第一部分,课题概况,包括研究意义、研究目标、研究内容、预期成果和研究现状;第二部分,课题承担情况,包括总课题承担情况和各分课题承担情况;第三部分,课题技术问题,包括课题难点、课题创新点、课题技术路线和课题可行性分析;第四部分,课题进度;第五部分,经费预算。
2.4 课题技术设计方案架构
2.4.1 课题技术设计方案架构图
课题技术设计方案架构见图4、图5。图4以粗略的形式呈现了课题技术设计方案,其具体的方案从最普遍被使用的“试验设计方案”到最难以驾驭的“真实世界研究设计方案”。图5的中间显示“课题技术设计方案”的名称,右侧与图4内容相同;左侧揭示出课题技术设计方案的内核,即需要充分利用“基本常识”“各科专业知识”和“统计知识”,才有可能制订出高质量的“课题技术设计方案”。
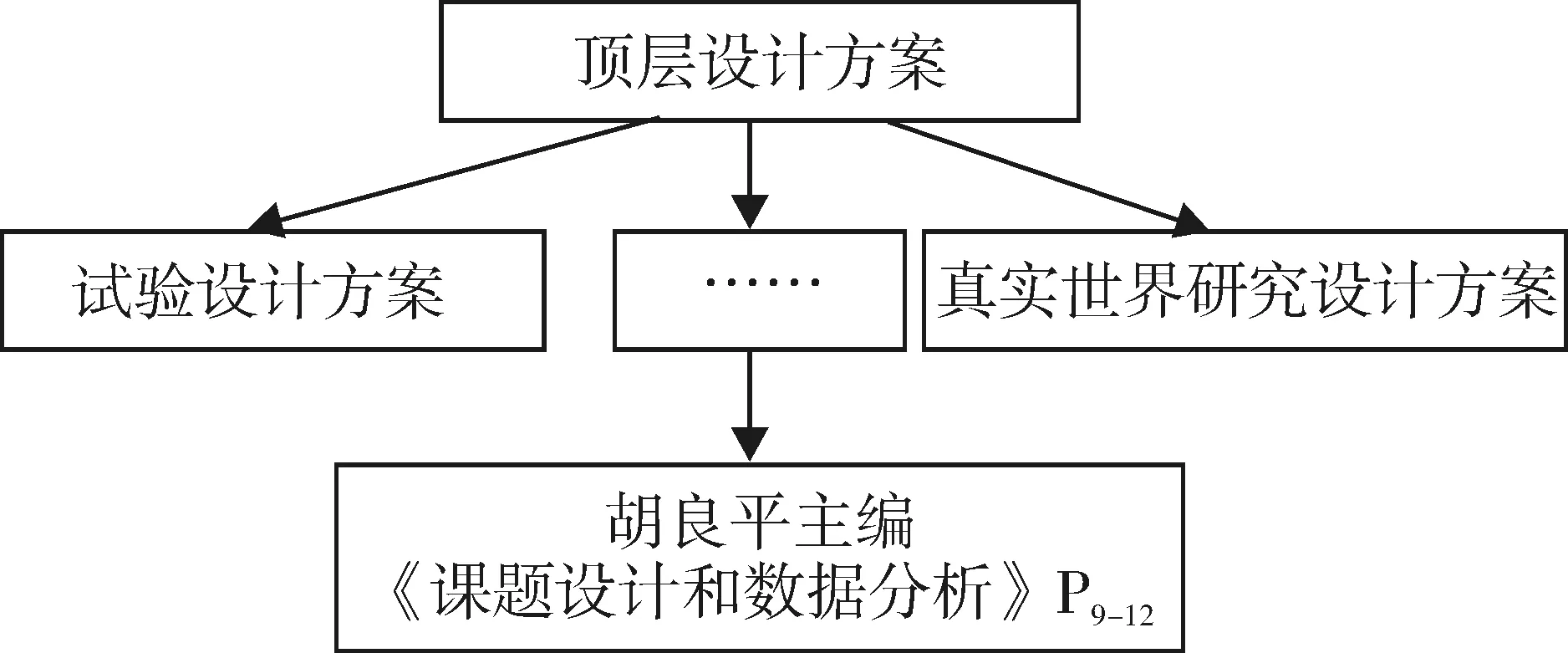
图4 课题技术设计方案之一
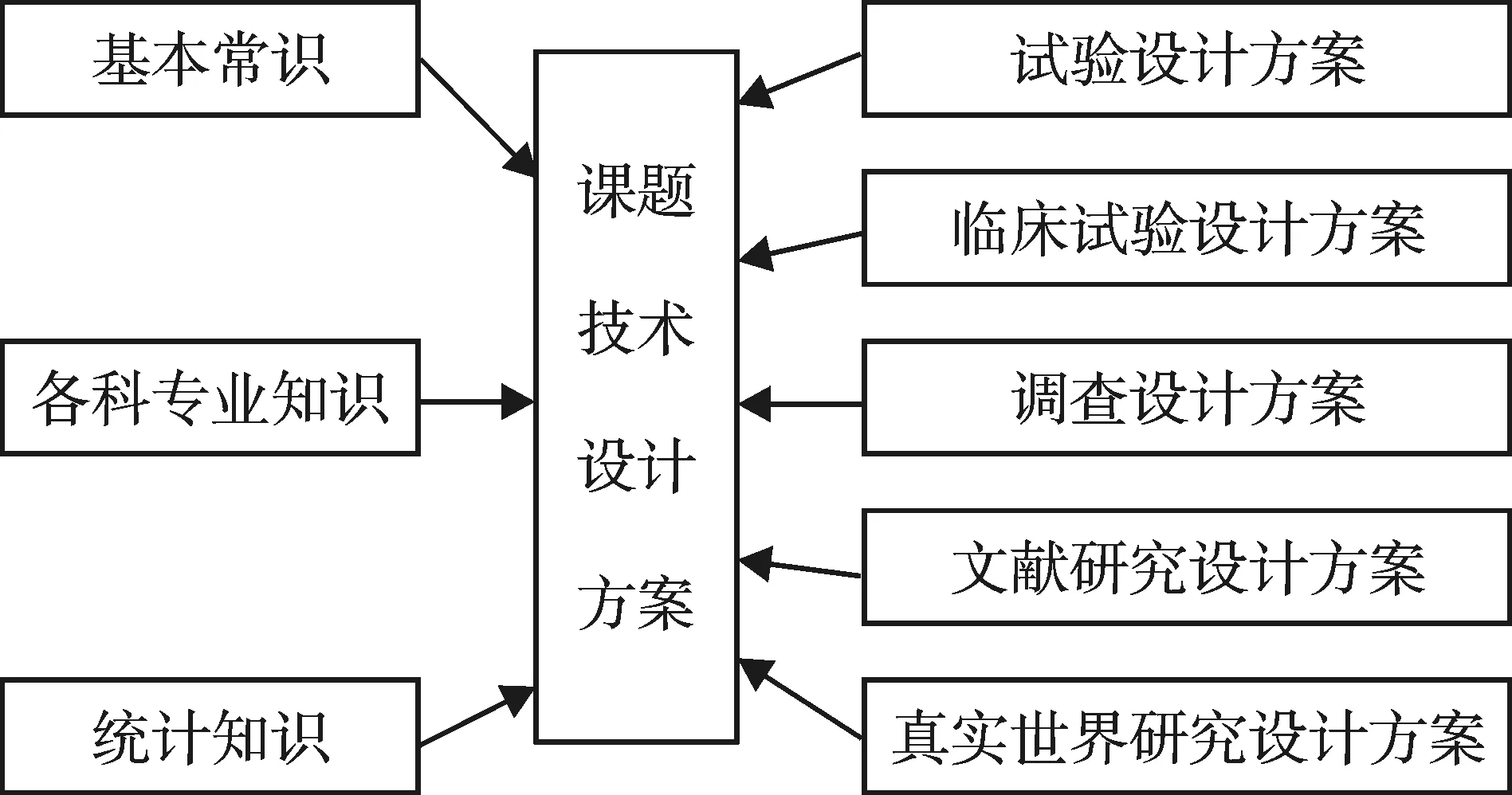
图5 课题技术设计方案之二
值得一提的是:人们习惯上说“课题统计设计方案”,这似乎暗示此类方案全靠“统计学知识”就可撰写完成。其实是不可能的。因为在现实的生活、生产和科学研究中,人们所做的“课题”绝大部分都是要解决某些学科领域中的“疑难问题”的。要想妥善地解决疑难问题,下面三方面的知识缺一不可。
第一,基本常识。离开或违背“基本常识”去考虑或安排事情(特别是制订课题技术设计方案)显然是行不通的。例如,在温带地区且在夏秋季节开展治疗冻伤药物的疗效与安全性评价的临床试验研究,不用思考就知道此试验研究必然会以失败告终。事实上,在几乎所有的课题技术设计方案制订过程中,“基本常识”所占的分量是相当大的。
第二,各科专业知识。这里特指“与拟研究课题有关的各科专业知识”。因为任何一个课题组或科研团队的参与者都不可能完全掌握各科专业知识,但他们必须基本具备或掌握与当前拟研究课题有关的学科的知识,否则,所制订出来的课题技术设计方案将是无实用价值的。例如:有人请一位数学和统计学专家为其制订一个课题技术设计方案,其课题名称为“北京市环境中有害化学物质的分布、数量和成份的研究”。这如同让一个幼儿园的小朋友去研究“数论”问题一样,严重缺乏基础知识和专业知识。
第三,统计知识。仅懂得统计学的人是很难为临床科研课题制订出高质量的课题技术设计方案的;但是,拥有丰富统计知识的人一定是绝大多数科研课题(特别是临床和生物医药类科研课题)参与者中最受欢迎的人。在制订课题技术设计方案的过程中,必然会涉及到与统计学密不可分的内容,如样本含量的估计、随机抽样与随机分组、设计类型的选定与构造、比较类型的确定和统计分析计划书的撰写等。值得指出的是:有相当多的国家级重大重点科研课题的科研队伍中,严重缺乏真正懂得统计学的专门人才。
2.4.2 课题技术设计方案的主要内容
从图5的右边部分可知:与医学科研有关的课题有五大类(注意:一般试验研究指以“动物或样品”为受试对象的试验研究;而临床试验研究特指以“人”为受试对象的试验研究),其中每一类课题在实施之前都需要为其制订出合格的“课题技术设计方案”。它们在内容上大同小异,现以“临床试验设计方案”为例,概要呈现其主要内容如下:第一,与医学伦理有关的内容及其处置情况;第二,与试验研究“三要素(受试对象、影响因素和评价指标)”有关的内容及其处置情况;第三,与试验研究“四原则(随机原则、对照原则、重复原则和均衡原则)”有关的内容及其处置情况;第四,与“设计类型”有关的内容及其处置情况;第五,与“比较类型”有关的内容及其处置情况;第六,与“标准操作规程”有关的内容及其处置情况;第七,与“质量控制”有关的内容及其处置情况;第八,与“研究监管”有关的内容及其处置情况;第九,与“统计分析”有关的内容及其处置情况。
2.5 小结
提高重大重点医学科研课题质量的重要举措是制订并严格落实前述提及的科研设计方案,严格落实标准操作规程方案、实时精准质量控制方案和数据收集管理分析与呈现方案。需要引起高度重视的是:我国现阶段已完成和正在进行的部分重大重点科研课题,在总课题框架设计和技术设计方案的质量方面尚存在较大的提升空间。需要妥善解决的问题有:在多个分课题中做了很多雷同的工作,不仅造成了时间、精力、人力、物力和财力的巨大浪费,更严重的是有些研究内容和关键技术(如课题技术设计方案、课题实施过程中的操作规程与质量控制、数据库建设和数据管理质量、统计分析计划和统计分析质量)因标准不统一、技术水平参差不齐,在“课题设计、实施和结题”等重要环节上,与“无懈可击”还有较大的距离。由此可知,我国医学科研人员的科研素质和技能有待进一步提高,以便从根本上真正提高医学科研课题的研究质量和效益。
3 临床试验研究注册
3.1 概述
在正式开展临床试验研究之前,向国内或国际有关网站或平台或公用数据库上提交必要的信息,称为临床试验注册。临床试验注册的历史是:2004年11月,由世界卫生组织(WHO)牵头建立国际临床试验注册平台(ICTRP),在此之后,英国、美国和澳大利亚都纷纷建立了自己国家的临床试验注册中心;2005年,由四川大学华西医院发起并建立了“中国临床试验注册中心(ChiCTR)”。主要的国际临床试验注册库或网站或平台如下:美国国立注册资料库(http://www.clinicaltrials.gov),英国国立研究注册库(http://www.nrr.nhs.uk),英国当前对照试验注册库(http://www.controlled-trials.com),澳大利亚临床试验注册库(http://www.actr.org.au/)。目前已有几百个注册库。
3.2 意义
所有的干预性临床试验的注册均被视为一种科学、伦理、道德和开明的责任。国际医学杂志编辑委员会(ICMJE)、WHO以及很多国家政府组织都支持临床试验注册。为什么要进行临床试验注册?第一,是学术要求。因为未注册的临床试验研究将来可能难以成为循证医学的重要证据;所撰写出来的临床研究学术论文难于被国内外某些学术期刊接受(特别是国际顶尖级医学学术期刊)。第二,是伦理学要求。从伦理学角度考量,患者参与临床试验,有权获悉临床试验结果,体现其权益得到了保障。临床试验的承办方有责任按伦理学原则开展临床试验研究,并诚实地报告和公布临床试验的结果。第三,是科研效率和质量要求。通过全面、深入了解国内外现有临床试验及其结果,将极大地减少不必要的重复临床试验研究。同时,也有利于核查一稿多投,避免类似的学术论文重复发表。
3.3 注册方法
通过国际互联网进入某个拟注册的“临床试验注册资料库或网站或平台”,首先全面了解其概况,然后找到临床试验注册系统的入口并进入。再按提示输入相应的信息,待每个页面需要填写的内容都完成且符合注册系统要求后,即注册成功。
[1] 胡良平, 陶丽新.临床科研设计与统计分析[M].北京: 中国中医药出版社, 2012: 41-90.
[2] 胡良平, 陶丽新.临床试验设计与统计分析[M].北京: 军事医学科学出版社, 2013: 1-149.
[3] 胡良平.课题设计与数据分析—关键技术与标准模板[M].北京: 军事医学科学出版社, 2014: 1-136.
[4] 邓伟, 贺佳.临床试验设计与统计分析[M].北京: 人民卫生出版社, 2012: 1-11,42-53,174-183.
[5] Chow SC, Liu JP. Design and analysis of clinical trials[M]. 2ndedition. New Jersey: Wiley-Interscience, 2004: 88-299.
[6] Young D, Lamb SE, Shah S, et al. High-frequency oscillation for acute respiratory distress syndrome[J]. N Engl J Med, 2013, 368(9): 806-813.
[7] Gottlieb DJ, Punjabi NM, Mehra R, et al. CPAP versus oxygen in obstructive sleep apnea[J].N Engl J Med, 2014, 370(24): 2276-2285.
[8] Skolnick BE, Maas AI, Narayan RK, et al. A clinical trial of progesterone for severe traumatic brain injury[J].N Engl J Med, 2014,371(26): 2467-2476.
(本文编辑:陈 霞)
Introduction to methods of medical research design
ShenNing1,HuLiangping1,2*
(1.ConsultingCenterofBiomedicalStatistics,AcademyofMilitaryMedicalSciences,Beijing100850,China;2.SpecialtyCommitteeofClinicalScientificResearchStatisticsofWorldFederationofChineseMedicineSocieties,Beijing100029,China*Correspondingauthor:HuLiangping,E-mail:lphu812@sina.com)
This paper aims to provide guidelines for the applied medical research by introducing several key components in the methods of medical research design. Firstly, we summarized the five major types of medical research, which are non-clinical trial, clinical trial, observational study, systematic review and real world research. Next, we presented the architectures of medical research, which are design plan, implementing plan and conclusion plan. The three major plans can be further divided into 6 sub-plans. At last, we introduced the registration of clinical trials, including the definition, meaning, and concrete methods.
Medical research; Clinical trial; Survey study; Scientific research design; Design plan
国家高技术研究发展计划课题资助(2015AA020102)
R195.1
A
10.11886/j.issn.1007-3256.2017.04.002
2017-08-17)

