烟草品种GDSY-1的青枯病抗性与遗传分析
张振臣,袁清华,马柱文,郭培国,李集勤,邱妙文, 谢锐鸿,李淑玲,赵伟才,陈俊标*
(1.广东省农业科学院作物研究所,广东省农作物遗传改良重点实验室,广州 510640;2.广州大学生命科学学院,广州 510006;3.广东省烟草公司南雄科学研究所,广东 南雄 512400)
烟草品种GDSY-1的青枯病抗性与遗传分析
张振臣1,袁清华1,马柱文1,郭培国2,李集勤1,邱妙文3, 谢锐鸿1,李淑玲1,赵伟才3,陈俊标1*
(1.广东省农业科学院作物研究所,广东省农作物遗传改良重点实验室,广州 510640;2.广州大学生命科学学院,广州 510006;3.广东省烟草公司南雄科学研究所,广东 南雄 512400)
为比较广东地方晒烟品种GDSY-1和传统抗源DB101的青枯病抗性与遗传规律,于2011—2016年在温室和大田、苗期和成株期共7次对GDSY-1、DB101和长脖黄(感病品种)等3个品种的青枯病病情进行调查,并配制组合GDSY-1×长脖黄、DB101×长脖黄和GDSY-1×DB101,对其P1、P2、F1和F2代群体的青枯病发生情况进行比较,利用主基因+多基因混合遗传模型联合分析方法进行遗传分析。结果表明,GDSY-1的青枯病抗性优于DB101;DB101的抗性遗传以加性效应为主,符合2对加性主基因+加性-显性多基因模型(E-4),主基因遗传率低;GDSY-1的抗性遗传表现为部分显性,符合2对加性-显性-上位性主基因+加性-显性-上位性多基因模型(E-0),第1对主基因的加性效应值和显性效应值分别为−2.690 9和−2.690 9,抗病对感病完全显性,第2对主基因的加性效应值和显性效应值分别为−1.219 4和−0.230 7,抗病对感病呈部分显性,2对主基因存在互作效应,主基因遗传率高,为85.02%。GDSY-1的抗性遗传显性程度高、主基因遗传率高,具有较大的育种利用价值。
烟草;青枯病;抗性;遗传分析;主基因;多基因
烟草青枯病是茄科青枯劳尔氏菌(Ralstonia solanacoarum)引起的细菌性土传病害,广泛分布于热带、亚热带及某些温带地区,是威胁世界烟草生产的毁灭性病害,在我国南方烟区发生广、危害严重。该病害的药剂防治效果目前尚不十分理想,控制烟草青枯病最根本、最有效的措施是选育抗病品种。已报道发现的烟草青枯病抗源主要有以下3类:(1)美国从哥伦比亚收集的普通烟草品种T.I.448A,具有高水平抗性,抗性为多基因遗传[1-2];(2)土耳其香料烟品种Xanthi,具有低水平抗性,由部分显性基因Rxa控制[1-2];(3)日本地方晾晒烟品种Kokubu、Hatano、Odaruma、Awa,抗性由部分显性基因Rps控制,在病害压力较低时,表现为低抗至中抗;日本地方晾晒烟品种Enshu、Hatanodaruma等,抗性由部分显性基因Rps和多基因控制,具有高水平抗性[2-3]。张振臣等[4-5]从广东地方晒黄烟中筛选出高抗青枯病品种“大叶密合”,抗性为部分隐性遗传,符合2对加性-显性-上位性主基因+加性-显性多基因遗传模型。孙学永等[6-7]报道安徽歙县地方晾晒烟品种“歙圆四号”高抗青枯病,其一般配合力负向效应(抗性效应)值较强。T.I.448A是在烤烟抗病育种中应用最为广泛的抗源,由此育成的DB101及其衍生的Coker139、NC95和Coker319是抗青枯病育种的主体亲本[1-2,8-9],未见有利用其他几类抗源育成烤烟品种的报道,烤烟品种抗源单一使烟叶生产面临巨大风险。在野生烟草种中未发现抗青枯病资源[1],所有已知的抗源均来源于普通烟草种,我国地方烟草种质资源丰富,但大多数未进行过青枯病抗性鉴定或抗性遗传分析。GDSY-1是广东地方晒烟种质资源,遗传系谱不明,为了解其青枯病抗性及遗传规律,2011—2016年对其进行了抗性鉴定;通过构建GDSY-1×长脖黄、DB101×长脖黄和GDSY-1×DB101组合的P1、P2、F1和F2世代群体,采用植物数量性状混合遗传模型主基因+多基因多世代联合分析方法[10-11],分析比较GDSY-1和DB101的抗性遗传规律,为烟草抗青枯病育种提供理论依据。
1 材料与方法
1.1 青枯菌
2011—2012年抗性鉴定使用从广东韶关烟草植株中分离获得的中等致病力青枯菌菌株Tb588、Tb590(生理小种Ⅰ,生化变种Ⅲ)[12],由华南农业大学植物细菌研究室提供。
2016年抗性鉴定使用中等致病力青枯菌菌株B-2(生理小种Ⅰ,生化变种Ⅲ)[13],该菌株于2013年从广州市白云区烟草植株中采集,在氯化三苯基四氮唑(TTC)培养基上分离,−80 ℃下保存于25%甘油中。
将保存的菌液取10 µL在TTC平板上划线,30 ℃活化培养,待长出单菌落,挑单菌落接种于NA液体培养基,30 ℃,36 h。用无菌水配成所需浓度的菌悬液用于接种。
1.2 烟草品种
使用3个烟草品种:GDSY-1、DB101(抗病对照)和长脖黄(感病对照)。DB101的抗性来源于T.I.448A;GDSY-1为广东地方晒烟品种,抗性来源不明。2011年配制GDSY-1×长脖黄(G×长)、DB101×长脖黄(D×长)和GDSY-1×DB101(G×D)杂交组合F1,2012年通过套袋自交获得3个组合的F2代种子。
1.3 试验设计与病情调查
2011—2016年共7次对GDSY-1、DB101和长脖黄进行青枯病抗性鉴定,地点均位于广州市白云区钟落潭镇。(1)2011年5月12日将3个品种幼苗移栽至温室大棚内塑料盆中(土壤为新黄土),每品种16株,塑料盆置于盛水3~5 cm的薄膜池;5月22日用伤根灌菌液的方法,每株灌150 mL的细菌悬浮液(Tb588、Tb590混合菌株,1×107CFU/mL);在发病高峰期调查病情。(2)2012年3月14日将3个品种幼苗移栽至大田(土壤为砂质土,前茬水稻),随机区组设计,3次重复,每小区15株,行株距1.1 m×0.4 m;5月4日用伤根灌菌液的方法,每株灌150 mL的细菌悬浮液(Tb588、Tb590混合菌株,1×107CFU/mL);在发病高峰期调查病情。(3)2013—2015年,每年3月将3个品种幼苗移栽至上述大田(该田块每年种植2季烟草,多年观察发现除青枯病外其他病害较少发生),随机区组设计,3次重复,每小区15~20株,行株距1.1 m×0.4 m,不接青枯菌,自然发病;在发病高峰期调查病情。(4)2015年12月10日3个品种播种至温室内浅水育苗128孔塑料盘(基质配方为泥炭土∶碳化谷壳∶珍珠岩=3∶2∶1,播种前1周用甲醛和高锰酸钾熏蒸消毒),随机区组设计,3次重复,每小区1盘,于2月5日(烟苗5叶1心期)接种青枯菌菌株B-2,将菌液20 L/m2(3×107CFU/mL)加入育苗池;在发病高峰期调查病情。(5)2016年3月30日将3个品种幼苗移栽至大田(土壤为砂质土,前茬水稻),顺序排列,2次重复,每小区25株,行株距1.1 m×0.4 m,5月6日用伤根灌菌液的方法,每株灌150 mL的细菌悬浮液(B-2菌株,1×107CFU/mL);在发病高峰期调查病情。
2013年3月在广州市白云区钟落潭镇农田(2012年在该田块种植烟草并接种青枯菌菌株Tb588和Tb590,前茬烟草)种植GDSY-1、DB101和长脖黄及GDSY-1×长脖黄、DB101×长脖黄和GDSY-1×DB101组合的F1、F2,随机区组设计,3次重复,亲本和F1每小区种植20株,F2每小区种植60~90株,行株距1.1 m×0.4 m。在发病初期开始调查病情,每7 d调查1次,连续调查3~4次。
青枯病病情调查按GB/T 23222—2008标准进行,计算病情指数。
病情指数(病指)=∑(各级病株数×该病级值)/(调查总株数×最高级值)×100
1.4 数据分析
应用DPS软件对病情指数进行方差分析和多重比较(LSD)。采用数量性状主基因+多基因混合遗传分析windows版本软件包SEA[14](由章元明教授惠赠)对各组合P1、P2、F1和F2等4个世代单株的病情等级进行分析,其中P1、P2、F1的病级为重复平均数,通过比较1对主基因(A),2对主基因(B),多基因(C),1对主基因+多基因(D)和2对主基因+多基因(E)等5类24个遗传模型的AIC值,经遗传模型的适合性测验,确定最优模型,估算最适合模型的主基因和多基因效应值、遗传率等一阶遗传参数和二阶遗传参数。
2 结 果
2.1 3个品种的青枯病发病情况
从GDSY-1、DB101和长脖黄连续多年的发病情况来看(图1),3个品种的病情趋势基本一致,感病对照长脖黄病情最为严重(平均病指92.32),GDSY-1病情最轻(平均病指11.47),抗病对照DB101病情居中(平均病指34.35)。经方差分析表明(表1),品种间差异极显著,年份(批次)间差异不显著,长脖黄病指极显著高于GDSY-1和DB101,DB101病指极显著高于GDSY-1。
在温室或大田种植,接种混合菌株(Tb588、Tb590)、B-2菌株或病圃,苗期(图2)、移栽后39 d(图3)或移栽后80~92 d,GDSY-1的青枯病抗性均优于DB101。
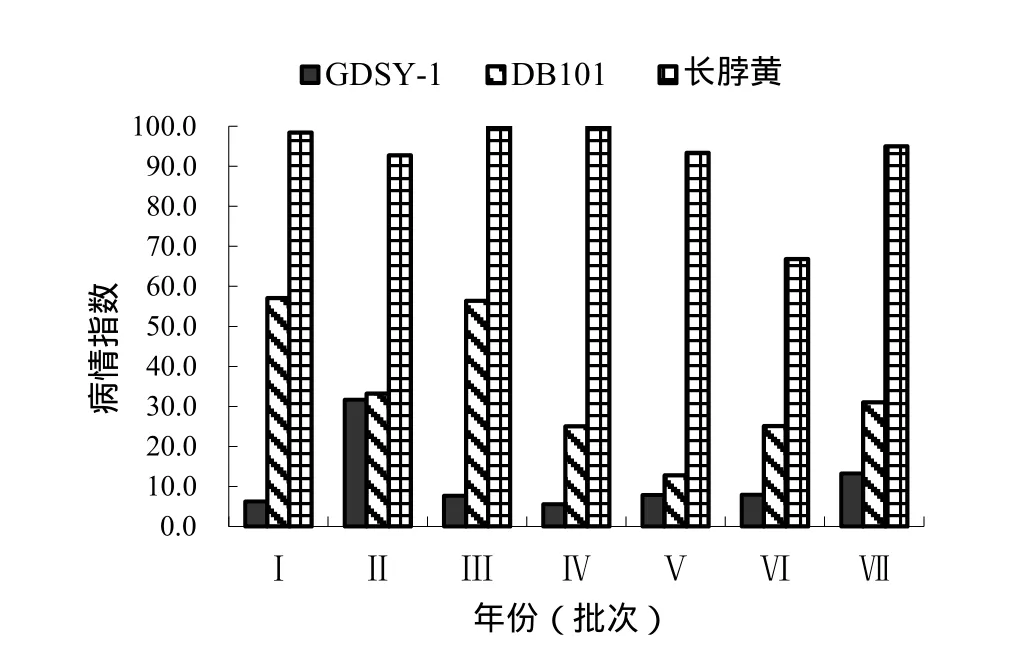
图1 2011—2016年GDSY-1、DB101和长脖黄病情指数Fig. 1 Disease indexes of GDSY-1, DB101 and Changbohuang in 2011 to 2016
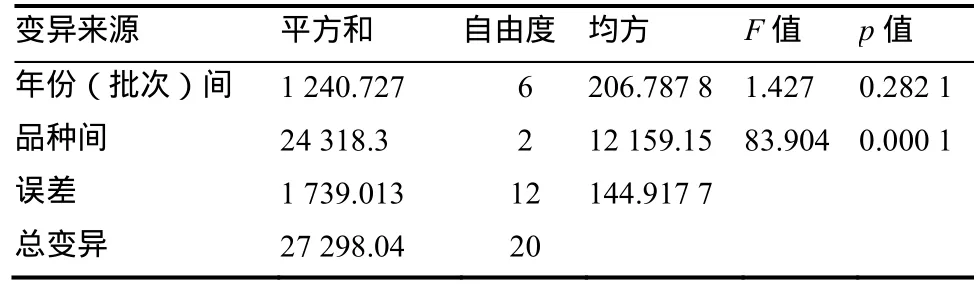
表1 病情指数方差分析Table 1 Variance analysis of disease index

图2 GDSY-1(A)、DB101(B)和长脖黄(C)苗期发病情况(2016年,广州)Fig. 2 Seedling disease situation of GDSY-1 (A), DB101 (B) and Changbohuang (C) in Guangzhou in 2016

图3 温室盆栽GDSY-1(A)、DB101(B)和长脖黄(C)发病情况(2011年,广州)Fig. 3 GDSY-1 (A), DB101 (B) and Changbohuang (C) plant disease in greenhouse in Guangzhou in 2011
2.2 F1发病情况
3个品种及其F1的病情指数发展曲线见图4,对亲本、F1的病情指数和双亲中值进行多重比较(表2)。DB101×长脖黄F1的病情指数位于双亲之间,与双亲中值的差异不显著,与抗、感亲本差异显著或极显著,表明DB101的抗性遗传主要表现为加性效应。GDSY-1×长脖黄F1的病情指数位于双亲之间,与感病亲本和双亲中值的差异极显著,在病情发展的早、中期与GDSY-1病情指数的差异不显著,在病情发展后期与GDSY-1病情指数的差异显著,表明GDSY-1的抗性遗传表现为部分显性。GDSY-1×DB101 F1的病情指数位于双亲之间,与DB101和双亲中值差异显著或极显著,与GDSY-1差异不显著,表明GDSY-1的抗性对DB101主要表现为显性效应。
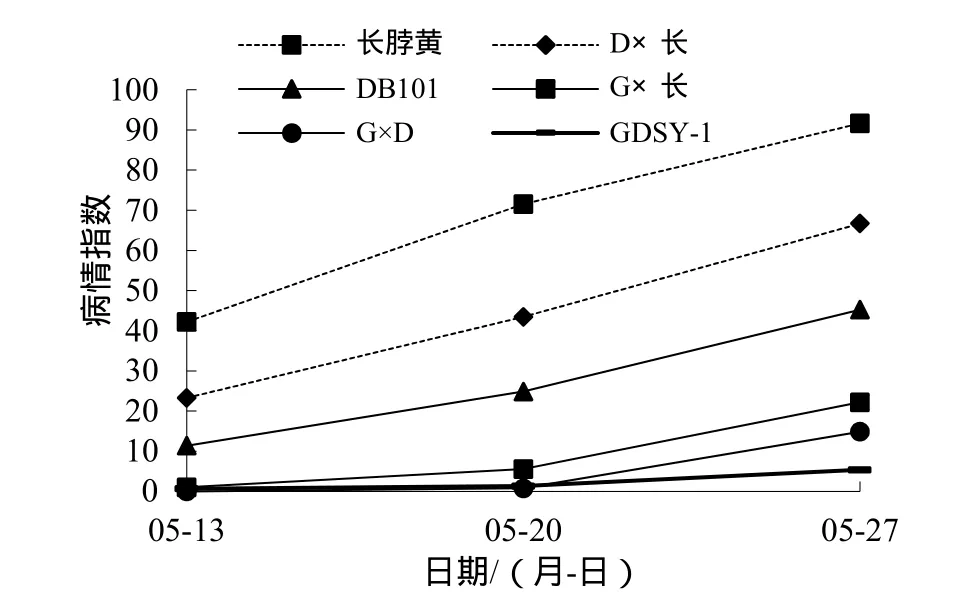
图 4 GDSY-1、DB101、长脖黄及其F1病情指数 (2013年,广州)Fig. 4 Disease indexes of GDSY-1, DB101, Changbohuang and their F1 in Guangzhou in 2013
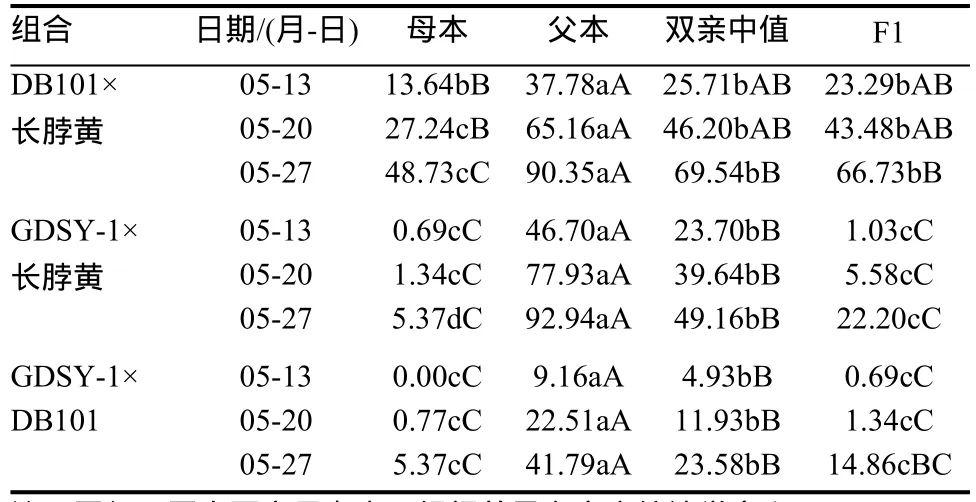
表2 亲本、F1的病情指数与双亲中值多重比较Table 2 Deviations of the F1s from the parents and the mid-parents
2.3 F2世代发病级别分布特征
为描述3个组合F2的发病级别分布特征,选取所有调查时期的数据制作次数分布图(图5~7)。在病情发展的所有时期,DB101×长脖黄组合F2的发病级别分布出现2个明显的峰,GDSY-1×长脖黄和GDSY-1×DB101组合F2的发病级别分布呈现偏态或双峰。从表型分布图形看,3个组合的抗性遗传均存在主效基因。
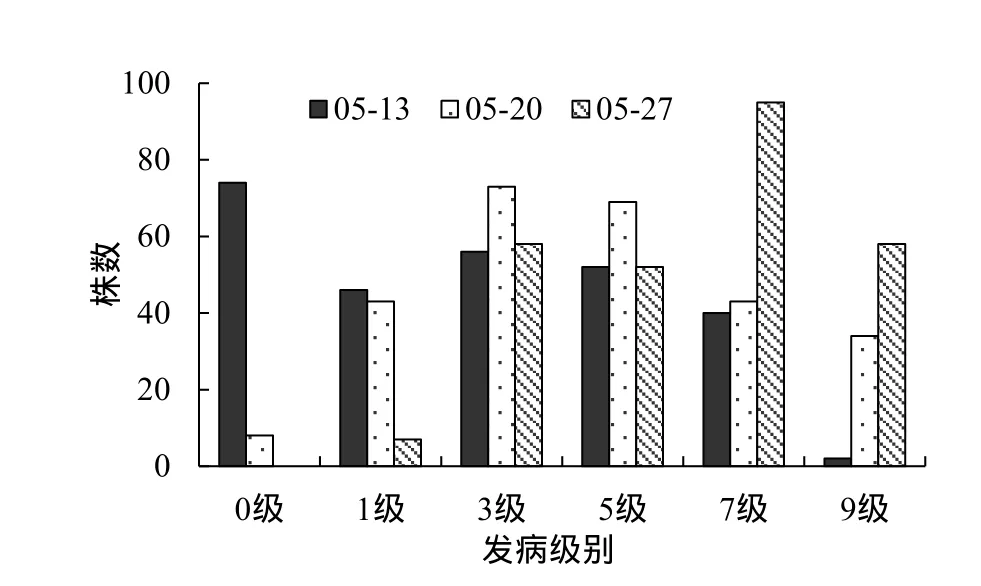
图5 DB101×长脖黄F2病情等级次数分布图 (2013年,广州)Fig. 5 Disease distribution of DB101×Changbohuang F2 at various growing dates in Guangzhou in 2013

图6 GDSY-1×长脖黄F2病情等级次数分布图 (2013年,广州)Fig. 6 Disease distribution of GDSY-1×Changbohuang F2 at various growing dates in Guangzhou in 2013
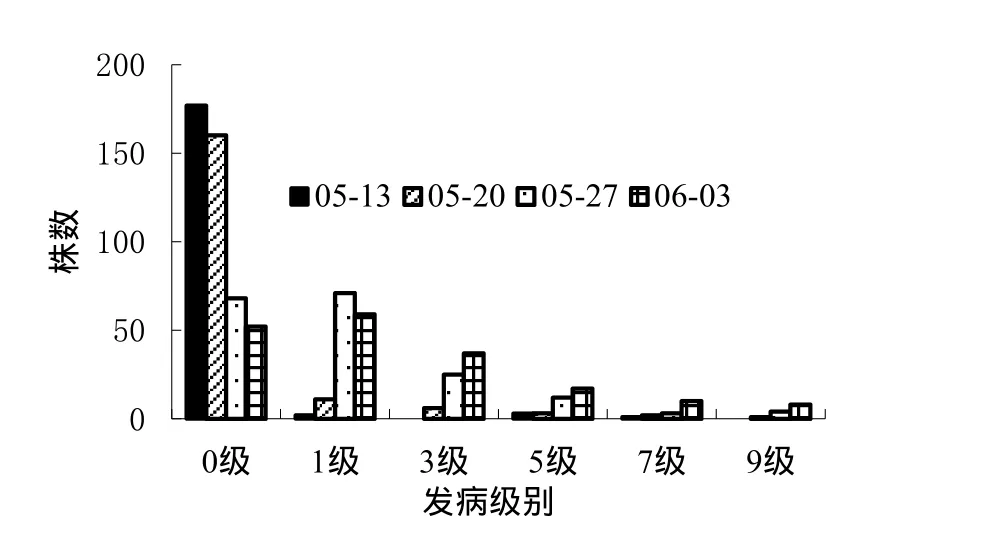
图7 GDSY-1×DB101 F2病情等级次数分布图 (2013年,广州)Fig. 7 Disease distribution of GDSY-1×DB101 F2 at various growing dates in Guangzhou in 2013
2.4 遗传模型选择
鉴于在青枯病害发展中期,感病单株普遍较大程度地发病,而抗病单株发病程度中等或较轻,这个时期抗性基因得到充分表达又能较好地区分抗感单株,因此,采用青枯病害发展中期的病情数据进行分析。将A-E 5类共24个遗传模型分别配合3个组合P1、P2、F1、F2四世代的病级次数表型分布,得到24个遗传模型的极大对数似然函数值(MLV)和AIC值(表3)。根据遗传模型的选取原则,选取AIC值最小及与最小AIC值比较接近的遗传模型作为备选模型。经适合性检验表明,DB101×长脖黄组合最适模型为E-4(2对等加性主基因+加性-显性多基因模型)。GDSY-1×长脖黄组合最适模型为E-0(2对加性-显性-上位性主基因+加性-显性-上位性多基因模型)。GDSY-1×DB101组合最适遗传模型为E-0。
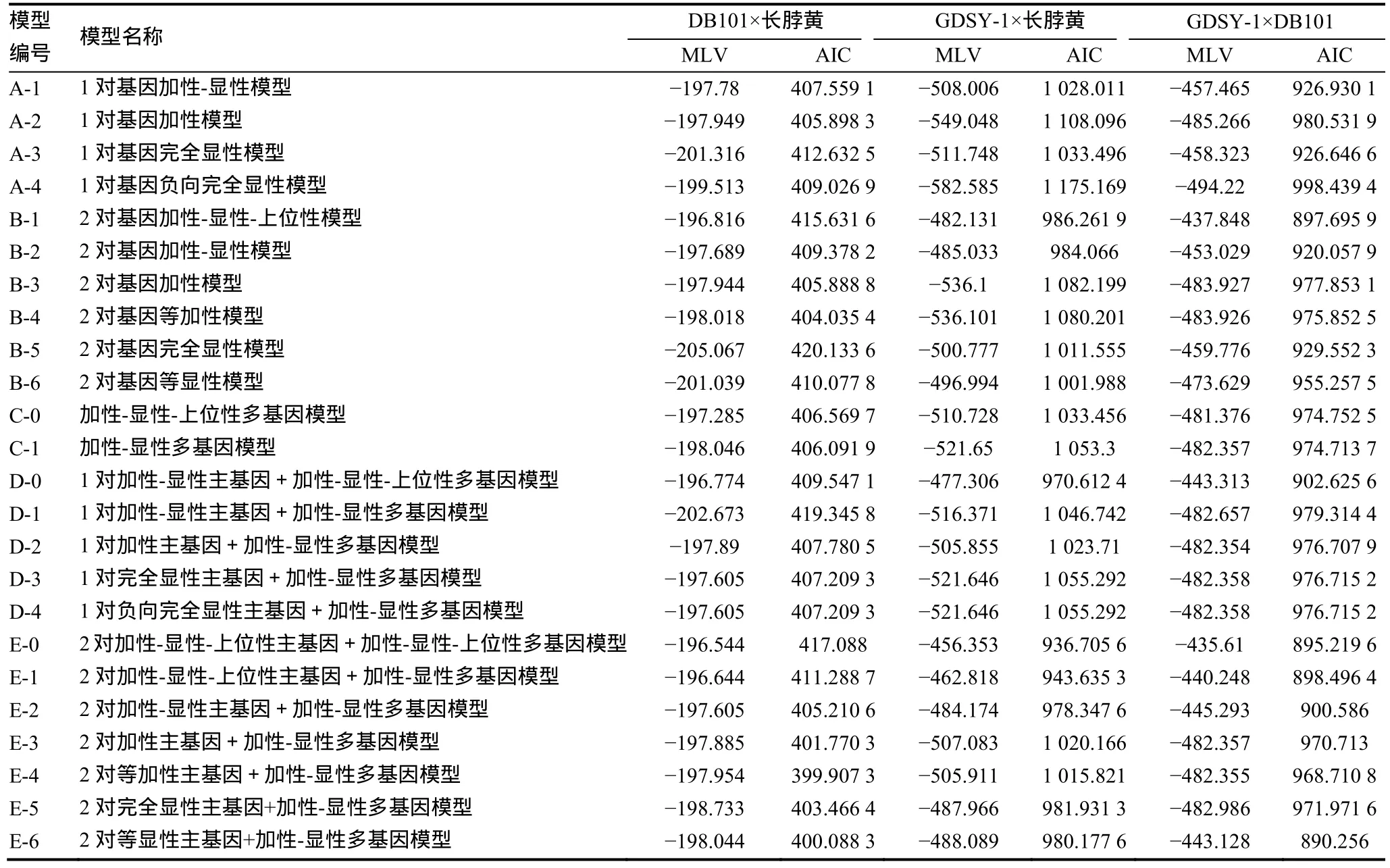
表3 各组合不同遗传模型的极大对数似然函数值(MLV)与AIC值估算结果Table 3 Maxinum likelihood value (MLV) and Akaike’s information criterion (AIC) of the genetic models
2.5 遗传参数估计
根据最适合模型估算各组合的青枯病抗性遗传参数(表4),DB101×长脖黄组合的抗性受2对等加性主基因控制,加性效应值为−0.848 8,主基因无显性和上位性效应,同时抗性还受多基因修饰,多基因加性效应值[d]和显性效应值[h]分别为−0.055 4和−0.727,主基因遗传率(hmg2)较低,为10.95%。
GDSY-1×长脖黄组合的抗性遗传符合2对加性-显性-上位性主基因+加性-显性-上位性多基因模型,第1对主基因的加性效应值和显性效应值分别为−2.690 9和−2.690 9,抗病对感病完全显性,第2对主基因的加性效应值和显性效应值分别为−1.219 4和−0.230 7,抗病对感病呈部分显性,第1对主基因的加性效应和显性效应作用均大于第2对主基因;2对主基因互作效应明显,加性效应间互作(i)为1.214 9,显性效应间互作(l)为0.230 7,加性和显性效应之间的互作(jab和jba)分别为0.230 7和1.219 4,上位性效应均为正向,i=jba=−db和l=jab=−hb,说明大主基因对次大主基因有显性上位作用。主基因遗传率(hmg2)较高,为85.02%,多基因的效应 值为0,说明多基因作用较小,检测不到且易受环境因素的影响。
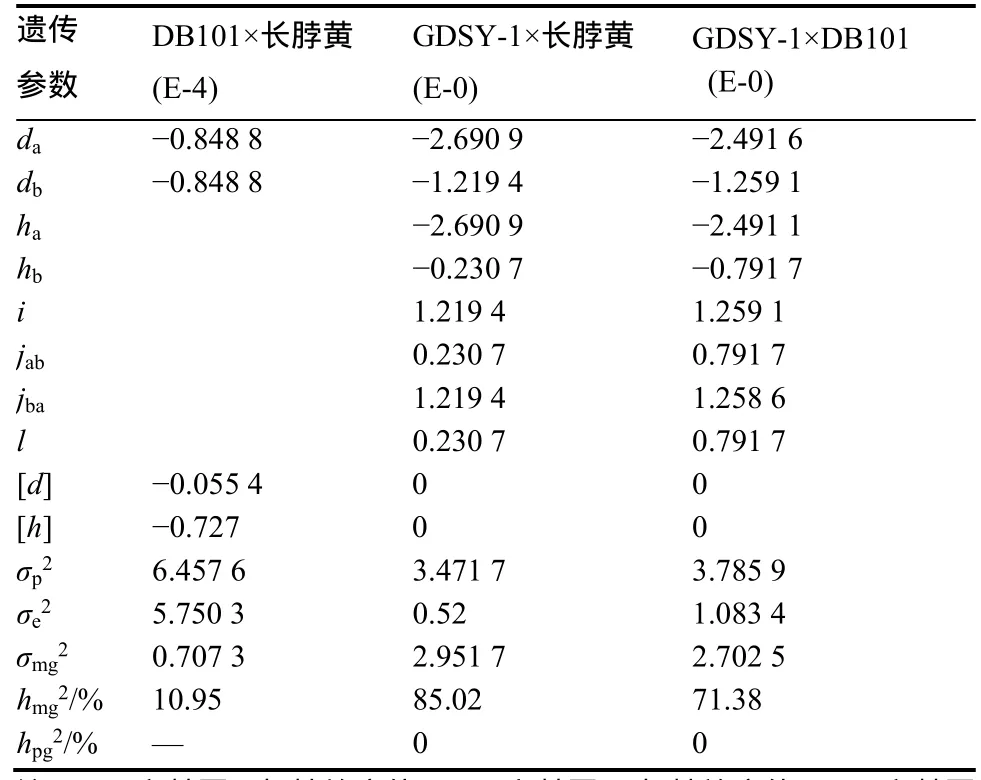
表4 青枯病抗性的遗传参数估计Table 4 Estimates of genetic parameters of resistant to bacterial wilt
GDSY-1×DB101组合的抗性遗传符合2对加性-显性-上位性主基因+加性-显性-上位性多基因模型,第1对主基因的加性效应值和显性效应值分别为−2.491 6和−2.491 1,抗病对感病近似于完全显性,第2对主基因的加性效应值和显性效应值分别为−1.259 1和−0.791 7,抗病对感病呈部分显性,2对主基因存在互作效应,加性×加性效应(i)为1.259 1,加性×显性效应值(jab)为0.791 7,显性×加性效应值(jba)为1.259 1,显性×显性效应值(l)为0.791 7,存在i=jba=−db和jab=−hb,说明大主基因对次大主基因有显性上位作用。主基因遗传率(hmg2)较高,为71.38%,主基因遗传率较GDSY-1×长脖黄组合略低。多基因的效应值为0,说明多基因作用较小,检测不到且易受环境等因素的影响。
3 讨 论
以往众多研究表明,烟草青枯病抗性遗传较为复杂,不同抗源的抗性遗传存在差异。来源于T.I.448A的抗性受多基因控制[1],早期报道为隐性遗传[1,15-16],近年多数报道为加性遗传[2,17]或以加性遗传为主[4,18-19],研究结果的差异可能与病害压力水平、其他病害影响或接种方法有关[2,20]。本研究结果表明,DB101的抗性遗传主要表现为加性效应,与近年研究者的结果基本一致。MATSUDA等[15]用来自T.I.448A抗源的抗病品种DB101与日本地方品种杂交,结果表明,两者抗性遗传方式不同。土耳其香料烟品种Xanthi,抗性由部分显性基因Rxa控制[21],高加明等[22]研究认为,Xanthi青枯病抗性遗传符合2对加性-显性-上位主基因+加性-显性多基因模型。部分抗源的抗性可以累加,通过TI79A×Xanthi杂交,选育出的79-X的抗性优于双亲[1];低抗品种Davis Special和Pinkney Arthur的抗性为隐性遗传,2个品种的杂交后代DSPA的抗性水平高于任何一个亲本[1]。本研究结果表明,GDSY-1的抗性遗传表现为部分显性,GDSY-1× DB101 F1和F2的病情指数分别比GDSY-1×长脖黄组合F1、F2低,推测GDSY-1与DB101的抗性既有显性效应又有累加效应。GDSY-1的抗病基因与Rxa、Rps基因的关系有待于进一步研究。
青枯菌菌株与烟草品种之间存在显著的相互作用[23]。根据青枯菌菌株在鉴别烟草品种上的反应特征,可将青枯菌菌株分为3种致病型:弱致病力型、中等致病力型和强致病力型[12,24]。本研究结果表明,GDSY-1对中等致病力青枯菌菌株Tb588、Tb590和B-2的抗性优于DB101。GDSY-1及其后代对不同区域的青枯菌菌株的抗性仍有待于研究。
烟草不同植株年龄对青枯病抗性表达存在差异[23]。方树民等[25]研究了18个烟草品种不同生育期与强致病力菌株t1的互作反应,将参试材料分为苗感成株抗病型和全期感病型两类。范江等[26]采用强致病力菌株Y45接种、漂浮池恒温水培方法对79个烟草种质苗期进行了青枯病抗性鉴定,结果表现抗病的品种2个,表现中抗的种质11个。本研究结果表明,在苗期和成株期,GDSY-1的青枯病抗性均优于DB101。
多年来,育种工作者不断尝试将各青枯病抗源应用于烟草育种。T.I.448A在植物学性状方面与烤烟相似,烤后烟叶具有均匀的颜色且没有不良的香气[1]。选择不同的杂交或回交亲本,其后代的表现差异较大,当T.I.448A与优质感病亲本400杂交,可获得较多的农艺性状优良的抗病后代,抗性筛选至F5代可获得与T.I.448A抗性相当的后代。T.I.448A的抗性由多基因控制,抗病育种时种植杂交后代分离群体的数量要大,SMITH等[1]通过T.I.448A与烤烟品种杂交,种植F2~F6代超过52 000株,测试了532个单株,最终只获得了5个具有育种价值的抗病品系。当使用79-X作为烤烟育种抗性来源时,抗性后代单株倾向于具有质量差的小叶[1]。日本地方晾烟类型的抗性与不良的烘烤性能紧密连锁,未应用于烤烟抗病育种,但对于抗青枯病白肋烟育种是有用的[16]。广东地方晒烟品种GDSY-1的抗性主基因遗传率高、显性程度高,在烤烟抗病育种中应用的关键是打破其抗性与不良性状的连锁。2012年至今,作者以GDSY-1为抗源,在青枯病圃进行烤烟抗病育种,通过杂交和回交获得了多个具有良好农艺性状的后代抗病单株。
4 结 论
经多年抗性鉴定结果表明,广东地方晒烟品种GDSY-1的青枯病抗性优于传统抗源DB101。对P1、P2、F1和F2 4个世代的联合分析结果表明,GDSY-1与DB101的抗性遗传不同。DB101的抗性遗传主要表现为加性效应,DB101×长脖黄组合的青枯病抗性遗传符合2对加性主基因+加性-显性多基因模型(E-4),主基因遗传率低。GDSY-1的抗性遗传表现为部分显性,GDSY-1×长脖黄组合的青枯病抗性遗传符合2对加性-显性-上位性主基因+加性-显性-上位性多基因模型(E-0),第1对主基因的加性效应值和显性效应值分别为−2.690 9和−2.690 9,抗病对感病完全显性,第2对主基因的加性效应值和显性效应值分别为−1.219 4和−0.230 7,抗病对感病呈部分显性,2对主基因存在互作效应,主基因遗传率85.02%。
[1] SMITH T E, CLAYTON E E. Inheritance of resistance to bacterial wilt in tobacco[J]. Journal of Agricultural Research, 1948, 76(1): 27-32.
[2] JACK A M.The CORESTA collaborative study on bacterial wilt (Ralstonia solanacearum) 2002 report[C]// CORESTA Information Bulletin, 2002(4): 45-58.
[3] MATSUDA T, OHASHI Y. Inheritance of Resistance to Bacterial Wilt Disease in Tobacco: I. Analysis of Gene Controlling the Resistance in Japanese Domestic Cultivars[J]. Japanese Journal of Breeding, 1973, 23(1): 35-42.
[4] 张振臣,吕永华,马柱文,等. 烟草品种“大叶密合”青枯病抗性遗传分析[J]. 中国烟草学报,2015,21(3):57-64.
[5] 张振臣,邓海滨,刘琼光,等. 广东抗青枯病烟草资源筛选[J]. 广东农业科学,2014,41(7):27-29.
[6] 孙学永,周应兵,杨华应,等. 烟草种质抗青枯病鉴定及其抗性分类[J]. 中国烟草学报,2011,17(3):61-66,88.
[7] 孙学永,钱益亮,王新胜,等. 烟草青枯病抗性的配合力分析[J]. 中国烟草科学,2014,35(1):72-75.
[8] 王元英,周健. 中美主要烟草品种亲源分析与烟草育种[J]. 中国烟草学报,1995,2(3):11-22.
[9] VALLEAU W D. Breeding tobacco for disease resistance[J]. Economic Botany, 1952, 6(1): 69-102.
[10] 章元明,盖钧镒,张孟臣. 利用P1F1P2和F2或F(2:3)世代联合的数量性状分离分析[J]. 西南农业大学学报,2000,22(1):6-9.
[11] 盖钧镒,章元明,王健康. 植物数量性状遗传体系[M]. 北京:科学出版社,2003.
[12] 郑向华,邓海滨,刘琼光,等. 广东省烟草青枯菌的菌系和遗传多样性[J]. 华中农业大学学报,2007,26(4):463-468.
[13] 谢锐鸿,巫升鑫,罗正友,等. 粤、闽、贵烟草青枯病菌分离株及其致病力[J]. 微生物学通报,2014,41(9):1800-1806.
[14] 曹锡文,刘兵,章元明. 植物数量性状分离分析Windows软件包SEA的研制[J]. 南京农业大学学报,2013,36(6):1-6.
[15] MATSUDA T, OHASHI Y. Inheritance of resistance to bacterial wilt disease in tobacco: II. inheritance of resistance originated from TI448 A and relation between those and Rps gene[J]. Japanese Journal of Breeding, 1973, 23(4): 175-180.
[16] NAKAMURA A, MATUDA T, OHASHI Y. Inheritance of resistance to bacterial wilt in tobacco[J]. Indian Journal of Genetics & Plant Breeding, 1974, 34A: 83-88.
[17] 范江,刘勇,童治军,等. 烤烟品种‘Oxford207’青枯病抗性的遗传分析与分子标记初选[J]. 中国农学通报,2013,29(34):50-55.
[18] 孙学永,王新胜,张丽娜,等. 烟草青枯病抗性的遗传分析[J]. 中国农学通报,2013,29(34):56-60.
[19] JIN J E, KO M S. Inheritance of resistance to bacterial wilt in flue-cured tobacco (Nicotiana tabacum L.)[J]. Korean Journal of Breeding, 1988, 20(2): 146-154.
[20] 刘勇,范江,李永平. 烟草抗青枯病育种研究进展[J]. 中国烟草学报,2012,18(6):93-99.
[21] MATSUDA T. Fundamental studies on the breeding of bacterial wilt resistant varieties in tobacco[J]. Bulletin of the Utsunomiya Tobacco Experiment Station, 1977, 15: 95.
[22] 高加明,王志德,张兴伟,等. 香料烟青枯病抗性基因的遗传分析[J]. 中国烟草科学,2010,31(1):1-4.
[23] KATAWCZIK M, L MILA A. Plant age and strain of Ralstonia solanacearum affect the expression of resistance of tobacco cultivars to granville wilt[J]. Tobacco Science, 2012, 49: 8-13.
[24] 方树民,顾钢,纪成灿,等. 烟草青枯菌致病型及分布的研究[J]. 中国烟草学报,2002,8(3):40-43.
[25] 方树民,陈剑芳,顾刚,等. 烟草品种抗青枯病鉴定中相关因素分析[J]. 植物保护学报,2001,28(2):123-128.
[26] 范江,刘勇,李永平,等. 烟草苗期青枯病抗性鉴定及其抗性评价方法的比较[J]. 云南农业大学学报,2014,29(4):487-493.
Inheritance of Resistance to Bacterial Wilt in Chinese Domestic Tobacco Cultivar GDSY-1
ZHANG Zhenchen1, YUAN Qinghua1, MA Zhuwen1, GUO Peiguo2, LI Jiqin1, QIU Miaowen3XIE Ruihong1, LI Shuling1, ZHAO Weicai3, CHEN Junbiao1*
(1. Crops Research Institute, Guangdong Academy of Agricultural Sciences, Guangdong Provincial Key Laboratory of Crops Genetics and Improvement, Guangzhou 510640, China; 2. College of Life Science, Guangzhou University, Guangzhou 510006, China; 3. Nanxiong Research Institute of Guangdong Tobacco Co., Ltd., Nanxiong, Guangdong 512400, China)
In order to clarify the mode of inheritance of resistance to bacterial wilt disease, genetic analysis was performed under major gene+polygene mixed inheritance model using the P1, P2, F1 and F2 populations of three crosses among GDSY-1, DB101 and Changbohuang. GDSY-1, a Chinese domestic sun-cured cultivar, was newly identified to have high resistance to bacterial wilt caused by Ralstonia solanacearum. DB101 is a USA cultivar, carrying the polygenic resistance derived from T.I.448A. Changbohuang, a Chinese domestic flue-cured cultivar, was susceptible to bacterial wilt. The results indicated that GDSY-1 was considerably more resistant than DB101. The inheritance of DB101 resistance showed mainly additive effects, conforming to the two adding major genes plus additive-dominance polygene model (E-4). The inheritance of GDSY-1 was partially dominant, conforming to the two additive-dominance-epistatic major gene plus additive -dominance-epistatic polygene model (E-0). The additive and dominant effect values of the first major gene were -2.6909 and -2.6909, with the resistance being completely dominant. The additive and dominance effect values of the second major gene were -1.2194 and -0.2307, with the resistance being partially dominant. The heritability of major genes was 85.02%.
tobacco; bacterial wilt; resistance; inheritance; major gene; polygene
S572.03
1007-5119(2017)04-0009-08
10.13496/j.issn.1007-5119.2017.04.002
广东省烟草专卖局(公司)科技项目“烟草抗青枯病育种及分子标记辅助选择研究”(201403)、“烟草种质资源保护利用和全省品种区试”(201302)、“晾晒烟资源的挖掘、评价和利用”(201217)
张振臣(1977-),男,高级农艺师,从事烟草遗传育种研究。E-mail:zhangzhenchen163@163.com。*通信作者,E-mail:jbchen2007@126.com
2017-01-09
2017-05-23

