DC-CIK细胞联合化疗治疗晚期非小细胞肺癌的临床研究
王志尚, 冯谢敏, 田东东
(延安大学附属医院, 陕西 延安, 716000)
DC-CIK细胞联合化疗治疗晚期非小细胞肺癌的临床研究
王志尚, 冯谢敏, 田东东
(延安大学附属医院, 陕西 延安, 716000)
目的 探讨DC-CIK联合化疗治疗晚期非小细胞肺癌的疗效及安全性。方法 112例晚期非小细胞肺癌患者随机分为实验组(n=56)和对照组(n=56),实验组给予DC-CIK细胞联合化疗治疗,对照组仅给予化疗治疗,比较2组的疗效及安全性。结果 2组有效率分别为60.7%和48.9%, 差异无统计学意义(P>0.05); 实验组疾病控制率为89.3%, 显著高于对照组的73.2%(P<0.05); 治疗后实验组KPS评分提高率显著高于对照组(P<0.05); 实验组患者的毒副反应显著轻于对照组,中位生存期显著长于对照组 (P<0.05)。结论 DC-CIK细胞与化疗联合用于晚期非小细胞肺癌的治疗,能够有效提高疾病控制率,延长患者生存期,改善患者生存质量。
DC-CIK; 晚期非小细胞肺癌; 临床效果
肺癌包括非小细胞肺癌和小细胞肺癌,其主要治疗方式首选手术切除治疗,术后结合放疗及化疗,但肺癌对化疗药物有多重耐药性,对放疗的敏感性也较低,从而导致肺癌患者的5年生存率不足15%[1]。免疫细胞治疗是通过激活肿瘤患者体内T细胞介导的肿瘤杀伤效应,提高机体对抗肿瘤细胞的能力[2]。树突状细胞(DC)及细胞因子诱导的杀伤细胞(CIK)疗法对肿瘤细胞具有更为强大的杀伤力及更低的毒副作用,且在体外增殖能力活跃,是目前较为常用的免疫细胞疗法[3]。本研究对晚期非小细胞肺癌患者采取DC-CIK联合化疗治疗,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取本院2012年1月—2014年1月收治的晚期非小细胞肺癌患者112例,男64例,女48例,年龄41~72岁,平均年龄(57.8±6.1)岁,所有患者入院后均经组织病理学检查确诊,且预计生存期均超过3个月,入院前未经过任何放化疗、手术及免疫治疗,且血常规、尿常规、肝肾功能及凝血功能均正常。所有患者排除严重心脑血管疾病、肝肾功能不全、严重血液系统疾病及免疫系统疾病,排除合并其他恶性肿瘤者,排除精神障碍类患者。将112例患者按照随机数字表法分为对照组和实验组,每组56例。对照组男31例,女25例,年龄43~72岁,平均年龄(58.9±5.4)岁; 病理类型: 鳞癌29例,腺癌15例,大细胞癌12例; 临床分期: ⅢA期28例, ⅢB期19例, Ⅳ期9例。实验组男29例,女27例,年龄41~70岁,平均年龄(57.1±6.2)岁; 病理类型: 鳞癌27例,腺癌17例,大细胞癌12例; 临床分期: ⅢA期30例, ⅢB期16例, Ⅳ期10例。所有患者治疗前均签署知情同意书。2组患者在年龄、性别、病理类型及临床分期等方面比较均无显著差异(P>0.05), 具有可比性。
1.2 方法
所有患者均采用相同的化疗方案进行治疗, 75 mg/m2多西他赛注射液加入到250 mL 0.9%氯化钠溶液中,第1天滴注,在1 h内滴注完成,顺铂75 mg/m2分3 d静点, 1个治疗周期为3周。实验组患者于治疗前2 d采集外周血,通过血细胞成分分离机分离出核细胞,并对DC-CIK细胞进行培养。2周后,将培养的DC-CIK细胞分3次输入患者体内。1个治疗周期为3周,所有患者均给予2个周期的治疗。
1.3 观察指标
疗效评定: 根据WHO实体瘤近期疗效评判标准对两种治疗方法的疗效进行评估[4]: 完全缓解(CR), 部分缓解(PR), 疾病稳定(SD), 疾病发展(PD)。总有效率=CR+PR, 疾病控制率=SD+PR+CR。生存质量: 记录所有患者治疗前后身体状况,根据Karnofsky (KPS)法进行评分[5], 分值增加≥10分为改善,增加或减少<10分为稳定,减少≤10分为下降。总改善率=(改善+稳定)/总例数×100%。比较2组患者治疗期间毒副反应发生情况。所有患者随访时间为1~24个月,中位随访时间为13.5个月,记录生存时间。生存时间为从开始治疗至随访截止时间或死亡的时间。
1.4 统计学方法
应用SPSS 13.0统计软件进行统计分析,率的比较采用χ2分析,生存分析采用Kaplan-Meier生存曲线和log rank检验,检验水准α=0.05。P<0.05为差异有统计学意义。
2 结 果
2.1 2组临床疗效比较
实验组CR 1例, PR 33例, SD 16例, PD 6例,总有效率为60.7%, 疾病控制率为89.3%; 对照组CR 0例, PR 24例, SD 17例, PD 15例,总有效率为42.9%, 疾病控制率为73.2%。2组总有效率比较无显著差异(P=0.089),实验组疾病控制率显著高于对照组(P=0.029)。见表1。

表1 2组临床疗效比较[n(%)]
与对照组比较, *P<0.05。
2.2 2组患者治疗后生活质量比较
实验组治疗后KPS评分提高率显著高于对照组(P<0.05)。见表2。
2.3 2组患者不良反应发生情况比较
2组患者均出现不同程度的血液系统、消化系统、肝肾功能等方面的不良反应,实验组消化道反应、发热、乏力的发生率显著低于对照组(P<0.05), 2组其他不良反应发生率比较无显著差异(P>0.05), 见表3。
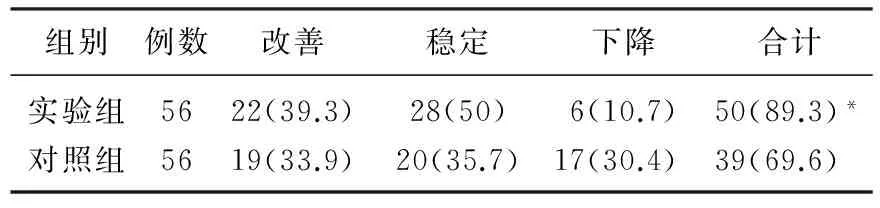
表2 2组患者生活质量比较[n(%)]
与对照组比较, *P<0.05。

表3 2组患者不良反应发生情况比较[n(%)]
与对照组比较, *P<0.05。
2.4 2组患者生存时间比较
实验组患者的中位生存时间为13.5个月(95%CI: 10.4~16.8), 对照组患者中位生存时间为11.2个月(95%CI: 8.9~14.3); log-rank结果显示,实验组中位生存期显著长于对照组(P=0.048), 见图1。
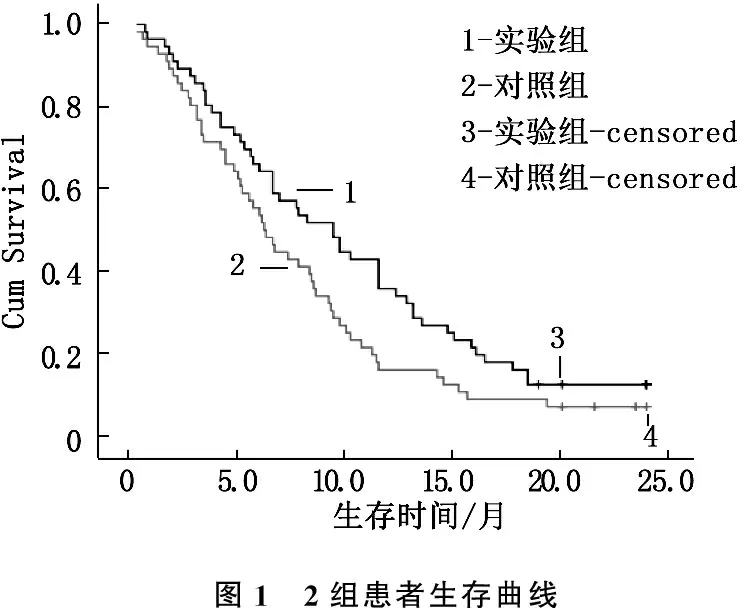
图1 2组患者生存曲线
3 讨 论
肺癌是最为常见的恶性肿瘤之一,5年生存率极低,仅为15%左右,80%的肺癌属于非小细胞肺癌,严重威胁着人们的生命与健康[6]。非小细胞肺癌起病隐匿,患者确诊时大多已属晚期,手术已无法实施,且多数患者身体状况较差,难以耐受高强度的放疗或化疗,导致治疗效果不理想[7]。随着医疗技术的快速发展,肿瘤生物免疫治疗在抗肿瘤治疗中得到了越来越广泛的应用。肿瘤生物免疫治疗是通过分离自体外周血中的单个核细胞,并在体外进行扩增,再回输入体内,增强并调节机体的免疫功能以达到对抗肿瘤的目的[8]。DC为抗原递呈细胞,可以诱导初始型T细胞抗原呈递,把信息传输给CIK细胞。CIK细胞在DC的指导下,能够有效杀伤肿瘤细胞。通过联合DC和CIK, 有效地提高了肿瘤治疗的靶向性,CIK细胞被激活后,其增殖能力显著增加,且效应细胞的数量也明显增多,显著提升了杀伤肿瘤细胞的能力[9]。因此,DC细胞不仅激活CIK细胞的杀伤作用,而且刺激抗原特异性T细胞增殖,二者联合增强了抗肿瘤的作用[10]。
本研究结果显示,实验组和对照组的疾病控制率分别为89.3%和73.2%, 差异有统计学意义(P<0.05), 说明DC-CIK细胞联合化疗治疗效果优于单纯化疗,能够有效地杀伤肿瘤细胞并控制其生长; 实验组患者KPS评分提高率显著高于对照组(P<0.05), 原因可能是单纯化疗在杀伤肿瘤细胞的同时,对机体其他正常细胞也具有杀伤作用,导致患者免疫力低下,在原有病情的基础上又增加了并发感染等并发症的风险,而联合DC-CIK细胞治疗不仅能直接杀伤肿瘤细胞,还能刺激机体产生获得性免疫,恢复正常的免疫功能[11], 提高机体对抗肿瘤的能力,减少并发症的发生率,改善患者生存质量。生存分析结果显示,实验组和对照组中位生存期分别为13.5个月和11.2个月, 2组比较有显著差异(P<0.05)。有临床研究结果[12]证实, DC-CIK联合化疗能够延长非小细胞肺癌患者的生存期,提高患者的生存率及生活质量。2组患者治疗后均出现不同程度的毒副反应,实验组患者胃肠道反应,食欲下降及乏力的发生率显著低于对照组,说明DC-CIK联合化疗方法可以缓解患者化疗后的胃肠道不适,增加食欲和减轻乏力。
综上所述, DC-CIK联合化疗治疗晚期非小细胞肺癌不仅能提高治疗的效果,还能有效地延长患者生存时间,改善生活质量,缓解不良反应,具有良好的安全性及有效性。
[1] 支修益, 石远凯, 于金明, 等. 中国原发性肺癌诊疗规范(2015年版)[J]. 中华肿瘤杂志, 2015, 37(1): 67-78.
[2] 刘丽萍, 王军, 王丽霞, 等. 树突状细胞-细胞因子诱导的杀伤细胞治疗晚期非小细胞肺癌的疗效分析[J]. 中国肿瘤临床与康复, 2016(2): 143-145.
[3] 陈东升, 吴光兴. 树突状细胞联合细胞因子诱导的杀伤细胞治疗晚期非小细胞肺癌的近期疗效观察[J]. 中国肿瘤临床与康复, 2015(3): 264-266.
[4] Chung B M, Tom E, Zutshi N, et al. Nexus of signaling and endocytosis in oncogenesis driven by non-small cell lung cancer-associated epidermal growth factor receptor mutants[J]. World J Clin Oncol, 2014, 5(5): 806-823.
[5] Rades D, Dziggel L, Nagy V, et al. A new survival score for patients with brain metastases who received whole-brain radiotherapy (WBRT) alone[J]. Radiother Oncol, 2013, 108(1): 123-127.
[6] 蔡文科, 石云. 非小细胞肺癌分期技术的应用研究及第七版肺癌分期的解析[J]. 国际肿瘤学杂志, 2013, 40(7): 523-526.
[7] 张岩, 易升明, 吴志雄, 等. 中晚期非小细胞肺癌同步放化疗与树突状细胞联合细胞因子活化杀伤细胞生物治疗的临床效果[J]. 中国肿瘤临床与康复, 2016(1): 59-62.
[8] 郭卫东. 探析DC-CIK联合化疗治疗晚期非小细胞肺癌的临床效果[J]. 中华肿瘤防治杂志, 2016, 23(5): 335-336.
[9] 李威威, 张海萍, 吴敏, 等. DC-CIK细胞联合常规化疗治疗晚期非小细胞肺癌的临床有效性与安全性分析[J]. 河北医药, 2016, 38(19): 2900-2904.
[10] 高岱清, 刘淑贞, 赵鹏, 等. 恶性肿瘤术后DC联合CIK治疗的临床观察[J]. 中华肿瘤防治杂志, 2009, 16(3): 222-225.
[11] 吴标, 郭增清, 王丽莉, 等. DC/CIK维持治疗晚期非小细胞肺癌的临床观察[J]. 临床肿瘤学杂志, 2014(10): 917-920.
[12] 邵青, 石磊, 黄丽斌, 等. 自体DC-CIK维持治疗对晚期非小细胞肺癌患者生活质量的影响[J]. 肿瘤预防与治疗, 2015, 28(6): 322-329.
Clinical study of DC-CIK cell combined with chemotherapy in the treatment of advanced non-small cell lung cancer
WANG Zhishang, FENG Xiemin, TIAN Dongdong
(Affiliated Hospital of Yan′an University, Yan′an, Shaanxi, 716000)
Objective To evaluate the safety and clinical efficacy of DC-CIK cell combined with chemotherapy in the treatment of patients with advanced non-small cell lung cancer (NSCLC). Methods A total of 112 patients with NSCLC were randomly divided into observation group (n=56) and control group (n=56), the observation group was treated with DC-CIK immunotherapy combined with chemotherapy, and the control group was treated with chemotherapy only, then the efficacy and safety were compared between the two groups. Results The response rate of the observation group and the control group were 60.7% and 48.9%, respectively, and there was no significantly difference(P>0.05), and the disease control rate of the observation group was 89.3%, which was higher than 73.2% in the control group(P<0.05). The KPS score in the observation group after treatment was significantly higher than that in the control group (P<0.05). Compared with the control group, the observation group had less toxicity reaction, and longer middle survival time (P<0.05). Conclusion DC-CIK cell combined with chemotherapy can effectively increase the disease control rate, extend the survival time, and improve the quality of life in patients with NSCLC, so it is worthy of promotion.
DC-CIK; advanced non-small cell lung cancer; clinical efficacy
2017-01-14
R 734.2
A
1672-2353(2017)15-085-03
10.7619/jcmp.201715023

