肺腺样囊性癌4例病例报告
贺玺兰 陈建华
肺癌是我国非常常见的肺部肿瘤,不同的病理学分型及分期的肺癌患者,其治疗方案也千差万别。肺腺样囊性癌是涎腺样中肿瘤的一种,发病率极低,在临床极为少见。本文收集了2012年1月-2016年12月间我院收诊的4例肺腺样囊性癌患者,通过对患者病理学分型,免疫组化检查,表皮生长因子受体(epidermal growth factor receptor, EGFR)及间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)突变检测,影像学表现,治疗及预后情况进行汇报,分析该疾病的治疗及预后情况。
1 病例资料
1.1 病例1 患者男,78岁,吸烟30余年,20支每天。因“咳嗽1个月,胸痛10天”2014年在当地医院行胸部计算机断层扫描(computed tomography, CT)检查,检查提示:“右下肺病变性质待查:肺癌?结核瘤?”患者为求进一步诊疗,遂来我院。肺部增强CT(图1A、图1B):1.右下肺肿块,性质待定,肺癌?炎性假瘤?并右下肺炎性病变。2.慢性支气管疾患,双肺肺大泡及少许纤维化灶。B超:肝、胆、脾脏、胰腺、双肾未见明显异常;腹腔、腹膜后、双侧肾上腺区未见明显肿块;心内结构未见明显异常;左心舒张功能减退、收缩功能正常范围。脑磁共振成像(magnetic resonance imaging, MRI)平扫+增强:双侧基底节及放射冠区多发腔隙性梗塞灶;脑白质疏松。完善支气管镜检查:提示支气管炎。考虑肿块局限,遂于2014年9月22日予以胸腔镜手术治疗。术后病理结果:腺样囊性癌。免疫组化:CD117(++)、LCK(+)、CK-7(散在个别+)、GCDFP-15(-)、HCK(++)、CK-P(+)、CD56(-)、CD99(-)、EMA(-)、VIM(++)、TTF-1(-)、P63(-)、SYN(-)、CGA(-)、CK5/6(++)。完善肿瘤组织EGFR突变检测:19号外显子与21号外显子均无突变。ALK突变检测(-)。术后患者未行其他治疗,随访至今,患者目前仍健在。
1.2 病例2 患者女,50岁。无吸烟史。2013年11月发现“右肺肿块”,行支气管镜检查提示:右肺主气管可见粘膜肥厚肿胀,粗糙不平,管腔内狭窄堵塞。行外科手术,术后病检提示:右下肺中分化腺样囊性癌,肿块最大径2.8 cm,支气管残端未见癌累及,送检第7、9、11、12组淋巴结未见癌转移。2016年7月因受凉后出现头晕、咳嗽,无明显发热、胸闷等不适。在当地医院予以抗炎治疗。未见明显好转,2016年8月复查胸部CT发现右前上纵隔肿块。遂再次来我院,体查发现颈部淋巴结肿大,肺部CT及胸部MRI(图1C、图1D)提示纵隔淋巴结肿大。完善颈部淋巴结活检,考虑肺腺样囊性癌淋巴结转移。完善血液EGFR突变检测,检测提示:19号外显因子与21号外显因子均无突变。予以行长春瑞滨74 mg+顺铂100 mg方案化疗,3周期后患者纵隔淋巴结较前增大,考虑疾病进展,后改放疗100% GTVnd 60 Gy/28次+100%CTVnd 60 Gy/28次+98.2% PTVnd 60 Gy/28次+紫杉醇脂质体120 mg单药化疗,后续仍用长春瑞滨74 mg+顺铂100 mg方案化疗3周期及贝伐珠单抗400 mg抗肿瘤血管生成。病情稳定后持续使用贝伐珠单抗抗血管生成维持治疗。随访至今患者颈部及纵隔淋巴结未见继续增大,仍在用贝伐珠单抗抗肿瘤血管生成。
1.3 病例3 患者男,62岁,因“刺激性咳嗽10天,发现左肺肿块1周”于2012年入院,完善检查后于2012年10月12日行手术治疗,术中病理检查提示:肺腺样囊性癌。肿瘤组织EGFR突变检测:19号外显子与21号外显子均无突变。术后每年复查肺部CT,2017年电话随访患者,患者目前良好,2017年4月复查肺部CT未见肿块。未服用药物。
1.4 病例4 患者男,70岁,因“声嘶18天”于2014年入住我院,完善肺部+腹部增强CT,提示:左上肺肿块,考虑肺癌可能性大,伴双侧肾上腺及腹膜后转移。支气管镜检查:发现左上叶管腔见新生物阻塞。活检行病理学检查提示:实性腺样囊性癌,免疫组化结果提示:免疫组化:Ki-67约20%、CK5/6(-)、P63(-)、SYN(-)、TTF-1(-)、CGA(-)、LCK(-)、HCK(+)、CD117(+)、PLAP(-)。EGFR及ALK突变检测均(-)。行肺癌综合讨论,考虑患者目前病变范围广,不考虑行手术及放疗,遂予以行紫杉醇脂质体240 mg及卡铂400 mg方案化疗1周,后患者拒绝化疗予以出院,后患者6个月后死亡。
2 讨论
腺样囊性癌(adenoid cystic carcinoma, ACC)是涎腺肿瘤[1],可出现远处转移。腺样囊性癌常发生在头颈部唾液腺,腺样囊性癌也少见发生在脾脏、肾脏、骨、淋巴结、肝脏[2]。然而原发于肺部的腺样囊性癌更少见,占肺癌患者的0.09%-0.2%[3]。既往认为这是一种低度恶性肿瘤,并且患者较常见的肺癌类型如非小细胞肺癌患者预后好。该病主要发病于50岁-60岁,男女发病率无性别差异,发病率及预后与是否吸烟无关。本文4例患者中2例未吸烟。
大多数肺腺样囊性癌发生于大气道,也可发生于小气道。本文4例患者中3例发生于大气道,1例发生在小气道。即使该肿瘤被认为是低度恶性肿瘤,但晚期患者可出现全身转移及肿块压迫气管导致使患者窒息死亡。本文只有1例患者病情晚,发现时已转移至腹膜后淋巴结,不能手术仅行内科治疗,预后不好,其他3例均可手术治疗,2例治愈,1例复发,复发后患者经放化疗,治疗效果尚好,维持治疗存活中。
目前研究认为:肺腺样囊性癌病程长,从出现肺部肿块到患者出现症状可达数年至数十年。早期发现手术治疗多数可治愈。该肿瘤也可出现远处转移,一般是原发肿瘤出现数年后再发生远处转移,可通过淋巴道转移至纵隔淋巴结,腹膜后淋巴结;也可通过血道转移至肝、骨、心脏瓣膜、肾上腺等[4,5]。本研究结果与之相符。
该肿瘤病理学一般表现有3种组织学亚型,即实性、囊状和管状,但分级困难,因为肿瘤可能会显示多于一种亚型的病理学表现。患者病理学表现提示为实性,可能预后更差。但是目前认为对于该疾病预后分析,分期比病理及免疫组化都更为重要。细胞学研究发现瘤体内存在重复的中型大小的肿瘤细胞聚集。该瘤体细胞核浓染颗粒,均匀分布的染色质。肿瘤细胞通常围绕一个核心安排均匀黏液样物质,或三维形式及“球形”集群[6]。目前研究[7]发现,miR-205在原发腺样囊性癌中高表达,然而miR-155和miR-342在复发的腺样囊性癌中高表达。免疫组化检查可出现:细胞角蛋白(CK)、p63、S-100、波形蛋白(vimentin)和平滑肌肌动蛋白表达阳性。而甲状腺转录因子-1、突触小泡蛋白、CD-56、CK20及嗜铬粒蛋白A不表达[8]。
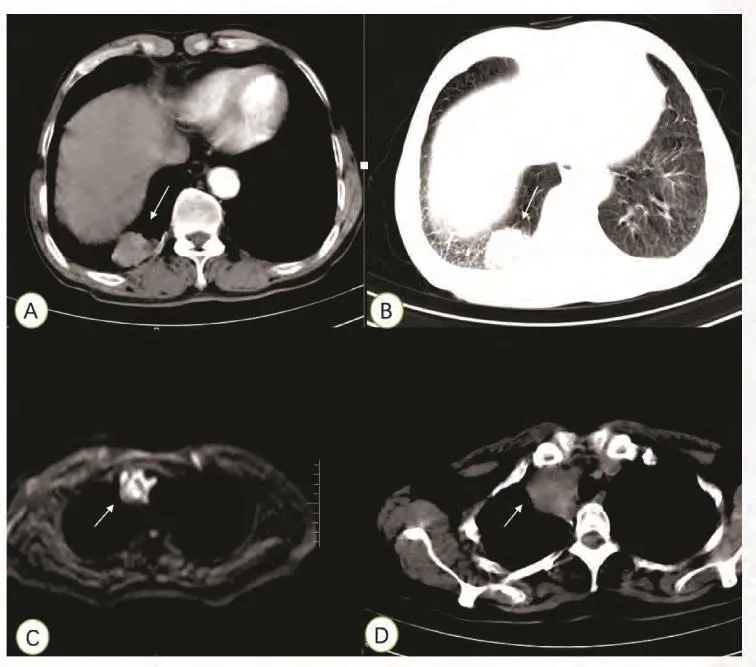
图 1 病例影像学资料:A、B为病例1患者肺部CT检查资料,箭头处可见该肿块,该肿块位于右下叶后基底段;C、D为病例2患者肺部及纵隔MRI及CT纵膈窗检查资料,箭头处可见该肿块。Fig 1 Imaging data of cases. A and B belong to Case 1, the mass could be seen from arrow,the mass was located in the lower lobe basal segment; C, D belong to Case 2, figure C was MRI data in lung and mediastinumand, D was CT scan data of this mass. MRI: magnetic resonance imaging; CT: computed tomography.
针对肺腺样囊性癌患者行基因突变检测,本文报告该4例患者均未出现EGFR突变阳性,2例行肿瘤组织ALK突变检测均提示(-)。Huo等[9]在24例原发肺腺样囊性癌患者通过桑格测序法、二代基因检测等方法行EGFR、KRAS、BRAF、ALK、PIK3CA、PDGFRA和DDR2突变检测,24例患者均未发现基因突变检测。有文献[3]报道对32例肺腺样囊性癌患者肿瘤组织行KIT基因突变检测,32例均表达阳性,且其中18例患者提示所测肿瘤组织中50%出现KIT表达检测阳性。且小型临床试验提示该类肿瘤对靶向药物不敏感[10],考虑该类肿瘤EGFR、ALK突变可能低,针对EGFR及ALK突变的靶向药物治疗不理想。然而也有个例报道肺腺样囊性癌存在EGFR突变,2016年日本报道了1例80岁老年女性肺腺样囊性癌患者病理检测出现EGFR突变,患者每日口服吉非替尼250 mg,病灶缩小。提示肺腺样囊性癌极少存在EGFR突变,偶有EGFR突变,口服EGFR-TKI有效[11]。本文4例患者均无EGFR突变,2例无ALK突变,与多数文献报道相符。
早期肺腺样囊性癌主要以手术治疗为主,但由于影像学无法准确评估该肿块大小及范围,且腺样囊性癌倾向于浸润神经,导致大约30%手术患者可出现切缘阳性,出现术后复发转移。在我院就诊的4例肺腺样囊性癌患者中3例行手术治疗,2例治愈,1例复发,1例出现多处转移,分期较晚患者预后明显不良。
肺腺样囊性癌是一种放疗敏感性肿瘤[12]。对于无法切除的肺腺样囊性癌,手术病理提示切缘阳性,以及术后原位复发无法再次行手术的患者,放疗是可行的治疗方式,对于能够完全切除且切缘阴性的肺腺样囊性癌,是否行术后放疗,目前文献存在争议[13]。
对于晚期无法行手术及放疗的患者,且患者肿块出现快速进展增大及压迫症状时可考虑化疗[14]。目前已有5-氟尿嘧啶、顺铂、表柔比星、紫杉醇、吉西他滨单药化疗对于治疗反应的评估。然而仅在顺铂及米托蒽醌组少数患者出现完全缓解,其余组均未见完全缓解。目前常用化疗是含铂的第三代化疗药物联合的双药方案。
随着分子靶向药物的发展,对于晚期无法行手术、放疗及化疗患者,分子靶向药物临床试验也在进行。目前已有伊马替尼[15]、吉非替尼[16]、硼替佐米[17]、拉帕替尼[10]、西妥昔单抗[18]的小型临床试验结果,然而目前临床实验结果均不甚理想,暂未予以加入临床推荐治疗。
目前暂未见免疫治疗及CAR-T治疗用于肺腺样囊性癌临床试验,但是对于晚期肺腺样囊性癌患者我们期待更多更好的临床治疗。
肺腺样囊性癌预后,对于能行完全切除腺样囊性癌患者其5年生存率为100%,其10年生存率为90%[19]。对于不能行完全切除的腺样囊性癌生存期降低,5年及10年生存率仅为33.3%-53%[20]。
总之,肺腺样囊性癌手术患者预后较好,正确认识,早期发现能提高患者生存率,但晚期预后不好。虽然该肺部肿瘤发病率低,但在临床实践中仍可遇见,其发生机制与常见的小细胞肺癌及非小细胞肺癌有区别,预后也存在差异。

