矮秆基因Rht_NM9在小麦株高建成中对内源激素含量的影响
卢 媛崔超凡胡 平陈佩度沈雪芳韩 晴王义发邢莉萍,*曹爱忠,*
1上海市农业科学院作物育种栽培研究所, 上海 201403;2南京农业大学作物遗传与种质创新国家重点实验室 / 细胞遗传研究所 / 江苏省现代作物生产协同创新中心, 江苏南京 210095
矮秆基因Rht_NM9在小麦株高建成中对内源激素含量的影响
卢 媛1,2崔超凡2胡 平2陈佩度2沈雪芳1韩 晴1王义发1邢莉萍2,*曹爱忠2,*
1上海市农业科学院作物育种栽培研究所, 上海 201403;2南京农业大学作物遗传与种质创新国家重点实验室 / 细胞遗传研究所 / 江苏省现代作物生产协同创新中心, 江苏南京 210095
普通小麦品种“南农9918”经甲基磺酸乙酯(ethyl methanesulfonate, EMS)诱变获得一个矮秆、多蘖、长穗突变体“NM9”, 在该突变体中定位到一个新的矮秆突变基因 Rht_NM9。内源激素在普通小麦株高建成的过程中发挥重要的调节作用, 为了解析Rht_NM9致矮的生理机制, 本研究以南农9918及其矮秆突变体NM9为材料, 利用酶联免疫吸附分析法(enzyme-linked immunosorbent assays, ELISA)测定了不同生育期各节间内源赤霉素(GA)、生长素(IAA)、脱落酸(ABA)和玉米素核苷(ZR)的含量, 分析小麦发育关键时期的内源激素含量变化与株高的关系。结果表明, 在孕穗期和抽穗期, 矮秆突变体NM9中GA、ABA含量均显著高于南农9918, 而ZR含量则显著低于南农9918, IAA含量在南农9918和突变体NM9之间无明显差异。此外, 突变体NM9各节间中GA/ABA比值显著高于南农9918,而IAA/ABA、(IAA+GA)/ABA、ZR/ABA比值显著低于南农9918。以上结果表明小麦株高受多种激素调控, 突变体中内源ABA含量升高, IAA/ABA和ZR/ABA比值降低会抑制植物株高伸长。
小麦; 株高; 突变体; 内源激素
株高是禾本科作物的重要农艺性状, 它不仅影响植株表型, 还影响作物的高产稳产。近年来, 随着肥水条件的不断改善, 倒伏仍是限制小麦高产的重要因素。倒伏与小麦千粒重、经济系数和产量均呈负相关[1]。此外, 倒伏不仅会对小麦产量造成不良影响, 严重时可减产80%, 同时还会降低籽粒品质[2]。株高与倒伏呈正相关[3]。目前, 降低株高仍是提高抗倒伏性最主要的措施[4]。从“第一次绿色革命”开始,植物株高性状的调控机制和遗传基础一直是遗传育种研究的热点。
植物内源激素通过促进、抑制或改变生理活动,调控植物的生长发育进程[5]。在已发现的植物激素中, 赤霉素(gibberellin, GA)、细胞分裂素(cytokinin, CTK)、生长素(auxin, IAA)和脱落酸(abscisic acid, ABA)均参与了植物的株高建成[6-9]。目前, 在模式植物拟南芥和水稻中, 对植株的矮化机制已有较深入的研究。例如, 过表达水稻 GA信号转导抑制因子SLR1, 会导致株高降低[10]。拟南芥DDF1基因通过抑制GA合成, 降低内源GA含量, 使植株矮化[11]。在ACL5等位基因突变体tkv中, 通过抑制IAA极性运输, 使株高降低[12]。矮秆突变体nhr1中内源ABA含量较野生型显著提高; 对其野生型外施 ABA, 野生型株高显著降低[13]。在小麦中, 对矮秆基因的研究还远不如拟南芥和水稻深入。目前, 在小麦中仅克隆了矮秆基因Rht-B1b、Rht-D1b和Rht-B1c, 均是拟南芥GAI基因的同源基因, 编码GA信号转导通路的抑制因子DELLA蛋白, DELLA蛋白的GA信号感知区发生突变, 导致突变体对外源 GA信号感知功能丧失, 从而对茎秆伸长产生持续的抑制作用,最终形成对GA不敏感的矮化表型[10,14-16]。
多种植物激素间的相互作用对植物生长发育起着综合调控作用。熊国胜等[17]认为大多数植物激素对植物生长发育的调控作用比较复杂, 同一种激素可以调控多个发育过程, 而一个特定的发育过程同时需要多种不同激素的协同作用。其中, 激素含量比值变化就是影响植物发育的重要因素。张立军等[18]研究发现, GA/ABA、IAA/ABA和(IAA+GA)/ABA的比值能反映植物生长与休止状况, 比值较低时抑制型激素ABA的含量占优势, 植物处于缓慢发育或休止状态; 比值高则相反。殷稳娜等[19]发现, 高秆型小黑麦中GA/ABA、IAA/ABA、(IAA+GA)/ABA比值均高于矮秆型小黑麦, 这 3种内源激素间比值与小黑麦的株高密切相关。苜蓿中随着外施ABA浓度的提高, GA/ABA、IAA/ABA、ZR/ABA比值明显下降, 株高也随之降低[20]。Dong等[21]研究发现, GA/ABA和(IAA+GA+ZR)/ABA比值升高, 能促进苹果晚熟品种的种子萌发。此外, IAA/ABA比值与板栗生根率高度正相关, 连续继代培养时IAA/ABA比值增加有利于生根率提高[22]。小麦籽粒中ZR/ABA、GA/ABA、IAA/ABA比值与籽粒产量和淀粉含量极显著正相关[23]。以上研究结果表明, 植物内源激素含量以及内源激素含量比值变化与包括株高在内的植物生长发育密切相关。
本研究前期利用EMS对普通小麦“南农9918”进行诱变, 获得一个矮秆、多蘖、长穗突变体“NM9”,并在其 2A染色体短臂上定位了一个新的小麦矮秆基因 Rht_NM9。本研究以普通小麦品种南农 9918及其矮秆突变体NM9为材料, 通过对其不同生育期各节间中内源 GA、IAA、ZR和 ABA含量, 以及GA/ABA、IAA/ABA、(IAA+GA)/ABA、ZR/ABA比值变化的比较, 分析小麦株高建成中内源激素含量变化和激素间的相互作用, 探究Rht_NM9对激素的调控模式。
1 材料与方法
1.1 试验材料
以南农9918和NM9为试材。普通小麦品种南农9918含有矮秆基因Rht-B1b和Rht8, 由南京农业大学细胞遗传研究所培育。NM9为前期研究利用EMS对南农9918进行诱变, 获得的一个矮秆、多蘖、长穗突变体, 其株高(28.95±3.46 cm)较野生型(89.95±2.65 cm)降低了68%, 表现为极度矮化, 且有效分蘖数较野生型增加近 1倍, 穗长较野生型长了约3 cm[24]。Lu等[24]利用F2遗传群体及其F2:3家系,在突变体 NM9中定位到一个新的小麦部分显性矮秆基因Rht_NM9。
1.2 材料种植和取样
2013年和2014年的11月10日于南京农业大学江浦试验站塑料大棚种植试验, 行长 1.50 m, 行距0.25 m, 每行播 30粒, 二叶一心期间苗, 每行保留长势一致的7株(株距0.25 m)。田间常规管理, 在冬季气温较低时, 将塑料大棚内与外环境隔离, 以提升棚内温度, 提高材料的生长速度; 在气温较高的3月中旬至成熟, 打开大棚两侧通风降温。
前期研究发现, 突变体在孕穗期和抽穗期的苗高极显著低于野生型, 各节间长度显著缩短, 导致成株期突变体株高较野生型极显著降低[24]。因此,本研究在孕穗期随机选取每行中间的共 10个单株,在测量株高的同时, 分别在孕穗期和抽穗期从突变体及野生型顶端第 1节间(1IU, 节向上 1 cm处取样)、第2节间(2IU)、第3节间(3IU), 以及抽穗期顶端数第4节间(4IU)取0.5 g样品, 液氮速冻, -70℃保存, 取样结束后统一测定内源激素含量。
1.3 激素提取及其含量测定
向样品中加入 2 mL提取液(80%甲醇, 含 1 mmol L–1二叔丁基对甲苯酚), 在冰浴下研磨成匀浆,转入10 mL试管中, 再用2 mL提取液分2次将研钵冲洗干净, 一并转入试管中, 摇匀后放置在4℃冰箱中浸提 4 h。取上清液过 C-18固相萃取柱(C18 Sep-Park Cartridge, Waters Corp, USA), 真空浓缩干燥过柱后的样品, 除去甲醇, 最后用1 mL样品稀释液(PBS, pH 7.5, 含0.1% Tween-20, 0.1%明胶)溶解。
根据Teng等[25]的方法, 用酶联免疫吸附分析法(enzyme-linked immunosorbent assays, ELISA)测定内源赤霉素(GA)、脱落酸(ABA)、玉米素核苷(ZR,细胞分裂素类物质)和生长素(IAA)的总含量。用酶标仪(Tecan M200 PRO, Tecan, Switzerland)测定标准物和各样品在490 nm处的OD值。最后, 用激素标样各浓度(ng mL–1)的自然对数与各浓度显色值的logit值的回归方程, 求样品激素浓度。试剂盒购于中国农业大学作物化学控制研究中心, 标准样的最大浓度, IAA、ABA为100 ng mL–1, ZR为20 ng mL–1, GA为10 ng mL-1。重复2年试验, 每年重复2次, 每次每样品均设置3个重复。
1.4 统计分析
用 SPSS 16.0软件计算内源激素含量和激素含量比值的标准差; 以t-test统计分析突变体与野生型对应节间内源激素含量、激素含量比值的差异显著性。用SigmaPlot 12.5软件根据内源激素含量、激素含量比值的平均值和标准差绘制柱形图。
2 结果与分析
2.1 突变体 NM9及其野生型株高建成中内源GA、IAA、ZR、ABA含量变化
比对野生型和突变体各个节间长度及细胞形态,发现突变体 NM9茎秆薄壁细胞及各节间长度的显著缩短, 导致突变体株高较野生型极显著降低。为了研究 NM9茎秆中内源激素含量变化是否是Rht_NM9基因引起突变体表型变异的原因, 分别在孕穗期和抽穗期对突变体及其野生型各节间内源GA、IAA、ZR、ABA含量进行了测定。
2.1.1 突变体和野生型 GA 含量变化 在孕穗期和抽穗期, 突变体各节间中GA含量均极显著高于野生型(图 1-A)。野生型在抽穗期顶端第 3节间的 GA含量最低(5.68±1.79 ng g–1), 而突变体在孕穗期顶端第3节间的GA含量最低, 为64.25±5.18 ng g–1, 是野生型GA最低含量的11倍; 野生型在孕穗期顶端第 1节间的 GA含量最高(17.36±4.85 ng g–1), 而突变体在抽穗期顶端第4节间的GA含量最高, 为155.15±14.56 ng g–1, 是野生型GA最高含量的 9倍(图 1-A)。此外, 比较发现, 即使突变体节间中GA最低含量也是野生型节间中GA最高含量的4倍, 突变体各节间中GA含量远高于野生型(图1-A)。
2.1.2 突变体和野生型 ABA含量变化 在孕穗期和抽穗期, 突变体各节间内源ABA含量极显著高于野生型的对应节间(图1-B)。突变体中, 孕穗期顶端第2节间的ABA含量最高, 为809.25±50.31 ng g–1,在抽穗期顶端第 1节间的 ABA含量最低, 为183.44±7.77 ng g–1; 而在野生型中, 在孕穗期顶端第3节间ABA含量最高, 仅为152.96±9.18 ng g–1,显著低于突变体各节间 ABA最低含量(图 1-B), 可见突变体茎秆中ABA含量远高于野生型。
2.1.3 突变体和野生型 ZR含量变化 在孕穗期和抽穗期, 突变体和野生型 內源 ZR含量变化趋势相同, 均呈先上升后下降(图1-C)。突变体和野生型ZR含量在各节间的分布相同, 孕穗期突变体(25.87±1.67 ng g–1)和野生型(32.71±0.38 ng g–1)顶端第2节间的ZR含量最高, 抽穗期突变体(21.51±2.05 ng g–1)和野生型(41.51±2.10 ng g–1)顶端第3节间的ZR含量最高(图1-C)。比较发现, 孕穗期和抽穗期突变体各节间内源 ZR含量均显著低于野生型对应节间(图1-C)。
2.1.4 突变体和野生型IAA含量变化 在孕穗期和抽穗期, 突变体和野生型各节间中IAA含量变化趋势相同, 表现为从形态学上端节间(顶端第1节间)至形态学基部节间(孕穗期顶端第3节间, 抽穗期顶端第4节间) IAA含量呈逐渐上升趋势, 在基部节间IAA含量达到最大值(图1-D), 在突变体和野生型各节间之间形成了IAA浓度梯度。然而, 将突变体各节间内源IAA含量和野生型对应节间相比, 均无显著差异(图1-D)。
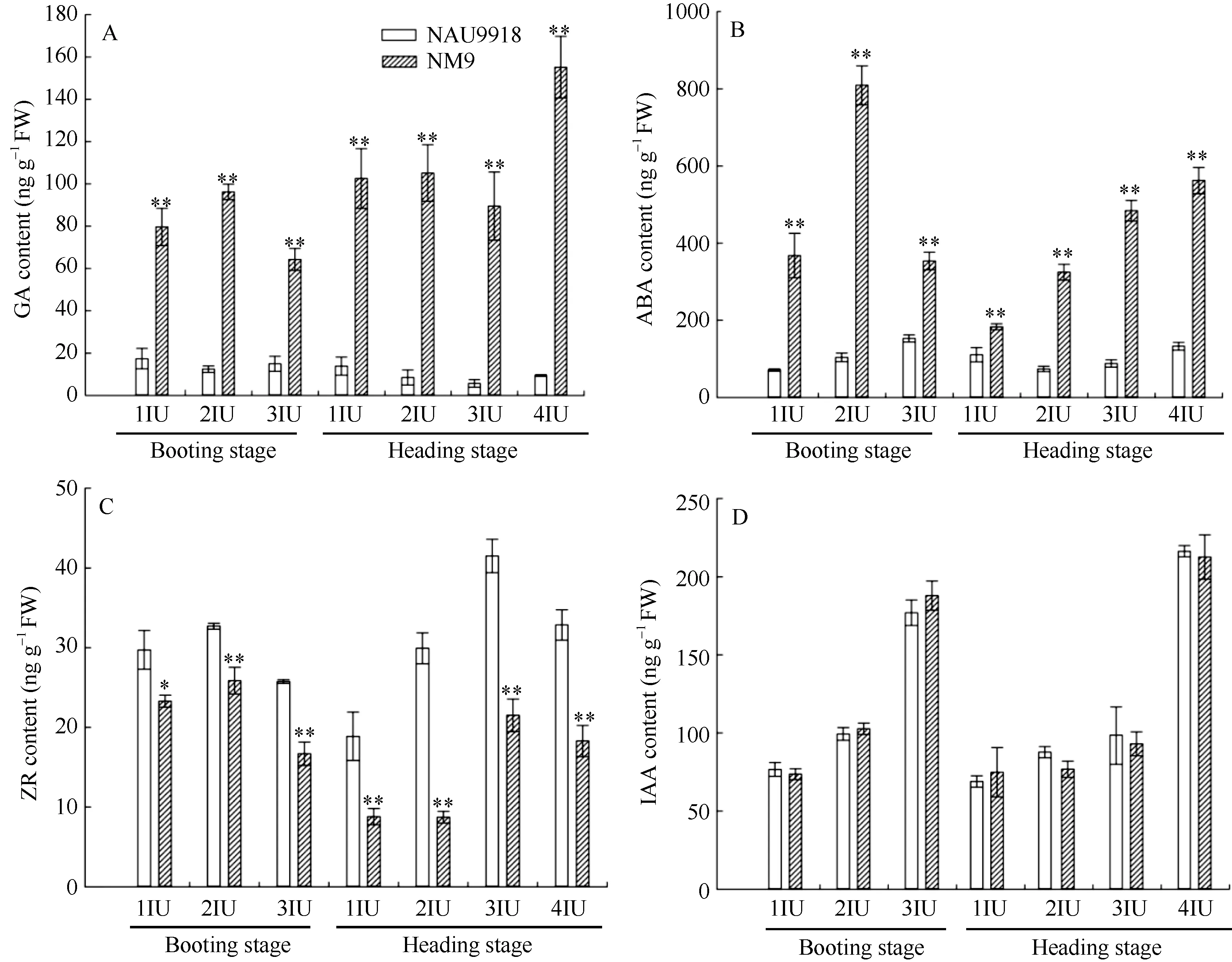
图1 孕穗期和抽穗期矮秆突变体NM9及其野生型南农9918各节间内源激素含量变化Fig. 1 Changes of endogenous phytohormone contents in different internodes of dwarf mutant NM9 and its wild-type NAU9918 at booting and heading stageA: GA含量; B: ABA含量; C: ZR含量; D: IAA含量; 1IU~4IU: 顶端第1~第4节间。*和**分别表示突变体和野生型在P < 0.05 和P < 0.01水平差异显著。A: GA content; B: ABA content; C: ZR content; D: IAA content; 1IU–4IU: the first, second, third, and forth internode from the top, respectively. * and ** indicate significant difference between the mutant and the wild-type at the 0.05 and 0.01 probability level, respectively.
2.2 突变体 NM9和野生型各节间内源激素含量比值变化
突变体孕穗期顶端第 3节间以及抽穗期各节间的 GA/ABA比值均显著高于野生型(图 2-A)。除了抽穗期顶端第1节间中(IAA+GA)/ABA比值在突变体和野生型之间无显著差异外, 突变体各节间的IAA/ABA、(IAA+GA)/ABA、ZR/ABA比值均极显著低于野生型对应节间(图2-B, C, D)。
3 讨论
3.1 小麦株高发育与內源GA激素含量变化的关系
GA是促进植物茎秆伸长的重要激素[26-27]。目前,在水稻、拟南芥等模式植物中对内源 GA含量变化与株高发育的关系已有较深入的研究, 发现 GA合成代谢和信号转导通路相关基因, 通过对 GA合成代谢途径或信号转导通路的调控, 调节植株 內源GA含量, 控制植物株高发育。例如GA合成通路中,赤霉素合成关键酶基因OsGA20ox2突变会抑制GA合成, 降低内源GA含量, 导致植株矮化[28]。GA代谢通路中, OsGA2ox1基因通过2β-羟基化活性GA降低突变体内源活性 GA含量, 导致株高降低[29]。PHOR1是GA信号转导通路的正向调控因子, 抑制PHOR1表达会降低植株对GA的响应, 使内源GA大量累积, GA含量显著提高, 植株矮化[30]。虽然小麦中根据植株对外施 GA的响应, 将矮秆突变体分为GA敏感型和GA不敏感型两大类, 认为GA敏感型矮化突变体内源GA合成通路受阻, 内源GA缺乏或痕量存在; 而GA不敏感型矮化突变体的内源GA含量变化不大, 甚至显著高于野生型。然而, 目前对GA含量变化对小麦株高发育影响的定量分析研究还很少。突变体 NM9株高降低是由 GA不敏感型小麦矮秆基因Rht_NM9导致[24]。本研究发现, 矮秆突变体NM9各节间中GA含量均极显著高于野生型,该结果与前人对 GA信号转导通路受阻的矮秆突变体中 GA含量变化的研究结果相同, 推测Rht_NM9基因通过抑制突变体中GA信号转导途径抑制受GA诱导的植物生长发育, 导致突变体内源 GA含量显著升高, 植株矮化。

图2 孕穗期和抽穗期矮秆突变体NM9及其野生型南农9918各节间激素含量比值变化Fig. 2 Changes of phytohormone content ratio in different internodes of dwarf mutant NM9 and its wild-type NAU9918 at booting and heading stageA: GA/ABA比值; B: IAA/ABA比值; C: (IAA + GA)/ABA比值; D: ZR/ABA比值; 1IU~4IU: 顶端第1~第4节间。*和**分别表示突变体和野生型在P < 0.05 和P < 0.01水平差异显著。A: GA/ABA ratio; B: IAA/ABA ratio; C: (IAA + GA)/ABA ratio; D: ZR/ABA ratio; 1IU–4IU: the first, second, third, and forth internode from the top, respectively. * and ** indicate significant difference between the mutant and the wild-type at the 0.05 and 0.01 probability level, respectively.
3.2 小麦株高发育与內源ABA含量变化的关系
ABA是一种抑制生长的植物激素, 对 ABA和植物株高关系的研究认为, 内源ABA含量变化会影响植物株高。Hoffmann等[31]用不同浓度ABA溶液处理深水稻茎秆切段, 发现ABA能抑制节间伸长。宋平等[32]研究发现, 矮秆籼稻品种幼苗内源ABA含量显著高于高秆品种, 含有强矮化效应 sd-g基因的“新桂矮”内源ABA含量明显高于含半矮秆基因sd-1的“广场矮”。殷稳娜等[19]研究发现, 矮秆小黑麦品种的ABA含量显著高于高秆品种, 推测ABA具有抑制小黑麦茎秆生长的作用。Wu等[33]发现普通小麦矮秆突变体“Meh0239”内源ABA含量极显著高于野生型。和以上结果相同的是, 本研究中矮秆突变体NM9 各节间 內源ABA含量也均极显著高于高秆野生型, 说明小麦 內源ABA含量提高会抑制株高伸长。
3.3 內源激素的相互作用对小麦株高发育的影响
植物的生长发育不是由单一激素调控, 而是多种激素协调作用的结果[5]。本研究发现, 在不同生育期, 矮秆突变体NM9各节间内源GA、ZR、ABA含量均较野生型有显著差异, 说明NM9的矮化同样并不是由单一激素调控, 而是多种激素协调作用的结果。研究发现, 矮秆型小黑麦中的 GA/ABA、IAA/ABA、(IAA+GA)/ABA比值较高秆型小黑麦均显著降低[19]。苜蓿中GA/ABA、(IAA+GA)/ABA比值与株高极显著正相关, 随着GA/ABA、IAA/ABA、ZR/ABA 比值下降, 株高也随之降低[20]。本研究的矮秆突变体NM9中IAA/ABA、(IAA+GA)/ABA、ZR/ABA比值均极显著低于野生型, 这和前人研究结果一致, 再次说明突变体 IAA/ABA、(IAA+GA)/ ABA、ZR/ABA比值降低会抑制株高伸长。然而, 与前人研究结果不同的是, 突变体NM9中GA/ABA比值显著高于野生型, 推测前人研究的多是 GA合成通路受阻的矮秆突变体, 突变体内源 GA含量降低,导致矮秆突变体中GA/ABA比值低于野生型; 而本研究中NM9为GA不敏感型突变体, 内源GA大量积累, GA增加幅度远高于ABA含量的上升幅度, 导致矮秆突变体NM9中GA/ABA比值显著高于野生型。可见 GA对植物株高发育的影响是一个复杂过程, 由于 GA合成通路或信号通路受阻导致植株矮化的机制不同, 突变体中 GA含量分别表现为升高和降低, 因此, 不能仅根据突变体中 GA/ABA比值变化判断其对植物株高发育的影响。目前, 在小麦中对内源激素含量比值与株高发育关系的研究还较少, 本结果丰富了该领域的研究。
3.4 GA与ABA的互作与竞争
GA和ABA的代谢和信号途径通过互作和竞争,对植物的生长发育进行调控[34]。已有研究表明, GA和ABA信号互作存在拮抗作用, 抑制ABA合成可激活GA信号转导, 促进植株茎秆伸长[35]。水稻中, SUB1A基因通过提高GA信号抑制因子SLR1、SLRL1的表达, 降低植株对 GA的响应, 同时提高其对ABA 的响应, 抑制株高和根系的伸长[36-37]。FUS3基因过表达可降低GA合成代谢关键酶基因GA3ox1和GA20ox1的表达, 抑制GA合成, 同时促进ABA合成[38-39]。大麦糊粉层细胞中, ABA通过诱导ABA响应激酶基因PKABA1的表达抑制受GA调控的转录因子GAMyb, 导致GA信号转导通路受阻, 抑制GA通路下游α淀粉酶基因的表达[40]。目前, 在水稻和拟南芥中的研究认为, 植物体内GA与ABA之间主要是通过对 DELLA蛋白代谢的调节达到动态平衡。DELLA蛋白是GA信号途径的抑制因子, GA通过泛素/蛋白酶途径诱导 DELLA蛋白降解, 解除DELLA蛋白对下游因子的抑制作用, 促进植物生长发育[41]。同时, DELLA蛋白也可通过上调E3连接酶基因XERICO的表达促进内源ABA积累, 抑制植物生长[42]。相比之下, 小麦中对ABA参与调控的植株矮化机制、GA和ABA通路互作对植物株高建成影响的研究还鲜有报道。目前, 小麦中对矮秆基因致矮机制的研究还主要集中在由GAI基因参与调控的 GA信号转导通路。已克隆的小麦矮秆基因Rht-B1b、Rht-D1b和Rht-B1c都是拟南芥GAI基因的直系同源基因[10], 它们在DELLA蛋白的GA信号感知区发生突变, 导致对 GA的信号感知功能受阻,抑制了受GA诱导的DELLA蛋白降解, 从而无法解除对下游生长响应基因的抑制作用, 导致茎秆伸长受阻[43]。本研究发现, 突变体 NM9中内源 GA和ABA含量较野生型均极显著提高, 推测GA不敏感型矮秆基因Rht_NM9可能在GA和ABA的信号通路互作中起一定作用, 在抑制 GA信号传导的同时,促进了ABA的合成, 导致突变体内ABA和GA大量积累, 植株表现矮化。本研究的发现为解析小麦矮化过程中的植物激素控制机制提供了新模型。
4 结论
小麦矮秆突变体 NM9的矮化是多种激素相互作用、综合调控的结果。矮秆基因Rht_NM9对GA不敏感, 导致突变体茎秆 GA含量较野生型极显著提高, 进而降低株高。此外, ABA 含量提高和IAA/ABA、ZR/ABA比值降低均会抑制植物株高的增长。
[1] 姚瑞亮, 朱文祥. 小麦形态性状与倒伏的相关分析. 广西农业大学学报, 1998, 17(增刊): 16–18
Yao R L, Zhu W X. The correlation analysis of the stem traits and lodging in wheat. J Guangxi Agric Univ, 1998, 17(suppl): 16–18 (in Chinese with English abstract)
[2] Foulkes M J, Slafer G A, Davies W J, Berry P M, Sylvester-Bradley R, Martre P, Calderini D F, Griffiths S, Reynolds M P. Raising yield potential of wheat: III. Optimizing partitioning to grain while maintaining lodging resistance. J Exp Bot, 2011, 62: 469–486
[3] Wiersma D W, Oplinger E S, Guy S O. Environment and cultivar effects on winter wheat response to ethephon plant growth regulator1. Agron J, 1986, 78: 761–764
[4] Kashiwagi T, Ishimaru K. Identification and functional analysis of a locus for improvement of lodging resistance in rice. Plant Physiol, 2004, 134: 676–683
[5] Davies P J. Plant hormones and their role in plant growth and development. Netherlands: Springer Science & Business Media B V, 2012. pp 3–10
[6] Wang L, Mu C, Du M W, Chen Y, Tian X L, Zhang M C, Li Z H. The effect of mepiquat chloride on elongation of cotton (Gossypium hirsutum L.) internode is associated with low concentration of gibberellic acid. Plant Sci, 2014, 225: 15–23
[7] Srinivasan C, Liu Z R, Scorza R. Ectopic expression of class 1 KNOX genes induce adventitious shoot regeneration and altergrowth and development of tobacco (Nicotiana tabacum L.) and European plum (Prunus domestica L.). Plant Cell Rep, 2011, 30: 655–664
[8] Chen Y N, Fan X R, Song W J, Zhang Y L, Xu G H. Over-expression of OsPIN2 leads to increased tiller numbers, angle and shorter plant height through suppression of OsLAZY1. Plant Biotechnol J, 2012, 10: 139–149
[9] Agehara S, Leskovar D I. Age-dependent effectiveness of exogenous abscisic acid in height control of bell pepper and jalapeño transplants. Sci Hortic-Amsterdam, 2014, 175: 193–200
[10] Ikeda A, Ueguchi-Tanaka M, Sonoda Y, Kitano H, Koshioka M, Futsuhara Y, Matsuoka M, Yamaguchi J. Slender rice, a constitutive gibberellin response mutant, is caused by a null mutation of the SLR1 gene, an ortholog of the height-regulating gene GAI/RGA/RHT/D8. Plant Cell, 2001, 13: 999–1010
[11] Magome H, Yamaguchi S, Hanada A, Kamiya Y, Oda K. Dwarf and delayed-flowering 1, a novel Arabidopsis mutant deficient in gibberellin biosynthesis because of overexpression of a putative AP2 transcription factor. Plant J, 2004, 37: 720–729
[12] Clay N K, Nelson T. Arabidopsis thickvein mutation affects vein thickness and organ vascularization, and resides in a provascular cell-specific spermine synthase involved in vein definition and in polar auxin transport. Plant Physiol, 2005, 138: 767–777
[13] Quiroz-Figueroa F, Rodríguez-Acosta A, Salazar-Blas A, Hernández-Domínguez E, Campos M E, Kitahata N, Asami T, Galaz-Avalos R M, Cassab G I. Accumulation of high levels of ABA regulates the pleiotropic response of the nhr1 Arabidopsis mutant. J Plant Biol, 2010, 53: 32–44
[14] Fu X, Richards D E, Ait-Ali T, Hynes L W, Ougham H, Peng J, Harberd N P. Gibberellin-mediated proteasome-dependent degradation of the barley DELLA protein SLN1 repressor. Plant Cell, 2002, 14: 3191–3200
[15] Peng J, Richards D E, Hartley N M, Murphy G P, Devos K M, Flintham J E, Beales J, Fish L J, Worland A J, Pelica F. “Green revolution” genes encode mutant gibberellin response modulators. Nature, 1999, 400: 256–261
[16] Wu J, Kong X Y, Wan J M, Liu X Y, Zhang X, Guo X P, Zhou R H, Zhao G Y, Jing R L, Fu X D, Jia J Z. Dominant and pleiotropic effects of a GAI gene in wheat results from a lack of interaction between DELLA and GID1. Plant Physiol, 2011, 157: 2120–2130
[17] 熊国胜, 李家洋, 王永红. 植物激素调控研究进展. 科学通报, 2009, 54: 2718–2733
Xiong G S, Li J Y, Wang Y H. Advances in the regulation and crosstalks of phytohomones. Chin Sci Bull, 2009, 54: 2718–2733 (in Chinese)
[18] 张立军, 梁宗锁. 植物生理学. 北京: 科学出版社, 2007. pp 205–237
Zhang L J, Liang Z S. Plant Physiology. Beijing: Science Press, 2007. pp 205–237 (in Chinese)
[19] 殷稳娜, 孔广超, 王雪玉, 高静涛, 何萱. 六倍体小黑麦株高形成中内源激素含量的变化. 麦类作物学报, 2011, 31: 953–958
Yin W N, Kong G C, Wang X Y, Gao J T, He X. Dynamic changes of plant hormone contents in hexapoid triticale (× Triticosecale Wittmack) with different plant height. J Triticeae Crops, 2011, 31: 953–958 (in Chinese with English abstract)
[20] 王成章, 潘晓建, 张春梅, 胡喜峰, 杨雨鑫. 外源ABA对不同秋眠型苜蓿品种植物激素含量的影响. 草业学报, 2006, 15(2): 30–36
Wang C Z, Pan X J, Zhang C M, Hu X F, Yang Y X. Effects of exogenous ABA on hormone content in different varieties of fall dormancy Medicago sativa varieties. Acta Pratacult Sin, 2006, 15(2): 30–36 (in Chinese with English abstract)
[21] Dong Q, Wang J Z, Guo J M, Heng Z. The relation between endogenous hormones and late-germination in buds of avrolles apple. Agric Sci China, 2009, 8: 564–571
[22] Hou J W, Guo S J, Wang G Y. Effects of in vitro subculture on the physiological characteristics of adventitious root formation in microshoots of Castanea mollissima cv. “Yanshanhong”. J For Res, 2010, 21: 155–160
[23] Xie Z J, Jiang D, Cao W X, Dai T B, Jing Q. Relationships of endogenous plant hormones to accumulation of grain protein and starch in winter wheat under different post-anthesis soil water statusses. Plant Growth Regul, 2003, 41: 117–127
[24] Lu Y, Xing L P, Xing S J, Hu P, Cui C F, Zhang M Y, Xiao J, Wang H Y, Zhang R Q, Wang X E, Chen P D, Cao A Z. Characterization of a putative new semi-dominant reduced height gene, Rht_NM9, in wheat (Triticum aestivum L.). J Genet Genomics, 2015, 42: 685–698
[25] Teng N J, Wang J, Chen T, Wu X Q, Wang Y H, Lin J X. Elevated CO2induces physiological, biochemical and structural changes in leaves of Arabidopsis thaliana. New Phytol, 2006, 172: 92–103
[26] Hooley R. Gibberellins: perception, transduction and responses. Plant Mol Biol, 1994, 26: 1529–1555
[27] Harberd N P, King K E, Carol P, Cowling R J, Peng J R, Richards D E. Gibberellin: inhibitor of an inhibitor of...? BioEssays, 1998, 20: 1001–1008
[28] Sasaki A, Ashikari M, Ueguchi-Tanaka M, Itoh H, Nishimura A, Swapan D, Ishiyama K, Saito T, Kobayashi M, Khush G S, Kitano H, Matsuoka M. Green revolution: a mutant gibberellin-synthesis gene in rice. Nature, 2002, 416: 701–702
[29] Sakamoto T, Kobayashi M, Itoh H, Tagiri A, Kayano T, Tanaka H, Iwahori S, Matsuoka M. Expression of a gibberellin 2-oxidase gene around the shoot apex is related to phase transition in rice. Plant Physiol, 2001, 125: 1508–1516
[30] Amador V, Monte E, García-Martínez J, Prat S. Gibberellins signal nuclear import of PHOR1, a photoperiod-responsive protein with homology to Drosophila armadillo. Cell, 2001, 106: 343–354
[31] Hoffmann-Benning S, Kende H. On the role of abscisic acid and gibberellin in the regulation of growth in rice. Plant Physiol, 1992, 99: 1156–1161
[32] 宋平, 高红胜, 曹显祖, 谢迎兰. 不同籼稻品种的矮生性与内源ABA水平及其结合蛋白的关系. 西北植物学报, 1998, 18: 380–385
Song P, Gao H S, Cao X Z, Xie Y L. The relationships between dwarfism of indica rice and ABA/ABA-binding proteins. Acta Bot Boreali-Occident Sin, 1998, 18: 380–385 (in Chinese with English abstract)
[33] Wu K, Wang J Y, Kong Z X, Ma Z Q. Characterization of a single recessive yield trait mutant with elevated endogenous ABA concentration and deformed grains, spikelets and leaves. PlantSci, 2011, 180: 306–312
[34] Du H, Chang Y, Huang F, Xiong L Z. GID1 modulates stomatal response and submergence tolerance involving abscisic acid and gibberellic acid signaling in rice. J Integr Plant Biol, 2015, 57: 954–968
[35] Bailey-Serres J, Voesenek L A. Life in the balance: a signaling network controlling survival of flooding. Curr Opin Plant Biol, 2010, 13: 489–494
[36] Fukao T, Bailey-Serres J. Submergence tolerance conferred by Sub1A is mediated by SLR1 and SLRL1 restriction of gibberellin responses in rice. Proc Natl Acad Sci USA, 2008, 105: 16814–16819
[37] Fukao T, Yeung E, Bailey-Serres J. The submergence tolerance regulator SUB1A mediates crosstalk between submergence and drought tolerance in rice. Plant Cell, 2011, 23: 412–427
[38] Gazzarrini S, Tsuchiya Y, Lumba S, Okamoto M, McCourt P. The transcription factor FUSCA3 controls developmental timing in Arabidopsis through the hormones gibberellin and abscisic acid. Dev Cell, 2004, 7: 373–385
[39] Curaba J, Moritz T, Blervaque R, Parcy F, Raz V, Herzog M, Gilles V. AtGA3ox2, a key gene responsible for bioactive gibberellin biosynthesis, is regulated during embryogenesis by LEAFY COTYLEDON2 and FUSCA3 in Arabidopsis. Plant Physiol, 2004, 136: 3660–3669
[40] Gómez-Cadenas A, Zentella R, Walker-Simmons M K, Ho T D. Gibberellin/abscisic acid antagonism in barley aleurone cells: site of action of the protein kinase PKABA1 in relation to gibberellin signaling molecules. Plant Cell, 2001, 13: 667–679
[41] Hartweck L M, Olszewski N E. Rice GIBBERELLIN INSENSITIVE DWARF1 is a gibberellin receptor that illuminates and raises questions about GA signaling. Plant Cell, 2006, 18: 278–282
[42] Zentella R, Zhang Z L, Park M, Thomas S G, Endo A, Murase K, Fleet C M, Jikumaru Y, Nambara E, Kamiya Y, Sun T P. Global analysis of DELLA direct targets in early gibberellin signaling in Arabidopsis. Plant Cell, 2007, 10: 3037–3057
[43] Chandler P M, Harding C A. “Overgrowth” mutants in barley and wheat: new alleles and phenotypes of the “Green Revolution”DELLA gene. J Exp Bot, 2013, 64: 1603–1613
Effects of Dwarf Gene Rht_NM9 on Contents of Endogenous Hormone Regulating Plant Height of Common Wheat
LU Yuan1,2, CUI Chao-Fan2, HU Ping2, CHEN Pei-Du2, SHEN Xue-Fang1, HAN Qing1, WANG Yi-Fa1, XING Li-Ping2,*, and CAO Ai-Zhong2,*
1Crop Breeding and Cultivation Research Institute, Shanghai Academy of Agricultural Sciences, Shanghai 201403, China;2State Key Laboratory of Crop Genetics and Germplasm Enhancement / Cytogenetics Institute, Nanjing Agricultural University / Jiangsu Collaborative Innovation Center for Modern Crop Production, Nanjing 210095, China
A dwarf wheat mutant (NM9) with additional tillers and elongated spikes was obtained by treating NAU9918 seeds with ethyl methanesulfonate (EMS). The decreased plant height in NM9 was controlled by a novel dwarf gene Rht_NM9. The endogenous plant hormones play important roles in regulating plant height of common wheat. To understand the dwarfing mechanism of Rht_NM9 and the relationship between endogenous hormone contents and plant height, measured contents of endogenous gibberellic acid (GA), auxin (IAA), abscisic acid (ABA) and zeatin riboside (ZR) in internodes of NM9 and NAU9918 at different stages by enzyme-linked immunosorbent assays (ELISA). Our study indicated that contents of GA and ABA in NM9 were significantly higher than there in NAU9918, and ZR content in NM9 was significantly lower than that in NAU9918 at both booting and heading stages. Nevertheless, no difference of IAA content was observed between the mutant and the wild-type. In addition, the GA/ABA ratio in internodes of the mutant was significantly higher than that of the wild-type, however, the ratios of IAA/ABA, (IAA + GA)/ABA and ZR/ABA were significantly lower than there of the wild-type. All these results indicated that plant height in wheat was regulated by multiple hormones. Plant height would be inhibited with increasing content of endogenous ABA and decreasing ratios of IAA/ABA and ZR/ABA in wheat.
Wheat; Plant height; Mutant; Endogenous hormones
(
): 2016-12-16; Accepted(接受日期): 2017-05-10; Published online(网络出版日期): 2017-06-05.
10.3724/SP.J.1006.2017.01272
本研究由中央高校基本科研业务费专项(KYZ201601, KYYJ201602, KYZ201401)资助。
This study was supported by the Fundamental Research Funds for the Central Universities (KYZ201601, KYYJ201602, KYZ201401).
*通讯作者(Corresponding authors): 邢莉萍, E-mail: xingliping@njau.du.cn; 曹爱忠, E-mail: caoaz@njau.edu.cn
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20170605.1650.002.html

