热带山地雨林3个演替阶段幼树叶片特征比较
张 明,刘福德,安树青,曹学章
(1.环境保护部南京环境科学研究所,江苏 南京 210042; 2.南京大学生命科学学院,江苏 南京 210093; 3.天津理工大学环境科学与安全工程学院,天津 300384)
热带山地雨林3个演替阶段幼树叶片特征比较
张 明1,刘福德2,安树青3,曹学章1
(1.环境保护部南京环境科学研究所,江苏 南京 210042; 2.南京大学生命科学学院,江苏 南京 210093; 3.天津理工大学环境科学与安全工程学院,天津 300384)
在海南岛热带山地雨林的演替早期、中期和后期样地共选择30个物种,应用Li-6400光合测定系统测量其光合作用的光响应曲线。计算得出最大光合速率(Amax)、光补偿点(LCP)、表观量子效率(Ф)和暗呼吸速率(Rd)。并测量叶片的比叶面积(SLA)、氮(LN)和磷(LP)含量。结果表明:随着演替进行,最大光合速率(单位面积或单位重量)逐渐下降,次序为演替早期>演替中期>演替后期,但差异不显著(P>0.05);暗呼吸速率(单位面积或单位重量)和表观量子效率逐渐升高,差异也不显著(P>0.05);叶片的比叶面积、叶片氮含量和叶片磷含量都逐渐升高。3个演替阶段共有物种:子楝树(Decaspermumgracilentum)和鱼骨木(Canthiumdicoccum)的单位干重最大光合速率、单位干重暗呼吸速率、比叶面积和叶片氮含量随演替进行而逐渐升高,次序为演替早期<演替中期<演替后期。整体上,单位干重最大光合速率和单位干重暗呼吸速率与比叶面积显著正相关(P<0.01);单位干重暗呼吸速率和光补偿点与叶片氮含量显著正相关(P<0.01)。在演替过程中,植物表现出了共同的形态反应,但子楝树和鱼骨木显示出不同的适应策略。
热带山地雨林;群落演替;光响应曲线;比叶面积;叶片氮;叶片磷;海南岛
森林的演替是植物群落随着时间变化发生的不同物种的相互替代过程,从而改变了植物群落的结构和功能,这些变化与植物对不同演替阶段环境的生理适应机制是分不开的[1]。过度的森林砍伐和不合理的土地利用已导致海南岛的原始森林大面积减少,形成处于不同演替阶段的退化生态系统,由原始林破坏后发展起来的天然次生林已成为海南岛最重要的森林资源[2]。研究森林演替不同阶段的环境特征及不同植物类群对这些环境变化的生态适应性,将有助于对不同恢复阶段森林生态系统动态变化规律的认识,从而为热带林生物多样性的保护和生态系统功能恢复提供科学依据[3]。
海南岛热带山地雨林具有很高的生物多样性和复杂的群落结构,而郁闭层下的幼苗和幼树占热带森林物种的90%[4]。幼树对群落结构的更新和生物多样性的维持有着重要作用,研究林下幼苗幼树的光合生理特征有重要意义[5]。以往的研究往往只比较演替早期树种与后期树种的生理特征差异[6-7]。本文对海南岛热带山地雨林3个演替阶段幼树的叶片特征进行研究,并且研究同一物种在不同演替阶段的变化,从生理生态角度探讨它们对环境的适应能力和生存策略,为深入研究热带雨林树种更新、演替、森林结构层次的形成、植物功能群的研究和探讨高生物多样性的维持提供参考。
1 研究地概况
吊罗山位于海南岛东南部(18°50′N、109°50′E),属于东亚季风气候区[8]。海拔600 m 处年均气温20.8 ℃,最热月均温23.9 ℃,最冷月均温16.3 ℃,全年>10 ℃的积温7990 ℃[8]。具有明显的干湿季气候特征,12月—翌年1月为旱季,2—3月为过渡期,4—10月为雨季,96%降水来自雨季,年均降水量2565 mm[4]。研究地区位于吊罗山山地雨林林区(海拔800~1000 m)。成土母岩为花冈岩和闪长岩,土壤为山地黄壤[9]。
吊罗山山地雨林林区优势种有海南蕈树(Altingiaobovata)、扫把青冈(Cyclobalanopsisaugustinii)、黄枝木(Xanthophllumhainanense)、鸭脚木(Scheffleraoctophylla)等[9]。样地位于吊罗山原新安林场内,海拔750~980 m,植被类型属于热带山地雨林[8]。演替早期样地内华须芒草(Andropogonchinensis)、棕叶芦(Thysanolaenamaxima)等禾本科植物密布茂盛,高达2~4 m,林内以展毛野牡丹(Melastomanormale)、阔叶八角枫(Alangiumfaberi)、中平树(Macarangatanarius)等先锋树种为主,平均郁闭度为0.67。演替中期样地群落结构单一,以胸径小于5 cm的乔木幼树和灌木为主,树高多为3~5 m,林内平均郁闭度为0.86;林下植物丰富,广泛分布着乌毛蕨(Blechnumorientale)、吊罗山耳蕨(Polystichumtialooshanense)、锐齿鳞毛蕨(Dryopterisacutidens)等蕨类植物[8]。演替后期样地群落结构复杂,乔木高大,冠层可分为3层:顶层24~28 m,胸径40~60 cm,最大为100 cm;第2层15~23 m,胸径15~30 cm;第3层8~14 m,胸径5~10 cm。林内平均郁闭度为0.97,其组成成分丰富;按株数计算,乔木以樟科个体最多,占10.5%;壳斗科10.0%,桃金娘科5.6%,山茶科4.9%,调查的120个种中主要优势种有阿丁枫(Altingiaobovata)、扫把青冈、鸭脚木等[8]。
2 研究方法
2.1 物种的选择与分类
于2004—2005年的3—4月,在演替早期、中期、后期样地分别选取14、16、15个物种的幼苗幼树。根据样方调查数据,选取优势种,每种3株。选择完全舒展并且成熟的未受损叶片,每株3片。
2.2 光响应曲线的测定
用Li-6400便携式光合作用系统(Li-COR,Inc,USA)测定叶片的光响应曲线。使用开放气路,空气流速为0.5 L·min-1,大气温度(26±2) ℃,空气中相对湿度50%~70%,CO2浓度在自然条件下约(380±10) μmol·mol-1[4]。测量在野外天气晴朗的7∶00—12∶00进行,人工光源使用6400-02B内置式红蓝光源(Li-COR,Inc,USA)。测量前,依植物种类不同,将人工光源调控在600~1200 μmol·m-2·s-1光强下进行10~15 min的光合诱导,光照强度梯度设置为2500、2000、1500、1000、500、200、100、50、20、0 μmol·m-2·s-1[4]。
2.3 比叶面积的测定
从测定光合的每株幼树上采集10~15片完全展开且健康的叶片,用光电叶面积仪测定叶片的面积,然后带回实验室用烘箱烘干(105 ℃下杀青30 min,然后80 ℃连续烘48 h),称量烘干重,比叶面积(SLA)定义为叶面积与烘干重的比值,单位cm2·g-1[5]。
2.4 叶片氮、磷含量的测定
所采集的叶片在105 ℃烘箱内杀青30 min,然后温度调至80 ℃连续烘48 h[11],烘干的样品研磨并过2 mm筛,用于叶片氮(LN)、磷(LP)的测定,测定方法按照实验室常规方法测定[5]。
2.5 数据分析
得到的光响应数据根据Prioul & Chartier[12]提供的模型进行非线性回归拟合。具体模型为:
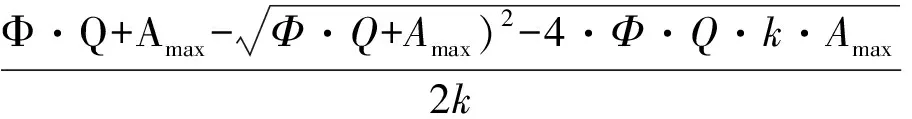
式中:A为净光合速率;Amax为最大净光合速率;Ф为表观量子效率;K为曲角;Rday为暗呼吸速率;Q为光照强度。根据拟合结果,计算出最大光合速率(light saturated net photosynthetic rate,Amax)、光补偿点(light compensation point,LCP)(表观光合速率为0时的光照强度)、表观量子效率Ф、曲角K和暗呼吸速率Rday(Rd)。根据计算时参数单位的不同,Amax值可分为A-area(单位面积的暗呼吸速率,μmol·kg-1·s-1)和A-mass(单位重量的最大光合速率,μmol·m-2·s-1);Rd值分为Rd-area(单位面积的暗呼吸速率,μmol·kg-1·s-1)和Rd-mass(单位重量的暗呼吸速率,μmol·m-2·s-1)。
试验所得数据采用SPSS 13.0软件进行分析。采用最小显著差法(LSD)对植物进行种间多重比较并进行相关分析和T检验。
3 结果与分析
3.1 3个演替阶段种的光合特征比较
3个演替阶段的物种见表1。从演替早期到演替后期,最大光合速率(单位面积或单位重量)逐渐下降,次序为演替早期>演替中期>演替后期,但差异不显著 (P>0.05);暗呼吸速率(单位面积或单位重量)和表观量子效率逐渐升高,但差异也不显著 (P>0.05);光补偿点逐渐升高,且演替后期显著大于演替早期和中期 (P<0.05)(图1)。
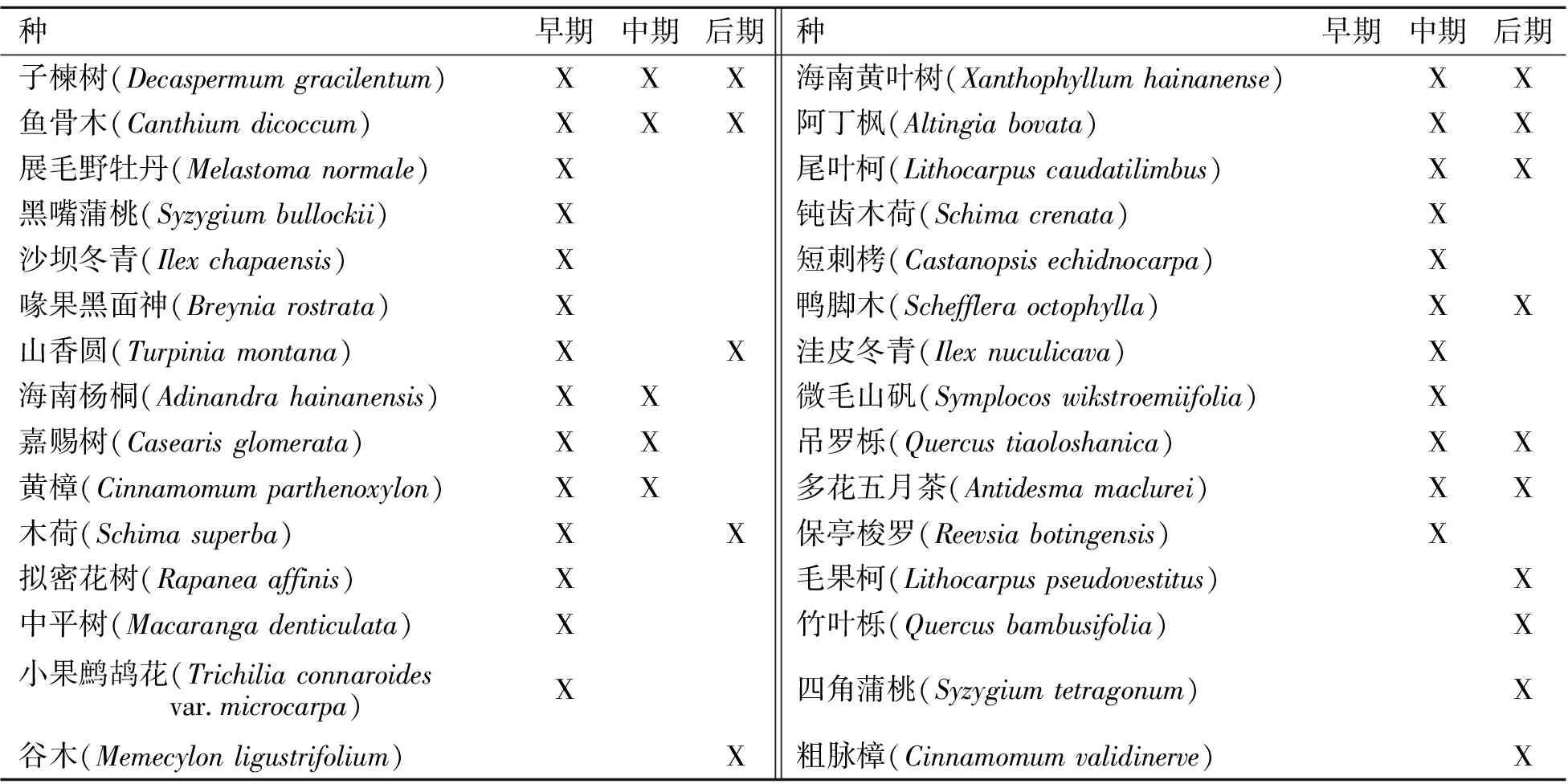
表1 海南岛热带雨林3个演替阶段测量的物种
*:X为该阶段存在。
3.2 3个演替阶段种的叶片生理特征比较
从演替早期到演替后期,叶片的比叶面积和叶片氮含量逐渐升高,次序为演替早期<演替中期<演替后期,且演替中期和后期显著大于演替早期 (P<0.05);叶片磷含量逐渐升高,次序为演替早期<演替中期<演替后期,且演替后期显著大于演替早期和中期 (P<0.05)(图1)。
3个演替阶段共有物种:子楝树和鱼骨木的单位干重最大光合速率、单位干重暗呼吸速率、比叶面积和叶片氮含量随演替的过程逐渐升高,次序为演替早期<演替中期<演替后期(图2)。

*:1、2、3分别为演替阶段早期、中期、后期。下同。图1 3个演替阶段物种的光合与生理特征比较
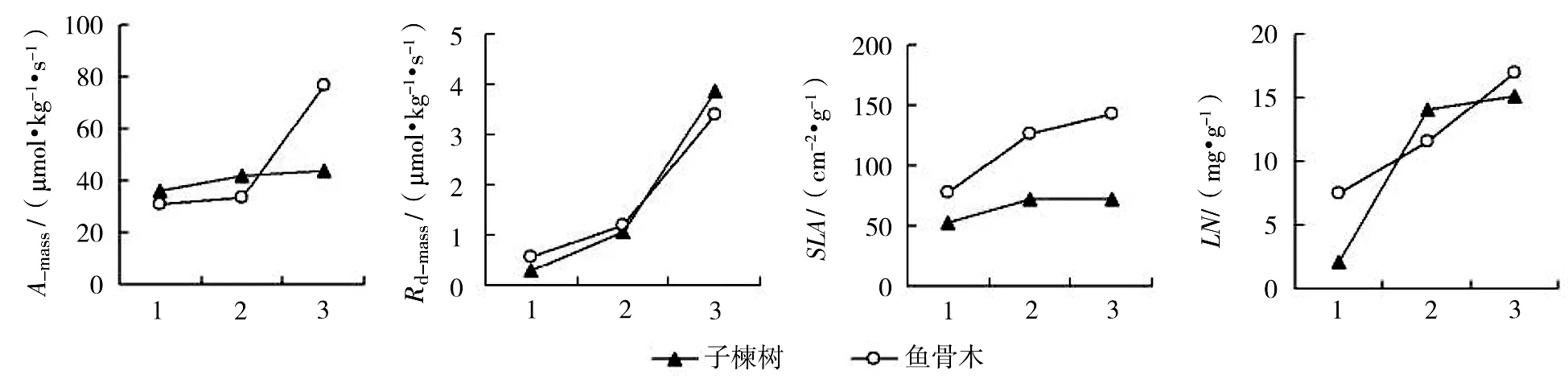
图2 子楝树和鱼骨木3个演替阶段的光合与生理特征差异
3.3 叶片光合特征与生理参数的关系
3个演替阶段物种的光合特征与生理参数密切相关。单位干重最大光合速率和单位干重暗呼吸速率与比叶面积显著正相关 (P<0.01);单位干重暗呼吸速率和光补偿点与叶片氮含量显著正相关 (P<0.01)(图3、图4)。
叶片生理参数之间也有相关关系。在所有物种中,叶片氮含量与比叶面积显著正相关(P<0.01);叶片磷含量与氮含量显著正相关 (P<0.01)。而在不同演替阶段,各参数之间的相关关系各不相同。演替1阶段的光合速率与光饱合点正相关,演替2阶段的光合速率与暗呼吸速率正相关,演替3阶段的光合速率与比叶面积正相关。各回归方程见表2。
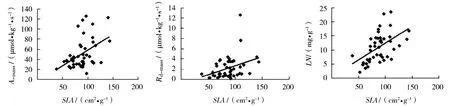
图3 3个演替阶段物种的最大光合速率、暗呼吸速率、叶片氮含量与比叶面积的关系

图4 3个演替阶段物种的单位干重暗呼吸速率、光补偿点、叶片磷含量与叶片氮含量的关系

表2 不同演替阶段物种的光合参数与叶片参数的回归分析
4 结论与讨论
随演替的进行,物种的最大光合速率(单位干重或单位面积)逐渐降低,对强光的利用能力降低;而表观量子效率逐渐升高,对光斑的利用效率增大,这是对林下光环境改变的适应,与他人的研究结果一致[13-16]。
3个演替阶段的共有物种:子楝树和鱼骨木的最大光合速率随演替的进行而逐渐升高,可能是因为两者在演替早期通过改变叶片结构或其它生理特征,如增加厚度、增加栅栏组织厚度等或改变生理活动途径,以减少光的吸收和适应高光胁迫[17],从而使单位干重或单位面积的最大光合速率降低。暗呼吸速率(单位干重或单位面积)和光补偿点随演替的进行而逐步升高,与Bazzaz & Carlon[18]的结果不同。这是因为中后期植物叶片的比叶面积、叶片氮含量和叶片磷含量都有显著升高,导致其呼吸的增加[19-20]。
植物的比叶面积、叶片氮含量和叶片磷含量都随演替的进行逐步升高,这是植物对林下环境的适应。弱光环境下SLA高,单位干重下叶片的面积大、捕光能力强,这就增强了叶片同化组织对输导组织和结构组织的相对比例,有利于碳的净积累,是植物对弱光环境做出的典型形态学反应[21]。研究未发现叶片磷含量与植物的光合特征存在相关关系。磷对光合的影响程度较小,这是因为磷对叶绿素含量和蛋白含量的影响相对氮较小[22-23]。研究发现,各演替阶段光合作用参数与叶片结构参数之间的相关关系均不相同,这可能是演替过程发生的内在机制。
在演替进行过程中,植物表现出了共同的形态反应,如增加比叶面积,增加叶片氮、磷含量,提高对弱光的利用能力,降低呼吸,以获得最大的适应。但对同一物种,叶片特征在不同演替阶段的变化可能与整体趋势不同。子楝树和鱼骨木在演替后期的光合速率和呼吸速率反而较高,显示出与其它植物不同的适应策略。
[1]李庆康,马克平.植物群落演替过程中植物生理生态学特性及其主要环境因子的变化[J].植物生态学报,2002,26(S1):9-19.
[2]臧润国,安树青,陶建平,等.海南岛热带林生物多样性维持机制[M].北京:科学出版社,2004.
[3]毛培利.海南岛热副山地雨林不同演替阶段植物功能群光生态适应性研究[D].北京:中国林业科学研究院,2007.
[4]张明,王文进,刘福德,等.海南岛热带山地雨林幼苗幼树的光合能力与水分利用效率[J].应用生态学报,2007,18(10):2160-2166.
[5]刘福德,王中生,张明,等.海南岛热带山地雨林幼苗幼树光合与叶氮、叶磷及比叶面积的关系[J].生态学报,2007,27(11):4651-4661.
[6]Bazzaz,F.A.,R.W.Carlson.Phtotosynthetic acclimation to variability in the light environment of early and late successional plants[J].Oecologia,1982(54):313-316.
[7]Nogueira A.,Martinez C.A.,Ferreira L.L.,et al.Photosynthesis and water use efficiency in twenty tropical tree species of differing succession status in a Brazilian reforestation[J].Photosynthetica,2004,42(3):351-356.
[8]王文进,张明,刘福德,等.海南岛吊罗山热带山地雨林2个演替阶段的种间联结性[J].生物多样性,2007,15(3):257-263.
[9]张明,刘福德,王中生,等.热带山地雨林演替早期先锋树种与非先锋树种叶片特征的差异[J].南京林业大学学报:自然科学版,2008,32(4),28-32.
[10]安树青,王铮峰,曾繁敬,等.海南吊罗山热带山地雨林植物种类多样性研究[J].中山大学学报,1999,38(6):78-83.
[11]陈飞宇,罗天祥,张林,等.江西九连山常绿阔叶林主要树种叶建成消耗的比较[J].生态学报,2006,26(8):2485-2493.
[12]Prioul J.L.,Chartier P.Partitioning of transfer and carboxylation components of intercellular resistance to photosynthetic CO2fixation:a critical analysis of the method used[J].Ann.Bot.,1977(41):789-800.
[13]Bazzaz,F.A.Plants in changing environments:linking physiological,population,and community ecology[M].New York:Cambridge University Press,1996:264-280.
[14]Koike,T.Leaf structure and photosynthetic performance as related to the forest succession of deciduous broad-leaved trees[J].Plant Species Biology,1988(3):77-87.
[15]梁春,林植芳,孔国辉.不同光强下生长的亚热带树苗的光合-光响应特性的比较[J].应用生态学报,1997(8):7-11.
[16]Braatne,J.H.,L.C.Bliss.Comparative physiological ecology of lupines colonizing early successional habitats on Mount St.Helens[J].Ecology,1999(80):891-907.
[17]张守仁,高荣孚.光胁迫下植物光合生理生态研究进展[M]∥李承森.植物科学进展:第2卷.北京:高等教育出版社,1999.
[18]Bazzaz,F.A.,R.W.Carlson.Phtotosynthetic acclimation to variability in the light environment of early and late successional plants[J].Oecologia,1982(54):313-316.
[19]Osmond,C.B.Interactions between irradiance,nitrogen nutrition,and water-stress in the sun-shade responses of Solanum dulcamara[J].Oecologia,1983(57):316-321.
[20]Evans,J.R.Photosynthesis and nitrogen relationships in leaves of C3plants[J].Oecologia,1989(78):9-19.
[21]王博轶,冯玉龙.生长环境光强对两种热带雨林树种幼苗光合作用的影响[J].生态学报,2005,25(1):23-30.
[22]Lima J.D.,Mosquim P.R.,Da Matta F.M.Leaf gas exchange and chlorophyll fluorescence parameters in Phaseol us v ulgaris as affected by nitrogen and phosphorus deficiency[J].Photosynthetica,1999(37):113-121.
[23]吴楚,王政权,孙海龙,等.氮磷供给对长白落叶松叶绿素合成、叶绿素荧光和光合速率的影响[J].林业科学,2005,41(4):31-36.
Comparison of Leaf Characteristics Among Three Successional Stages′ Species of Tropical Montane Rain Forest
ZHANG Ming1,LIU Fude2,AN Shuqing3,CAO Xuezhang1
(1.NanjingInstituteofEnvironmentalSciences,MinistryofEnvironmentalProtection,Nanjing210042,Jiangsu,China;2.SchoolofLifeScience,NanjingUniversity,Nanjing210093,Jiangsu,China;3.EnvironmentalScienceandSafetyEngineering,TianjinUniversityofTechnology,Tianjin300384,China)
Thirty species were selected from 3 successional stages in Hainan Island tropical montane rain forest,and their light response curves were measured using a Li-6400 portable photosynthesis system.The maximal photosynthesis rate (Amax),light compensation point (LCP),apparent quantum yield (Ф),day-time dark respiration rate (Rd) were calculated from these light response curves.And leaf nitrogen (LN),leaf phosphorus (LP) and specific leaf area (SLA) of these species were also measured.The value ofAmax (A-area,per unit leaf area,andA-mass,per unit leaf dry mass) gradually decreased in the progress of succession,had the order of early successional stage (ES)>middle successional stage (MD)>latter successional stage (LS),but no significant difference exited (P>0.05);the value ofRd(bothRd-area andRd-mass) and Ф were opposite,with the order of ES tropical montane rainforest;community succession;light response curve;specific leaf area;nitrogen;phosphorus;Hainan Island 2016-11-01; 2017-01-22 国家环境保护公益性行业科研专项(重要生态功能区退化生态系统修复模式研究与应用示范,201409055) 张明(1982—),男,福建顺昌人,环境保护部南京环境科学研究所助理研究员,从事生态保护与修复研究。E-mail:zhangming@nies.org。 曹学章(1967—),男,湖南宜章人,环境保护部南京环境科学研究所研究员,从事生态恢复研究。E-mail:caoxuezhang@126.com。 10.13428/j.cnki.fjlk.2017.02.002 S718.43 A 1002-7351(2017)02-0007-06

