鲍内脏多糖的抗氧化活性
王 姣,魏好程,何传波,马 英,熊何健,*
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.集美大学水产学院,福建 厦门 361021)
鲍内脏多糖的抗氧化活性
王 姣1,魏好程1,何传波1,马 英2,熊何健1,*
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.集美大学水产学院,福建 厦门 361021)
为研究鲍内脏多糖的抗氧化活性,采用体外抗氧化实验,评价不同化学组成的鲍内脏多糖对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和•OH的清除作用,并以人体肝细胞LO2建立过氧化氢损伤模型,探讨鲍内脏多糖在细胞水平的抗氧化能力。结果表明:鲍内脏多糖CAVP、AVP1、AVP2具有良好的清除体外自由基能力。多糖CAVP、AVP1、AVP2清除DPPH自由基的半抑制率浓度(half maximal inhibitory concentration,IC50)分别为1.46、1.74、1.55 mg/mL。其清除•OH的IC50分别为7.14、15.27、8.11 mg/mL。另外,细胞模型法评价结果显示,鲍内脏多糖CAVP、AVP1、AVP2在质量浓度0.5~4.0 mg/mL条件下对肝细胞LO2的H2O2氧化损伤有保护作用,3 种多糖样品均能显著提高LO2细胞存活率;CAVP(4.0 mg/mL)、AVP1(0.5 mg/mL)和AVP2(0.5 mg/mL)能极显著降低氧化损伤时乳酸脱氢酶的释放;CAVP能极显著提高LO2细胞内谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)(4.0 mg/mL)、过氧化氢酶(catalase,CAT)(0.5 mg/mL)、超氧化物歧化酶(superoxide dismutase,SOD)(0.5 mg/mL)活力;AVP1质量浓度为4.0 mg/mL时,能极显著提高LO2细胞内GSH-Px、SOD活力,显著提高CAT活力;AVP2分别在质量浓度0.5、4.0 mg/mL 时极显著提高LO2细胞内CAT活力;在质量浓度为4.0 mg/mL时,3 种多糖样品对降低细胞氧化损伤产生的丙二醛(malondialdehyde,MDA)均有显著作用。因此,鲍内脏多糖是一类潜在的抗氧化物,可用于此类功能食品的开发。
鲍内脏;多糖;抗氧化;LO2细胞
引文格式:
王姣, 魏好程, 何传波, 等. 鲍内脏多糖的抗氧化活性[J]. 食品科学, 2017, 38(15): 115-121. DOI:10.7506/spkx1002-6630-201715019. http://www.spkx.net.cn
WANG Jiao, WEI Haocheng, HE Chuanbo, et al. Antioxidant activity of polysaccharides from abalone viscera[J]. Food Science, 2017, 38(15): 115-121. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201715019. http://www.spkx.net.cn
氧化损伤不仅与多种疾病的发生有着密切的关系[1-3],还可诱导机体细胞的坏死与凋亡,是人类衰老的重要原因之一。所以,抗氧化研究对于各种氧化应激相关疾病的预防与治疗以及对人类的抗衰老[4]有着重要的指导和现实意义。
近年来,多糖的生物活性和化学多样性受到学者关注。许多从食物中分离得到的多糖类化合物具有清除自由基[5-7]、抑制脂质过氧化,抑制亚油酸氧化等抗氧化作用[8-9],在生物体内其抗氧化机理大多与直接清除活性氧和提高抗氧化酶的活性有关[10]。有研究发现,黄芪多糖对H2O2诱导的MRC-5人胚肺成纤维细胞的氧化损伤具有保护作用[11]。Xue Changhu等[12]从海带中提取出的一种低相对分子质量的岩藻聚糖能对抗高脂血症大鼠体内的氧化反应。不少研究表明,多糖的抗氧化性可能是抗肿瘤、抗衰老等其他活性的作用机制之一。
鲍属海洋软体动物,其体内富含蛋白质、肝糖、多种氨基酸、维生素、矿物元素[13]及其他生理活性物质[14],不仅具有很高的食用价值,还具有很好的保健功效[15],因此,鲍的相关产品深受消费者喜爱,且鲍的养殖与加工产业也在逐年扩大。然而,在鲍加工中,为避免外观和口感受到影响,营养成分丰富的鲍内脏常被剥去,造成了资源的浪费。鲍内脏多糖是通过蛋白酶酶解和超滤技术从废弃的、约占鲍质量15%~25%的内脏[16]中分离提取出来的一类大分子活性物质,该多糖类化合物结构复杂但具有多种功能特性。目前已有多个研究表明,鲍内脏中多糖类化合物具有清除体外自由基的抗氧化作用[17-19],而其在细胞水平上的抗氧化作用鲜有报道。因此,本实验同时研究鲍内脏多糖在体外和细胞水平的抗氧化作用,建立LO2细胞的H2O2损伤模型,选取1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率、•OH清除率、乳酸脱氢酶(lactate dehydrogenase,LDH)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)含量指标,充分探究和验证不同化学组成的鲍内脏多糖的抗氧化活性差异,为开发抗氧化功能产品提供理论依据。
1 材料与方法
1.1 材料与试剂
鲍内脏粗多糖(a b a l o n e v i s c e r a l c r u d e polysaccharide,CAVP)由集美大学食品与生物工程学院功能性食品研究实验室自制。
DPPH、噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT) 美国Sigma公司;·OH试剂盒、超氧阴离子自由基试剂盒南京建成生物工程研究所;DMEM高糖基础培养基、双抗(青霉素/链霉素)、0.25%胰酶 美国Hyclone公司;其他试剂均为国产分析纯。
1.2 仪器与设备
UV-8000紫外分光光度计 上海元析仪器有限公司;EVOS倒置显微镜 美国AMG公司;DW-FL253低温冰箱中科美菱公司;M200PRO酶标仪 瑞士Tecan公司;Series Ⅱ Water CO2细胞培养箱 美国Thermo公司。
1.3 方法
1.3.1 鲍内脏多糖的分离纯化流程
CAVP样品→DEAE Sepharose CL-6B阴离子交换层析→收集0.2、0.6 mol/L NaCl目标洗脱液→透析→旋蒸浓缩→Sephacryl S-300HR柱层析→收集目标洗脱液→冷冻干燥→得到两个纯化组分AVP1、AVP2
1.3.2 鲍内脏多糖纯化组分性质测定
总糖含量的测定:参照GB/T15672—2009《食用菌中总糖含量的测定》,采用苯酚硫酸法[20];蛋白质含量的测定:参照GB5009.5—2010《食品中蛋白质的测定》,采用微量凯氏定氮法;硫酸根含量的测定:采用明胶比浊法[21];分子质量的测定:采用凝胶渗透色谱-激光光散射分析联用技术[22-25]。
1.3.3 鲍内脏多糖清除DPPH自由基能力的测定
配制浓度为2×10-4mol/L的DPPH-乙醇溶液,分别取2 mL不同样品溶液,加入2 mL DPPH溶液,混合均匀,室温条件下放置30 min后,于517 nm波长处测定吸光度。样品对DPPH自由基的清除率用公式(1)计算。
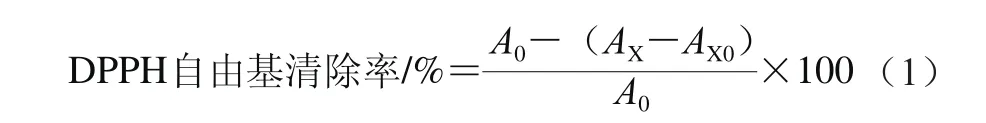
式中:A0(对照组)为2 mL样品溶剂+2 mL DPPH溶液的吸光度;AX(测定组)为2 mL样品溶液+ 2 mL DPPH溶液的吸光度;AX0(调零组)为2 mL样品溶液+2 mL无水乙醇的吸光度。
1.3.4 鲍内脏多糖清除•OH能力的测定
采用•OH试剂盒进行测定。按说明依次加样,混匀后37 ℃条件下反应1 min,立即加入2 mL显色剂终止反应,混匀室温条件下静置20 min,蒸馏水调零,在550 nm波长处测定其吸光度,因样品有颜色,需加颜色扣除管,•OH清除率按公式(2)计算。
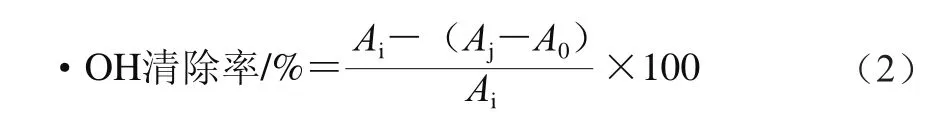
式中:Ai为样品对照管在550 nm波长处吸光度;Aj为样品测定管在550 nm波长处吸光度;A0为调零组,样品颜色扣除管在550 nm波长处吸光度。
1.3.5 细胞水平抗氧化实验
1.3.5.1 鲍内脏多糖对LO2细胞生长的影响
取对数生长期的LO2细胞,稀释细胞个数为1×105个/mL,接种于96 孔板,每孔接种100 µL,置于37℃、5% CO2培养箱中培养24 h。细胞培养结束后,弃上清液后分组:空白组不加细胞只加完全培养基培养;实验组为经过24 h细胞培养后加入事先用完全培养基配好的不同质量浓度的多糖样品,每个样品质量浓度做6 组平行;正常对照组为用完全培养基代替多糖样品,3 组继续培养24 h,在培养期间用显微镜观察细胞生长状态,培养结束后,弃上清液,加入20 µL MTT,继续培养4 h,加入二甲基亚砜(dimethyl sulfoxide,DMSO)150 µL,振荡5 min,酶标仪490 nm波长处测OD值。通过公式(3)计算细胞存活率。

1.3.5.2 LO2细胞氧化损伤模型的建立
取对数生长期细胞,以1×105个/mL细胞接种于96 孔板,每孔接种100 µL,置于37℃、5% CO2培养箱中培养24 h。细胞培养结束弃去培养液,每孔加入100 µL浓度为0.0(空白组)、0.5、1.0、2.0、4.0、6.0、8.0、10.0 mmol/L的H2O2溶液,H2O2溶液用磷酸盐缓冲液配制,每个浓度做6 个平行,继续培养2、4、6 h,用MTT法测定细胞存活情况,通过公式(3)计算细胞存活率。
1.3.5.3 鲍内脏多糖对H2O2诱导LO2细胞损伤的保护作用
取对数生长期的LO2细胞,稀释细胞个数为1×105个/mL,接种于96 孔板,每孔接种100 µL,置于37℃、5% CO2培养箱中培养24 h。分组情况:设置正常对照组、H2O2损伤模型组、实验组。24 h培养后,弃培养上清液,实验组中加入多糖培养基,正常对照组和损伤模型组加入完全培养基,继续培养24 h。将4 mmol/L H2O2溶液加入实验组与损伤模型组中培养2 h建立氧化损伤。培养结束用MTT检测细胞存活情况,通过公式(3)计算细胞存活率。
1.3.5.4 抗氧化指标的测定
选择对数生长期的LO2细胞,稀释细胞个数至1×106个/mL,接种于6 孔板中,每孔接种1 mL,进行培养。分组情况:设立正常对照组、H2O2模型组、CAVP组、AVP1组、AVP2组,VC阳性对照组。细胞经过多糖和H2O2处理后,收集细胞和培养液进行各指标(蛋白质、LDH、GSH-Px、CAT、SOD、MDA水平)的测定。其中LDH活力、MDA含量直接用上清培养液进行测定,其余指标选用细胞测定。细胞的GSH-Px、SOD、CAT活力、MDA含量各指标的计算以细胞蛋白含量为基础,蛋白质测定以2,2-联喹啉-4,4-二甲酸二钠(bicinchoninic acid,BCA)法定量。所有上述测定方法均以南京建成生物研究所试剂盒检测,操作严格按照说明书进行。
1.4 数据统计
2 结果与分析
2.1 鲍内脏多糖纯化组分性质分析
CAVP通过DEAE Sepharose CL-6B阴离子交换层析和Sephacryl S-300HR葡聚糖凝胶柱层析纯化后得到两种多糖组分AVP1、AVP2。通过对两种多糖的性质进行测定,结果显示AVP1的总糖含量和硫酸根含量高于AVP2;两种多糖均含有少量蛋白质。AVP1的分子质量小于AVP2(表1)。

表1 鲍内脏多糖的性质Table 1 Chemical properties of abalone visceral polysaccharides
2.2 鲍内脏多糖的DPPH自由基清除能力
多糖能够提供质子给DPPH自由基生成稳定的化合物,从而具有DPPH自由基的清除能力,表现为在517 nm波长处的吸收减弱,其褪色程度与自由基清除剂的活性相关[26]。鲍内脏多糖清除DPPH自由基的结果如图1所示,3 种多糖样品对DPPH自由基的清除能力较为接近,当样品质量浓度为0.5 mg/mL时开始表现出具有DPPH自由基的清除活性,且其清除活性随样品质量浓度的增加而增加,当CAVP、AVP2质量浓度为4 mg/mL时,清除率达到80%左右后增长缓慢。比较3 种样品对DPPH自由基的清除活性发现,CAVP的DPPH自由基的清除率高于AVP1和AVP2,而AVP2又高于AVP1。
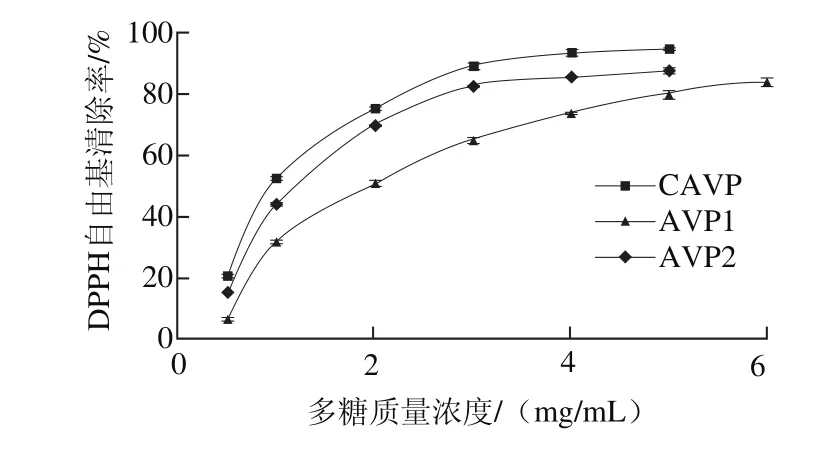
图1 鲍内脏多糖对DPPH自由基的清除作用Fig. 1 DPPH radical scavenging capacity of abalone visceral polysaccharides
鲍内脏多糖对DPPH自由基的清除作用回归方程和半抑制率浓度(half maximal inhibitory concentration,IC50)值如表2所示,在相同的反应体系中,使DPPH自由基的清除率达到50%(IC50),3 种鲍内脏多糖样品需要1.5 mg/mL左右。

表2 鲍内脏多糖清除DPPH自由基的回归方程和IC50Table 2 Regression equations and IC50for DPPH radical scavenging activity of abalone visceral polysaccharides
2.3 鲍内脏多糖的•OH清除能力
•OH是国际学者们公认的毒性最强的活性氧自由基,是生物有机体过氧化损伤的主要因素。因此分析样品对•OH的清除作用对抗氧化的研究起着至关重要的作用。实验测得鲍内脏多糖清除•OH的结果如图2所示,鲍内脏多糖均具有较好的•OH清除活性。CAVP对•OH的清除能力随质量浓度的增加近乎呈近线性增加,最终清除率可达约80%。而两种纯化鲍内脏多糖AVP1和AVP2的•OH清除率均只能达到60%左右,之后增长缓慢呈近持平状态,但是AVP2在低质量浓度0~5 mg/mL范围内对•OH的清除率即可达到60%,表明在低质量浓度条件下AVP2与CAVP、AVP1对比抗氧化性能较强。
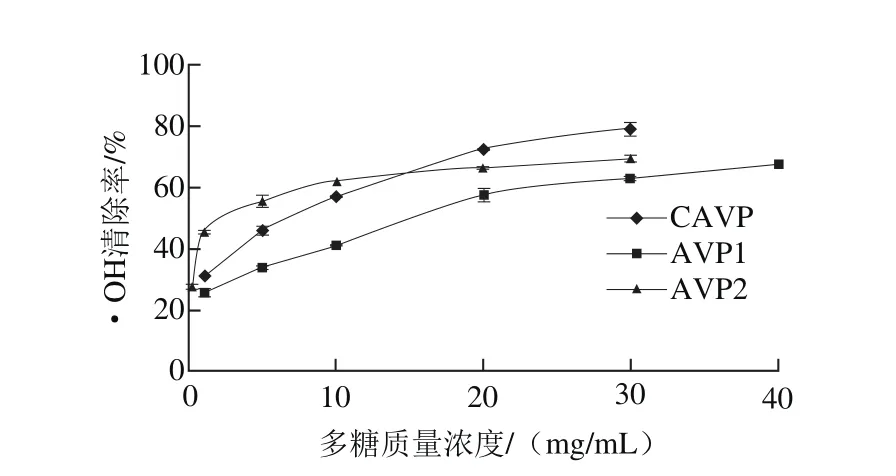
图2 鲍内脏多糖对•OH的清除作用Fig. 2 Hydroxyl radical scavenging capacity of abalone visceral polysaccharides
鲍内脏多糖对•OH的清除作用回归方程和IC50如表3所示,AVP1的IC50为15.27 mg/mL,CAVP和AVP2仅需要约AVP1的一半的剂量,因此以IC50值来分析样品对•OH的清除能力,CAVP和AVP2要好于AVP1。

表3 鲍内脏多糖清除·OH的回归方程和IC50Table 3 Regression equations and IC50for hydroxyl radical scavenging capacity of abalone visceral polysaccharides
2.4 鲍内脏多糖对H2O2引起LO2细胞损伤的保护作用
2.4.1 鲍内脏多糖对LO2细胞生长的影响

图3 不同质量浓度的鲍内脏多糖对LO2细胞生长的影响Fig. 3 Effects of different concentrations of abalone visceral polysaccharides on LO2 cells growth
由图3可知,在多糖质量浓度为4、2、1、0.5、0.25 mg/mL时,LO2细胞的存活率均在90%以上,细胞增殖率均在20%以下,多糖对细胞生长无显著增殖或衰亡作用,因此确定以此多糖质量浓度范围进行进一步实验具有一定的可行性。
2.4.2 LO2细胞氧化损伤模型的建立
筛选H2O2剂量与作用时间的条件是与空白对照组比较达到细胞的半致死率。H2O2对LO2细胞的损伤结果如图4所示。随着H2O2浓度的增加和H2O2作用时间的延长,细胞存活率明显下降。在H2O2浓度为4 mmol/L,作用时间为2 h时,细胞存活率下降至50%,已达到半数致死率,因此选择H2O2浓度为4 mmol/L、作用时间2 h,作为LO2细胞氧化损伤模型条件。

图4 不同浓度H2O2对LO2细胞相对存活率的影响Fig. 4 Effects of different concentrations of H2O2 on the relative survival rate of LO2 cells
2.4.3 鲍内脏多糖对H2O2损伤LO2细胞的保护作用
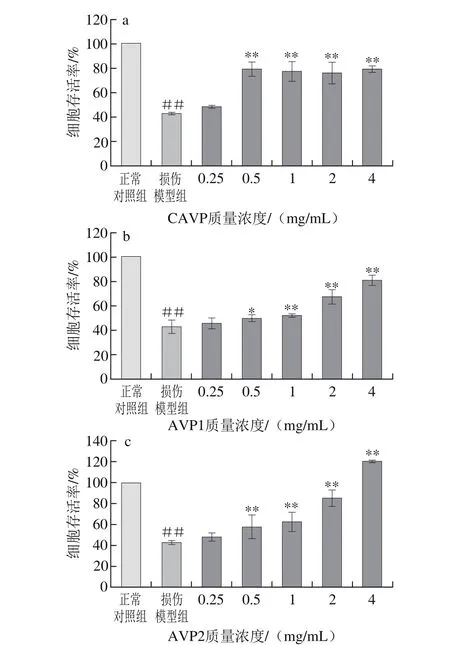
图5 鲍内脏多糖对LO2细胞氧化损伤的保护作用Fig. 5 Protective effect of abalone visceral polysaccharides against oxidative damage in LO2 cells
鲍内脏多糖对LO2细胞氧化损伤的保护作用结果如图5所示,与H2O2损伤模型组相比,CAVP在质量浓度为0.5 mg/mL时细胞存活率增长至78%,之后随质量浓度的增加细胞存活率相对持平(图5a);AVP1和AVP2在质量浓度为0.25 mg/mL时细胞存活率开始较损伤模型组有所增长,且随着质量浓度的升高细胞存活率增加(图5b、c)。统计分析表明,CAVP、AVP1和AVP2均在加样量0.5 mg/mL时较模型组开始差异显著性(P<0.05,P<0.01),当质量浓度为4 mg/mL时,保护细胞存活率较所选其他质量浓度相比最高,且与损伤模型组相比差异极显著(P<0.05),选择加样质量浓度0.5 mg/mL和 4 mg/mL同时进行做后续指标的测定,比较各样品间抗氧化指标的差异。
2.4.4 鲍内脏多糖对细胞上清中LDH活力的影响
正常细胞经由H2O2处理后,细胞膜被破坏从而导致细胞内的LDH释放。因此,上清液LDH活力的高低可反映出细胞的损伤程度。从图6可以看出,LO2细胞经H2O2损伤后细胞培养液中LDH活力显著升高,而经VC和鲍内脏多糖保护的LO2细胞培养液中LDH的含量明显少于损伤模型组。其中质量浓度为0.5 mg/mL的VC对细胞损伤的抑制作用最强,而3 种样品组间差异不明显,表明实验组细胞损伤程度相对较低,鲍内脏多糖具有抑制细胞损伤的能力。

图6 鲍内脏多糖对LDH活力的影响Fig. 6 Effects of abalone visceral polysaccharides on LDH activity
2.4.5 鲍内脏多糖对细胞内GSH-Px、CAT、SOD活力的影响
GSH-Px、CAT、SOD是机体内抗氧化酶系统的重要组成部分,对催化H2O2分解、维持机体的氧化平衡起着至关重要的作用,因此,3 种抗氧化酶活力的高低可同时反映出组织清除自由基的能力[27]。
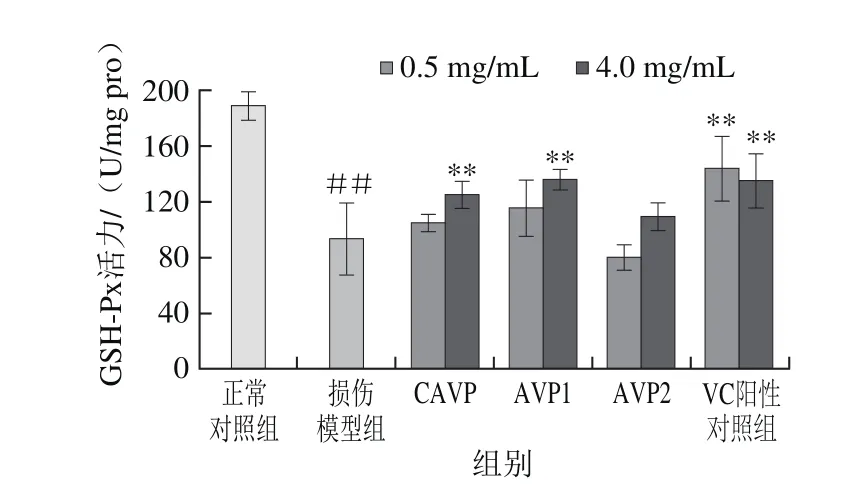
图7鲍内脏多糖对GSH-Px活力的影响Fig. 7 Effect of abalone visceral polysaccharides on GSH-Px activity
图7 结果显示,经H2O2损伤的LO2细胞中GSH-Px活性较对照组极显著降低(P<0.01),VC阳性对照组在两个质量浓度条件下较模型组均具有极显著提高GSH-Px活力的作用(P<0.01),而CAVP、AVP1在质量浓度达到4 mg/mL条件下才能极显著提高受损细胞内GSH-Px的活力(P<0.01)。AVP2对提高GSH-Px活力作用效果不显著(P>0.05)。
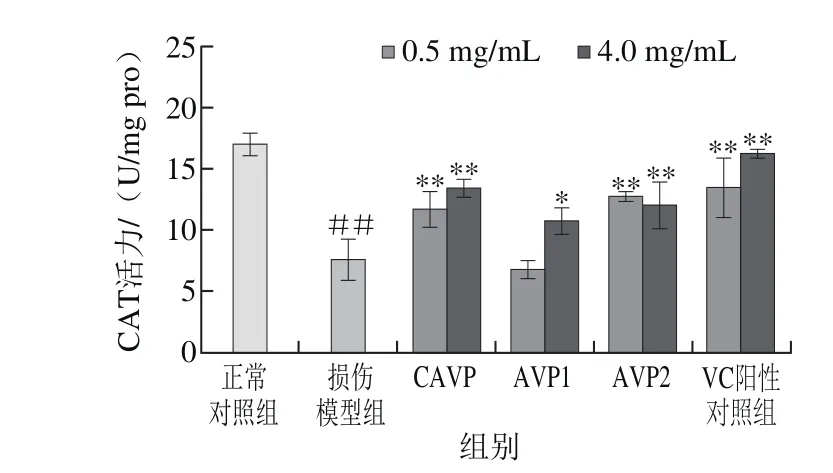
图8 鲍内脏多糖对CAT活力的影响Fig. 8 Effect of abalone visceral polysaccharides on CAT activity
图8结果显示,经H2O2损伤的LO2细胞中CAT活性较正常对照组极显著降低(P<0.01),CAVP、AVP2在质量浓度0.5 mg/mL条件下极显著提高受损细胞内CAT活性(P<0.01),AVP1对CAT活力的提高作用较弱,在质量浓度为4 mg/mL条件下受损细胞内的CAT活性才显著升高(P<0.05),而VC阳性对照组对提高提高细胞内CAT活力作用均优于鲍内脏多糖样品。
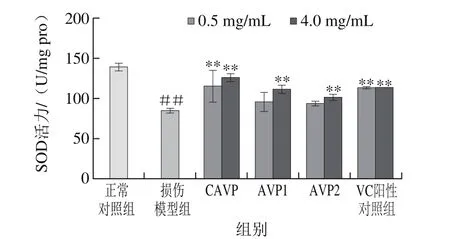
图9鲍内脏多糖对SOD活力的影响Fig. 9 Effect of abalone visceral polysaccharides on SOD activity
图9 结果显示,经H2O2损伤的LO2细胞中SOD活性较正常对照组极显著降低(P<0.01),CAVP对提高受损细胞内SOD活性作用较强,其次为VC阳性对照组,经它们作用后的细胞中SOD活性与模型组相比均呈极显著增加(P<0.01),样品AVP1、AVP2也有相应提高SOD活力的能力,表明鲍内脏多糖能提高受损细胞中SOD活力,能防止其受损后快速氧化,具有一定的保护能力。
2.4.6 鲍内脏多糖对MDA含量的影响
MDA是脂质过氧化的生物标记物之一,几十年来一直被国内外学者用来反映脂质过氧化的水平,MDA含量的高低又间接反映了机体细胞受到自由基攻击的严重程度。图10结果显示,经H2O2损伤LO2细胞脂质过氧化产物MDA含量较正常对照组极显著增加(P<0.01),鲍内脏多糖对受损细胞过氧化具有保护性能,可降低受损细胞内MDA的产生,在质量浓度为4 mg/mL时,样品CAVP、AVP1和AVP2对降低脂质过氧化产物MDA的生成具有显著作用(P<0.05,P<0.01),VC对降低脂质过氧化作用较强,其MDA的含量几乎接近正常对照组。
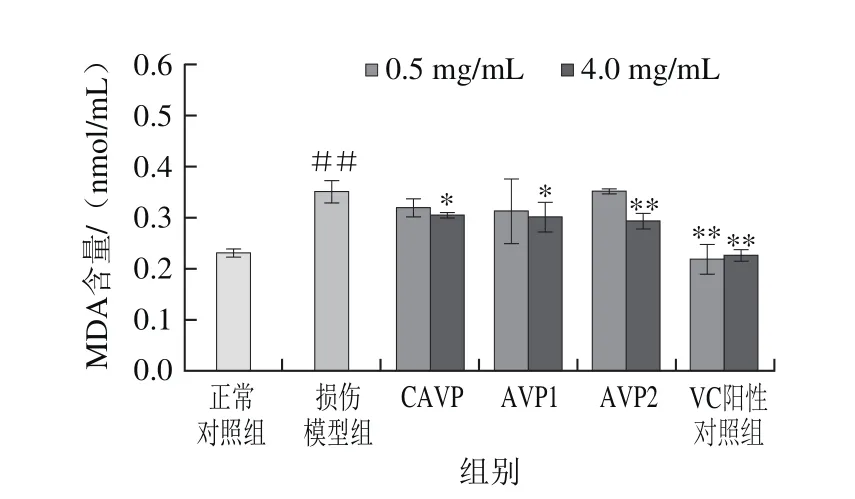
图10 鲍内脏多糖对MDA含量的影响Fig. 10 Effect of abalone visceral polysaccharides on MDA content
3 讨论与结论
抗氧化在细胞水平发挥作用的机制有很多[28],其中重要的一点是抗氧化物可以上调抗氧化酶活性,减少有毒过氧化产物的生成,提高细胞氧化防御体系,增强细胞抗氧化能力。Zhai Li等[29]研究发现,川芎嗪衍生物可保护被H2O2损伤的静脉内皮细胞,进一步机理分析得出,这种衍生物可增加内皮型NO和一氧化氮合酶活性,可以增加SOD和GSH-Px的活性,减少LDH和过氧化产物的释放,这些指标的变化均减少了细胞凋亡,提高了细胞活力,从而证明川芎嗪衍生物是通过上调抗氧化酶的活性来发挥抗氧化与抗凋亡作用;Qiu Lihong等[30]研究抗氧化物黄芪皂苷的抗氧化作用,发现它可以促进活化内皮型一氧化氮合酶,从而产生内源性一氧化氮,且一定程度上提高了SOD水平和活力。本实验细胞水平抗氧化研究结果表明,H2O2的损伤导致LO2细胞存活率降低,细胞上清液LDH漏出量增多且能够显著造成细胞内GSH-Px、CAT、SOD的活性降低及细胞脂质过氧化产物的增加。但当提前加入VC和鲍内脏多糖样品对细胞进行保护后,可通过上调细胞内GSH-Px、CAT、SOD抗氧化酶活性、减少MDA的生成量,发挥其抗氧化作用,并且3 种多糖在一定质量浓度范围内可小幅促进肝细胞LO2的增殖。该结果与之前研究发现的通过上调抗氧化物酶活性、减少有毒过氧化产物的生成作用机制相一致,说明3 种鲍内脏多糖在细胞水平上均有抗氧化活性,表现为CAVP在提高细胞存活率的作用中效果较纯化多糖好,但是两种纯化多糖对于保护细胞膜避免LDH的释放作用较优,而3 种样品在对提高细胞内抗氧化酶活力上均起不同作用,原因可能是具体指标的作用机制与多糖的性质结构对细胞作用的差异有关。
有研究证明,多糖的结构和性质是影响其生物活性的重要因素。多糖的活性与支链的性质密切相关,如支链的多少和取代基的位置等,本实验鲍内脏多糖支链的主要取代基为蛋白氨基和硫酸基团,经测定CAVP和AVP2的蛋白含量较高,因此推断其氨基取代基较多,糖-蛋白的复合叠加效应可使其抗氧化活性提高。硫酸化多糖中C4位上的硫酸基变为C6位硫酸基,其抗凝血活性完全丧失[31]。鲍内脏多糖AVP1中硫酸根含量较多,但并不是活性较高的多糖,可能原因就与其硫酸根位置有一定关系。多糖分子质量过高不利于多糖跨越多重细胞膜障碍进入生物体内发挥活性作用,而分子质量过低,会导致无法形成聚合的活性结构,Alban等[32]研究发现分子质量与硫酸化多糖抗凝血活性之间具有一种哑铃型的相关曲线关系。由此可见,不同多糖产生生物活性的分子质量范围不同,本实验中粗多糖CAVP分子质量范围宽泛、混合物种类较多、溶解性好、使其生物活性较好。多糖的性质和结构对生物活性的影响存在着相关性,结构决定理化性质,从而影响活性。鲍内脏多糖的构效关系有待进一步研究。
综上所述,鲍内脏多糖具有一定的抗氧化能力,可有效清除DPPH自由基和•OH,且在一定质量浓度范围内提高细胞存活率、改善抗氧化酶的活力、减少过氧化产物生成、对经H2O2损伤的LO2细胞具有保护作用。
[1] PYROR W A. Free radical biology: xenobiotics, cancer and aging[J]. Annals of the New York Academy of Sciences, 1982, 393: 1-22. DOI:10.1111/j.1749-6632.1982.tb31228.x.
[2] LOMNITSKI L, BERGMAN M, SCHON I, et al. The effect of dietary vitamin E and β-carotene on oxidantion processes in the rat testis[J]. Biochimica et Biophysica Acta, 1991, 1082(1): 101-107. DOI:10.1016/0005- 2760(91)90305-2.
[3] HARMAN D. Free radicals in aging[J]. Molecular and Cellular Biochemistry, 1988, 84(2): 155-161. DOI:10.1007/BF00421050.
[4] 张君慧, 张晖, 王兴国, 等. 抗氧化活性肽的研究进展[J]. 中国粮油学报, 2008, 23(6): 227-233. DOI:10.3321/j.issn:1003-7969.2004.05.013.
[5] 许龙, 黄运安, 朱秋劲, 等. 天麻多糖的提取及其清除自由基作用研究[J]. 广东农业科学, 2015, 42(21): 117-123. DOI:10.3969/ j.issn.1004-874X.2015.21.022.
[6] 许小向, 洪艳平, 胡捷敏, 等. 松针多糖微波提取工艺及抗氧化性研究[J]. 食品工业科技, 2015, 36(23): 222-227.
[7] 李霞, 张峰, 李永才, 等. 兰州百合不同部位多糖含量及抗氧化活性的比较[J]. 食品工业科技, 2012, 33(24): 88-91.
[8] CHEN Y, ZHANG H, WANG Y X, et al. Acetylation and carboxymethylation of the polysaccharide from Ganoderma atrum and their antioxidant and immunomodulating activities[J]. Food Chemistry, 2014, 156: 279-288. DOI:10.1016/j.foodchem.2014.01.111.
[9] ZENG W C, ZHANG Z, JIA L R. Antioxidant activity and characterization of antioxidant polysaccharides from pine needle (Cedrus deodara)[J]. Carbohydrate Polymers, 2014, 108: 58-64. DOI:10.1016/j.carbpol.2014.03.022.
[10] 谢明勇, 聂少平. 天然产物活性多糖结构与功能研究进展[J]. 中国食品学报, 2010, 10(2): 1-11. DOI:10.3969/j.issn.1009-7848.2010.02.001.
[11] 陈珏晓, 王桂芬, 李丽, 等. 黄芪多糖对过氧化氢诱导的MRC-5细胞氧化损伤的保护作用[J]. 细胞与分子免疫学杂志, 2015, 31(8): 1062-1066.
[12] XUE Changhu, FANG Yu, LIN Hong, et al. Chemical characters and antioxidative properties of sulfated polysaccharides from Laminaria japonica[J]. Journal of Applied Phycology, 2001, 13(1): 67-70. DOI:10.1023/A:1008103611522.
[13] 林国荣, 吴明霞, 张泽生, 等. 南日鲍营养成分分析及评价[J]. 营养学报, 2015(1): 99-101.
[14] 薛长湖, 林洪, 曾名勇, 等. 我国水产品加工的现状和未来[J]. 科学养鱼, 2002(2): 6-7.
[15] 周歧存, 麦康森. 皱纹盘鲍营养研究进展[J]. 饲料研究, 1999(2): 16-17.
[16] ZHOU D Y, ZHU B W, QIAO L, et al. In vitro, antioxidant activity of enzymatic hydrolysates prepared from abalone (Haliotis discus hannai, Ino) viscera[J]. Food and Bioproducts Processing, 2012, 90(2): 148-154. DOI:10.1016/j.fbp.2011.02.002.
[17] 苏永昌, 刘淑集, 王茵, 等. 鲍鱼内脏多糖的提取及其抗氧化活性研究[J]. 吉林农业(学术版), 2010(10): 170-171.
[18] 邓维星, 李绍锋, 白佳欣, 等. 鲍鱼内脏多糖的分离及体外抗氧化的研究[J]. 中国食品添加剂, 2016(9): 103-109. DOI:10.3969/ j.issn.1006-2513.2016.09.010.
[19] 叶燕军, 陈俊, 翁武银. 超滤膜分离鲍鱼内脏酶解物及其体外抗氧化活性的研究[J]. 现代食品科技, 2015, 31(5): 130-136; 284.
[20] JIN Y, ZHANG L N, ZHANG M, et al. Antitumor activities of heteropolysaccharides of Poria cocos mycelia from different strains and culture media[J]. Carbohydrate Research, 2003, 338(14): 1517-1521. DOI:10.1016/S0008-6215(03)00198-8.
[21] DODGSON K S, PRICE R G. A note on the determination of the ester sulphate content of sulphated polysaccharides[J]. Biochemical Journal, 1962, 84(1): 106-110. DOI:10.1016/ biochemj00801-0113.
[22] 陈健英, 周秋璇, 胡丽华. 凝胶渗透色谱与多角度激光光散射联用仪(GPC-MALLS)的使用和维护[J]. 分析仪器, 2015(2): 94-95. DOI:10.3969/j.issn.1001-232X.2015.02.27.
[23] 涂立英. 魔芋多糖及其降解产物生物活性的研究[D]. 厦门: 集美大学, 2015: 9-15.
[24] 陈同强, ADILBEKOV J, 王娟, 等. 凝胶渗透色谱-多角度激光散射联用技术研究红芪多糖中4 个组分分子特征[J]. 中国中药杂志, 2012, 37(12): 64-65.
[25] 张俐娜, 薛奇. 高分子物理近代研究方法[M]. 武汉: 武汉大学出版社, 2003: 65-73.
[26] 韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J].食品科学, 2014, 35(9): 317-322. DOI:10.7506/spkx1002-6630-201409062.
[27] 陈瑞川, 李立, 苏金华, 等. 抗氧化剂Isoverbascoside对MGC80-3细胞抗氧化酶活性和癌基因表达的影响[J]. 厦门大学学报(自然科学版), 1999, 38(6): 913-917. DOI:10.3321/ j.issn:0438-0479.1999.06.021.
[28] 郭玉文, 曹婧然, 何立杰. 细胞水平的抗氧化机制研究进展[J]. 医学综述, 2016(1): 13-16. DOI:10.3969/j.issn.1006-2084.2016.01.004.
[29] ZHAI Li, ZHANG Peng, SUN Renyuan, et al. Cytoprotective effects of CSTMP, a novel stilbene derivative, against H2O2-induced oxidative stress inhuman endothelial cell[J]. Pharmacological Reports, 2011, 63(6): 1469-1480. DOI:10.1016/S1734-1140(11)70711-3.
[30] QIU Lihong, XIE Xianji, ZHANG Biqi, et al. Astragaloside Ⅳimproves homocysteineinduced acute phase endothelial dysfunction via antioxidation[J]. Biological & Pharmaceutical Bulletin, 2010, 33(4): 641-646. DOI:10.1248/bpb.33.641.
[31] MULLOY B, MOURAO P A S, GRAY E. Structure/function studies of anticoagulant sulphated polysaccharides using NMR[J]. Journal of Biotechnology, 2000, 77(1): 123-135. DOI:10.1016/S0168-1656(99)00211-4.
[32] ALBAN S, FRANZ G, Characterization of the anticoagulant actions of a semisynthetic curdlan sulfate[J]. Thrombosis Research, 2000, 99(4): 377-388. DOI:10.1016/S0049-3848(00)00264-4.
Antioxidant Activity of Polysaccharides from Abalone Viscera
WANG Jiao1, WEI Haocheng1, HE Chuanbo1, MA Ying2, XIONG Hejian1,*
(1. College of Food Science and Biotechnology, Jimei University, Xiamen 361021, China; 2. College of Fisheries, Jimei University, Xiamen 361021, China)
The antioxidant capacity of polysaccharides extracted from abalone viscera was studied by measuring their 1,1-diphenyl-2-picrylhydrazyl (DPPH) and hydroxyl radical scavenging capacity and their ability to protect human liver LO2 cells against H2O2-induced oxidative damage. The results demonstrated that the crude polysaccharide (CAVP) and two purified fractions (AVP1 and AVP2) all had apparent free radical scavenging capacity with a half maximal inhibitory concentrations (IC50) of DPPH radical scavenging activity of 1.46, 1.74 and 1.55 mg/mL, respectively, and an IC50of hydroxyl radical scavenging activity of 7.14, 15.27 and 8.11 mg/mL, respectively. In addition, all three polysaccharides in the concentration range from 0.5 to 4.0 mg/mL could protect LO2 cells against H2O2-induced oxidative damaged as indicated by signif i cantly increased survival rate and CAVP at 4.0 mg/mL, AVP1 at 0.5 mg/mL and AVP2 at 0.5 mg/mL decreased the activity of lactic dehydrogenase (LDH) in cell culture supernatant. CAVP significantly increased the intracellular activities of glutathione peroxidase (GSH-Px) at 4.0 mg/mL, catalase (CAT) at 0.5 mg/mL and superoxide dismutase (SOD) at 0.5 mg/mL. AVP1 at 4.0 mg/mL resulted in a signif i cant elevation in CAT activity and a highly signif i cant increase in GSH-Px and SOD activities. AVP2 at both 0.5 and 4.0 mg/mL could highly signif i cantly increase CAT activity. All three polysaccharides at 4.0 mg/mL could signif i cantly reduce the content of malondialdehyde (MDA) as a lipid peroxidation product. Therefore, abalone visceral polysaccharides could be used as potential antioxidant ingredients in functional foods.
abalone viscera; polysaccharide; antioxidant activity; LO2 cells
10.7506/spkx1002-6630-201715019
TS254.1
A
1002-6630(2017)15-0115-07
2016-06-28
海洋公益性行业科研专项(201405016);福建省科技重点项目(2016N0022);
厦门市科技计划项目(3502Z20153014)
王姣(1989—),女,硕士研究生,研究方向为天然活性物质。E-mail:w.j0131@163.com
*通信作者:熊何健(1968—),男,研究员,硕士,研究方向为天然活性物质。E-mail:hjxiong@jmu.edu.cn

