土培条件下不同盐分梯度对水稻产量及其生理特性的影响
荆培培 崔敏 秦涛 周在中 戴其根
(扬州大学/农业部长江流域稻作技术创新中心/江苏省作物遗传生理重点实验室,江苏扬州225009;第一作者:1902558087@qq.com;*通讯作者:qgdai@yzu.edu.cn)
土培条件下不同盐分梯度对水稻产量及其生理特性的影响
荆培培 崔敏 秦涛 周在中 戴其根*
(扬州大学/农业部长江流域稻作技术创新中心/江苏省作物遗传生理重点实验室,江苏扬州225009;第一作者:1902558087@qq.com;*通讯作者:qgdai@yzu.edu.cn)
以南粳9108和甬优2640为材料,设置6个土壤含盐量(0%、0.07%、0.14%、0.21%、0.28%、0.35%),研究不同盐分梯度对水稻产量和生理特性的影响。结果表明:(1)盐胁迫影响水稻的生长和发育进程。株高、叶面积、干物质量等形态指标均随盐浓度的上升而下降;稻谷产量亦随盐浓度增加而下降,在0.14%、0.21%、0.28%、0.35%盐浓度处理时产量显著下降,南粳9108分别减产14.14%、43.65%、58.91%、65.68%,甬优2640分别减产20.25%、31.97%、40.41%、49.82%。(2)随着盐浓度的增加,2个参试品种抽穗期叶片抗氧化酶活性均呈先升后降趋势,在0.07%处理下达最高值。(3)抽穗期叶片中游离脯氨酸含量随盐浓度的上升而增加,盐浓度大于0.14%,游离脯氨酸含量较对照显著增加。(4)盐胁迫下,水稻植株吸收Na+并置换出K+,除叶片中K+变化无规律之外,随着盐浓度上升,各部位K+含量均下降,Na+含量均上升,K+/Na+均呈下降趋势。茎鞘与叶运输的SK、Na随盐浓度的上升而上升,茎选择性运输K+而抑制Na+进入叶片;根与茎的SK、Na随盐浓度的上升而下降,茎吸收Na+并输出K+到根系。总体而言,低盐浓度对高产水稻品种产量和生理特性无显著影响,盐浓度大于0.07%时影响显著。
水稻;盐分梯度;盐胁迫;产量;生理特性
江苏沿海地区是传统的水稻主产区,但其“人、地、粮”矛盾较为突出,不断淤长的沿海滩涂无疑成为最重要的后备耕地资源[1]。江苏沿海滩涂面积达67万多hm2,占全国的近1/3[2]。这些滩涂大多集中分布,且气候温润、雨热同季、光照充足、无霜期长,适合多种农作物生长[3-4],因此一直都是研究开发的重点。
水稻具有的一定的耐盐性和灌溉水生的独特优势,有降低土壤盐分的生物功能,加快了盐碱地的脱盐和有机质的积累,土壤既被利用又被改良[5-8],形成改良与应用相互促进的循环。目前江苏沿海滩涂水稻种植是以生长期土壤的淹灌和排水换水,冲洗和排走盐分为主要手段[9],但是江苏沿海滩涂并没有足够的淡水资源。因此,使用一定的手段使水稻能够适应今后将大力发展的盐地农业和海水灌溉,是江苏沿海滩涂农业发展中亟待解决的问题[10]。
近年来,人们积累了盐碱地种植水稻的丰富经验,如客水压盐、覆膜、施肥等方法,尽管如此,还是会有很多盐碱地水稻种植失败的案例发生,这是因为没有清楚地认识盐碱地的含盐量和水稻品种的耐盐程度。大部分植物在土壤含盐量为0.3%时便会产生不良反应,大于0.5%便不能生存[11],水稻在幼苗期对土壤盐分极为敏感,幼苗期土壤含盐量临界度为0.09%~0.26%[12]。余为仆[13]认为,水稻能适应的土壤最大含盐量为0.15%,一旦超过,极易发生死苗现象。王建飞等[14-15]研究发现,在适宜的温度下,以0.5%的盐浓度进行水稻耐盐性的筛选较为合适。江苏沿海滩涂面积广阔,并且一直在持续增长中,不同盐碱地的含盐量不尽相同。研究发现,江苏省如东县土壤剖面的平均含盐量在0.8838‰~2.4698‰之间[16],属于轻度至中度盐渍土壤[17],这使得水稻受不同程度的盐害影响,难以发挥其产量潜力。前人[18-19]研究表明,可以依靠一些生理指标来评价植物耐盐能力。因此,研究不同程度的盐分胁迫对水稻产量和生理特性的影响,对于江苏沿海滩涂水稻生产和有效开发可利用耕地具有重要意义。
前人对水稻耐盐性的研究多集中在吉林等地,对江苏沿海滩涂的水稻种植报道较少。此外,前人对水稻的盐分处理也大多局限在某一生育时期,一种或两种盐浓度对水稻产量和生理指标的影响也有一些报道,但不同盐分梯度对水稻整个生育期的生理特性及产量的影响报道较少。本文在前期筛选出水稻能适应的盐浓度范围的基础上,研究了6个盐分梯度对南粳9108和甬优2640的产量及生理指标的影响,以为江苏沿海滩涂水稻高产抗盐品种的选育提供参考指标。
1 材料与方法
1.1 试验材料与地点
试验于2015年在扬州大学农学院试验农场土培池进行,每个土培池长3.7 m、宽1.6 m,含土壤2.3 m3。供试品种选用具有代表性的高产水稻品种南粳9108和甬优2640。拌土所用盐为浙江蓝海星盐制品厂生产的Q/ZLY型速溶海水晶。
1.2 试验设计
设置6个盐浓度梯度,即0、0.07%、0.14%、0.21%、0.28%、0.35%,根据土壤体积、密度及土壤含盐量计算出各土培池应施的海盐质量,移栽前将对应质量的速溶海水晶均匀撒施在各个土培池中,并与土壤搅拌均匀;试验采用机插软盘育秧,6月6日播种,7月20日移栽,行株距30.0 cm×13.2 cm,每个土培池前半部种植南粳9108,后半部种植甬优2640;南粳9108 4本栽插,甬优2640双本栽插。纯氮用量300 kg/hm2,氮肥按基蘖肥∶穗粒肥=6∶4,基肥∶蘖肥=5∶5施用。N∶P2O5∶K2O=2∶1∶2,磷肥作基肥一次性施用,钾肥50%作基肥施用、50%作穗肥施用。秧苗移栽后采用湿润灌溉为主;群体达到目标穗数的80%时搁田,控制无效分蘖发生;灌浆结实期间歇灌溉,干湿交替,收割前7 d断水搁田。按常规高产栽培要求防治病虫。
1.3 测定项目与方法
1.3.1 形态指标的测定
于水稻抽穗期,每个小区取代表性植株5丛,测定株高,叶片分高效叶、有效叶、无效叶,并分别测量其叶面积,按茎、穗、叶分组烘干称量。
1.3.2 生理指标的测定
于抽穗期,各处理分别取5张剑叶测定抗氧化酶活性:超氧化物歧化酶(SOD)活性采用氮蓝四唑光还原法测定,酶活性单位为u/g·FM[20];过氧化氢酶(CAT)采用紫外吸收法测定,酶活性以u/g·min表示[21];过氧化物酶(POD)活性采用愈创木酚法测定,以u/g·min表示[22]。
1.3.3 Na+、K+含量测定

图1 不同盐分梯度对水稻抽穗期株高的影响
各处理于抽穗期取根、茎、叶干样,粉碎后称取0.25 g,加5 mL H2SO4,微波消解后定容至25 mL,用FP640火焰光度计测定Na+、K+含量。K+和Na+在不同器官(根、茎、叶)的运输选择性系数参考相关文献[23]计算如下:
根与茎鞘SK、Na(运输)={[K+]茎鞘/[Na+]茎鞘}/{[K+]根/ [Na+]根}
茎鞘与绿叶SK、Na(运输)={[K+]绿叶/[Na+]绿叶}/{[K+]茎鞘/ [Na+]茎鞘}
游离脯氨酸含量测定:取抽穗期叶片干样测定。采用水合茚三酮法测定[24],用磺基水杨酸提取叶片中的脯氨酸,在酸性条件下,脯氨酸与茚三酮反应生成红色缩合物,经甲苯萃取后用可见分光光度计测定520 nm处的吸光度。脯氨酸含量单位以μg/g表示。
1.3.4 产量测定
成熟期每处理调查40丛,计算有效穗数,取5丛调查每穗粒数、结实率和测定千粒重,计算理论产量,并实收核产。
1.4 数据分析与作图
用Excel 2010进行数据整理,用SPSS 17.0软件进行方差分析,Sigmaplot 10.0作图。
2 结果与分析
2.1 不同浓度盐胁迫对水稻株高的影响
如图1所示,南粳9108株高在低盐浓度下降幅较小,0.07%浓度处理时,株高与对照差异不显著;随着盐浓度的进一步增加,株高急剧下降,0.14%和0.21%处理比对照分别下降16.8%和26.3%,差异达显著水平。说明低盐浓度对南粳9108株高影响较小,但盐浓度高于0.07%的处理对株高会产生明显的抑制作用。

表1 不同盐分梯度对水稻抽穗期干物质、叶面积指数以及粒叶比的影响
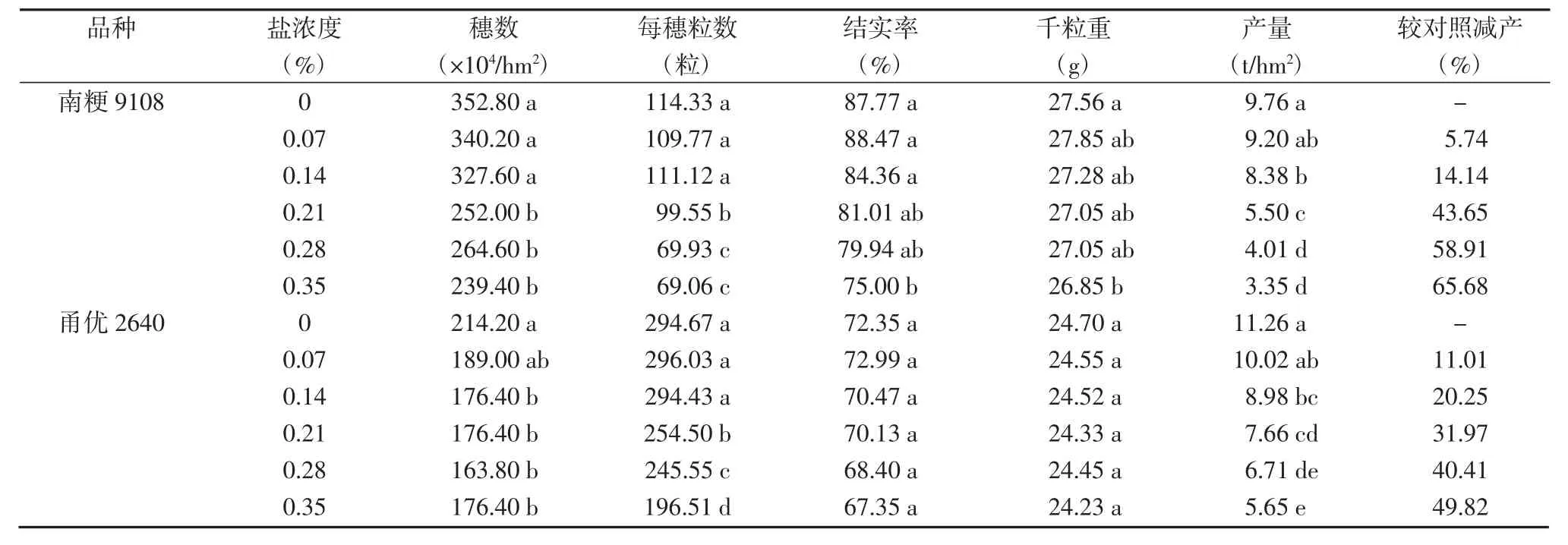
表2 不同盐分梯度对水稻产量及其构成因素的影响
甬优2640的株高对盐胁迫较为敏感,随盐浓度增加呈递减趋势,且各处理与对照相比差异均达显著水平。总体上,盐胁迫会抑制水稻株高的增加,且盐浓度越大株高降低越多。
2.2 不同盐浓度对水稻抽穗期干物质积累、群体叶面积组成与粒叶比的影响
由表1可知,2个品种抽穗期干物质积累量在0.07%盐浓度处理下下降幅度小,与对照相比差异不显著,随着盐浓度的进一步增加干物质积累量显著下降。低盐浓度处理对南粳9108叶面积影响较小,0.07%和0.14%处理比对照分别下降1.0%和2.0%,差异不显著,当盐浓度大于0.14%时差异达显著水平。甬优2640的叶面积变化对盐胁迫较为敏感,与对照相比,叶面积在各个盐浓度处理下均显著下降。2个品种有效叶面积率和高效叶面积率均随盐浓度上升而下降。就粒叶比(颖花/叶)而言,盐浓度低于0.28%时较对照差异不显著,0.35%处理较对照差异显著。
2.3 不同盐浓度对水稻产量及其构成因素的影响
由表2可知,2个品种的产量均随盐浓度的上升而下降,在0.07%浓度处理时,产量与对照差异不显著,随盐浓度增加,产量较对照显著下降,在高盐浓度0.35%处理下,南粳9108和甬优2640分别较对照减产65.68%和49.82%。穗数和每穗粒数在低盐浓度处理下较对照差异不大,但随浓度增加,下降幅度增大。就结实率和千粒重而言,南粳9108只有在0.35%处理下才与对照有显著差异,甬优2640在不同浓度盐处理下结实率和千粒重的变化均不显著。
2.4 不同盐浓度对水稻抽穗期抗氧化酶活性的影响
如图2所示,2个品种的超氧化物歧化酶(SOD)活性均随盐浓度的增加而呈现先升后降的趋势,在0.07%处理达到最大值。与对照相比,南粳9108在0.35%处理时达显著水平,甬优2640在0.28%处理时达显著水平。

表3 水稻抽穗期不同部位Na+、K+含量 (%)
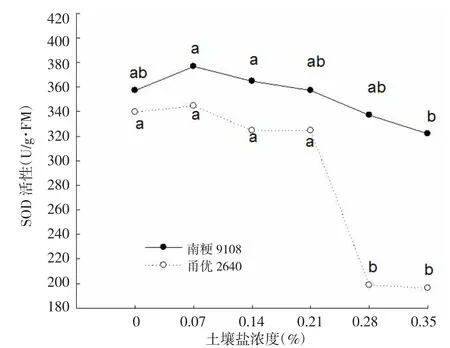
图2 不同盐分梯度对抽穗期水稻叶片SOD活性的影响

图3 不同盐分梯度对抽穗期水稻叶片POD活性的影响
从图3可以看出,随盐浓度上升,2个品种过氧化物酶(POD)活性呈现先升后降的趋势,且在0.07%处理下达到最大值。南粳9108叶片POD活性在0.07%盐处理时显著高于对照,在0.14%、0.21%、0.28%盐处理时与对照差异不显著。甬优2640的叶片POD活性在0.07%处理下与对照差异不明显,随盐浓度的进一步上升而明显降低,达显著水平。

图4 不同盐分梯度对抽穗期水稻叶片CAT活性的影响
如图4所示,随土壤含盐量上升,2个品种水稻叶片过氧化氢酶(CAT)活性呈现先升后降的趋势。在0.07%盐处理时,南粳9108叶片CAT活性略有升高,但未达显著水平,但随盐浓度的进一步增加而明显降低。甬优2640叶片CAT活性在0.07%盐处理时较对照显著升高,在0.21%、0.28%、0.35%盐处理下,较对照显著降低。
2.5 不同盐浓度对水稻不同部位K+、Na+含量及其分配的影响
从表3可见,除叶片中K+含量变化无规律之外,随盐浓度上升,各部位K+含量均下降,Na+含量均上升,且变化幅度较大。在无盐条件下,各部位K+含量由低到高为根、叶、茎,盐胁迫下由低到高为根、茎、叶,这说明盐胁迫下K+有从茎秆向其他器官运输的趋势。在无盐及低盐处理下(0、0.07%、0.14%),各部位Na+含量由低到高依次为叶、茎、根,其他处理下Na+由低到高为叶、根、茎,叶片中Na+含量平均只有茎的一半左右。

图5 不同盐分梯度对水稻各部分K+/Na+的影响

图6 不同盐分梯度对水稻各部位K+、Na+运输选择性系数的影响

图7 不同盐分梯度对水稻抽穗期叶片中游离脯氨酸含量的影响
从图5可以明显看出,随盐浓度上升,各部位的K+/Na+均呈下降趋势。各部位的K+/Na+由低到高依次为根、茎、叶,根中K+/Na+要较茎和叶片低。
SK、Na的选择性系数越高,K+的选择性运输越强。从图6可见,茎鞘与叶运输的SK、Na随盐浓度的上升而上升,表明茎秆选择性运输K+,并且抑制Na+进入叶片;根与茎的SK、Na随盐浓度的上升而下降,表明茎吸收Na+并输出K+到根系。
2.6 不同盐浓度对水稻游离脯氨酸含量的影响
如图7所示,2个品种叶片中游离脯氨酸含量随盐浓度的上升而增加,0.07%和0.14%处理与对照差异不显著,当盐浓度大于0.14%时,游离脯氨酸含量较对照显著增加。
3 讨论
3.1 盐胁迫对水稻生长及产量的影响
盐胁迫会使水稻发育缓慢,返青期和抽穗期延迟,不同程度的盐胁迫对水稻的生长发育和产量有显著影响。本研究结果表明,盐胁迫下水稻的生物量下降,这与前人研究结果一致[25-26]。研究表明,盐胁迫下,水稻幼苗生长受到抑制,表现为株高降低,心叶卷曲,枯叶增加[27],盐胁迫使水稻株高、干物质量和叶面积显著降低[28-29]。高显颖[30]研究发现,土壤盐浓度为0.22%时,水稻形态指标和产量与对照差异不显著,但随着盐浓度的增加,下降显著;余为仆[13]研究发现,土壤含盐量超过0.03%,水稻产量即表现显著下降;但本研究发现,土壤含盐量为0.14%时,2个水稻品种的产量与对照相比显著下降。可能原因是高显颖试验所用盐土为吉林西部自然盐碱土与黑土混合而成,松嫩平原盐碱地土壤质地粘重、有机质含量高,且黑土肥力较高,所以水稻能承受的盐浓度较高,而江苏沿海滩涂盐碱地与内陆盐碱地不同,盐分主要以氯化钠为主。本试验以氯化钠拌土,模拟江苏沿海滩涂土壤,研究结果对江苏沿海地区更有意义。
对于产量构成因素而言,Lee等[31]认为,分蘖数、有效穗数和千粒重等在盐胁迫下明显降低。张瑞珍[32]研究发现,盐胁迫使水稻千粒重显著下降,但结实率却随着盐浓度的上升而增加。但本研究结果发现,在盐胁迫下水稻千粒重和结实率的变化并不显著,产量下降主要是由穗数和穗粒数的下降引起的,可能原因是一定程度的盐胁迫影响了幼穗分化和小穗的形成[33]。
3.2 盐胁迫对水稻抗氧化酶活性和游离脯氨酸含量的影响
盐胁迫下,Na+在植物体内大量积累,打破了活性氧的产生和清除,从而导致膜脂过氧化作用和膜脂脱脂作用,破坏膜结构。POD、CAT和SOD是植物细胞中清除活性氧的重要组成成分,它们共同构成保护酶系统,其中SOD和POD是抵御活性氧和其他自由基对细胞膜伤害的极为重要的酶,其活性的提高是植物耐盐性提高的重要因素[34]。多数研究认为,盐胁迫使植物保护酶活性增强[35-36];符秀梅[37]研究表明,低盐浓度促进POD、SOD活性,高盐浓度抑制其活性,但CAT的变化无明显规律;李长润[38]研究发现,小麦叶片SOD活性在盐胁迫下降低。本研究发现,随盐浓度升高,POD、CAT、SOD活性呈现先升后降的趋势,在0.07%处理时活性达最高值,说明低盐浓度能促进植物体对膜系统的修复,保持细胞膜的完整性,一旦盐浓度上升可能导致活性氧自由基浓度增加,细胞膜伤害加剧,最终破坏膜系统。
植物细胞可以通过积累脯氨酸来提高抵抗渗透胁迫的能力,脯氨酸的积累能够降低叶片细胞的渗透势,避免细胞质脱水,同时脯氨酸可以消除蛋白质分解时所产生的氨,防止其他有毒基酸的积累[39]。但是目前对于脯氨酸对植物耐盐性的影响至今仍有争议。有研究发现,脯氨酸积累与植物耐盐性呈负相关[40-41];赵勇[42]研究发现,脯氨酸含量与植物耐盐性高低无关。本研究发现,游离脯氨酸积累量随盐胁迫的上升而增加,这与王志春等[43]的研究结果相一致。
3.3 盐胁迫对水稻不同部位K+、Na+含量及其分配的影响
盐胁迫下,水稻体内大量积累Na+等有毒离子,打破了植株体内的离子平衡,并且导致水分失衡,最终对水稻的生长发育造成影响[44-45]。为维持正常的生理代谢功能,植物体常通过根系的选择性吸收来抑制Na+的进入,促进Na+的外排及区隔化,维持较高的K+/Na+比,降低盐害影响[46]。
本研究发现,随盐浓度上升,除叶片中K+含量变化规律不明显外,其他各部位的K+含量均呈下降趋势,Na+呈上升趋势,这与王志春等[47]的研究结果相一致。从K+、Na+在植株体内的分配情况看,Na+在茎部积累较多,叶片中Na+含量只有茎中的一半左右,这说明茎是Na+的积累器官,水稻在受到一定程度盐胁迫时,盐分首先在茎中积累,这有利于维持叶片的活力。
维持植株体内一定的K+/Na+比是重要的,它是衡量植物耐盐性的一个重要指标。本研究发现,随盐浓度上升,各部位的K+/Na+比均呈下降趋势,水稻体内的K+、Na+的平衡被破坏。从各部位来看,叶片中的K+/Na+比最高,植株通过离子运输和平衡来首先保证叶片中维持较高的K+/Na+比,把叶片所受的盐害降到最低。
水稻根系吸收的K+、Na+会向茎和叶运输,植株各部位对K+、Na+的选择性运输会导致不同部位K+、Na+的累积量不同,从而影响水稻的耐盐性。SK、Na反映了盐胁迫下植株对K+、Na+的吸收和运输的选择性。随盐浓度上升,茎与叶运输的SK、Na呈上升趋势,而根与茎的SK、Na呈下降趋势,表明在盐胁迫下,茎向叶片运输K+而抑制Na+进入叶片,同时,茎向根部运输K+并从根部吸收Na+。这一结果表明,茎是水稻重要的K-Na库,可以通过吸收Na+和输出K+来提高水稻的耐盐性。
4 结论
盐胁迫会严重抑制水稻的生长发育进程,且随着土壤含盐量的增加,其抑制作用也增加。低盐浓度对水稻产量影响较小,但当盐浓度超过0.14%时,参试的2个水稻品种产量较对照显著下降,产量下降的主要原因是由有效穗数和穗粒数的下降导致的。当土壤盐浓度不高于0.07%时,这2个水稻品种具有一定的抗氧化酶清除能力。盐胁迫下,K+、Na+响应增强,茎是Na+的积累器官,也是水稻重要的K-Na库,可以通过吸收Na+和输出K+来提高植株的耐盐性。本研究结果进一步揭示了高产水稻品种在盐胁迫下发生的多种生理指标的变化,盐胁迫对水稻生理和产量的影响与土壤含盐量密切相关。
[1]王资生,阮成江,郑怀平.盐城滩涂资源特征及可持续利用对策[J].海洋通报,2001,20(4):64-69.
[2]李冬顺,杨劲松,姚荣江.生态风险分析用于苏北滩涂土壤盐渍化风险评估研究[J].土壤学报,2010,47(5):857-864.
[3]孙明法,严国红,唐红生,等.江苏沿海滩涂盐碱地水稻种植技术要点[J].大麦与谷类科学,2012,6(1):6-7.
[4]王芳,朱跃华.江苏省沿海滩涂资源开发模式及其适宜性评价[J].资源科学,2009,35(4):619-628.
[5] Shi D C,Sheng Y M,Zhao K f.Stress effects of mixed with various salinities on the seedlings of Aneuro lepidium Chinense[J].Acta Bot Sin,1998,40(12):1 136-1 142.
[6] Shaddad M A K.Comparative effect of sodium carbonate,sodium sulphate,and sodium chloride on the growth and related metabolic activities of pea plants[J].J Plant Nutr,1996,19(5):717-728.
[7]石德成,盛艳民,赵可夫.复杂盐碱条件对向日葵胁迫作用主导因素的实验确定[J].作物学报,2002,28(4):461-467.
[8]石德成,李玉明,杨国会,等.盐碱混合生态条件的人工模拟及其对羊草胁迫作用因素分析 [J].生态学报,2002,22(8):1 323-1 332.
[9]丁金海,吴春,洪立洲.在沿海滩涂上发展盐土农业技术的探讨[J].江苏农业科学,2006(6):440-442.
[10]赵可夫.盐生植物[J].植物学通报,1997,14(4):1-12.
[11]张福锁.植物营养生态生理学和遗传学[M].北京:科学出版社,1993:3-58.
[12]安延儒,左长喜,李新波,等.康地宝在盐碱地微咸水灌溉水稻苗床上的应用初探[J].垦殖与稻作,2001(4):32-33.
[13]余为仆.秸秆还田条件下盐胁迫对水稻产量与品质形成的影响[D].扬州:扬州大学,2014.
[14]程广有,许文会,黄永秀,等.水稻品种耐盐碱性的研究[J].延边农学院报,1995,17(4):195-201.
[15]王建飞,陈宏友,杨庆利,等.盐胁迫浓度和胁迫时的温度对水稻耐盐性的影响[J].中国水稻科学,2004,18(5):75-80.
[16]李鹏,濮励杰,朱明,等.江苏沿海不同时期滩涂围垦区土壤剖面盐分特征分析——以江苏省如东县为例 [J].资源科学,2013,35(4):764-772.
[17]王遵亲,祝寿泉,俞仁培.中国盐渍土[M].北京:科学出版社,1993:10-12.
[18]Tanji K.Agricultural salinity assessment and management[M].New York:ASCE,1990:161-185.
[19]Flowers T J,Yeo A R.Breeding for salinity resistance in crop plants:where next[J].Aust J Plant Physiol,1995,22:875-884.
[20]李合生.植物生理生化实验原理和技术 [M].北京:高等教育出版社,2000.pp 167-169.
[21]张志良,瞿伟菁.植物生理学实验指导:3版[M].北京:高等教育出版社,2003:274-277.
[22]邹琦.植物生理生化实验指导[M].北京:中国农业出版社,2003:173-174.
[23]陈德明,俞仁培.盐胁迫下不同小麦品种的耐盐性及其离子特征[J].土壤学报,1998,35(1):88-94.
[24]张宪政.作物生理研究法[M].北京:农业出版社,1990:142-143.
[25]Herralde F De,Biel C,Save R,et al.Effect of water and salt stresses on the growth,gas exchange and water relations in Argyranthemum coronopifolium plants[J].Plant Sci,1998,139(1):9-17.
[26]Silva E C,Nogueira R J M C,de Araujo F P.Physiological responses to salt stress in young umbu plants[J].Environ Exp Bot,2008,63(3): 147-157.
[27]郭望模,傅亚萍,孙宗修,等.盐胁迫下不同水稻种质形态指标与耐盐性的相关分析[J].植物遗传资源学报,2003,4(3):245-251.
[28]李姝晋,朱建清,叶小英,等.干旱和盐胁迫下水稻品种的双重耐性差异[J].西南农业学报,2005,18(2):128-132.
[29]祁栋灵,韩龙植,张三元.水稻耐盐/碱性鉴定评价方法[J].植物遗传资源学报,2005,6(2):226-230.
[30]高显颖.不同浓度盐碱胁迫对水稻生长及生理生态特性影响[D].长春:吉林农业大学,2014.
[31]Lee C K,Yoon Y H,Shin J.Growth and yield of rice as affected by saline water treatment at different growth stages[J].Korean J Crop Sci,2002,47(6):402-408.
[32]张瑞珍,邵玺文,童淑媛,等.盐碱胁迫对水稻源库与产量的影响[J].中国水稻科学,2006,20(1):116-118.
[33]Abdullah Z,Khan M A,Flowers T J.Causes of sterility in seed set of rice under salinity stress[J].J Agron Crop Sci,2001,187:25-32.
[34]毛桂莲,许兴,徐兆桢.植物耐盐生理生化研究进展[J].中国生态农业学报,2004,12(1):48-51.
[35]Soussi M,Ocana A,Lluch C.Effects of salt stress on growth, photosynthesis and nitrogen fixation in chick-pea(Cicer arietinum L.)[J].J Exp Bot,1998,49(325):1 329-1 337.
[36]Raza S H,Athar H R,Ashraf M,Hameed A.Glycinebetaine induced mod-ulation of antioxidant enzymes activities and ion accumulation in two wheat cultivars differing in salt tolerance[J].Environ Exp Bot, 2007,60:368-376.
[37]符秀梅,朱红林,李小靖,等.盐胁迫对水稻幼苗生长及生理生化的影响[J].广东农业科学,2010,04:19-21.
[38]李长润,刘友良.小麦的耐盐性及其耐盐机理初探[J].江苏农业学报,1993,9(1):8-12.
[39]曾玲玲,季生栋,王俊强,等.植物耐盐机理的研究进展[J].黑龙江农业科学,2009(5):156-159.
[40]Haro R,Baneulos M A,Quintero F J,et a1.Genetic basis of sodium exclusion and sodium toleranee in yeast—a model for plants[J]. Physiol Plant,1993,89:868-874.
[41]Petrusa L M,Winicol L.Proline statusin salt tolerant and salt sensitive alfalfa cell lines and plants in response to NaCl[J].Plant Physiol Biochem,1997,35:303-310.
[42]赵勇.盐胁迫下植物组织中甜菜碱和脯氨酸变化的研究 [D].北京:中国农业科学院,2004.
[43]王志春,杨福,齐春艳,等.盐碱胁迫下水稻渗透调节的生理响应[J].干旱地区农业研究,2010,28(6):153-157.
[44]Munns R,Termaat A.Whole-plant responses to salinity[J].Funct Plant Biol,1986,13(1):143-160.
[45]Yeo A R,Flowers T J.The physiology of salinity resistance in rice(Oryza sativa L.)and a pyramiding approach to breeding varieties for saline soils[J].Aust J Plant Physiol,1986,13:161-173.
[46]陈惠哲,Natalia L,朱德峰,等.盐胁迫下水稻苗期Na+和K+吸收与分配规律的初步研究 [J].植物生态学报,2007,31(5):937-945.
[47]王志春,杨福,陈渊,等.苏打盐碱胁迫下水稻体内的Na+、K+响应[J].生态环境,2008,17(3):1 198-1 203.
Effects of Different Saline Stress on Yield and Physiological Properties of Rice in Soil Culture
JING Peipei,CUI Min,QIN Tao,ZHOU Zaizhong,DAI Qigen*
(Innovation Center of Rice Cultivation Technology in Yangtze River Valley,Ministry of Agriculture/Key Laboratory of Crop Genetics and Physiology of Jiangsu Province/Yangzhou University,Yangzhou,Jiangsu 225009,China;1st author:1902558087@qq.com;*Corresponding author:qgdai@yzu.edu.cn)
In order to study the effects of different saline stress on yield and physiological properties of rice at six salinity gradient(0%,0.07%,0.14%,0.21%,0.28%,0.35%),a comparative experiment was conducted using Nanjing 9108 and Yongyou 2640 as materials.Key findings of this study were the following:(1)Saline stress affected the growth and development of rice.Plant height, leaf area and dry matter weight were decreased with the increase of salt concentration.The yield of rice decreased with the increase of salt concentration.When the salt concentration was higher than 0.07%,the yields were significantly lower compared with the control. Yields of Nanjing 9108 were respectively dropped by 14.14%,43.05%,58.91%,65.68%and Yongyou 2640 were dropped by 20.25%, 31.97%,40.41%,49.82%.(2)With the increase of salt concentration,the activities of superoxide dismutase(SOD),peroxidase(POD)and catalase(CAT)of the leaves of two varieties showed a trend of rise first then fall,and the highest value was given at the level of 0.07%.(3)During heading stage,free proline content in leaves increased with the increase of salt concentration.When the salt concentration was higher than 0.14%,the free proline content increased significantly compared with the control.(4)Under saline stress, rice seedling absorbed Na+from roots and discharged K+.With the increase of salt concentration,the K+concentration in different organs decreased and the Na+concentration increased,in addition to the K+concentration in the leaves.K+/Na+ratio of different parts showed downward trend.SK、Nabetween stem and leaves increased with the increase of salt concentration.The stem selectively transported K+and inhibited Na+into the leaves.SK、Nbetween root and stem decreased with the increase of salt concentration,The stem absorbed Na+and outputted K+to the root.Overall,low salt concentration had no significant effect on the yield and physiological characteristics of high yielding rice varieties,once the salt concentration is higher than 0.07%,the effect was significant.
rice;salinity gradient;saline stress;yield;physiological characteristics
S511.05
A
1006-8082(2017)04-0026-08
2017-06-20
国家科技支撑计划(2015BAD01B02);江苏省重点研发计划(BE2015337)

