不同植物种类、碳氮源供给和pH对人工湿地真菌反硝化的影响
刘文莉,张崇邦,管铭,韩文娟,葛滢,常杰
(1台州学院建筑工程学院,浙江椒江318000;2台州学院生命科学学院,浙江椒江318000;3浙江大学生命科学学院,浙江杭州310058)
不同植物种类、碳氮源供给和pH对人工湿地真菌反硝化的影响
刘文莉1,张崇邦2*,管铭2,韩文娟3,葛滢3,常杰3
(1台州学院建筑工程学院,浙江椒江318000;2台州学院生命科学学院,浙江椒江318000;3浙江大学生命科学学院,浙江杭州310058)
【目的】认识碳、氮和pH及其与植物的交互作用对垂直流人工湿地真菌反硝化作用的影响,为真菌反硝化作用的调控提供依据。【方法】采用4种常见的水生植物(黄菖蒲、美人蕉、水葱和伞草),在20个垂直流人工湿地中设置了4种单独栽培处理。运行5个月后,分别从20个湿地中收集0—30cm的细砂样品,利用微宇宙培养的方法,检验不同碳源、氮源补充和pH梯度对细砂样品中真菌反硝化潜力的影响。【结果】双因素方差分析表明,垂直流人工湿地中碳源、氮源与植物种类之间的相互作用对真菌反硝化潜力作用不明显(P>0.05),而pH与植物种类之间的相互作用对真菌反硝化潜力作用显著(P<0.05)。7种碳源中的葡萄糖和琥珀酸钠的应用最能促进湿地填料中真菌反硝化潜力的提高(P<0.05),而在4种氮源中亚硝酸钠是最能提高真菌反硝化潜力的氮源(P<0.05)。与未进行酸碱处理(pH6.89)相比,调节pH到2.8显著降低了真菌反硝化潜力(P<0.05),而调节pH到5.6或8.4均不同程度地提高了真菌反硝化潜力。【结论】本研究突出了葡萄糖、琥珀酸钠和亚硝酸盐在调节真菌反硝化潜力中的重要性,并发现在pH5.6~8.4范围内,湿地填料中的真菌反硝化潜力较大。
垂直流人工湿地;真菌反硝化潜力;碳源;氮源;pH范围
自从Bollag和Tung[1]报道了土壤尖镰孢菌(Fusarium oxysporum)和腐皮镰孢菌(Fusarium solani)在低氧条件下均能将亚硝酸盐还原成N2O以来,真菌反硝化作用引起了微生物学者的关注。随着对真菌反硝化研究的逐渐深入,人们发现真菌反硝化在森林、草地、农田以及干旱地区土壤中对总反硝化的贡献很重要[2–6],因为一方面反硝化真菌具有较大的生物量,另一方面更重要的是反硝化真菌细胞中的硝酸盐和亚硝酸盐还原酶位于线粒体膜上,所以其对氧的适应范围较大。
为了更好地对土壤真菌反硝化进行调控,人们已经调查了控制土壤真菌反硝化的环境因素[7]。McLain和Martens[3]研究了几种有机氮(蛋白质、短肽和氨基酸)与无机氮(NH4+、NO3
–和NO2
–)补充对土壤真菌反硝化潜力的影响,结果发现短肽类和亚硝酸盐补充最能改善土壤真菌反硝化。Crenshaw等[8]和Lavrent’ev等[9]在各自实验室里比较了不同的土壤含水量对土壤真菌反硝化潜力的影响,分别指出土壤含水量在30%~70%或16%~50%范围内土壤真菌反硝化潜力呈线性增长。Seo和DeLaune[10]调查了森林湿地土壤反硝化真菌和细菌对总反硝化的贡献,结果表明土壤反硝化真菌在微好氧或好氧条件下承担了绝大部分的反硝化(Eh250~400mV)。Herold等[5]发现土壤pH的改变对真菌反硝化没有多大影响,但对细菌反硝化却有显著作用。Crenshaw等[8]和Wei等[11]先后报道了农田表面施加氮肥促进了真菌反硝化的进行。Ma等[12]发现甲酸盐含量的提高对土壤反硝化真菌的促进要比对反硝化细菌大。
人工湿地是一类用于处理废水的工程系统[13]。反硝化是人工湿地中氮净化的最重要途径,据估计微生物反硝化对氮去除占在人工湿地总氮去除的75%~90%[14–15]。长期以来,人们一直认为细菌驱动的反硝化才是人工湿地的反硝化途径[13]。由于环境工作者研究背景的局限,使得真菌反硝化一直未引起重视[10]。最近Liu等[16]调查了垂直流人工湿地的真菌反硝化潜力,结果表明0—30cm深的滤料中的真菌反硝化潜力很大。与陆地土壤不同,人工湿地常以高碳、高氮污染负荷以及连续或间歇式供水为主要特征[13]。在这种特殊的生态系统中,碳、氮和pH等因素与真菌反硝化的关系如何?这直接涉及到真菌反硝化的调控问题,但目前还少有报道。
已有研究表明,植物是人工湿地的主要组成成份,植物不仅可直接吸收污水中的氮、磷等污染物,而且还可以向根际填料中分泌有机物和氧气,进而影响根际微生物群落结构及其活性[17–18]。Liu等[16]的研究表明,在垂直流人工湿地中栽培不同的植物种类会对真菌反硝化产生很大影响。因此,综合现有研究,另一个值得探讨的问题就是在垂直流人工湿地中,植物种类与不同碳、氮以及pH载荷之间的相互作用对真菌反硝化的影响如何?
为了探明上述问题,我们建立了20个小型模拟垂直流人工湿地进行试验,试图回答以下几个问题:1)哪种碳源、氮源和pH最能影响模拟湿地中真菌的反硝化活性?2)碳源、氮源供给和pH与植物种类之间的相互作用如何影响模拟湿地中真菌的反硝化活性?
1 材料与方法
1.1 垂直流模拟湿地构建
于2014年秋季在浙江省台州学院内(121°21'E, 28°34'N)构建了20个模拟垂直流人工湿地(长、宽、高分别为0.45m、0.45m、1.20m)。根据Liu等[16]的设计,除了顶部10cm以外,每个湿地填料组成及深度自上而下分别为:细河砂50cm(直径1~2 mm)、粗河砂30cm(直径4~6mm)、鹅卵石30cm (直径50~85mm)。湿地备选植物为黄菖蒲(Iris pseudacorus-IP)、美人蕉(Canna glauca-CG)、水葱(Scirpus validus-SV)和伞草(Cyperus alternifolius-CA)。2015年3月份从温室中分别采集上述4种苗龄和大小基本一致幼苗,然后按每单元湿地4株或4丛的密度进行栽培,每种植物重复5个湿地单元。然后对湿地进行定期灌溉,水载荷率为0.2m3/d,水滞留时间为10d,湿地排空时间为0.5d。为了保证每个湿地的废水质量一致,将20个湿地以并联的方式与储水箱连接。在湿地运行的初期,每天检查幼苗的生长状况,如果发现幼苗出现萎蔫现象,则马上替换,以保证植物的同步生长及各湿地单元植物栽培密度的一致性。期间要及时剔除非备选的入侵植物,以保证实验处理的一致性。本研究采用的灌溉水为Hoagland营养液,具体组成成份见Liu等[16]的相关研究。Hoagland营养液质量指标分别为:CODcr132.51mg/L、BOD579.51mg/L、总氮79.73 mg/L、总磷34.52mg/L、NH4+-N38.05mg/L和NO3–-N 39.63mg/L。
1.2 样品收集
待湿地运行5个月后(同年8月中旬)进行样品采集。根据Liu等[16]的试验结果,主要收集0—30cm深度范围的细砂样品,因为该层的反硝化真菌活性最大。每个湿地用直径3cm的PVC管分别垂直采集5个点样,然后将这些点样混匀,于阴凉处过孔径0.15mm筛以保证不同样品粒径的可比性。筛后的样品马上分装到铝盒与封口袋中,并标记。铝盒样品马上称鲜重,并放在105℃的干燥箱中烘干,以测定样品的含水量。同时袋装样品于4℃保鲜柜中储存,备用。
1.3 室内样品碳、氮源补充和pH梯度设置及样品培养
1.3.1 放线菌酮抑制真菌处理采用国际通用的呼吸选择性抑制技术[5],首先确定放线菌酮最佳应用剂量。将10g鲜砂放进100mL的血清瓶中,然后将硫酸链霉素和放线菌酮分别用无菌水溶解,配成不同浓度的水溶液,然后按不同的添加浓度进行抗生素处理。根据选择性抑制实验原理,即当[(A–B)+ (A–C)]/(A–D)接近1时所填加的放线菌酮剂量为最佳剂量。式中:A为不添加任何抗生素的处理中测得的CO2释放量;B为填加硫酸链霉素后测得的CO2释放量;C为填加放线菌酮后测得的CO2释放量;D为同时填加硫酸链霉素和放线菌酮后测得的CO2释放量。最后得出硫酸链霉素和放线菌酮在砂子中最佳用量分别为3.2mg/g DW和2.5mg/g DW。
根据Herold等[5]的研究,基于乙炔处理(抑制反硝化细菌将N2O进一步还原为N2)为前提,不填加抗生素处理的砂子释放的N2O被定义为总反硝化活性,而用放线菌酮处理的砂子释放的N2O定义为细菌和其他可能途径引起的反硝化活性,二者之差为真菌反硝化活性。将10g鲜砂放入100mL的血清瓶中,加适量放线菌酮水溶液,使放线菌酮在砂子中的含量达到2.5mg/g DW,手动摇匀。同时,只加10g鲜砂和适量无菌水的处理作为对照。将放线菌酮和无菌水2种处理的血清瓶25℃预培养12h,供后面碳、氮、pH处理用。
1.3.2 碳源、氮源补充和pH处理预培养结束后,在放线菌酮和无菌水2种处理的血清瓶中先添加硝酸钠溶液,使其在砂子中最终浓度为N10mg/g DW[19],然后分别填加葡萄糖、琥珀酸钠、柠檬酸钠、甲醇、乙醇、甘油和醋酸钠的无菌水溶液[10],使它们的最终浓度均为C5mg/g DW[5],以不补充碳源的作为对照。所有处理均重复3次。
在放线菌酮和无菌水2种处理的血清瓶中,添加葡萄糖溶液,使其在砂子中的最终浓度为C5 mg/g DW[5]。然后,分别添加天冬氨酸、硝酸钠、氯化铵和亚硝酸钠,使它们的最终浓度均为N10 mg/g DW[19],以不补充氮源的处理作为对照。所有处理均重复3次。
砂子的pH采用0.1mol/L HCl或0.1mol/L NaOH溶液来调整[20]。放线菌酮和无菌水2种处理的血清瓶中砂子的平均pH值为6.8。首先,在两种血清瓶中加入葡萄糖和硝酸钠溶液,调整其碳、氮浓度分别为C5mg/g DW和N10mg/g DW,以满足真菌反硝化的基本要求。然后用0.1mol/L的HCl或NaOH溶液调整砂子的pH至分别为2.8、5.6和8.4,以不调整的为对照。所有处理均重复3次。
1.4 培养和N2O含量分析
上述处理后的血清瓶均用特制的胶塞密封,即每个胶塞上均有2个孔,一个用于通入乙炔气体,另一个孔为取气样用。将胶塞涂上凡士林后,塞好瓶口。每个瓶子注入10mL乙炔[10]后,于25℃培养箱中培养8h。其间,每2h用注射器取气样1次,储存在气袋中,用于分析N2O含量。N2O分析采用装有63Ni电子检测器的(ECD)气相色谱(Shimadzu GC-14B,Kyoto,Japan)进行,Poropak Q柱子和检测器的温度分别为65℃和300℃。最后计算N2O随时间变化的线性方程的斜率,该斜率即为N2O的释放速率,并转换成N2Oμg/(g·d)DW。
1.5 统计分析
不同碳源、氮源和pH梯度处理及其与不同植物栽培之间的相互作用对真菌反硝化影响的显著性用双因素方差方法进行分析,并辅以Turkeyxs法进行检验。上述统计均利用SPSS11.5统计软件完成。
2 结果分析
2.1 不同碳源对真菌反硝化活性的影响
图1表明,在栽培同一种植物的湿地中,与未补充碳源相比,补充7种碳源都显著增加了人工湿地砂子中的真菌反硝化潜力(P<0.05),其中又以补充葡萄糖和琥珀酸钠的作用最强。补充同一种碳源,不同植物对真菌反硝化潜力的影响不显著(P>0.05)。双因素方差分析显示(表1),碳源和植物种类对真菌反硝化潜力的影响没有显著交互作用(P>0.05)。
2.2 不同氮源对真菌反硝化活性的影响
图2表明,类似于碳源补充处理,与未补充处理相比较,4种氮源补充均显著地强化了真菌反硝化活性(P<0.05)。在同一种植物栽培处理中,与其他3种含氮化合物相比,亚硝酸钠补充处理最能提高湿地砂子中的真菌反硝化潜力(P<0.05)。另外在补充氮源条件下,不同植物种类并未显著改变真菌反硝化潜力,即植物种类与氮源补充之间的相互作用对真菌反硝化潜力影响不显著(P>0.05)(表1)。
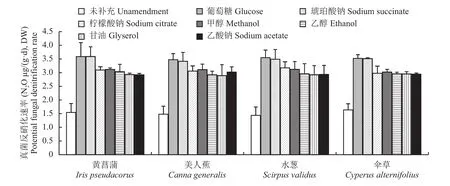
图1 栽培不同植物条件下补充7种碳源对模拟垂直流人工湿地真菌反硝化潜力的影响Fig. 1 Effects of seven carbon sources on fungal denitrification potential in constructed vertical flow wetlands under different plants
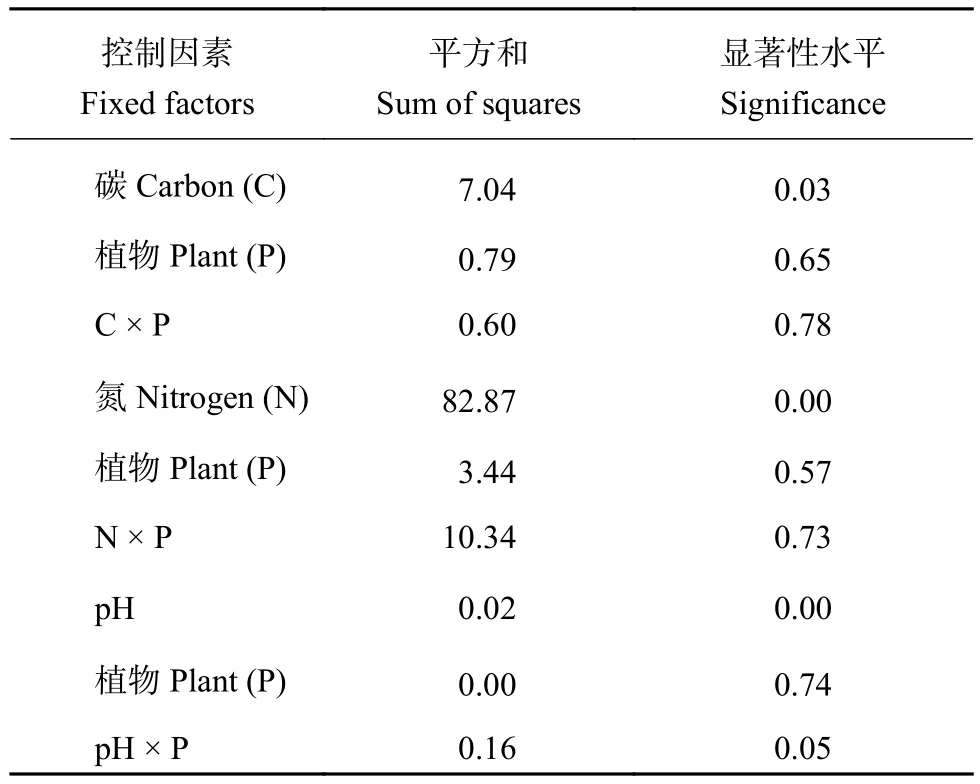
表1 植物种类、碳、氮和pH影响模拟人工湿地真菌反硝化潜力的双因素方差分析Table 1 The two-way ANOVA of fungal denitrification potential affected by plant species, carbon and nitrogen sources and pH in simulated wetlands
2.3 不同pH对真菌反硝化活性的影响
类似于碳源和氮源补充处理,与未进行酸碱处理(pH6.89)相比较,pH降低至2.8时显著地降低了真菌反硝化活性(P<0.05)(图3),但当pH提高到5.6和8.4时真菌反硝化活性的改变却依赖于具体栽培的植物种类,即pH与植物种类之间存在着明显的相互作用(P=0.05)(表1)。当湿地栽培黄菖蒲或伞草时pH提高为5.6和8.4均未显著改变真菌反硝化活性,但当湿地栽培美人蕉或水葱时,pH提高为5.6和8.4均显著提高了真菌反硝化活性。在同一种植物栽培处理中,与pH2.8相比,pH为5.6或8.4均显著提高了真菌反硝化活性(P<0.05)。另外在同一pH条件下,植物种类变化并未显著改变真菌反硝化活性(P>0.05)。
3 讨论
众所周知,在反硝化过程中,碳水化合物被用作电子供体和能量来源[21],因此湿地中的一些可溶性含碳化合物的含量大小就可能影响真菌反硝化活性[12]。在人工湿地的以往研究中,人们主要关注的是含碳化合物对细菌反硝化的影响,很少考虑对真菌反硝化的作用。本研究所涉及到的7种可溶性含碳化合物补充到湿地填料中均不同程度地强化了真菌反硝化活性,表明碳源对真菌反硝化的重要性。这一发现是符合客观实际的,因为在7种含碳化合物中,除了甲醇和乙醇外,其他5种均为常见的根系分泌物[22–23]。还有,Bais等[24]和Esperschütz等[25]研究发现,40%以上的产自光合作用的根系分泌物可用于促进真菌的生长。另外一些早先的研究也发现葡萄糖、醋酸钠和甲醇均能改善人工湿地中的细菌反硝化[26–27]。
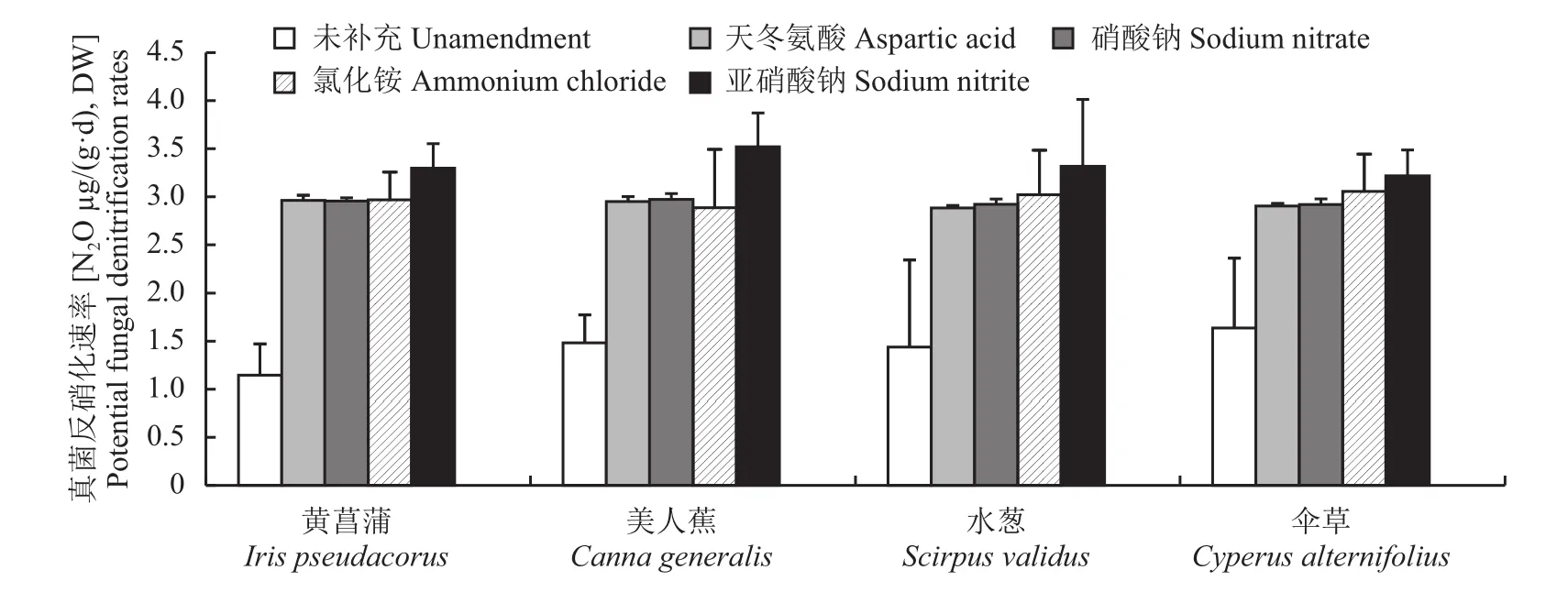
图2 不同植物栽培条件下补充4种氮源对模拟垂直流人工湿地真菌反硝化潜力的影响Fig. 2 Effects of four nitrogen sources on fungal denitrification potential in vertical flow constructed wetlands under different plants
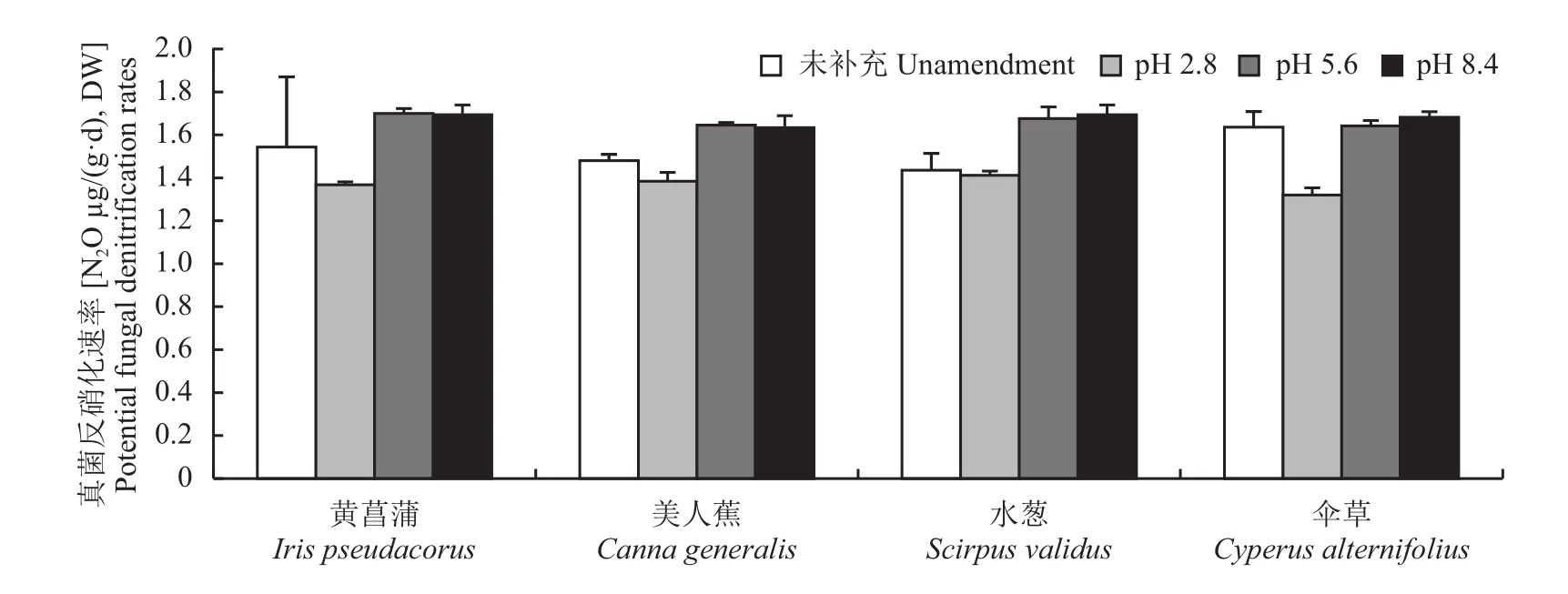
图3 不同植物栽培条件下pH变化对模拟垂直流人工湿地真菌反硝化潜力的影响Fig. 3 Effects of pH on fungal denitrification potential in vertical flow constructed wetlands under different plants
同时我们也观察到,无论栽培哪一种植物,在供试的7种碳源中,葡萄糖和琥珀酸钠最能刺激人工湿地中的真菌反硝化活性。尽管相关机理尚不清楚,但我们推测葡萄糖和琥珀酸钠可能是真菌反硝化的最适电子供体,因为真菌反硝化需要的硝酸盐/亚硝酸盐还原酶均位于线粒体膜上,而葡萄糖和琥珀酸钠在有氧呼吸过程中均可以通过脱氢产生电子[28]。然而,在补充碳源的条件下,不同植物种类栽培并没有对湿地填料中的真菌反硝化产生显著影响,这与Liu等[16]的报道不同,他们发现在灌溉废水一致的前提下不同植物种类显著影响了湿地真菌反硝化活性。本研究的发现最有可能的原因是碳源补充到湿地填料中后,由于外加碳源的浓度高于植物根系碳分泌物的量,从而掩盖了植物根系碳分泌物的影响。
在本研究中,供试的4种氮源补充均显著地强化了真菌反硝化活性,表明氮化合物可以直接影响环境中的细菌/真菌反硝化活性,因为含氮化合物可以直接或间接充当反硝化作用的底物[28]。Crenshaw等[8]和Wei等[11]也发现无机和有机氮肥促进了草地和农田中的真菌反硝化活性。同时,无论栽培哪种植物,亚硝酸盐在4种氮源中均是改善湿地填料中真菌反硝化活性的最佳氮源。McLain等[3]比较了NH4
+、NO3
–和NO2–对土壤真菌反硝化活性的影响,结果也表明NO2–最能提高土壤真菌反硝化活性,他们认为这可能与亚硝酸盐的参与缩短了真菌反硝化的进程有关。后来Lavrent’ev等[9]同样发现草甸灰化土补充NO3–或NO2
–后真菌反硝化均有明显的提高。类似于碳源处理,在向湿地填料中补充氮源的前提下,不同植物种类栽培对真菌反硝化活性也没有产生显著影响。这也可能与氮源补充到湿地填料中后,氮源的添加浓度高于植物根系氮分泌物的量,从而掩盖了植物根系含氮分泌物的影响有关。
长期以来,pH一直被认为是环境中各种环境物理–化学特性和生物过程的主导因素,但也存在着争议。Oishi等[28]和Herold等[5]调查了土壤有机质和pH对真菌反硝化的影响,结果表明,pH在4.5~7.6范围内,土壤有机碳含量是主要影响因素,而土壤pH影响不明显。Šimek等[20]和Chen等[30]均类似地研究了影响土壤反硝化的最佳pH,他们观察到在pH 4.0~11.0范围内,土壤反硝化的最佳pH接近于中性[20,30]。在本研究的人工湿地环境中,未进行酸碱处理的湿地填料pH平均为6.89,接近于中性。无论在栽培哪种植物的湿地中,与未进行酸碱处理相比,当填料pH降至2.8时,真菌反硝化活性显著降低。这一发现与过低的pH抑制了真菌硝酸盐或亚硝酸盐还原酶有关。迄今为止,人们发现真菌反硝化所能忍受的最低pH为4.0左右[5,30]。然而当pH分别提高到5.6和8.4时,真菌反硝化的大小则显著依赖于具体植物种类,即在栽有黄菖蒲或伞草的湿地中真菌反硝化与未进行酸碱处理湿地中的没有显著差异,但当湿地栽有美人蕉或水葱时真菌反硝化显著大于未进行酸碱处理的湿地。这个发现最有可能与植物根系对基质pH缓冲能力的差异有关,因为已有的研究表明植物根系可以分泌H+或OH–到根际环境中,结果是要么提高根际pH,要么降低根际pH,进而影响根际微生物活性[31–32]。为此我们推测栽培黄菖蒲或伞草可能将5.6和8.4缓冲为接近于6.89的pH环境,而美人蕉或水葱栽培可能将5.6和8.4缓冲为真菌反硝化最适的pH环境。
本研究还发现,在栽培同一种植物的湿地中,pH为5.6和8.4时真菌反硝化均高于pH为2.8时的活性,这至少表明供试的人工湿地环境有利于适合pH5.6~8.4的反硝化真菌的生长,因为真菌能在非常广谱的土壤或湿地等环境中分布[30]。
4 结论
补充碳源和氮源以及改变pH都会不同程度地影响垂直流人工湿地0—30cm填料中的真菌反硝化活性。葡萄糖、琥珀酸钠和亚硝酸盐是最能强化真菌反硝化活性的碳化合物和氮化合物。同时,在pH 5.6~8.4范围内,湿地填料均具有较大的真菌反硝化活性。本研究的这些结果对于今后强化垂直流人工湿地这一好氧系统中的真菌反硝化活性,提高氮净化效率尤为重要。
[1]Bollag JM,Tung G.Nitrous oxide release by soil fungi[J].Soil Biology and Biochemistry,1972,4:271–276.
[2]Laughlin RJ,Stevens RJ.Evidence for fungal dominance of denitrification and codenitrification in agrassland soil[J].Soil Science Society of American Journal,2002,66:1540–1548.
[3]McLain JE T,Martens DA.N2O production by heterotrophic N transformations in asemiarid soil[J].Applied Soil Ecology,2006,32: 253–263.
[4]Mothapo N,Chen HH,Cubeta MA,et al.Phylogenetic,taxonomic and functional diversity of fungal denitrifiers and associated N2O production efficacy[J].Soil Biology and Biochemistry,2015,83: 160–175.
[5]Herold MB,Baggs EM,Daniell TJ.Fungal and bacterial denitrification are differently affected by long-term pH amendment and cultivation of arable soil[J].Soil Biology and Biochemistry, 2012,54:25–35.
[6]Marusenko Y,Huber DP,Hall SJ.Fungi mediate nitrous oxide production but not ammonia oxidation in arid land soils of the southwestern US[J].Soil Biology and Biochemistry,2013,63:24–36.
[7]Wallenstein MD,Myrold DD,Firestone M,Voytek M. Environmental controls on denitrifying communities and denitrification rates:insights from molecular methods[J].Ecological Applications,2006,16:2143–2152.
[8]Crenshaw CL,Lauber C,Sinsabaugh RL,Stavely LK.Fungal control of nitrous oxide production in semiarid grassland[J]. Biogeochemistry,2008,87:17–27.
[9]Lavrent’ev RB,Zaitsev SA,Sudnitsyn II,Kurakov AV.Nitrous oxide production by fungi in soils under different moisture levels[J]. Moscow University Soil Science Bulletins,2008,63:178–183.
[10]Seo DC,DeLaune RD.Fungal and bacterial mediated denitrification in wetlands:Influence of sediment redox condition[J].Water Research,2010,44:2441–2450.
[11]Wei W,Isobe K,Shiratori Y,et al.N2O emission from cropland field soil through fungal denitrification after surface applications of organic fertilizer[J].Soil Biology and Biochemistry,2014,69: 157–167.
[12]Ma WK,Farrell RE,Siciliano SD.Soil formate regulates the fungal nitrous oxide emission pathway[J].Applied and Environmental. Microbiology,2008,74:6690–6696.
[13]Vymazal J.Constructed wetlands for wastewater treatment:Five decades of experience[J].Environmental Science&Technology, 2011,45:61–69.
[14]Truu M,Juhanson J,Truu J.Microbial biomass,activity and community composition in constructed wetlands[J].Science of the Total Environment,2009,407:3958–3971.
[15]Song K,Lee SH,Kang H.Denitrification rates and community structure of denitrifying bacteria in newly constructed wetland[J].European Journal of Soil Biology,2011,47:24–29.
[16]Liu WL,Guan M,Liu SY,et al.Fungal denitrification potential in vertical flow microcosm wetlands as impacted by depth stratification and plant species[J].Ecological Engineering,2015,77:163–171.
[17]Calheiros CS C,Duque AF,Moura A,et al.Changes in the bacterial community structure in two-stage constructed wetlands with different plants for industrial wastewater treatment[J].Bioresource Technology,2009,100:3228–3235.
[18]Zhang CB,Ke SS,Wang J,et al.Responses of microbial activity and community metabolic profiles to plant functional group diversity in afull-scale constructed wetland[J].Geoderma,2011,160: 503–508.
[19]Castaldi S,Smith KA.Effect of cycloheximide on NO and NO–23production in aforest and an agricultural soil[J].Biology and Fertility of Soils,1998,27:27–34.
[20]Šimek M,JíšováL,Hopkins DW.What is the so-called optimum pH for denitrification in soil?[J].Soil Biology and Biochemistry,2002, 34:1227–1234.
[21]Xu Z,Piwpuan N,Arias CA,et al.Can root exudates from emergent wetland plants fuel denitrification in subsurface flow constructed wetland systems?[J].Ecological Engineering,2013,61(19):555–563.
[22]Sandnes A,Eldhuset TD,Wollebæk G.Organic acids in root exudates and soil solution of Norway spruce and silver birch[J].Soil Biology and Biochemistry,2005,37:259–269.
[23]Haichar FZ,Santaella C,Heulin T,Achouak W.Root exudates mediated interactions belowground[J].Soil Biology and Biochemistry,2004,77:69–80.
[24]Bais HP,Weir TL,Perry LG,et al.The role of root exudates in rhizosphere interactions with plants and other organisms[J].Annual Review of Plant Biology,2006,57:233–266.
[25]Esperschütz J,Pritsch K,Gattinger A,et al.Influence of chronic ozone stress on carbon translocation pattern into rhizosphere microbial communities of beech trees(Fagus sylvatica L.)during a growing season[J].Plant and Soil,2009,323:85–95.
[26]Salomo S,Münch C,Röske I.Evaluation of the metabolic diversity of microbial communities in four different filter layers of a constructed wetland with vertical flow by biological analysis[J]. Water Research,2009,43:4569–4578.
[27]Kozub DD,Liehr SK.Assessing denitrification rate limiting factors in aconstructed wetland receiving landfill leachate[J].Water Science and Technology,1999,40:75–82.
[28]Oishi K,Kusuda T.Effect of bacteria and fungi on N2O concentration by denitrification in soil environments[J].Environmental Engineering Research,1997,34:35–40.
[29]Morozkina EV,Kurakov AV.Dissimilatory nitrate reduction in fungi under conditions of hypoxia and anoxia:a review[J].Applied Biochemistry and Microbiology,2007,43(5):544–549.
[30]Chen HH,Mothapo NP,Shi W.Soil moisture and pH control relative contributions of fungi and bacteria to N2O production[J]. Microbial Ecology,2015,69:180–191.
[31]Blossfeld S,Gansert D,Thiele B,et al.The dynamics of oxygen concentration,pH value,and organic acids in the rhizosphere of Juncus spp.[J].Soil Biology and Biochemistry,2011,43:1186–1197.
[32]Yang JX,Liu Y,Ye ZH.Root-induced changes of pH,Eh,Fe(II) and fractions of Pb and Zn in rhizosphere soils of four wetland plants with different radial losses[J].Pedosphere,2012,22:518–527.
Effects of plant species, carbon and nitrogen amendments and pH on potential fungal denitrification in constructed wetlands
LIU Wen-li1,ZHANG Chong-bang2*,GUAN Ming2,HAN Wen-juan3,GE Ying3,CHANG Jie3
(1 School of Architecture Engineering, Taizhou University, Jiaojiang Zhejiang 318000, China; 2 School of Life Sciences, Taizhou University, Jiaojiang Zhejiang 318000, China; 3 College of Life Sciences, Zhejiang University, Hangzhou 310058, China)
【Objectives】To provide guidelines for controlling fungal denitrification in constructed vertical flow wetlands,some factors affecting the fungal denitrification were investigated.【Methods】Four monocultured treatments were set up using four macrophyte species(Iris pseudacorus,Canna glauca,Scirpus validus and Cyperus alternifolius)in twenty simulated vertical flow constructed wetlands.After wetlands were operated for five months,fine sand samples were collected from0–30cm depth of wetlands,and effects of carbon and nitrogen amendments and pH gradient on potential fungal denitrification were tested using aroom-incubating method.【Results】The two-way ANOVA(analysis of variance)indicated that the interactions between carbon or nitrogen amendments and plant species did not significantly affect the potential fungal denitrification(P> 0.05),while the interactions between environmental pH and plant species significantly affected the potential fungal denitrification(P<0.05).Among seven carbon compounds,applications of both glucose and sodium succinate mostly improved the potential fungal dentrification in the wetland filled materials(P<0.05),whereas among four nitrogen compounds,sodium nitrite was the best nitrogen compound in enhancing the potential fungal denitrification(P<0.05).Compared with the treatments unamended with acid or alkaline,the treatment with pH2.8significantly decreased the potential fungal denitrification,whereas the treatments with pH5.6or8.4 significantly increased the potential fungal denitrification to different extents.【Conclusions】The study highlights the importance of glucose,succinate and nitrite in enhancing the fungal denitrification potential,and the pH range of5.6to8.4for active fungal denitrification.
constructed vertical flow wetland;potential fungal denitrification;carbon source;nitrogen source; pH range
2017–01–11接受日期:2017–05–06
国家自然科学基金项目(51279121,31270377);浙江省自然科学基金项目(LY17D010001)资助。
刘文莉(1968—),女,山东济宁人,硕士,副教授,主要从事人工湿地氮净化及其机理研究。E-mail:1625331431@qq.com
*通信作者Tel:0576-85137065,E-mail:llhzcb@163.com

