TMPO基因表达对肺癌患者临床预后的影响
熊 智
TMPO基因表达对肺癌患者临床预后的影响
熊 智
目的 探讨TMPO基因对肺癌患者预后的影响。方法 检索并下载NCBI的肿瘤公共数据集,分析肺癌基因表达谱资料及临床信息,明确TMPO基因在正常肺组织和肺癌组织中的表达差异,并利用基因集富集分析方法(GSEA)进一步探讨TMPO基因对肺癌细胞的具体作用机制。结果 TMPO基因在肺癌组织中的相对表达值为0.254 ±0.594,明显高于在正常肺组织中的相对表达值-0.332 ±0.285(P<0.0001 )。TMPO基因高表达肺癌患者的TNM分期明显高于TMPO低表达的肺癌患者(P<0.0001,P<0.0001,P=0.031), TMPO低表达组肺癌患者的无进展生存期(P<0.0001)、总生存期(P<0.0001)结果均优于TMPO高表达组的肺癌患者。TMPO高表达样本富集了与DNA修复、MYC信号通路1、有丝分裂、细胞周期G2M检查点、精子发生、E2F信号通路、MYC信号通路2、mTORC1信号通路相关的基因集。结论 TMPO基因在多种肿瘤中高表达,其通过多种途径来促使肿瘤细胞增殖,进而影响肿瘤患者的临床预后,因此TMPO基因可以作为诊疗肺癌的标志物和潜在靶点。
TMPO基因;肺癌;临床预后
全球肿瘤中,肺癌致死率占据首位,其最常见的病理类型是非小细胞癌[1],多数患者确诊病情时已发展至中晚期肺癌,导致治疗难度增大预后差[2]。目前,临床上对治疗肺癌的方法主要有放化疗、手术、介入、基因及免疫疗法等[3]。肺癌在预后方面影响因素较复杂,仅从宏观上分析肺癌预后因素并不能全面、准确地推断治疗效果与生存情况,但随着分子生物学的深入发展,从微观的角度探究基因对肺癌预后的影响,能发现肺癌预后的生物学本质的因素。TMPO(thymopoietin)又称LAP2(lamina-associated polypeptide 2),位于染色体12q21.2区域,包括8个外显子,通过选择性剪切TMPO可产生6个不同功能的亚型基因(α、β、γ、δ、ε和ζ)[4]。TMPO目前已被发现在多种癌症中表达上调,如恶性血液疾病、乳腺癌、宫颈癌、肺癌、胃癌。近年的研究报道LAP2β(TMPO)在恶性增殖的血液系统疾病中的表达情况明显高于恶性程度相对比较低的血液系统疾病[5];Kim等[6]研究表明,LAP2β表达于多种消化道肿瘤组织(胃癌、胰腺癌、肝癌等)。在胰腺癌细胞中,敲低TMPO的表达会抑制癌症细胞增殖、迁移、浸润及转移[7]。目前已经了解TMPO基因已参与多种肿瘤的发生与发展,但是基于TMPO与肺癌患者的发病机制鲜有报道,因此本研究通过挖掘NCBI(National Center for Biotechnology Information)中公开的肿瘤基因表达数据集,来探讨TMPO基因表达与肺癌患者临床预后的相关性,并进一步阐明其在肺癌组织中的作用机制。
1 资料与方法
1.1 资料 通过在NCBI的GEO数据库下载肺癌患者的基因表达谱公共数据集GSE30219[8]和GSE19188[9]。两组数据集均采用Affymetrix公司的HG-U133_PLUS_2基因表达芯片,其中GSE30219提供了307例肺癌患者的基因表达谱和年龄、性别、无进展生存期、总生存期以及TNM分期,并对基因表达值使用RMA(Robust Multi-Array average)算法进行校正。GSE19188该数据集共包含了156例临床样本,其中肺癌组织样本91例,癌旁正常组织样本65例。
1.2 方法 (1)将TMPO(224944_at)根据GSE30219数据集中所有样本表达值的中位数把该数据集中的肺癌样本分为TMPO高表达组和TMPO低表达组。分析TMPO基因与肺癌患者的年龄、性别、TNM分期、总生存期之间及无进展生存期的关系。(2)将GSE19188数据分为肺癌组织与癌旁正常肺组织两组,分析TMPO基因在肺癌组织和癌旁组织之间的表达情况。以hallmark基因集作为参考基因集,置换次数为1000次,以P<0.05、FDR(false discovery rates)<0.25使用基因集富集分析(gene set enrichment analysis)法分析TMPO基因对肺癌细胞增殖可能的作用机制。
1.3 统计学处理 采用SPSS 21.0软件进行数据处理,使用χ2检验分析TMPO基因在不同年龄阶段、性别及TNM分布情况;使用log-rank法对TMPO高表达和TMPO低表达组肺癌患者的总生存期和无进展生存期进行分析,并运用Graphpad 5.0软件绘制相应的生存曲线;使用两独立样本t检验比较TMPO基因在肺癌组织和癌旁正常肺组织中的表达差异情况,TMPO在肺癌及正常组织中的表达值以来表示。以P<0.05为差异有统计学意义。
2 结 果
2.1 肺癌组织与癌旁正常组织中的TMPO基因表达 TMPO基因在肺癌组织中的相对表达值为0.254±0.594,明显高于正常肺组织中的相对表达值-0.332±0.285,组间比较,差异有统计学意义(P<0.0001)。
2.2 TMPO基因与肺癌患者的临床病理相关性 如表1所示,肺癌患者中TMPO基因高表达组与低表达组在年龄和性别的分布方面无统计学差异,但TMPO高表达组在T、N、M分期方面明显劣于低表达组(P<0.01,P<0.01,P=0.031)。
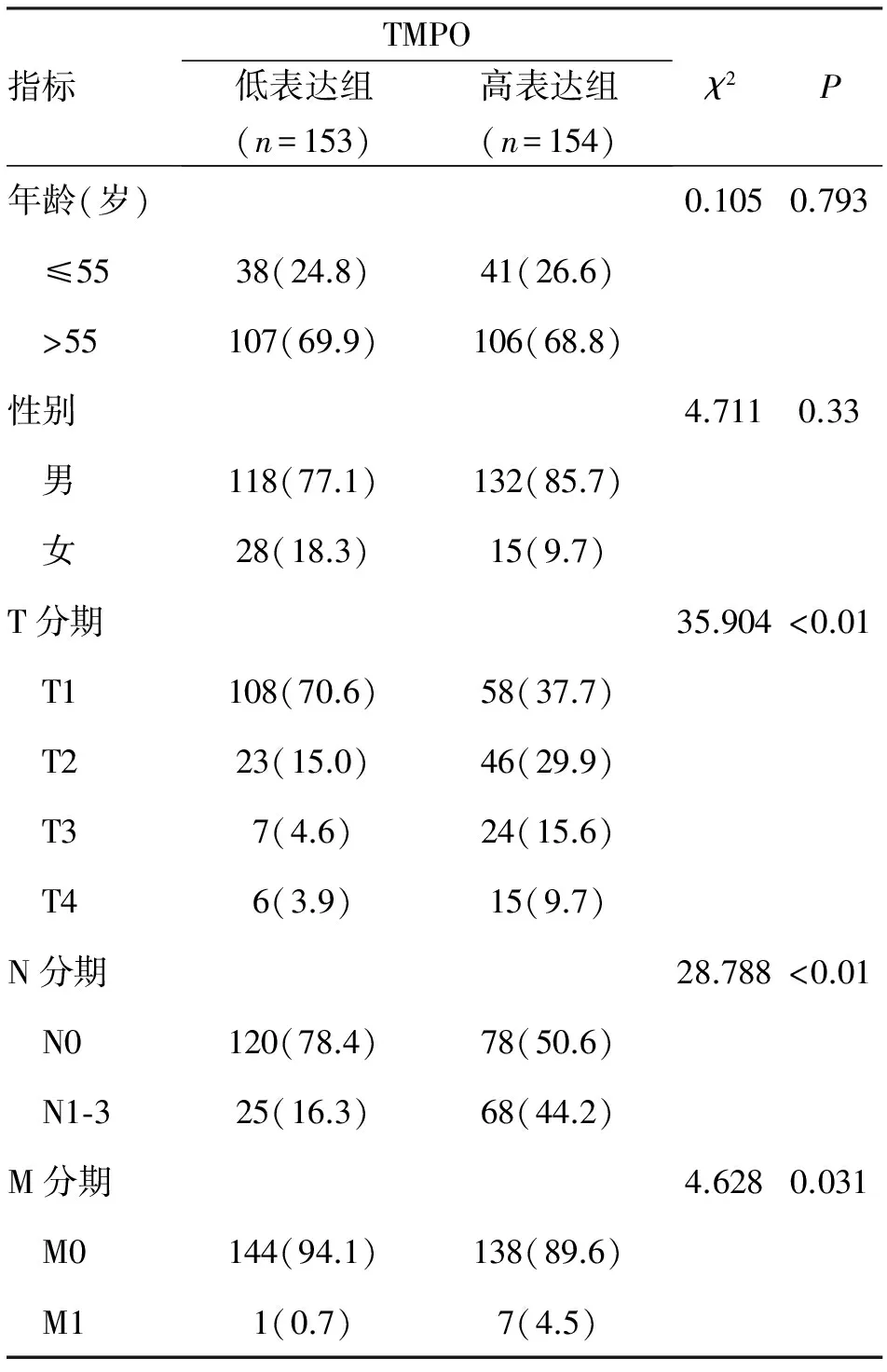
表1 TMPO基因与肺癌患者临床病例特点的相关性 (n;%)
2.3 TMPO基因低表达组和高表达组肺癌患者的预后 如图1A所示,TMPO高表达组肺癌患者的总生存率明显低于TMPO低表达组肺癌患者(log-rankP<0.01);如图1B所示,TMPO高表达组肺癌患者的无进展生存率也明显低于TMPO低表达组肺癌患者(log-rankP<0.01)。
2.4 TMPO基因的GSEA分析 如表2所示,TMPO基因高表达组主要富集在DNA修复、MYC信号通路1、MYC信号通路2、有丝分裂、细胞周期G2M检查点、精子发生、E2F信号通路、mTORC1信号通路。其中以DNA修复(NOMP<0.0001, FDR<0.29%, 图2)和MYC信号通路1(NOMP<0.01, FDR<0.20%, 图3)富集最为明显。

图1 肺癌患者TMPO高、低表达组生存曲线和无进展生存曲线

表2 GSEA分析TMPO基因高表达样本富集基因集
注:SIZE,所富集基因数;ES, enrichment score, 富集分数;NES, normalized enrichment score, 校正后富集分数;FDR, false discovery rate, 错误发现率; NOM-pval, norminal P value, 名义P值
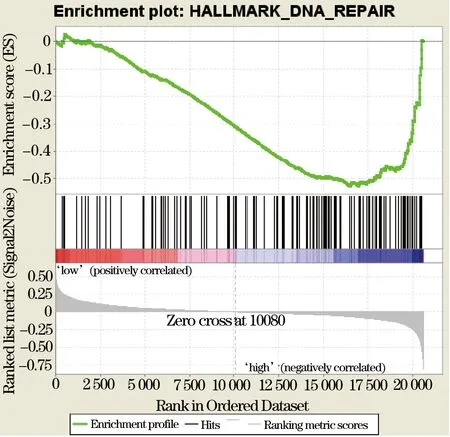
图2 DNA修复在TMPO基因高表达肺癌患者中的富集图
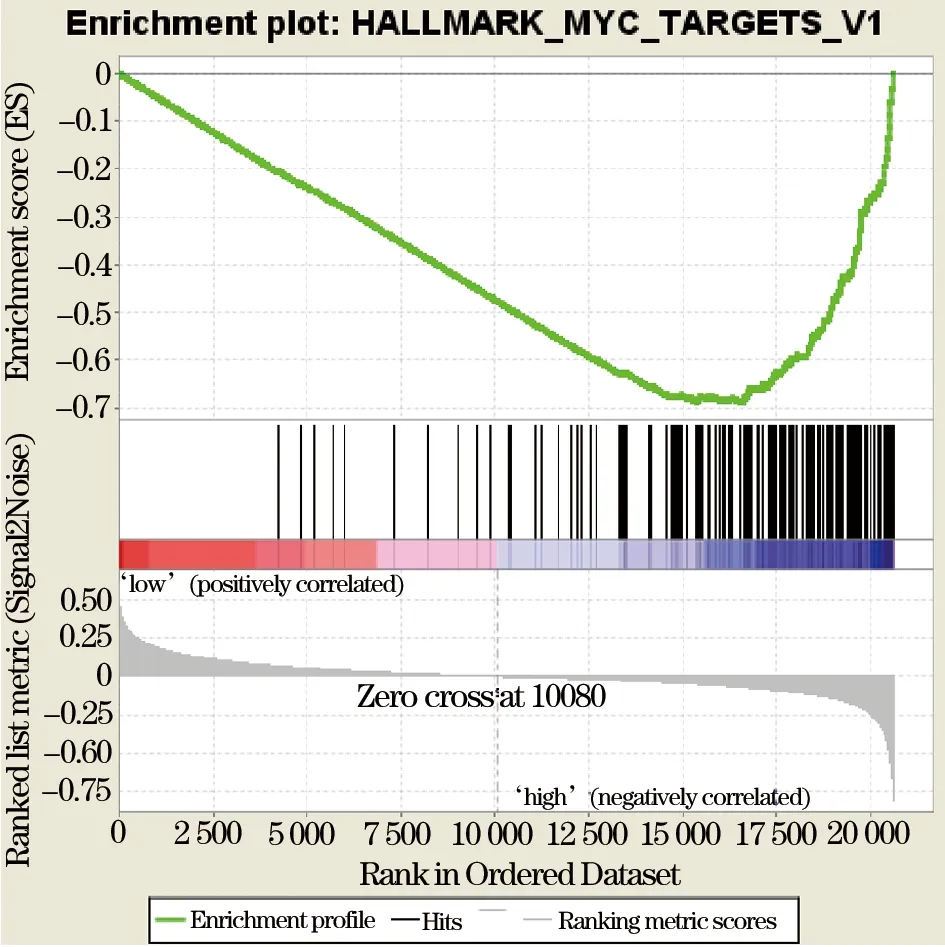
图3 MYC信号通路1在TMPO基因高表达肺癌患者中的富集图
3 讨 论
肺癌的预后影响因素复杂,除肿瘤分类、分期、转移、治疗方式等以外,主要受肿瘤基因、表皮生长因子受体、SNPs、miRNA等因素影响[9]。随着近年的分子生物学发展,从微观层面攻克癌症难题受到临床医师的极大关注,因此,从分子层面来探讨肺癌的发病机制、独立危险因素及可能的靶向治疗措施,将具有重要意义[10]。
本研究通过分析肺癌基因表达公共数据集,发现TMPO基因在肺癌患者中的表达明显增加,TMPO高表达组的肺癌患者TNM分期更差、无进展生存率和总生存率也更低。通过GSEA分析发现,TMPO高表达组的肺癌样本富集了多种与肿瘤增殖密切相关的信号通路(MYC1、E2F和mTORC1信号通路)、细胞分裂(有丝分裂、细胞周期G2M检查点)及DNA修复等多种生物学过程,提示TMPO基因与肺癌细胞增殖可能密切相关。
Brachner等[11]研究表明,TMPO能够协同核纤层蛋白、BAF调控细胞核结构和细胞周期过程中的能量代谢。Matakidou等[12]认为,DNA修复基因TMPO可能导致化疗疗效的差异,从而影响肺癌患者预后。Lin等[13]研究表明,下调TMPO基因的表达能够明显诱导胶质母细胞瘤细胞凋亡和细胞周期阻滞。Pekovic 等[14]认为,TMPO正向调节细胞增殖可能通过TMPO-lamin复合体实现。敲低lamin或TMPO能有效诱导人纤维原细胞细胞周期阻滞,并且在人成纤维细胞中突变LMNA基因能够导致lamin蛋白表达缺失,进而严重抑制细胞增殖[15]。同时也有研究表明, TMPO表达降低诱导的抗肿瘤效应可能是间接通过DNA损伤或抑制细胞周期和增殖的信号通路(NEK2信号通路[16]、Gli信号通路[17]、Notch信号通路[18]、雌激素受体相关信号通路[19]等)实现,而TMPO促进多种肿瘤细胞增殖可能是通过有丝分裂介导的E2F1信号通路活性增加实现。免疫共沉淀和基因芯片技术表明TMPO启动子区域存在E2F1、c-MYC、E2F4、E2F3b,以及E2F7结合区域,提示多种细胞周期调控因子(E2Fs)调控TMPO基因的表达[20,21]。
以上研究表明,TMPO可通过多种途径来促进肿瘤细胞增殖,进而影响肿瘤患者的临床预后,因此TMPO基因可以作为诊断肺癌的标志物和潜在靶点,这为今后的基础和临床研究提供了思路,以开展大样本、多中心、结合多因素分析的研究来证实TMPO在肺癌预后评价中的作用。
[1] Sateia H F, Choi Y, Stewart R W,etal. Screening for lung cancer [J]. Semin Oncol, 2017, 44(1): 74-82.
[2] Zheng M. Classification and pathology of lung cancer [J]. Surg Oncol Clin N Am, 2016, 25(3): 447-468.
[3] CHEN J, ZHAO Q W, Shi G M,etal. XRCC1 Arg399GIn and clinical outcome of platinum-based treatment for ad- vanced non-small cell lung cancer: a meta-analysis in 17 studies [J]. J Zhejiang Univ Sci B, 2013(3): 215.
[4] Dechat T, Vlcek S, Foisner R. Review: lamina-associated polypeptide 2 isoforms and related proteins in cell cycle-dependent nuclear structure dynamics [J]. Struct Biol, 2000, 129(3): 335-345.
[5] Somech R, Gal-Yam E N, Shaklai S,etal. Enhanced expression of the nuclear envelope LAP2 transcriptional repressors in normal and malignant activated lymphocytes[J]. Ann Hematol, 2007, 86(6):393-401.
[6] Hyun-Jung K, Sun-Hwi H, Han M E,etal. LAP2 is widely over expressed in diverse digestive tract cancers and regulates motility of cancer cells[J]. PloS One, 2012, 7(6): e39482.
[7] Rhodes D R, Yu J, Shanker K,etal. ONCOMINE: a cancer microarray database and integrated data-mining platform [J]. Neoplasia, 2004, 6(1):1-6.
[8] Rousseaux S, Debernardi A, Jacquiau B,etal. Ectopic activation of germline and placental genes identifies aggressive metastasis-prone lung cancers [J]. Sci Transl Med, 2013, 5(186):186ra66.
[9] Hou J, Aerts J, den Hamer B,etal. Gene expression-based classification of non-small cell lung carcinomas and survival prediction [J]. PLoS One, 2010, 5(4): e10312.
[10] Marrero-Rodríguez D, Taniguchi-Ponciano K, Lopez-Sleman J,etal. Thymopoietin Beta and Gamma Isoforms as a potential diagnostic molecular marker for breast cancer: preliminary data [J]. Pathol Oncol Res, 2015, 21(4):1-6.
[11] Brachner A, Foisner R. Lamina-associated polypeptide (LAP)2 alpha and other LEM proteins in cancer biology[J]. Adv Exp Med Biol, 2014, 773:143-163.
[12] Matakidou A, Galta R E, Webb E L,etal. Genetic variation in the DNA repair genes is predictive of outcome in lung cancer [J]. Hum Mol Genet, 2007, 16(19):2333-2340.
[13] Lin Z, Gan W, Chen S,etal. Depletion of thymopoietin inhibits proliferation and induces cell cycle arrest/apoptosis in glioblastoma cells [J]. World J Surg Oncol, 2016, 14(1): 267.
[14] Pekovic V, Harborth J, Broers J L,etal. Nucleoplasmic LAP2alpha-lamin A complexes are required to maintain a proliferative state in human fibroblasts [J]. J Cell Biol, 2007, 176(2):163-172.
[15] Gotic I, Schmidt W M, Biadasiewicz K,etal. Loss of LAP2α delays satellite cell differentiation and affects postnatal fiber-type determination [J]. Stem Cells, 2010, 28(3):480-488.
[16] Zhou W, Yang Y, Xia J,etal. NEK2, induces drug resistance mainly through activation of efflux drug pumps and is associated with poor prognosis in myeloma and other cancers [J]. Cancer Cell, 2013, 23(1): 48-62.
[17] Shi T, Mazumdar T, Devecchio J,etal. cDNA microarray gene expression profiling of hedgehog signaling pathway inhibition in human colon cancer cells [J]. PLoS One, 2010, 5(10):422-433.
[18] Viatour P, Ehmer U, Saddic L A,etal. Notch signaling inhibits hepatocellular carcinoma following inactivation of the RB pathway[J]. J Exp Med, 2011, 208(10): 1963-1976.
[19] Moudgil V K, Dinda S, Khattree N,etal. Hormonal regulation of tumor suppressor proteins in breast cancer cells [J]. J Steroid Biochem Mol Biol, 2001, 76(1-5): 105.
[20] Buterin T, Koch C, Naegeli H. Convergent transcriptional profiles induced by endogenous estrogen and distinct xenoestrogens in breast cancer cells[J]. Carcinogenesis, 2006, 27(8):1567-1578.
[21] Brachner A, Foisner R. Lamina-associated polypeptide (LAP)2α and other LEM proteins in cancer biology[J]. Adv Exp Med Biol, 2014, 773: 143-163.
(2017-04-15收稿 2017-05-15修回)
(责任编辑 武建虎)
Significance of TMPO forprognosis of patients with lung cancer
XIONG Zhi.
Department of Respiratory Medicine, the Second People’s Hospital of Jingzhou, Jingzhou 434000, China
Objective To clarify the relationships between TMPO gene expression and clinical prognosis of lung cancer.Methods NCBI datasets were collected while expression profiles and clinical information were analyzed to characterize the expressions of TMPO gene in lung cancer patients and adjacent normal lung tissues. The correlations between TMPO expressions and TNM staging, progression free survival and overall survival of lung cancer patients were studied. Gene set enrichment analysis was applied to investigate the exact mechanisms related to the expression of TMPO and the proliferation of lung cancer cells.Results The level of TMPO expression was higher in lung cancer patients than that in normal controls (P<0.0001). Lung cancer patients with higher expressions of TMPO were associated with better TNM staging(P<0.0001,P<0.0001,P=0.031), progression free survival(P<0.0001), and overall survival(P<0.0001)compared with TMPO low expression cohort. The result of GSEA indicated that TMPO might promote the proliferation of lung cancer cells involving DNA repair, MYC signaling, mitotic spindle, G2M checkpoint, spermatogenesis, E2F signaling and mTORC1 signaling.Conclusions Our results suggest that TMPO might be an independent risk factor for lung cancer patients.
TMPO; lung cancer; clinical prognosis
湖北省知识创新专项(2016CFB255)
熊 智,本科学历,主治医师。
434000,湖北省荆州市第二人民医院呼吸内科
R734.2

