盐酸地芬尼多片质量分析
耿韫 郄冰冰
·药物研究·
盐酸地芬尼多片质量分析
耿韫 郄冰冰
目的 采用法定检验方法和探索性研究方法相结合评价盐酸地芬尼多片的质量现状及存在问题。方法 采用现行标准对抽验样品进行法定检验;分别采用显微镜和粒度分析仪,分析原料药晶型和粒度及其分布情况;测定样品在不同pH值溶出介质中的溶出曲线;采用SPSS软件检验结果进行统计分析。结果 法定检验样品152批,151批合格,合格率为99%;盐酸地芬尼多原料药晶型相同;采用AV值进行溶出相似性比较,仅1家企业4条溶出曲线与标准曲线一致。结论 目前国内盐酸地芬尼多片总体质量较好,现行标准能够控制产品质量,但与原研制剂相比,需进一步提高处方及生产工艺。
盐酸地芬尼多;片剂;溶出度;质量分析
盐酸地芬尼多片为列入国家基本药物目录的镇吐药,商品名为“眩晕停”,为抗眩晕类非处方药药品。可用于治疗多种原因或疾病引起的眩晕、恶心与呕吐。国内于1975年合成本品,并进行了药理试验和临床观察,于1981年正式生产。盐酸地芬尼多片常见不良反应有口干、心悸、头昏、头痛、嗜睡、不安和轻度胃肠不适,偶有幻听、幻视、定向力障碍、精神错乱、忧郁等,偶见皮疹、一过性低血压反应等,一般在停药后消失。口服吸收快,组织分布以心肝较高,肾浓度较低。中国药典2000年版起收载,国外药典均未收载本品种,全国共有36家药品生产企业。本文在法定检验的基础上,结合探索性研究,评价本品种质量现状及存在的问题,并在试验过程中考察现行质量标准对药品质量的可控性。
1 仪器与试药
1.1 仪器 岛津LC-20AT高效液相色谱仪;Agilent6890气相色谱仪;天大RCZ-8M全自动溶出仪;粒度分布检测仪。
1.2 试药 盐酸地芬尼多对照品由中检院提供,批号100841-200501;烯化合物对照品由本所提供,批号HBHX20101020;152批盐酸地芬尼多片为流通领域和生产企业抽取样品,其中糖衣片147批,薄膜衣片5批,标示规格均为25 mg。
2 法定检验方法与结果
本次收到样品批号覆盖2010年10月1日前后,分别执行Chp2005和Chp2010[1,2]。经按法定标准检验,总体合格率99%,关键检验项目符合或近似符合正态分布。见图1。

图1 法定标准检验结果分布情况
3 探索性研究方法与结果[3]
3.1 杂质来源考察 盐酸地芬尼多在生产中极易产生一个主要杂质——烯化合物,即1,1-二苯基-4哌啶-1-丁烯盐酸盐,该杂质是生产过程中因酸性介质而产生的盐酸地芬尼多的脱水产物。
色谱柱:Shimadzu VP-ODS(250 mm 4.6 mm,5 m);以0.5%三乙胺溶液(用磷酸调节pH值至 4.0)- 甲醇(44∶56)为流动相;检测波长210 nm,流速0.8 ml/min。
取本品细粉适量(相当于盐酸地芬尼多25 mg),精密称定,置50 ml量瓶中,加流动相适量,振摇使盐酸地芬尼多溶解,用流动相稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;另取杂质Ⅰ对照品25 mg,精密称定,置50 ml量瓶中,加流动相溶解并稀释至刻度,摇匀,作为杂质Ⅰ对照品溶液;分别精密量取上述两种溶液各1 ml,置同一100 ml量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液。
本次评价样品原料药主要来自3家生产企业,按照现行标准检验,厂家2原料药的烯化合物高于其他厂家,见表1。原料和制剂的典型HPLC图谱显示,制剂中的杂质主要来源于原料药。见图2。
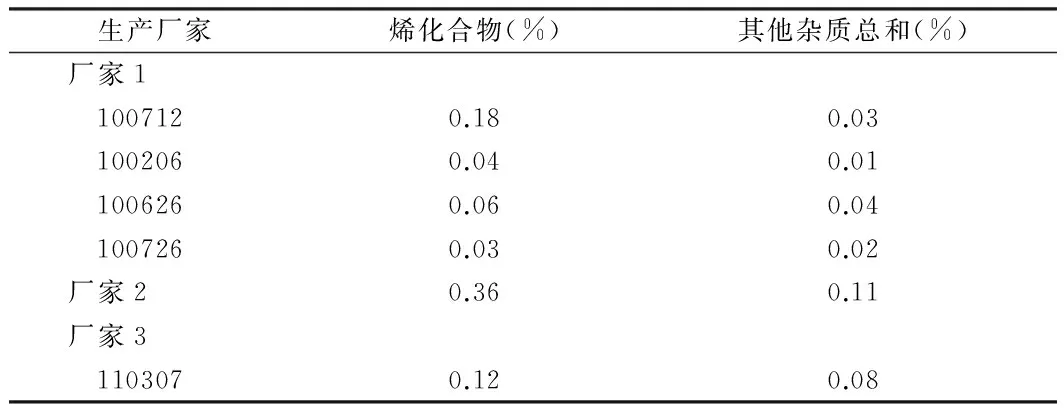
表1 原料药有关物质测定结果

图2 盐酸地芬尼多典型HPLC图谱
3.2 溶出曲线考察[4]采用浆法50转分别测定样品在水、pH值1.2、pH值4.0和pH值6.8四种介质中的溶出曲线,对影响药物溶出行为的主要因素包括原料药的晶型和粒度、制剂的处方和工艺进行考察,并依据溶出曲线相似性(AV值)进行评价。
F2因子在进行参比与受试制剂的溶出度曲线比校过程中,时间的点间隔无需相等,但两者所取各时间点必须一致。比较一般选择每个处方的12个剂量单位的测定均值来进行处理。因为不考虑参比和受试制剂批内样本间。内样本间差异较大时,用F2因子来评价两者溶出度曲线的相似性时候需要谨慎,从第2个
时间点至最后1个时间点溶出结果的变异F2值与平均偏差之间非线性关系,它只适用于描述参比与受试制剂溶出度曲线的相似性,而不能用于评价受试。
3.2.1 测定方法:色谱柱:Diamonsil ODS(200 mm 4.6 mm,5 m);以0.5%三乙胺溶液(用磷酸调节pH值至4.0)-甲醇(44:56)为流动相;检测波长210 nm。以水900 ml为溶出介质,转速为50 r/min,依法操作,经30分钟时,取溶液,滤过,取续滤液作为供试品溶液;精密量取供试品溶液20 μl,注入液相色谱仪,记录色谱图;另取盐酸地芬尼多对照品约12.5 tng,精密称定,加流动相溶解并定量稀释制成每毫升中含25 μg的溶液,同法测定。按外标法以峰面积计算每片的溶出量。
3.2.2 相似度比较分析:仅1家企业薄膜衣片的4条溶出曲线与参考曲线“基本相似”,其他企业的薄膜衣片和糖衣片与参考曲线差异较大,虽然在水、pH值1.2和pH值4.0中能够达到规定溶出量,但在pH值6.8中均未溶出,表明在工艺控制上与原研产品还存在差距,见图3、4。
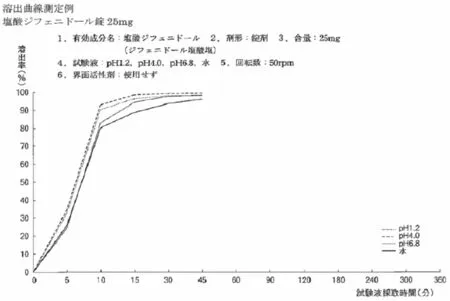
图3 《日本药品体外溶出试验信息库》中盐酸地芬尼多片溶出曲线
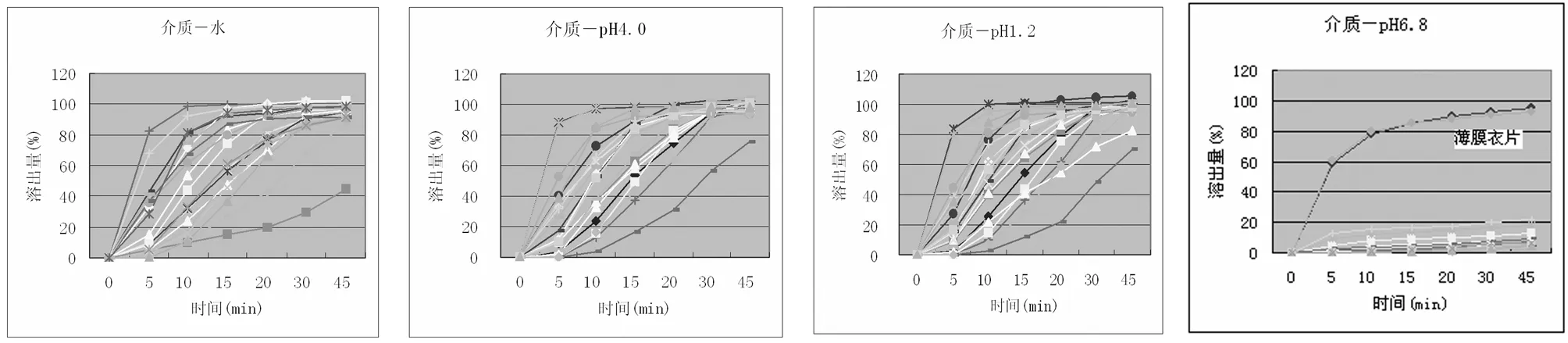
图4 四种介质中的典型溶出曲线
3.2.3 处方和工艺对比结果:根据“3.2.1”结果,对各厂家的处方和工艺进行对比分析,结果显示溶出较好的1家企业采用的包衣材料为LE白色包衣粉,而非其他厂家采用的胃溶型薄膜包衣粉;而糖衣片的包衣过程对技术要求较高,并且有些厂家添加了明胶,会产生胶联形成胶质层,使药物不易溶出。经对薄膜衣片和糖衣片溶出行为进行对比分析,认为薄膜衣在保证药品有效性方面优于糖衣。
3.3 原料药晶型 《日本药局方第十五改正书》(2006年版)于本品的概述中明确指出,本品存在多晶型现象。根据初步实验考察,国产本品中至少存在针状和矩形板状两种不同形状的晶体,两者是否属于不同晶型,尚待进一步研究。本品种目前使用的原料药均为矩形板状结晶,初步推断属同一晶型,见图5。

图5 原料药结晶典型显微图谱
3.4 原料药粒度及其分布 本品在水中略溶,为难溶性口服固体制剂原料药,为保证药品的有效性,需进行粒度分布对比考察。结果均由厂家3提供原料药的两家生产企业,样品在pH值6.8中的溶出行为完全不同,因此初步推断原料药粒度不是影响药品溶出行为的直接因素。另外,厂家3的1批原料药与另外两家差别较大,说明在原料药合成过程中各厂家存在差异。见表2。
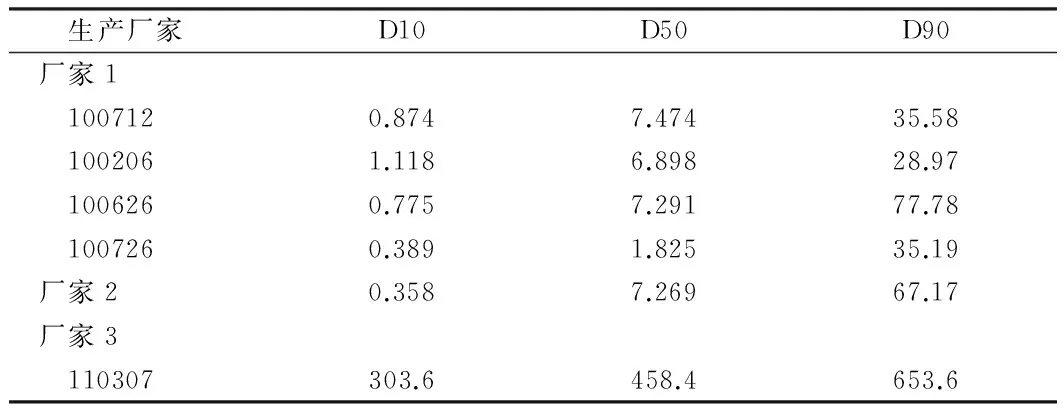
表2 原料药粒度测定结果
3.5 样品保存条件对检验结果的影响分析 本次抽验样品保存条件为温度4℃~28℃,相对湿度20%~80%,温度和相对湿度范围较大。采用SPSS相关分析法考察保存温度、湿度对主要检验指标的潜在影响。结果显示,有关物质(烯化合物和其他杂质)与温度有较显著的相关性(P<0.05);含量与湿度有较显著的相关性(P<0.05),说明严格控制样品的保存条件,能更有效地保证药品的质量稳定。见表3。
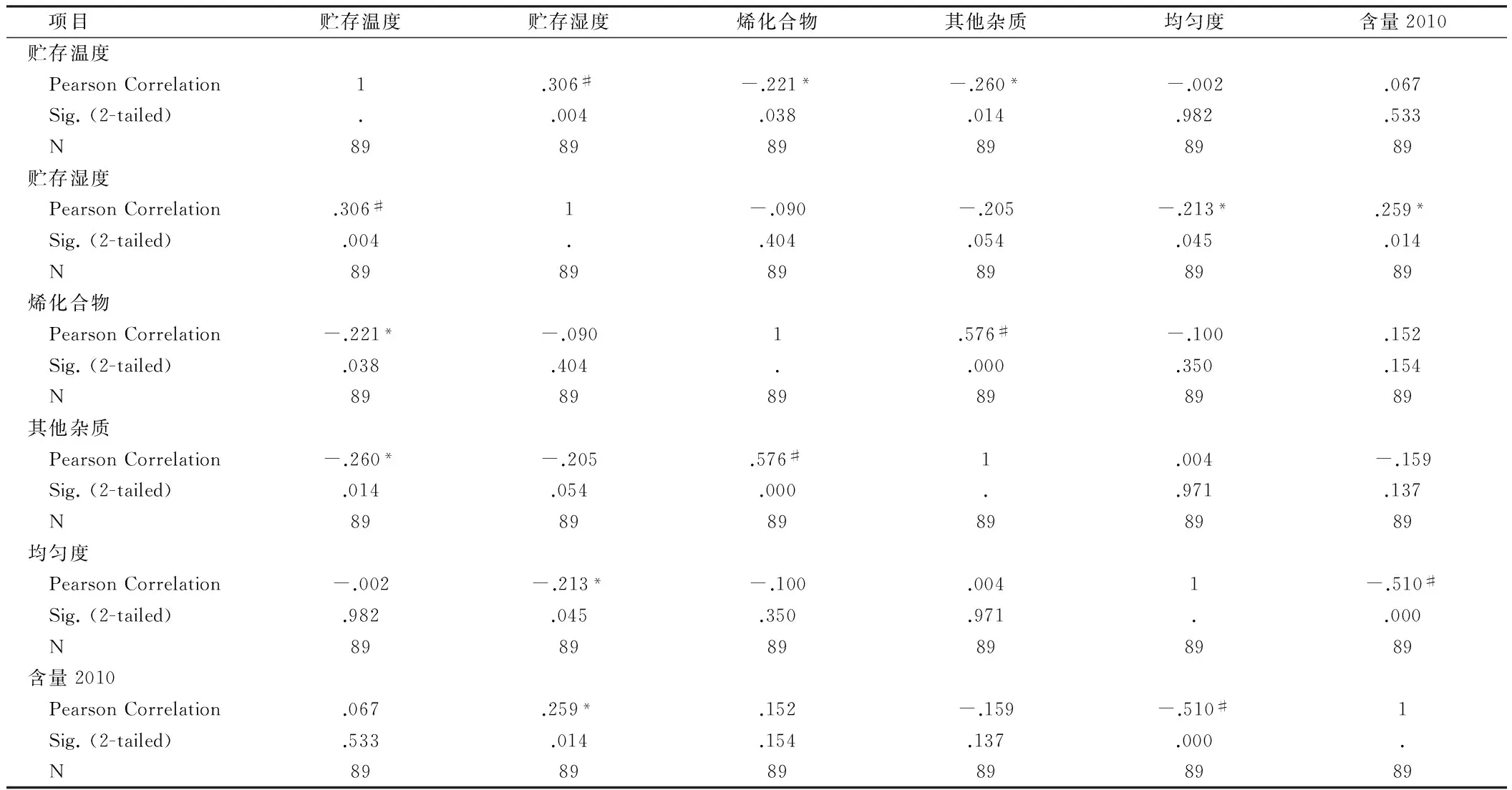
表3 多因素相关分析结果
注:*P<0.05,#P<0.01
4 讨论
4.1 法定检验和探索性研究结果显示本品种总体质量较好,现行质量标准项目设置较全面,能够反应企业间工艺控制上的差别,优于国外同品种质量标准。
4.2 由于不同年龄和不同体质的人群肠胃pH值不同,只有在4种pH值中均能有效溶出的药品,才能保证在各类人群中的有效性,检验结果发现大部分样品在pH值6.8介质中溶出较差,建议企业查找原因,改进工艺。
4.3 经对各厂家处方和工艺进行对比分析,确定造成溶出度差异的主要原因为包衣材料。由于糖衣片的包衣过程对技术要求较高,并且有些厂家添加了明胶,会产生胶联形成胶质层,使药物不易溶出,因此认为薄膜衣片优于糖衣片。
4.4 统计分析显示有关物质(烯化合物和其他杂质)与温度有显著的相关性,含量与湿度有较显著的相关性,建议制定合理的温、湿度贮存范围,保证药品质量。
4.5 经SFDA网站查询,国内已注册的生产企业37家,批准文号37个,标识规格均为25mg。原料药生产企业10家,批准文号10个,本次评价收到全国内样品152批。抽取样品涉及的生产企业和批准文号占国内已注册的生产企业和批准文号比例较小,经调研了解到,由于受市场竞争和销售滞后等因素的影响,大多数企业重新调整了产品结构,已多年未生产。因此。本次评价抽验样本依然具有一定的代表性。
4.6 本次抽验样品贮藏条件为温度4~28℃,相对湿度20%~80%,单位较大。
4.7 不同厂家相同包装样品有效期相差较大(12个月),经对厂家的长期稳定性数据考察,并结合本次检验结果,认为样品在有效期内,质量较稳定,无显著变化。
4.8 注重风险指数结果的分析,通过风险评估,建议对风险较高的企业,在加强行政监管的同时,提供技术支持,从技术角度帮助其分析原因,提高制剂工艺水平,真正保证人民用药安全有效。
4.9 粒度分布指用特定的仪器和方法反映出粉体样品中不同粒径颗粒占颗粒总量的百分数。有区间分布和累计分布两种形式。区间分布又称为频率分布,它表示一系列粒径区间中颗粒的百分含量。累计分布也叫积分分布,它表示小于或大于某粒径颗粒的百分含量。
4.10 药物的晶型 同一药物的不同晶型在外观、溶解度、熔点、溶出度、生物有效性等方面可能会有显著不同,从而影响了药物的稳定性、生物利用度及疗效,该种现象在口服固体制剂方面表现得尤为明显。药物多晶型现象是影响药品质量与临床疗效的重要因素之一。
4.11 分别对盐酸地芬尼多原料药进行了溶剂干扰试验,高温破坏,酸破坏,碱破坏,光照破坏和氧化破坏试验,结果显示本品在高温,碱,光照和氧化破坏条件下,均产生较少的降解产物,且能与主成分的色谱峰完全分离。在酸中不稳定,降解产物主要为烯化合物。
4.12F2计算公式只适用于受试与参比制剂的平均累积释放度差值小于100时的溶出度曲线比较如果二者的差值大于100,就要保证药物溶出90%以上,缓释制剂,肠溶制剂药物释放需达到80%以上,或达到释放平台。
1 中国药典.第2部.2005版.北京:化学工业出版社.2005.490-491.
2 中国药典.第2部.2010版.北京:化学工业出版社.2010.678.
3 金少鸿,粟晓黎.基于QbD理念的药品质量分析研究新概念.药物分析杂质,2011,31:1845-1849.
4 杨国伟,李青翠,陈煜,等.氢氯噻嗪片质量分析.药物分析杂质s,2011,31:1877-1879.
5 郭瑞锋,郄冰冰,韩学静,等.不同厂家盐酸地芬尼多片溶出曲线相似性考察.中国药师,2014,17:428-430.
6 郭瑞锋,郄冰冰,张铖源.盐酸地芬尼多片近红外光谱定量模型的建立.中国药房,2014, 25:2352-2354.
7 曹凤习,杜增辉,周建敏.RP-HPLC测定盐酸地芬尼多片的含量与有关物质.中国药学杂志,2009,44:1748-1751.
8 林文宏,饶智辉.高效液相色谱法测定盐酸地芬尼多片的含量.海峡药学,2009,21:93-94.
9 曹凤习.HPLC法测定盐酸地芬尼多片中杂质的含量.中国药师,2011,14:203-205.
10 郑金凤,杨汉初.盐酸地芬尼多片溶出度测定法的实验研究.中南药学,2005,3:103-104.
11 都兴东,赵娜娜.晕吐宁颗粒抗眩晕作用研究.中国药师,2015,18:1591-1593.
12 王健康,董晓莉,乔建忠,等.地芬尼多在健康人体内药动学研究.中国药学杂志,2009,44:524-527.
13 崔秀彦,郭怀忠,陈进哲,史超群.盐酸地芬尼多片溶出度考察. 中国现代应用药学,2001,18:201-202.
14 王健康,张福成,董晓莉,等.单次和连续口服地芬尼多对实验室指标的影响.中国药师,2008,11:450-452.
15 郭怀忠,崔秀彦,杨准.盐酸地芬尼多片含量的HPLC测定中国医药工业杂志,2000,31:166-167.
16 崔秀彦,郭怀忠.酸性染料比色法测定盐酸地芬尼多片的含量.中国医院药学杂志,1996,16:460-461.
17 林文宏,饶智辉.高效液相色谱法测定盐酸地芬尼多片的含量.海峡药学,2009,21:93-94.
18 张西如,曹风习,姜建国.高效液相色谱-电喷雾电离-质谱法分析盐酸地芬尼多的相关物质.中国药业,2010,19:41-42.
19 刘建梅,宋仕亮,陈常松.pH指示剂吸收度比值法测定盐酸地芬尼多片的含量.临沂医学专科学校学报,2002,24:227-228.
20 曹凤习,刘红莉.高效液相色谱法测定盐酸地芬尼多原料中杂质烯化合物的含量.中国药业,2011,20:19-20.
21 郑金凤,杨汉初.盐酸地芬尼多片溶出度测定法的实验研究.中南药学,2005,3:103-104.
22 崔秀彦,郭怀忠.酸性染料比色法测定盐酸地芬尼多片的含量.小儿急救医学,1996,16:460-461.
23 李季静,陈建,王丽琴.HPLC法测定盐酸地芬尼多片的含量.天津药学,2009,21:5-7.
10.3969/j.issn.1002-7386.2017.17.043
050011 石家庄市,河北省药品检验研究院
R 917
A
1002-7386(2017)17-2699-04
2017-03-11)

