鳊幼鱼能量代谢和个性行为的个体变异及表型关联
曾令清,付 成,奚 露,彭姜岚,付世建
重庆师范大学进化生理与行为学实验室,动物生物学重庆市重点实验室, 重庆 401331
鳊幼鱼能量代谢和个性行为的个体变异及表型关联
曾令清,付 成,奚 露,彭姜岚,付世建*
重庆师范大学进化生理与行为学实验室,动物生物学重庆市重点实验室, 重庆 401331
自然界中动物的表型特征(如形态、生理和行为)存在明显的种内个体差异,并且该差异在不同环境条件下保持稳定。为考察鲤科鱼类能量代谢和个性行为的个体差异及二者的关联,以鳊(Parabramispekinensis)幼鱼为实验对象,在(25.0±0.5) ℃条件下测定30尾鳊幼鱼的标准代谢率(SMR)、最大代谢率(MMR,由力竭运动诱导)和过量耗氧(EPOC)并计算代谢空间(MS)和相对代谢空间(FAS),随后测定鳊幼鱼的勇敢性(Boldness)和活跃性(Activity)两个个性行为学指标(测定Ⅰ),1个月后(测定Ⅱ)重复测定该种鱼的上述表型特征参数。结果显示:(1)1个月后鳊幼鱼的体重和体长均显著增加且具有较好的重复性(二者P<0.05)。(2)除MMR、MS、FAS和EPOC外,鳊幼鱼SMR具有明显的重复性;SMR与MS、FAS以及EPOC均呈现负相关(所有P<0.05),与MMR不相关;MS和FAS与MMR呈现正相关(二者P<0.01);实验期间,鳊幼鱼部分能量代谢参数的相关性保持不变。(3)鳊的勇敢性(潜伏时间)重复性较差,且测定Ⅱ鳊幼鱼的潜伏时间明显增加(P<0.05),测定Ⅰ和测定Ⅱ的潜伏时间与SMR均不相关;活跃性的移动路程、游泳速度和运动时间比的重复性较差,三者之间的正相关不受时间影响;相比较测定Ⅰ,测定Ⅱ鳊幼鱼活跃性的3个指标均明显增加(所有P<0.05)。(4)不论测定Ⅰ还是测定Ⅱ鳊幼鱼的SMR与实验期间特定体重增长率(SGR)均呈正相关(二者P< 0.01)。研究表明在实验室环境条件下鳊幼鱼的能量代谢和个性行为具有非平行的变化规律和重复性,表型特征之间存在关联,并且这些关联受环境条件的影响程度不尽相同;研究还提示该种鱼的SMR在短期内可预测个体的生长率。
标准代谢率;最大代谢率;个性;表型变异;鳊鱼
由于地域差异、气候变化及人为干扰,自然界水体环境具有很大的时空异质性,不仅体现在水体理化因子(如温度、溶氧),还呈现于环境资源(如食物丰度)方面。水体环境的变化必然影响鱼类的生理功能和行为特征[1- 6]。这些研究关注鱼类种内个体差异现象,它是指在某个种群的表型(如能量代谢和个性行为)存在个体差异,并且该差异在一段时间内保持稳定(即可重复测量)[7]。标准代谢率(Standard metabolic rate, SMR)是指变温动物在非活动、无食物消化的最小机体能量消耗强度[8]。即使排除体重、性别和年龄差异后,鱼类SMR的种内个体差异仍可达2—3倍[9- 11]。因此,上述研究首先聚焦于SMR的个体差异,这是因为SMR是生活史理论重要的能量代谢参数,某些种类的SMR可占个体能量总支出的50%[12],影响机体其它生理功能(如生长、运动、繁殖)的能量分配,对个体乃至种群的生活史特征和适合度产生影响[7, 13]。
动物个性也称行为综合症,是指在时空变化过程中动物种内存在的整体稳定的个体行为差异,并且完全是动物自身状态的内在表现特征[14- 15]。研究人员已筛选了一系列与个体适合度相关的个性行为指标,如活跃性、勇敢性、好斗性、探索性、群集性及反应性等6个指标[15- 16],其中前4个指标在鱼类研究中被广泛采用[2, 5- 6, 16]。研究发现鲑鳟鱼类的SMR与个性行为存在关联,如大西洋鲑(Salmosalar)和鳟(Salmotrutta)的SMR越高,其社群等级越高,好斗性越强[9- 10, 17];SMR越高的欧鲈(Dicentrarchuslabrax)个体的活跃性也较强[2]。鲤科鱼类锦鲫(Carassiusauratus)幼鱼也具有社群等级和好斗性行为,但与SMR并不相关[18]。因此,在鲑鳟鱼类中发现的能量代谢与个性行为的关联现象是否普遍存在于鲤科鱼类,已成为研究人员普遍关注的科学问题[6, 19]。
鳊(Parabramispekinensis)为温水性鲤科鱼类,是一种重要经济鱼类,也是基础研究的实验材料,相关研究涉及温度与能量代谢和低氧耐受的关系[20- 21],然而有关该种鱼能量代谢与个性行为个体差异及表型关联的研究尚未见报道。本研究以鳊幼鱼为实验对象,考察该种鱼能量代谢和个性行为的种内个体差异及重复性,分析能量代谢与个性行为之间的关联,探讨上述关联与环境因素的关系,为鱼类生态学研究累积资料,也为经济鱼类的人工养殖提供参考数据。
1 材料与方法
1.1 实验鱼来源与驯化
实验鱼购于重庆市北碚区歇马人工养殖基地,运回后在重庆师范大学进化生理与行为学实验室3个循环控温水槽(约250 L)中驯化3周,驯化水温为(25±0.5)℃。实验用水采用曝气3 d后的除氯自来水。用充气泵持续向驯化水体充入空气以使其溶氧水平(≥7.0 mg/L)接近饱和状态,每日换水量约换驯化水体积的15%,光周期为12L∶12D。每隔1 d用中国通威公司的浮性饲料((41.2±0.9)%蛋白质、(8.5±0.5)%脂肪、(25.7±1.2)%的碳水化合物和(12.3±0.4)%灰分)对所有鱼饱足投喂两次(当天9:00和15:00)。为减少流水和曝气对鱼摄食的影响,投喂之前5 min关闭气泵和水槽的循环水泵,使鱼自由摄食30 min,随后清除剩余饵料、残渣和粪便。
1.2 实验设计
驯化结束后,选取30尾鱼体健康、体重相近(7.81±0.24) g的鳊幼鱼作为实验对象,对鱼禁食48 h,然后进行SMR测定,随后测定单尾鱼的最大代谢率(MMR)、代谢空间(AS)以及过量耗氧量(EPOC)。能量代谢测定后,对鳊幼鱼进行1次维持日粮水平(约0.5%体重)的饵料投喂,以使运动后鳊幼鱼的生理状态较快恢复,所用饵料与驯化期间的一致。在测定单尾鱼的个性行为之前对鱼禁食48 h,该时间足以使饵料消化吸收生理活动完全结束,不影响后续个性行为观察实验;随后对鳊幼鱼进行个性行为(勇敢性和活跃性)的观察和拍摄。所有实验(测定Ⅰ)结束之后,将鱼放回已编号的养殖单元格(长17 cm × 宽10 cm × 高15 cm,水深12 cm)。为防止鳊幼鱼生长过快及饲养单元格大小成为其生命活动的空间限制因素,并基于预备生长实验,对所有鱼每隔3 d进行一次饱足日粮的饵料投喂。1个月之后,对所有鱼的形态参数(体重和体长)、能量代谢特征(SMR、MMR、AS和EPOC)及个性行为重复测定1次(测定Ⅱ)。实验期间,养殖水槽的溶氧水平和水温的控制、水体更换方式以及光周期均与驯化期间保持一致。鳊幼鱼的特定体重生长率(SGR,%/d)=l00 × [ln(Wt)-ln(W0)] /t,其中W0为初始体重(g),Wt为终末体重(g),t为实验时间(30 d)。
1.3 实验参数与测定方法
1.3.1 SMR
用流水式呼吸代谢仪进行SMR测定。测定前,将鱼(n=30)装入代谢仪的呼吸室中驯化48 h,并测量每尾鱼的体重(精度0.01 g)和体长(精度0.1 cm)。在第3天的9:00、11:00、13:00、15:00、17:00、19:00和21:00用溶氧仪(HQ30d,美国哈希公司)测量鳊幼鱼的SMR(用耗氧率表征)。在测定过程中,实验室环境保持安静以减少环境噪声对鱼生理代谢的干扰。因为鱼类存在生理代谢的昼夜节律[22],本研究设定的采样时间覆盖了白天和夜晚,将7次重复测定的耗氧率的平均值作为鳊幼鱼的SMR(mg O2kg-1h-1),其计算公式为:
SMR=ΔO2×v/m0.75
式中,SMR为标准代谢率,ΔO2为空白呼吸室(无鱼)和实验呼吸室(有鱼)出水口的溶氧差值(mg O2/L),v为呼吸室的流量(L/h),m为鱼的体重(kg),0.75为体重校正系数[18]。
1.3.2 MMR和EPOC
在SMR测定后的第2天,本研究通过力竭性运动诱导个体的MMR。将鱼从呼吸室取出至力竭运动驱赶装置的环形水道(φ外=52 cm,φ内=28 cm,水体容量约为20 L,水深10 cm)中,用手不断驱赶环形水道(水流速度约60 cm/s)中的鳊幼鱼以使其保持逆流游泳直至运动力竭;处于运动力竭状态的鱼通常失去鱼体平衡且用手继续触碰时不再有明显应激反应[23]。随后迅速(15 s内)将鱼转移至呼吸室内并进行恢复代谢测定。在进行0.5 h的恢复代谢测定过程中,呼吸室的水流速度设定约为500 mL/min,数据采集时间设定为运动力竭后1、2、3、4、5、6、7、8、9、10、15、20、25、30 min。恢复代谢的测量方法及计算公式均与SMR一致。将此时间段获取的最大耗氧率作为单尾鱼的MMR,计算代谢空间(MS= MMR-SMR,mg O2kg-1h-1)和相对代谢空间(FAS= MMR/SMR,无量纲)。力竭运动后的过量耗氧(EPOC,mg O2/kg)为力竭运动恢复过程中鳊幼鱼的代谢率超过SMR之上的耗氧量总和。为考察鳊幼鱼的个体差异及其重复性,并鉴于运动力竭后的恢复代谢曲线的特征,本研究仅计算单尾鱼在1—10 min之间的EPOC,用于统计分析。实验结束后,将单尾鱼放回单元格进行恢复。
1.3.3 个性行为
在能量代谢测定之后,对所有鱼进行一次维持日常的饵料投喂,饵料与驯化期间一致。在48 h之后,进行个性行为观察和拍摄。本研究个性行为包括勇敢性和活跃性,其中勇敢性的评价指标为潜伏时间(s),活跃性的评价指标包括移动路程(cm)、游泳速度(cm/s)和运动时间比(PTM,%)。将单尾鱼移入实验室自行设计的行为学观察装置(长60 cm × 宽20 cm × 高20 cm)的驯化室(长20 cm × 宽20 cm)驯化60 min,该装置的具体结构详见本实验室的前期研究工作[5- 6]。个性行为的观察与拍摄期间,实验环境保持安静,以使鳊幼鱼的个性行为完全由其内部生理状态决定。
勇敢性是评价鱼类进入新异环境的勇敢程度,此新异环境是鱼类从未经历的,以个体自实验开始时初次进入新环境所用的最短时间(称为潜伏时间),该时间越长,鱼类的勇敢性越低,反之越高。具体方法:鱼在驯化室适应1 h后,轻轻打开驯化室与观察室之间挡板上的活动门,同时开启在观察室上方装连接电脑的摄像头,拍摄鱼进入观察室(长40 cm × 宽20 cm)的活动,共持续拍摄15 min。对视频分析,得到每尾鱼初次进入观察室的时间。判定标准:从正上方角度观察,当鱼的上吻端刚好越过分界线时,此时对应的时间为潜伏时间。
活跃性是评价鱼类的活跃程度。本研究评价鱼类的活跃性指标包括移动路程、游泳速度以及PTM,评价指标的数值越高,说明鱼的活跃性越强。具体方法:在勇敢性测定完后,将活动门关闭,使鱼在观察室驯化1 h。随后拍摄鱼的自发活动,共进行10 min的拍摄。通过动物轨迹跟踪系统Ethvision XT(9.0)软件对视频分析。
1.4 数据处理与统计
实验数据先用Excel进行整理计算,再采用SPSS 19.0统计软件完成数理统计工作。所有统计值以平均值±标准误(Mean±SE) 表示,显著性水平为P< 0. 05。采用配对T-检验对两次测定的实验表型参数的平均值进行显著性统计。能量代谢参数之间、个性行为参数之间的相关性、SMR与个性行为的相关性以及所有表型参数的重复性均采用Pearson相关分析。
2 结果
2.1 形态参数及其重复性
测定Ⅰ时鳊幼鱼的体重与体长平均值分别为7.81±0.24 g和7.55±0.07 cm,而测定Ⅱ时体重和体长分别明显增加至(9.17±0.24) g和(7.89±0.08) cm(体重T=15.707,P< 0.001;体长T=7.696,P< 0.001)。实验期间,鳊幼鱼的体重和体长均呈较好的重复性(体重r=0.936,P< 0.001;体长r=0.817,P< 0.001)。
2.2 能量代谢和个性行为的变异情况
一个月后鳊幼鱼的SMR下降了28.2%(T=4.273,P< 0.001),而MMR、MS、FAS和EPOC无显著变化(MMR:T=1.542,P=0.134;MS:T=0.358,P=0.723;FAS:T=1.257,P=0.219;EPOC:T=1.436,P=0.162)(表1)。除MMR的变异系数(CV)外,SMR、MS、FAS和EPOC的CV均变小。与CV的变化方向相似,能量代谢参数的变异倍率(最大值/最小值)也呈下降趋势(表1)。
鳊幼鱼的勇敢性(以潜伏时间评价)明显降低(T=-2.511,P=0.018),相比较于测定Ⅰ(8尾,占26.7%),在测定Ⅱ中进入观察区的鳊幼鱼仅有3尾,占10%。测定Ⅱ时鳊幼鱼的移动路程、游泳速度及运动时间百分比(PTM)均明显大于测定Ⅰ(移动路程T=-3.252,P=0.003;游泳速度T=-3.203,P=0.003;PTM:T=-3.086,P=0.004)。鳊幼鱼潜伏时间的CV和变异倍率下降,而其移动路程、游泳速度以及PTM的CV和变异倍率均增加(表1)。
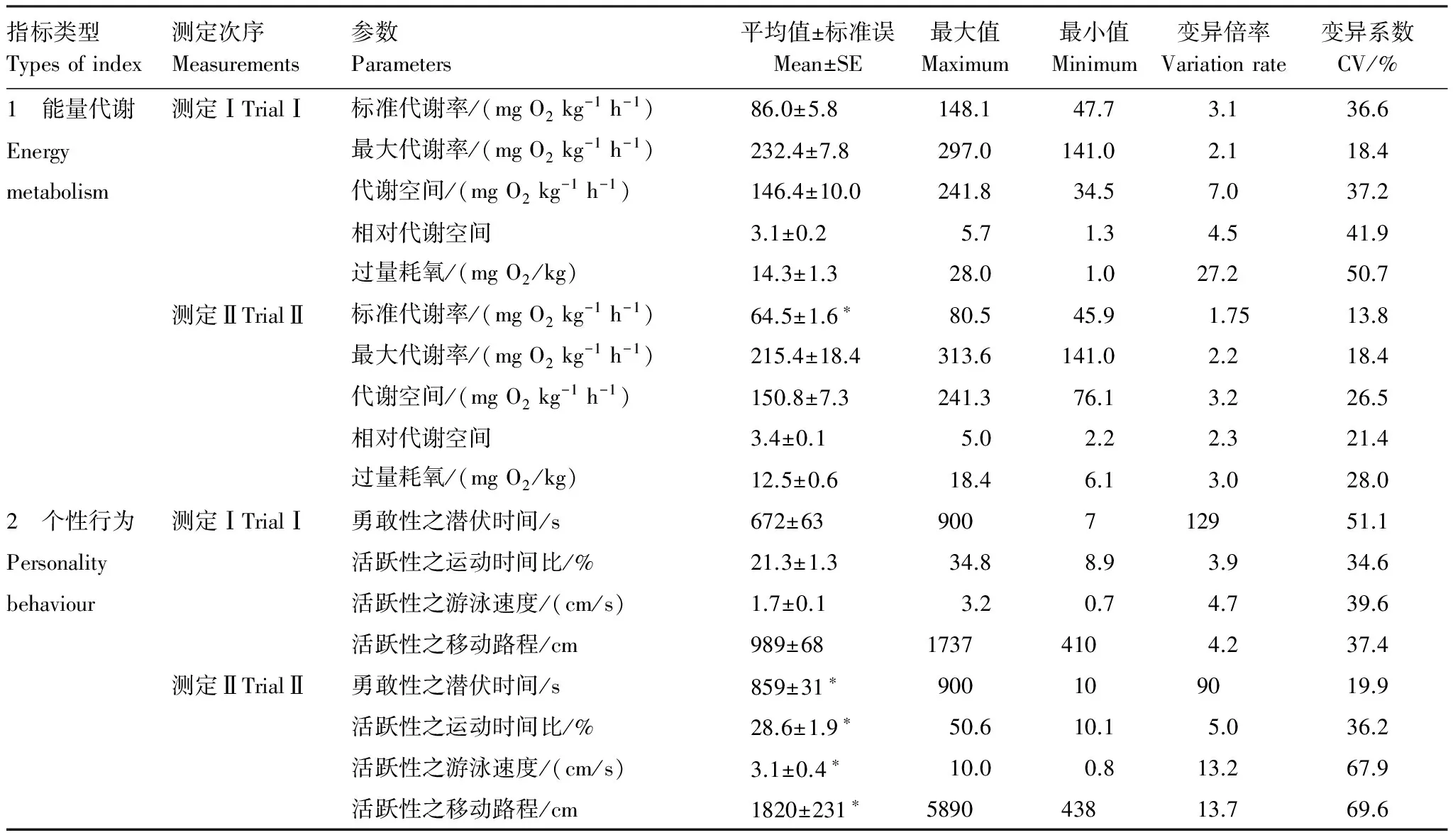
表1 鳊幼鱼能量代谢和个性特征的综合情况
变异倍率=最大值/最小值;* 表示两次测定中间同一指标数据差异显著(P<0.05)
2.3 能量代谢和个性行为的相关性及重复性
测定Ⅰ和测定Ⅱ的鳊幼鱼SMR与MMR均不相关;在测定Ⅰ,SMR与AS、FAS和EPOC呈负相关,但在测定Ⅱ,仅SMR与FAS及EPOC呈负相关,其它二者不存在相关性(表2)。此外,测定Ⅰ和测定Ⅱ的鳊幼鱼的MMR、AS、FAS和EPOC之间任意两者均呈正相关(表2);相比较于测定Ⅰ,测定Ⅱ67%的参数之间的相关性程度出现下降。
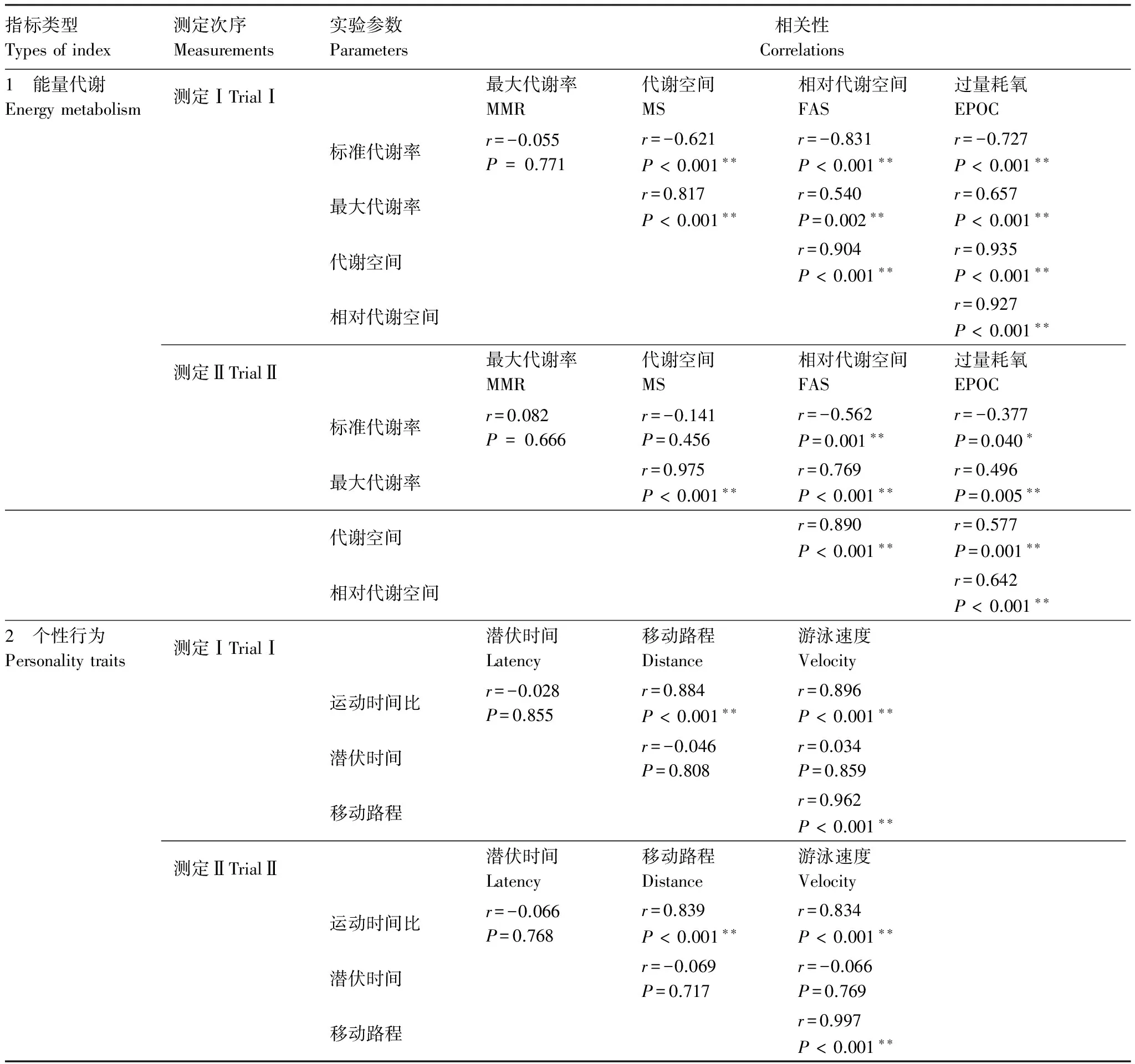
表2 鳊幼鱼能量代谢参数之间以及个性特征之间的相关性
*表示P< 0.05,**表示P< 0.01.
鳊幼鱼勇敢性的潜伏时间与活跃性的三个参数(移动路程、游泳速度和PTM)均不相关;然而,移动路程、游泳速度和PTM间均呈现正相关(表2)。除SMR外,鳊幼鱼能量代谢的其它参数及个性行为特征均无明显的重复性(表3)。在两次测定中,鳊幼鱼的SMR与个性行为特征(潜伏时间、移动路程、游泳速度和PTM)均不相关(表4)。
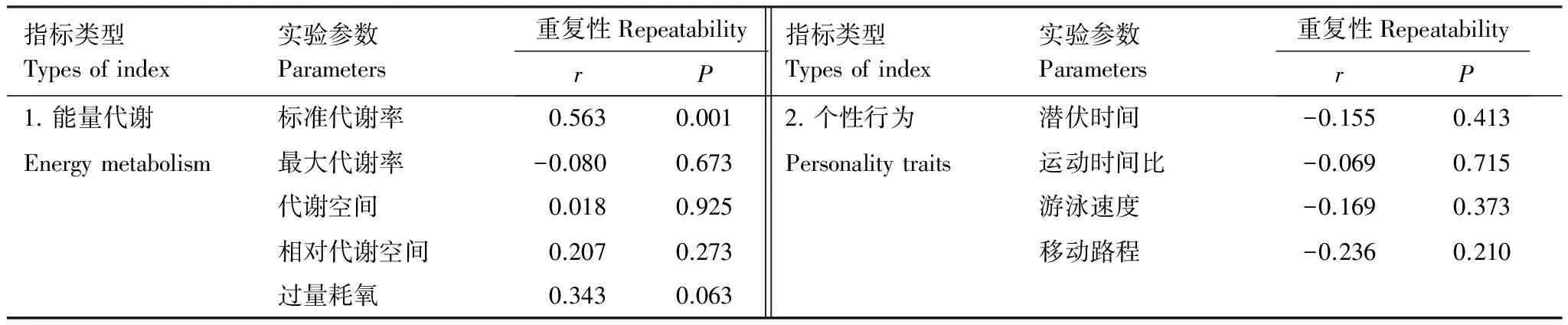
表3 鳊幼鱼能量代谢和个性特征的重复性
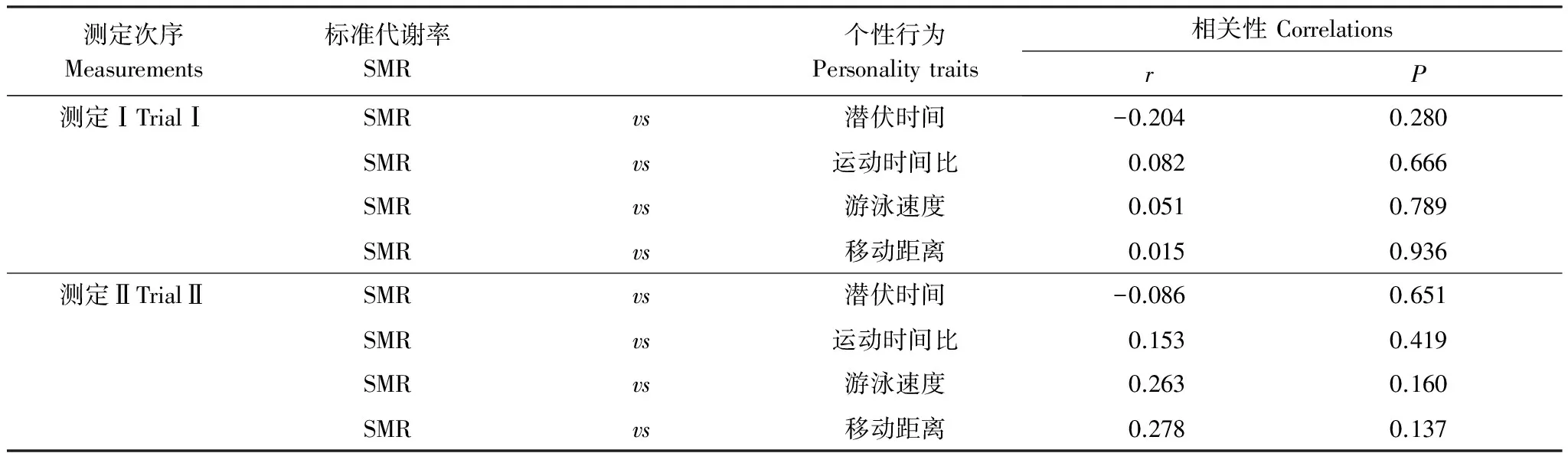
表4 鳊幼鱼标准代谢率与个性行为的关联
2.4 能量代谢与生长性能的关系
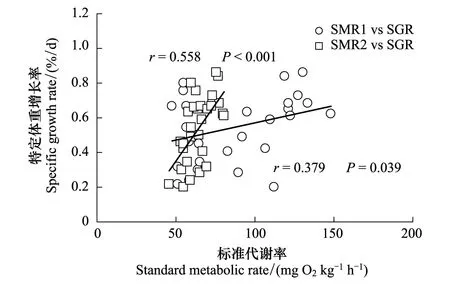
图1 鳊幼鱼的标准代谢率与特定体重增长率的相关性 Fig.1 The relationship between standard metabolic rate and specific growth rate in body mass in juvenile Chinese bream (P. pekinensis)
不论实验起始时的SMR还是实验结束时的SMR,二者均与实验期间鳊幼鱼的特定体重生长率(SGR)呈正相关(图1,二者P< 0.05)。协方差分析发现,二者的斜率和截距均存在差异(F1,59= 6.629,P=0.013)。
3 讨论
3.1 鳊幼鱼表型特征的个体差异与重复性
部分研究关注动物的生理表型(如能量代谢)和行为表型(如个性行为)的重复性及与环境食物资源(如饥饿或低食物丰度)的内在关联[6, 24- 26]。研究发现,饥饿不仅导致南方鲇幼鱼(Silurusmeridionalis)静止代谢率、活跃代谢率以及有氧代谢空间明显下降,其中静止代谢率的变异系数减少[27],而且还会降低该种鱼的有氧运动能力和持续加速游泳能力[28],并且南方鲇幼鱼的两种运动能力的重复性高于能量代谢表型[27- 28]。在较低食物丰度条件下,与测定Ⅰ比较,在测定Ⅱ中鳊幼鱼的SMR和MMR均出现显著降低,而MS、FAS和EPOC无明显变化,提示SMR和MMR的下降可能与较低的食物量摄入有关。除MMR外,鳊幼鱼上述其它代谢参数的变异系数均出现下降。此外,在测定Ⅱ中鳊幼鱼的活跃性明显增加,而勇敢性降低,前者的变异系数增加,后者变异系数减少。在自然界中水温的日变化与年变化均较为明显,而在实验室条件下鳊幼鱼的驯化水温波动极小,并且其它环境条件(如溶氧、氨氮和食物)也进行严格地局部控制,这种实验室养殖水体的环境异质性较低,可能是导致正常营养状态下鳊幼鱼SMR的变异系数变小的原因之一,即稳定的栖息环境容易导致该种鱼SMR的变异程度缩小。另外,测定Ⅱ中鳊幼鱼在驯化室的潜伏时间明显增长,这是因为16.7%鳊幼鱼的潜伏时间明显增加至最长时间(15 min),使得测定Ⅱ的数据更为单一,进而导致勇敢性的变异系数降低,可能与本研究设定的拍摄时间较短有关。由于鳊幼鱼在测定Ⅱ的勇敢性变低,鳊幼鱼可能想通过寻找出口逃离观察区,表现出活跃性增加,导致活跃性的变异程度增加。这种勇敢性降低和活跃性增加的行为变化表明鳊幼鱼再次在新异环境中采取更为谨慎的风险承担行为(如觅食、探索、警戒活动)。
有研究者对47篇有关昆虫、爬行类、鸟类以及哺乳类的能量代谢的研究论文进行统计分析,认为动物的能量代谢特征(如SMR和MMR,常用整个动物耗氧率表征)具有明显的重复性[24],并且环境因子影响表型特征的重复性[27]。以鱼类为例,花鳅(Cobitistaenia)[25]、大西洋鲑[26, 30]、锦鲫幼鱼[29]和鳟[31]的SMR均呈现较好的重复性;我们的前期研究发现南方鲇幼鱼SMR的重复性低,其MMR和MS的重复性却较高,然而两周的饥饿明显降低后两者的重复性[27]。除此之外,还有研究认为,动物表型特征的重复性不仅随测定时间的增加而逐渐降低,而且实验室条件下测定的表型重复性显著高于野外实验[32]。在本研究中,鳊幼鱼的SMR具有较好的重复性,与花鳅[25]、大西洋鲑[26, 29]、锦鲫[30]和鳟[31]的研究结果相似,然而鳊幼鱼的MMR和MS等表型参数的重复性较低,说明本研究中鳊幼鱼的MMR和MS可重复测量的时间可能短于一个月,与鳊幼鱼在稳定实验室环境中的生理调整程度存在差异有关。虽然测定Ⅱ中该种鱼SMR明显下降,而MMR和MS未显著降低,暗示用于其他生理功能的最大代谢潜能保持不变,同时鳊幼鱼不同个体的代谢可塑性不同。
3.2 鳊幼鱼表型特征的关联
鱼类的SMR与MMR、MS及EPOC的内在关联备受关注,不仅是因为SMR和MMR分别代表鱼类能量代谢能力的下限和上限,二者的差值即为MS,而且还因为这些表型参数具有不同的生态学意义[6, 33]。获得鱼类MMR的方式既可通过力竭运动获得,也可通过食物诱导或者两种生理活动叠加共同获得,取决于鱼类的代谢模式[34]。不论是由食物诱导的摄食代谢峰值还是力竭运动诱导的最大代谢率,二者均与机体的呼吸循环系统密切相关,分别代表单一生理状态下机体的最大摄氧能力。研究显示,不同活跃性鱼类的种间比较发现SMR与MMR呈正相关,即种类越活跃,其SMR与MMR相应越大[35];南方鲇幼鱼的SMR不但在常氧条件下与摄食代谢峰值呈正相关[36- 37],而且在低氧条件下二者的正相关仍然存在[37],相似研究结果在鲤(Cyprinuscarpio)[38]、大西洋鲑[39]和鳟[40]中也有报道。为从生化机制上解释上述正相关,研究者发现鳟肝脏中与有氧代谢相关的细胞色素c氧化酶和柠檬酸合成酶的活性与SMR及MMR呈正相关[40]。本实验室前期研究发现鲫(Carassiusauratus)幼鱼的SMR与其MMR呈正相关,且二者之间的正相关不受温度影响[19];青鱼(Mylopharyngodonpiceus)幼鱼的SMR与其MMR也呈正相关,且此相关不受溶氧水平的影响[41],表明该两种鲤科鱼类SMR与MMR的关联不具有环境依赖性。然而,也有研究发现鲫幼鱼和南方鲇幼鱼的SMR与MMR并不相关[6, 36]。本研究发现,两次测定中鳊幼鱼的SMR与MMR均不相关,并且在测定Ⅰ中SMR与MS、EPOC之间呈现的负相关在测定Ⅱ消失,仅维持了SMR与FAS的负相关,这种现象可能与在测定Ⅱ中上述能量代谢参数的变异系数降低有关,并且降低的表型特征变异系数可能是由较均质的养殖环境造成的[6]。
鱼类SMR与个性行为的关联方向不尽相同,如大西洋鲑和鲤的SMR与勇敢性呈正相关[42- 43];美洲红点鲑(Salvelinusfontinalis)的SMR与其活跃性呈正相关[44];大西洋鲑的SMR与其好斗性呈正相关[10, 45]。此外,大西洋鲑和马苏大麻哈鱼(Oncorhynchusmasou)的SMR越高,其统治地位相应越高,占有的领域面积越大[9, 46],而领域大小又与食物资源多少密切相关,必然影响个体的食物可获性[11]。另有研究报道,鲫幼鱼的SMR与其勇敢性和活跃性均不相关[6]。本研究发现,两次测定中鳊幼鱼的SMR与其勇敢性和活跃性均不相关,这与鲫的研究结果一致[6]。欧鲈也有类似的研究发现,即在常氧和中度低氧条件下二者均不相关,但在重度低氧条件下该种鱼的SMR与勇敢性呈负相关[47];在低捕食压力下,三刺鱼(Gasterosteusaculeatus)的好斗性和勇敢性不相关,但在高捕食压力下,二者呈正相关[48- 49]。上述现象不仅与实验室环境中食物资源丰富且可预测、水槽的物理空间均质、水体的理化因子稳定等特征相关[6],而且还与在较强的捕食压力或严重的低氧等环境胁迫下鱼类的应激程度和表型可塑性的高低存在差异有关,最终在较为极端环境或较强环境胁迫条件下鱼类表型特征之间的潜在关联得以强化并揭露[48- 49]。
3.3 鳊幼鱼SMR与生长性能的关系
自然水体中食物资源存在明显的时空异质性,影响鱼类的生存和生长,甚至种群的繁衍。鱼类的SMR与个体生长发育(如体重增长)或存活率可能存在关联,此关联可能有重要的生态结果[13, 50]。虽然鱼类SMR与生长性能的关联早被广泛关注,但不同研究的结果差异明显,相关研究多以鲑鳟鱼类为实验对象。在实验室食物资源丰富条件下个体的SMR与生长率通常呈现正相关[1],如银大麻哈鱼(Oncorhynchuskisutch)[3]、马苏大麻哈鱼[46]和大西洋鲑[10, 51]。然而,野外环境中鳟的SMR与生长率不相关或呈负相关[1];在丰富食物资源条件下鳟SMR的变化量与其体长呈正相关,而实验起始测定的SMR与生长参数并不相关[52]。上述研究认为不同SMR个体在环境食物丰度变动条件下呈现相应的优势,而且表明导致生长性能存在环境食物丰度依赖性的原因是SMR,而非生长性能的个体变异[3- 4]。本实验室的前期研究也发现,在实验室食物资源丰富条件下高SMR鲫个体的SGR显著高于低SMR个体,但在低食物丰度条件下二者的生长性能无明显差异,即该种鱼的SMR与生长性能的关联具有环境依赖性;实验起始时锦鲫幼鱼的SMR与摄食率、摄食转化率、特定体重生长率不相关,而生长实验结束的SMR却与摄食率呈正相关[30]。本研究显示,鳊幼鱼不论测定Ⅰ还是测定Ⅱ的SMR均与其SGR呈正相关,推测该种鱼在幼鱼阶段时的SMR可以预测其生长轨迹。协方差分析结果显示,测定Ⅱ中SMR与SGR的相关程度(或方程斜率)明显大于测定Ⅰ的,这与锦鲫幼鱼的研究结果相似,这种现象可能与一定时期内鳊幼鱼保持固定摄食消化频率有关,即时测量的SMR可能包括延迟的用于生长的能量部分,而这一部分可能偏高估计SMR,导致生长性能与即时SMR呈更高程度的正相关[4]。因此,鱼类适合的SMR测定时间的相关研究值得关注。
综上所述,在实验室环境条件下鳊幼鱼的能量代谢和个性行为具有非平行的变化规律和重复性,表型特征之间存在关联,并且这些关联受环境条件的影响程度不同。鳊幼鱼不论实验起始时还是实验结束时的SMR均与实验期间的SGR呈正相关,但后者的相关程度高于前者,提示在实验室环境下,该种鱼在幼鱼阶段时的SMR在短期内可预测其生长率。
[2] Killen S S, Marras S, McKenzie D J. Fuel, fasting, fear: routine metabolic rate and food deprivation exert synergistic effects on risk-taking in individual juvenile European sea bass. Journal of Animal Ecology, 2011, 80(5): 1024- 1033.
[3] Van Leeuwen T E, Rosenfeld J S, Richards J G. Effects of food ration on SMR: influence of food consumption on individual variation in metabolic rate in juvenile coho salmon (Onchorhynchuskisutch). Journal of Animal Ecology, 2012, 81(2): 395- 402.
[4] Rosenfeld J, Van Leeuwen T, Richards J, Allen D. Relationship between growth and standard metabolic rate: measurement artefacts and implications for habitat use and life-history adaptation in salmonids. Journal of Animal Ecology, 2014, 84(1): 4- 20.
[5] Fu C, Fu S J, Cao Z D, Yuan X Z. Habitat-specific anti-predator behavior variation among pale chub (Zaccoplatypus) along a river. Marine and Freshwater Behaviour and Physiology, 2015, 48(4): 267- 278.
[6] 曾令清, 付世建, 曹振东. 鲫幼鱼(Carassiusauratus)标准代谢的个体差异与力竭后代谢特征及行为的关联. 生态学报, 2016, 36(6): 1747- 1755.
[7] Biro P A, Stamps J A. Do consistent individual differences in metabolic rate promote consistent individual differences in behavior? Trends in Ecology and Evolution, 2010, 25(11): 653- 659.
[8] Beck F, Gropp J. Estimation of the starvation losses of nitrogen and energy in the rainbow trout (Oncorhynchusmykiss) with special regard to protein and energy maintenance requirements. Journal of Applied Ichthyology, 1995, 11(3/4): 263- 275.
[9] Metcalfe N B, Taylor A C, Thorpe J E. Metabolic rate, social status and life-history strategies in Atlantic salmon. Animal Behaviour, 1995, 49(2): 431- 436.
[10] Cutts C J, Metcalfe N B, Taylor A C. Aggression and growth depression in juvenile Atlantic salmon: the consequences of individual variation in standard metabolic rate. Journal of Fish Biology, 1998, 52(5): 1026- 1037.
[11] Armstrong J D, Millidine K J, Metcalfe N B. Ecological consequences of variation in standard metabolism and dominance among salmon parr. Ecology of Freshwater Fish, 2011, 20(3): 371- 376.
[12] Steyermark A C, Miamen A G, Feghahati H S, Lewno A W. Physiological and morphological correlates of among-individual variation in standard metabolic rate in the leopard frogRanapipiens. Journal of Experimental Biology, 2005, 208: 1201- 1208.
[13] Burton T, Killen S S, Armstrong J D, Metcalfe N B. What causes intraspecific variation in resting metabolic rate and what are its ecological consequences?. Proceeding of the Royal Society B: Biological Sciences, 2011, 278(1724): 3465- 3473.
[14] Dingemanse N J, De Goede P. The relation between dominance and exploratory behavior is context-dependent in wild great tits. Behavioral Ecology, 2004, 15(6): 1023- 1030.
[15] Réale D, Reader S M, Sol D, McDougall P T, Dingemanse N. Integrating animal temperament within ecology and evolution. Biological Reviews, 2007, 82(2): 291- 318.
[16] Lacasse J, Aubin-Horth N. A test of the coupling of predator defense morphology and behavior variation in two threespine stickleback populations. Current Zoology, 2012, 58(1): 53- 65.
[17] Hoogenboom M O, Armstrong J D, Groothuis T G G, Metcalfe N B. The growth benefits of aggressive behavior vary with individual metabolism and resource predictability. Behavioral Ecology, 2013, 24(1): 253- 261.
[18] 陈永鹏, 曹振东, 付世建. 锦鲫幼鱼的社群等级地位及其与标准代谢率、血糖和临界游泳能力的关系. 生态学报, 2010, 30(7): 1940- 1945.
[19] 唐国伟, 曹振东, 付世建. 温度、种内标准代谢差异与鲫幼鱼力竭运动后过量耗氧的关系. 生态学杂志, 32(12): 3255- 3260.
[20] 付成, 曹振东, 付世建. 温度和饥饿对鲤鱼幼鱼静止代谢率及自发运动的影响. 动物学杂志, 2012, 47(2): 85- 90.
[21] 陈波见, 曹振东, 付世建, 王宇翔. 温度对鳊鱼静止代谢和耐低氧能力的影响. 动物学杂志, 2010, 45(5): 1- 8.
[22] 曾令清, 付世建, 曹振东. 南方鲇幼鱼标准代谢的昼夜节律. 水产科学, 2007, 26(10): 539- 542.
[23] Zeng L Q, Zhang Y G, Cao Z D, Fu S J. Effect of temperature on excess post-exercise oxygen consumption in juvenile southern catfish (SilurusmeridionalisChen) following exhaustive exercise. Fish Physiology and Biochemistry, 2010, 36(4): 1243- 1252.
[24] Nespolo R F, Franco M. Whole-animal metabolic rate is a repeatable trait: a meta-analysis. Journal of Experimental Biology, 2007, 210(11): 2000- 2005.
[25] Maciak S, Konarzewski M. Repeatability of standard metabolic rate (SMR) in a small fish, the spined loach (Cobitistaenia). Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2010, 157(2): 136- 141.
[26] Seppänen E, Piironen J, Huuskonen H. Consistency of standard metabolic rate in relation to life history strategy of juvenile Atlantic salmonSalmosalar. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2010, 156(2): 278- 284.
[27] 曾令清, 彭韩柳依, 王健伟, 庞旭, 曹振东, 付世建. 南方鲇幼鱼运动代谢的个体变异和重复性及其饥饿响应. 水产学报, 2015, 39(1): 52- 64.
[28] 曾令清, 彭韩柳依, 王健伟, 庞旭, 曹振东, 付世建. 饥饿对南方鲇幼鱼游泳能力个体变异和重复性的影响. 水生生物学报, 2014, 38(5): 883- 890.
[29] O′Connor K I, Taylor A C, Metcalfe N B. The stability of standard metabolic rate during a period of food deprivation in juvenile Atlantic salmon. Journal of Fish Biology, 2000, 57(1): 41- 51.
[30] 刘欢, 李秀明, 付世建, 曾令清. 锦鲫幼鱼标准代谢率与生长性能的关联. 水生生物学报, 2016, 40(4): 836- 842.
[31] Norin T, Malte H. Repeatability of standard metabolic rate, active metabolic rate and aerobic scope in young brown trout during a period of moderate food availability. Journal of Experimental Biology, 2011, 214(10): 1668- 1675.
[32] Auer S K, Bassar R D, Salin K, Metcalfe N B. Repeatability of metabolic rate is lower for animals living under field versus laboratory conditions. The Journal of Experimental Biology, 2016, 219(5): 631- 634.
[33] Careau V, Thomas D, Humphries M M, Réale D. Energy metabolism and animal personality. Oikos, 2008, 117(5): 641- 653.
[34] 付世建, 曹振东, 曾令清, 夏继刚, 李秀明. 鱼类游泳运动——策略与适应性进化. 北京: 科学出版社, 2014, 78- 81.
[35] Fu S J, Zeng L Q, Li X M, Pang X, Cao Z D, Peng J L, Wang Y X. The behavioral, digestive and metabolic characteristics of fishes with different foraging strategies. The Journal of Experimental Biology, 2009, 212(14): 2296- 2302.
[36] Fu S J, Cao Z D, Peng J L, Wang YX. Is peak postprandial oxygen consumption positively related to growth rate and resting oxygen consumption in a sedentary catfishSilurusmeridionalis? Journal of Fish Biology, 2008, 73(3): 692- 701.
[37] Chen B J, Cao Z D, Fu S J. Hypoxia impairs the digestive advantage of individual southern catfish (Silurusmeridionalis) with high resting metabolic rates and postprandial metabolic responses. Marine and Freshwater Behaviour and Physiology, 2014, 47(3): 197- 204.
[38] 张曦, 曾令清, 付世建, 彭姜岚, 曹振东. 鲤幼鱼标准代谢率的个体差异与运动性能和摄食代谢的关系. 动物学杂志, 2016, 51(3): 384- 394.
[39] Millidine K J, Armstrong J D, Metcalfe N B. Juvenile salmon with high standard metabolic rates have higher energy costs but can process meals faster. Proceedings of the Royal Society B: Biological Sciences, 2009, 276(1664): 2103- 2108.
[40] Norin T, Malte H. Intraspecific variation in aerobic metabolic rate of fish: relations with organ size and enzyme activity in brown trout. Physiological and Biochemical Zoology, 2012, 85(6): 645- 656.
[41] Pang X, Fu S J, Zhang Y G. Individual variation in metabolism and swimming performance in juvenile black carp (Mylopharyngodonpiceus) and the effects of hypoxia. Marine and Freshwater Behaviour and Physiology, 2015, 48(6): 431- 443.
[42] Finstad A G, Forseth T, Ugedal O, Nsje T F. Metabolic rate, behaviour and winter performance in juvenile Atlantic salmon. Functional Ecology, 2007, 21(5): 905- 912.
[43] Huntingford F A, Andrew G, Mackenzie S, Morera D, Coyle S M, Pilarczyk M, Kadri S. Coping strategies in a strongly schooling fish, the common carpCyprinuscarpio. Journal of Fish Biology, 2010, 76(7): 1576- 1591.
[44] Farwell M, McLaughlin R L. Alternative foraging tactics and risk taking in brook charr (Salvelinusfontinalis). Behavioral Ecology, 2009, 20(5): 913- 921.
[45] Cutts C J, Metcalfe N B, Taylor A C. Competitive asymmetries in territorial juvenile Atlantic salmon,Salmosalar. Oikos, 1999, 86(3): 479- 486.
[46] Yamamoto T, Ueda H, Higashi S. Correlation among dominance status, metabolic rate and otolith size in masu salmon. Journal of Fish Biology, 1998, 52(2): 281- 290.
[47] Killen S S, Marras S, Ryan M R, Domenici P, McKenzie D J. A relationship between metabolic rate and risk-taking behaviour is revealed during hypoxia in juvenile European sea bass. Functional Ecology, 2012, 26(1): 134- 143.
[48] Bell A M. Behavioural differences between individuals and two populations of stickleback (Gasterosteusaculeatus). Journal of Evolutionary Biology, 2005, 18(2): 464- 473.
[49] Bell A M, Sih A. Exposure to predation generates personality in threespined sticklebacks (Gasterosteusaculeatus). Ecology letters, 2007, 10(9): 828- 834.
[50] Blanckenhorn W U. Behavioral causes and consequences of sexual size dimorphism. Ethology, 2006, 111(11): 977- 1016.
[51] McCarthy I D. Temporal repeatability of relative standard metabolic rate in juvenile Atlantic salmon and its relation to life history variation. Journal of Fish Biology, 2000, 57(1): 224- 238.
[52] Auer S K, Salin K, Rudolf A M, Anderson G J, Metcalfe N B. Flexibility in metabolic rate confers a growth advantage under changing food availability. Journal of Animal Ecology, 2015, 84(5): 1405- 1411.
Phenotypic correlations and individual variation of energy metabolism and personality in juvenile Chinese bream (Parabramispekinensis)
ZENG Lingqing, FU Cheng, XI Lu, Peng Jianglan, FU Shijian*
LaboratoryofEvolutionaryPhysiologyandBehaviour,ChongqingKeyLaboratoryofAnimalBiology,ChongqingNormalUniversity,Chongqing401331,China
In nature, consistent individual differences (CIDs) in phenotypic traits (e.g., morphology, physiology, or behavior) are a widespread phenomenon in animals. CIDs in phenotypic traits are maintained over time, and can be measured by repeatability at different times. We used juvenile Chinese bream (Parabramispekinensis) as an animal model to determine individual variation and correlation between energy metabolism and personality behaviors of cyprinid fish. Under conditions of (25±0.5)℃, the standard metabolic rate (SMR), maximum metabolic rate (MMR, induced by exhaustive exercise), and excess post-exercise oxygen consumption (EPOC) of fish were determined, and the metabolic scope (MS) and factorial metabolic scope (FAS) were also calculated. Personality behaviors, including boldness (indicated by latency), activity (indicated by distance moved, average swimming velocity, and percent time spent moving) were measured for individuals (trial Ⅰ). All of the aforementioned phenotypic traits were measured again after one month (trial Ⅱ). The results showed that both body mass and body length of juvenile Chinese bream increased substantially, and these two morphological parameters showed good repeatability during the experiment (bothP< 0.05). Only the SMR of fish was repeatable, and not MMR, MS, FAS, and EPOC. SMR was negatively correlated with MS, FAS, and EPOC (allP< 0.05), and showed no correlation with MMR. MS had a positive correlation with both FAS and MMR (bothP< 0.05). The direction of some correlations between components of energy metabolism of the juvenile Chinese bream did not change during the course of experiment. Boldness (indicated as latency) of the experimental fish did not exhibit repeatability, and was significantly higher in trial Ⅱ than in trial Ⅰ (P< 0.05). The latencies of the two measurements were not correlated with SMR. In addition, distance moved, swimming velocity, and percent time spent moving were also not repeatable. However, the relationships among these three activity parameters were all positive in spite of the effects of time. When compared to those of trial Ⅰ, the values of the three parameters of activity all increased in trial Ⅱ. SMR in the two trials were positively related to the specific growth rate (SGR) in this fish species during the course of experiment. The present study suggests there were nonparallel changes in tendency and repeatability between the energy metabolism and personality behaviors of juvenile Chinese bream under artificial rearing conditions where environmental parameters were spatially and temporally predictable. Some correlations existed between the phenotypic traits and were substantially affected, to different extents, by environmental conditions. SMR of juvenile Chinese bream may predict their growth trajectory during their juvenile stage.
standard metabolic rate; maximum metabolic rate; personality; phenotypic variation;Parabramispekinensis
国家自然科学基金项目(31300341);重庆市自然科学基金项目(cstc2014jcyjA00018);重庆市教委科技项目(KJ130619);重庆师范大学青年人才拔尖培育计划项目(02030307-00027)资助;重庆市高等学校青年骨干教师资助计划项目(CQJW-02060301-1714)
2016- 03- 27; 网络出版日期:2017- 03- 02
10.5846/stxb201603270548
*通讯作者Corresponding author.E-mail: shijianfu9@hotmail.com
曾令清,付成,奚露,彭姜岚,付世建.鳊幼鱼能量代谢和个性行为的个体变异及表型关联.生态学报,2017,37(14):4807- 4816.
Zeng L Q, Fu C, Xi L, Peng J L, Fu S J.Phenotypic correlations and individual variation of energy metabolism and personality in juvenile Chinese bream (Parabramispekinensis).Acta Ecologica Sinica,2017,37(14):4807- 4816.

