棘胸蛙(Quasipaaspinosa)对重复急性冷暴露的生理应激与适应耐受
颉志刚,王永鹏,王 娜,郑荣泉,2
1 浙江师范大学化学与生命科学学院,浙江省野生动物生物技术与保护利用重点实验室,金华 3210042 浙江师范大学行知学院, 金华 321004
棘胸蛙(Quasipaaspinosa)对重复急性冷暴露的生理应激与适应耐受
颉志刚1,2,*,王永鹏1,王 娜1,郑荣泉1,2
1 浙江师范大学化学与生命科学学院,浙江省野生动物生物技术与保护利用重点实验室,金华 3210042 浙江师范大学行知学院, 金华 321004
为探讨棘胸蛙(Quasipaaspinosa)这一溪源性两栖类对环境温度极端变化做出的生理响应与适应机制,测定了该物种在反复遭受急性冷暴露(4 ℃, 12 h)过程中其非特异性免疫反应、氧化还原状态以及热休克蛋白70(Hsp70)mRNA 表达的变化,结果发现:棘胸蛙在初次冷暴露过程中外周血细胞吞噬活性(第4小时 和第 12小时;P<0.05)、脾巨噬细胞呼吸爆发强度(第4小时 和第12小时;P<0.05)以及胃溶菌酶活力受到显著抑制(第12小时;P<0.05);当蛙返回到 22 ℃ 环境 12 h 后3种免疫指标均恢复到初始和对照组水平(P>0.05)。经过连续 7 d 冷暴露后,除溶菌酶外,血细胞吞噬活性和脾巨噬细胞呼吸爆发强度均能恢复到初始和对照组水平(P>0.05)。另外,冷暴露增加了肝脏和肾脏内丙二醛(MDA)的含量,但肾脏内 MDA 含量升高的幅度要明显大于肝脏;肝脏 SOD 活力和 GSH 含量也表现出急性和适应性升高,而肾脏仅 SOD 活力有所升高,暗示在低温胁迫状态下棘胸蛙肝脏氧自由基清除能力要强于肾脏。HSP70 作为应激保护蛋白,当机体遭受冷暴露后肝脏 Hsp70 mRNA 表达量始终未呈现出应激性升高,反而受到显著抑制(P<0.05)。综上所述,棘胸蛙在经历多次急性冷胁迫后体内部分非特异性免疫功能以及肝脏氧化防御系统可以产生不同程度的适应性改变。
棘胸蛙;冷暴露;免疫;氧化防御;热休克蛋白70
气候异常可能是导致全球两栖动物种群衰退和物种灭绝的重要因素之一[1-2]。如非季节性极端低温天气的频繁出现或季节交替期出现的寒流都可能严重干扰两栖动物的生理内稳态[1,3],从而增加感染疾病的风险,最终可能成为导致种群数量下降的诱因[2,4]。两栖类特异性免疫进化并不完全,非特异性免疫在特异性免疫被调动前可快速地为机体提供免疫保护,尤其在应激状态下占有主导地位[5-6]。温度依赖性是两栖类免疫反应的主要特征[7- 9],低温一方面可以直接降低免疫细胞的活力并抑制溶菌酶等胞外酶的分泌和活性,另一方面可通过激活丘脑-垂体-肾上腺轴(Hypothalamic-pituitary-adrenal axis, HPA)引起糖皮质激素(Glucocorticoid, GC)分泌的增加[10-11],而 GC 可以抑制巨噬细胞对病原的吞噬与加工,阻碍淋巴母细胞转化,减少血液循环中淋巴细胞数量[12]。
在胁迫状态下氧自由基或活性氧(Reactive oxygen species, ROS)的大量积累可导致机体氧化损伤[13-14]。ROS 可改变包括免疫细胞在内的细胞膜上磷脂双分子层中饱和脂肪酸/不饱和脂肪酸比例,并破坏膜内蛋白的生物活性造成细胞变性、肿胀乃至死亡[14]。体内超氧化物歧化酶(SOD)等抗氧化酶类和谷胱甘肽(GSH)等非酶抗氧化物质可清除多余的 ROS,以维持机体的氧化-抗氧化的内稳态(Oxidant-antioxidant Homeostasis, OAH)[15]。
热休克蛋白(Heat shock protein, HSPs)是机体受到胁迫时表达的一类重要的保护性蛋白, 在调节免疫功能和抗感染方面发挥着重要作用[16-19]。氧化胁迫可以通过激活热休克转录因子(Heat Shock Transcription Factor, HSF)来增加 HSPs 的合成[20],而 HSPs 可以促使 SOD 等抗氧化物的合成和释放[21]。
棘胸蛙(Quasipaaspinosa)隶属于蛙科、棘蛙属,主要分布在我国南方和越南山区(海拔在500—1000m)的溪流生境,具有较高的科研价值和经济价值。在养殖实践中,该物种对环境温度和洁净度的要求非常苛刻,尤其在季节交替期比其他常见养殖蛙类更易患病。本研究的目的是了解这一溪源性蛙类在遭受低温胁迫后机体的免疫功能和氧化防御会做出如何响应,以及在遭受多次胁迫后是否会表现出适应耐受。这对探讨两栖动物环境适应策略及种群波动机制具有重要的参考价值。
1 材料与方法
1.1 动物与驯化
棘胸蛙于 2010 年 10 月 12 日采自浙江省开化县山区(118°01′—118°37′N,28°54′—29°30′E ),将采集的个体驯养于水族箱(90 cm×40 cm×40 cm,15 只/箱)内驯化两周,提供充足的水陆环境和遮蔽物。驯化期间控制水温(22±1)℃和光周期(12 L∶12 D),每日以黄粉虫(Tenebriomolitor)活体作为饵料投食1次,隔日用经曝气脱氯的自来水换水1/3。
1.2 低温胁迫处理与取样
选择 80 只蛙(体重(75.77±1.66) g,性别1∶1)作为实验动物。将蛙随机分为两组,38 只动物仍饲养于驯化环境((22±1) ℃,12—13 只蛙/箱)作为对照组;为保障样本量将 42 只动物用于冷暴露,将蛙随机置入低温恒温((4±0.5) ℃)培养箱(MIR- 253, SANYO, Japan)内,每台培养箱配有3个玻璃槽(30 cm×20 cm×15 cm,保持1 cm 水位,14 只蛙/槽,外罩尼龙防逃网),每天冷暴露 12 h 后,再将其转入驯化环境 12 h,并反复处理 7 d。在冷暴露当天的第 0、4、12、24小时及第7天 的第12小时和 24小时分别取6只动物,对照组同期取样。蛙经毁髓后断头取血(用EDTA- 2Na抗凝),解剖后在冰上操作取脾脏立即用于巨噬细胞呼吸爆发的测定,肝脏、肾脏和胃保存于 -80 ℃ 用于后续分析。
1.3 免疫学指标测定
1.3.1 外周血吞噬活性
采用荧光标记法测定全血吞噬能力,参考 Miliukiené 等[22]方法进行:在 100 μL 抗凝全血加入 50 μL 经荧光素 FITC 标记的酵母(Saccaromycescerevisiae)悬液(1×108个/mL),于 25 ℃ 孵育 60 min,利用荧光分光光度计(RF- 5301PC, SHIMADZU, Japan)测定荧光强度,吸收光波长 480 nm,发射光波长 520 nm。
1.3.2 脾巨噬细胞呼吸爆发
采用氮蓝四唑(Bitroblue tetrazolium, NBT)还原法测定脾脏巨噬细胞的呼吸爆发,参照 Couso 等[23]的方法。
1.3.3 胃溶菌酶活力
采用比浊法测定胃溶菌酶活力,以溶壁微球菌(Micrcoccuslysoleikticus)为底物,详见Shugar[24]建立的方法。
1.4 氧化还原状态指标测定
肝脏和肾脏的脂质过氧化产物丙二醛(Malonaldehyde, MDA)、GSH 含量以及 SOD 活力用试剂盒(南京建成生物技术研究所)测定。
1.5 肝脏 Hsp70 基因表达半定量分析
肝脏总 RNA 提取方法参照总 RNA 提取试剂盒说明书(宝生物工程有限公司),反转录合成第一链 cDNA (RT 试剂盒,宝生物工程有限公司)。根据 GeneBank 中黑线仓鼠(CricetulusBarabensis)、牛(Bostaurus)、非洲爪蟾(Xenopusleavis)、欧非肋突螈(Pleurodeleswaltl)、虹鳟(Oncorhynchusmykiss)、斜带石斑鱼(Epinepheluscoioides)、中国明对虾(Fenneropenaeuschinensis) HSP70 cDNA 序列设计简并引物(上游引物 5′-GCAMCYAAAGGAGTCGYAGT- 3′,下游引物 5′-TYTCGTGKATCTGAGMTTTG- 3′)进行片段克隆,根据测序获得的片段序列设计上游引物 5′-GACCTCGGCACTACCTACTC- 3′,下游引物 5′-GTCAAAGTCTTCTCCACCCA- 3′;根据非洲爪蟾、灰树蛙(Hylaversicolor)、日本树蛙(Buergeriajaponica)的 β-actin 序列设计上游引物 5′-TGGAGAAGATCTGGCATCAC- 3′,下游引物 5′-TCATGAGGTAGTCTGTCAGG- 3′,PCR 反应程序:95 ℃ 5 min;94 ℃ 30 s,56 ℃ 退火 30 s,72 ℃ 30 s,共 30 循环;72 ℃ 延伸 10 min。PCR 产物电泳并测定 HSP70 和 β-actin 积分光密度比值。
1.6 数理统计与分析
采用 SPSS 17.0 统计软件包进行数据统计分析。对免疫、抗氧化和 Hsp70mRNA 表达等相关指标进行 Kolmogorov-Smirnov 正态分布检验,符合正态分布进行单因素方差分析(One-Way ANOVA),组内差异利用最小差异法(Least Significant Difference, LSD)检验;同一取样期对照组和处理组间差异采用独立样本t检验(Independent-sample T-test)分析;数据以平均值±标准误(Mean±S E)表示,显著水平均为 0.05。
2 结果
2.1 免疫指标
冷暴露(4 h 和 12 h)显著抑制了棘胸蛙外周血细胞吞噬活性(P<0.05)(图1)和脾巨噬细胞呼吸爆发强度(P<0.05)(图1),而胃溶菌酶活力在冷暴露 12 h 后才出现显著下降(P<0.05),并明显低于对照组(P<0.05)(图1)。当返回到 22 ℃ 环境后 12 h,3种免疫指标均恢复到初始和对照组水平(P>0.05)。经过 7 d 的反复冷暴露,外周血细胞吞噬活性和脾巨噬细胞呼吸爆发强度均回升到了初始和对照组水平(P>0.05),但胃溶菌酶活力无法恢复到初始和对照组水平(P<0.05)。
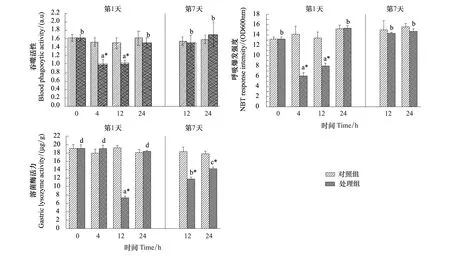
图1 冷暴露和恢复对棘胸蛙外周血吞噬活性、脾脏呼吸爆发强度及胃溶菌酶活力的影响Fig.1 The effect of cold exposure and recovery on peripheral blood phagocytic activity, splenic respiratory burst and gastric lysozyme activity in the giant spiny frog (Q. spinosa)数据以Mean±S E表示(n=5—6);* 表示同一时间对照组与处理组间差异显著(P<0.05);不同英文字母表示处理组内不同处理时间差异显著(P<0.05)
2.2 氧化还原状态指标
经过 4 h 的冷暴露后,棘胸蛙肝组织内 MDA 含量显著升高(P<0.05),但 12 h 后 MDA 含量则降至初始和对照组水平(P>0.05)(图2)。肝脏 SOD 活力和 GSH 含量随冷暴露时间的延长而逐渐升高(图2),并显著高于对照组(P<0.05);当转入 22 ℃ 环境后 12 h,SOD 活力仍保持较高活力,但 GSH 含量则恢复到初始和对照组水平(P>0.05)。经过反复冷暴露后的第7天,虽然肝脏 SOD 活力和 GSH 含量一直保持较高水平,但是在冷暴露第12小时 肝组织内 MDA 含量仍高于对照组(P<0.05),随后在 22 ℃ 环境下 12 h 后又恢复至初始和对照组水平(P>0.05)。
肾脏组织 MDA 含量升高的幅度要明显大于肝脏(图2),且处理组在第1天 和第7天 的各个时间点的 MDA 含量均显著高于初始和对照组水平(P<0.05)(图2)。与肝脏类似,肾脏 SOD 活力随冷暴露时间逐渐升高,当转入 22 ℃ 环境后 12 h 活力最高(P<0.05);经过反复冷暴露后,在低温下第12小时 略有升高(P<0.05),但返回到 22 ℃ 后 12 h 又降至初始和对照组水平(P>0.05)(图2)。但肾脏 GSH 含量在各个阶段与对照组间均无统计差异(P>0.05)(图2)。

图2 冷暴露和恢复对棘胸蛙组织MDA含量、SOD活力及GSH含量的影响Fig.2 The effect of cold exposure and recovery on tissue MDA content, SOD activity and GSH content of the giant spiny frog (Q. spinosa)
2.3 肝脏 Hsp70 mRNA 表达
肝脏 Hsp70 mRNA 表达量在低温下受到了显著抑制(P<0.05),转入 22 ℃ 环境下 12 h 后表达量虽有所增加(P>0.05),但未能恢复到初始水平(P<0.05)。经过反复冷暴露后, Hsp70 mRNA 表达依然受到显著抑制(P<0.05)(图3)。

图3 冷暴露和恢复对棘胸蛙肝脏Hsp70mRNA相对表达量的影响Fig.3 The effect of cold exposure and recovery on relative Hsp70 mRNA expression in liver of the giant spiny frog (Q. spinosa)
3 讨论
3.1 免疫功能
蛙类血液和免疫器官内含有大量的吞噬细胞。嗜中性粒细胞是外周血中最主要的吞噬性白细胞,而巨噬细胞是脾脏内最主要的吞噬细胞,该细胞会消耗大量氧气并产生 ROS 来消灭吞入胞内的病原生物,这一过程称为呼吸爆发,其反应强度可反映出机体的免疫状态。这些吞噬细胞的吞噬活性一方面表现出温度依赖性,另一方面在低温驯化下可能产生适应性改变。林蛙(Ranatemporaria)外周血吞噬活性随环境温度的下降而降低,当温度降至 5 ℃ 时白细胞的数量显著减少[25]。豹蛙(Ranapipiens)在 2 ℃ 低温下6h后外周血细胞吞噬活性和脾巨噬细胞呼吸爆发强度均显著下降[26]。虎纹蛙(Hoplobatrachusrugulosus)经急性低温(2 ℃, 6 h)处理后其外周血细胞吞噬活性和脾巨噬细胞呼吸爆发强度也均受到显著抑制[27]。上述结果与本研究相一致,而且棘胸蛙在 22 ℃ 环境下恢复 12 h 后外周血细胞吞噬活性和脾巨噬细胞呼吸爆发强均恢复到对照组水平,但胞外酶溶菌酶活力无法得到恢复,同样说明这些细胞免疫的温度依赖性。低温导致的免疫抑制可能是由于温度改变了免疫细胞膜的流动性和稳定性以及 ROS 的产生,从而影响到吞噬功能的发挥;还可能是因为低温通过激活 HPA 引起促肾上腺激素(ACTH)升高,进而促进 GC(如鱼类为皮质醇,而两栖类为皮质酮)的大量分泌[10-11],而 GC 是体内重要的免疫抑制剂。如将鲤鱼(Cyprinuscarpio)从 20 ℃ 迅速移至 12 ℃ 水环境 2 h 后血清皮质酮含量明显增加[5]。又如在金头鲷(Sparusaurata)白细胞的培养基中加入皮质醇可以明显抑制其呼吸爆发和吞噬活性[12]。然而,鱼类和两栖类等变温脊椎动物吞噬细胞的免疫功能在长期低温驯化条件下会得到恢复甚至强化。如林蛙在持续低温(5 ℃)下白细胞可以更迅速地达到活性峰值[25]。本研究发现棘胸蛙血液和脾脏内吞噬细胞经过连续 7 d 的反复冷暴露同样可以恢复到初始和对照组水平。类似地,法国火蝾螈(Salamandrasalamandra)和蟾蜍(Bufobufo)在经低温(5 ℃)驯化后其巨噬细胞的内吞作用要比暖驯化个体更加有效[28]。对鱼类的研究也有较多类似的报道[29-30]。值得注意的是,虹鳟[31]和红大马哈鱼(Oncorhynchusnerka)[33]在低温下加强了吞噬细胞活性,但免疫细胞的总量并未发生显著变化,只是头肾中具有免疫活性的细胞进入体液循环,从而增加了吞噬细胞的数量和总吞噬活力。然而,豹蛙经低温驯化后其血液内嗜中性粒细胞的比例升高,镜检发现这些细胞多为单叶核或双叶核,从而推测这些嗜中性粒细胞是在低温适应中新近形成的[26]。因此,变温脊椎动物吞噬细胞的低温适应机制可能存在较大的物种差异,值得深入研究。
3.2 氧化还原状态
非应激状态下棘胸蛙肝脏 MDA 平均含量要高于肾脏,但初次低温胁迫后肝脏 MDA 含量上升的幅度却小于肾脏,且在第12小时 降至初始和对照组水平,这说明肝脏比肾脏能更快地缓解氧化压力,这可能与肝脏 SOD 活力和 GSH 含量升高有关,而肾脏仅 SOD 活力有所升高。与此不同的是,虎纹蛙在低温(2 ℃)下处理 6 h 后,肝脏和肾脏 MDA 含量并未出现明显变化,SOD 活力仅在肝脏中有小幅升高,GSH 在肝脏和肾脏中浓度却同时出现了应激性升高[27]。在鱼类中,北海鳕(Zoarcesvivparus)在遭受急性低温胁迫后肝脏 SOD 活性没有明显变化,只有 GSH 含量显著增加[33]。这暗示 GSH 是非酶类抗氧化物质,其抗氧化作用在低温下比酶类抗氧化物可能更具优势或更为重要。此外,蛙经低温驯化后转入高温环境后,随着体温的回升,有氧呼吸代谢逐步加强同样可以导致氧化压力的增加。在本研究中,在 22 ℃ 环境下恢复 12 h 后肝脏可以有效减少 MDA 含量,但肾脏无法降低 MDA 含量,这可能与肾脏无法增加 SOD 活力和 GSH 含量有关。Bagnyukova 等[34]测定了经长期低温驯化(5 ℃, 2 个月)后的湖蛙(Ranaridibunda)在温度迅速回升过程中机体的氧化压力,发现温度回升(20 ℃, 1 h 和 24 h)虽然对肝脏 MDA 含量无显著影响,但可导致羰基蛋白(CP)(可反映蛋白氧化损伤程度)含量的增加,而对肾脏 MDA 和 CP 含量则全无显著影响,说明肾脏的抗氧化能力要强于肝脏,进一步分析发现湖蛙肝脏 SOD 和谷胱甘肽还原酶(GR)活力在第24小时 均显著升高,而肾脏过氧化氢酶(CAT)和 GR 活力显著升高。因此,酶类和非酶类抗氧化物在不同器官内对温度变化的反应存在物种差异,这直接反映了鱼类和两栖类等变温脊椎动物在应对温度极端变化过程中的氧化防御能力。
3.3 应激蛋白 HSP70
HSP70 是一类最保守、分布最广泛的热休克蛋白家族,作为应激保护性蛋白可提高细胞对氧化损伤的耐受程度,而且在降低炎症反应、协助抗原递呈等方面具有重要作用[35]。对双团棘胸蛙(Paayunnanensis)的研究表明,在低温 15 ℃ 处理 9 h 后肝脏 Hsp70 表达量显著增加[36]。然而,在本研究中棘胸蛙肝脏 Hsp70 mRNA 的表达在低温下不仅没有出现应激性升高,还受到了强烈抑制。这可能是因为 4 ℃ 低温已经超出了棘胸蛙体内 Hsp70 mRNA 表达可以响应的温度范围,所以推测 HSP70 在此低温下所发挥的应激保护和免疫调节作用的温度范围有限。
综上所述,棘胸蛙遭遇首次急性冷暴露后非特异性免疫功能受到明显的抑制,同时机体内的氧化水平明显增加,但经历反复应激后外周血细胞和脾脏吞噬功能产生了适应性升高,而且不同器官内抗氧化能力也存在不同程度的升高。然而,HSP70 作为应激性蛋白,该基因在整个冷暴露过程中不但始终没有出现高表达,而且被显著抑制,因此推测 HSP70 在此低温下无法起到相应的应激保护作用。
[1] Collins J P, Storfer A. Global amphibian declines: sorting the hypotheses. Diversity and Distributions, 2003, 9(2): 89- 98.
[2] Bacchetta R, Mantecca P, Andrioletti M, Vismara C, Vailati G. Axial-skeletal defects caused by Carbaryl inXenopuslaevisembryos. Science of the Total Environment, 2008, 392(1): 110- 118.
[3] Alford R A, Richards S J. Global amphibian declines: a problem in applied ecology. Annual review of Ecology and Systematics, 1999: 133- 165.
[4] Biek R, Funk W C, Maxell B A, et al. What is missing in amphibian decline research: insights from ecological sensitivity analysis. Conservation Biology, 2002, 16(3): 728- 734.
[5] Le Morvan C, Deschaux P, Troutaud D. Effects and mechanisms of environmental temperature on carp (Cyprinuscarpio) anti-DNP antibody response and non-specific cytotoxic cell activity: a kinetic study. Developmental and Comparative Immunology, 1996, 20(5): 331- 340.
[6] Voyles J, Rosenblum E B, Berger L. Interactions between Batrachochytrium dendrobatidis and its amphibian hosts: a review of pathogenesis and immunity. Microbes and Infection, 2011, 13(1): 25- 32.
[7] Hayman J R, Bly J E, Levine R P, Lobb C J. Complement deficiencies in channel catfish (Ictaluruspunctatus) associated with temperature and seasonal mortality. Fish & Shellfish Immunology, 1992, 2(3): 183- 192.
[8] Morgan A L, Thompson K D, Auchinachie N A, Migaud H. The effect of seasonality on normal haematological and innate immune parameters of rainbow troutOncorhynchusmykissL. Fish & Shellfish Immunology, 2008, 25(6): 791- 799.
[9] Wright R K, Cooper E L. Temperature effects on ectotherm immune responses.Developmental & Comparative Immunology, 1981, 5: 117- 122.
[10] Sapolsky R M, Romero L M, Munck A U. How do glucocorticoids influence stress responses? Integrating permissive, suppressive, stimulatory, and preparative actions. Endocrine Reviews, 2000, 21(1): 55- 89.
[11] Grutter A S, Pankhurst N W. The effects of capture, handling, confinement and ectoparasite load on plasma levels of cortisol, glucose and lactate in the coral reef fishHemigymnusmelapterus. Journal of Fish Biology, 2000, 57(2): 391- 401.
[12] Esteban M, Rodriguez A, Ayala A G, Meseguer J. Effects of high doses of cortisol on innate cellular immune response of seabream (SparusaurataL.). General and Comparative Endocrinology, 2004, 137(1): 89- 98.
[13] Joanisse D R, Storey K B. Oxidative damage and antioxidants inRanasylvatica, the freeze-tolerant wood frog. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 1996, 271(3): R545-R553.
[14] Halliwell B, Gutteridge J M C. Free radicals in biology and medicine. 2nd ed. Oxford: Clarendon Press, 1989.
[15] Baker P J, Costanzo J P, Lee Jr R E. Oxidative stress and antioxidant capacity of a terrestrially hibernating hatchling turtle. Journal of Comparative Physiology B, 2007, 177(8): 875- 883.
[16] Bond U, Schlesinger M J. Heat-shock proteins and development. Advances in Genetics, 1987, 24: 1- 29.
[17] Heikkila J J. Heat shock protein gene expression and function in amphibian model systems. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2010, 156(1): 19- 33.
[18] Miller D, McLennan A G. The heat shock response of the cryptobiotic brine shrimp Artemia-II. heat shock proteins. Journal of Thermal Biology, 1988, 13(3): 125- 134.
[19] Rupik W, Jasik K, Bembenek J, Widak W. The expression patterns of heat shock genes and proteins and their role during vertebrate′s development. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2011, 159(4): 349- 366.
[20] 回佳菡,唐咏. 热休克转录因子1调控热休克蛋白表达的研究进展. 现代生物医学进展,2006,02:84- 85+90.
[21] 程维杰,李秋玲,孙延鸣,王洪梅,李建斌,仲跻峰. 热休克蛋白70(HSP70)研究进展. 畜牧兽医杂志,2008,06:55- 57.
[23] Couso N, Castro R, Magarios B, Obach A, Lamas J. Effect of oral administration of glucans on the resistance of gilthead seabream to pasteurellosis. Aquaculture, 2003, 219(1/4): 99- 109.
[24] Shugar D. The measurement of lysozyme activity and the ultra-violet inactivation of lysozyme. Biochimica et Biophysica Acta, 1952, 8: 302- 309.
[25] Marnila P, Tiiska A, Lilius E M. Phagocyte activity in the frogRanatemporaria: whole blood chemiluminescence method and the effects of temperature and thermal acclimation. Comparative Biochemistry and Physiology Part A: Physiology, 1995, 111(4): 609- 614.
[26] Maniero G D, Carey C. Changes in selected aspects of immune function in the leopard frog,Ranapipiens, associated with exposure to cold. Journal of Comparative Physiology B, 1997, 167(4): 256- 263.
[27] 王娜, 邵晨, 颉志刚, 凌云, 程东海. 低温胁迫下虎纹蛙的生存力及免疫和抗氧化能力. 生态学报, 2012, 32(11): 3538- 3545.
[28] Pxytycz B, Józkowicz A. Differential effects of temperature on macrophages of ectothermic vertebrates. Journal of Leukocyte Biology, 1994, 56(6): 729- 731.
[29] Collazos M E, Barriga C, Ortega E. Enhanced granulocyte phagocytosis at low winter temperature and high summer temperature in the tench (TincatincaL.). Comparative Biochemistry and Physiology Part A: Physiology, 1994, 109(3): 643- 648.
[30] Chen W H, Sun L T, Tsai C L, Song Y L, Chang C F. Cold-stress induced the modulation of catecholamines, cortisol, immunoglobulin M, and leukocyte phagocytosis in tilapia. General and Comparative Endocrinology, 2002, 126(1): 90- 100.
[31] Hardie L J, Fletcher T C, Secombes C J. Effect of temperature on macrophage activation and the production of macrophage activating factor by rainbow trout (Oncorhynchusmykiss) leucocytes. Developmental & Comparative Immunology, 1994, 18(1): 57- 66.
[32] Alcorn S W, Murray A L, Pascho R J. Effects of rearing temperature on immune functions in sockeye salmon (Oncorhynchusnerka). Fish & Shellfish Immunology, 2002, 12(4): 303- 334.
[33] Heise K, Puntarulo S, Lucassen M, Pörtner H O, Abele D. Oxidative stress and HIF- 1 DNA binding during stressful cold exposure and recovery in the North Sea eelpout (Zoarcesviviparus). Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2006, 143(4): 494- 503.
[34] Bagnyukova T V, Storey K B, Lushchak V I. Induction of oxidative stress inRanaridibundaduring recovery from winter hibernation. Journal of Thermal Biology, 2003, 28(1): 21- 28.
[35] Moseley P L. Heat shock proteins and the inflammatory response. Annals of the New York Academy of Sciences, 1998, 856: 206- 213.
[36] 张晶晶, 朱静, 林钟婷. 丽江双团棘胸蛙热驯化中HSP70表达量的变化. 西南林学院学报, 2009, 29(4): 42- 46.
Stress response and adaptive tolerance of the giant spiny frog (Quasipaaspinosa) to repeated acute cold exposure
XIE Zhigang1,2,*, WANG Yongpeng1, WANG Na1, ZHENG Rongquan1,2
1ZhejiangProvincialkeyLaboratoryofWildlifeBiotechnologyandProtectiveUtilization,CollegeofChemistryandLifeSciences,ZhejiangNormalUniversity,Jinhua321004,China2XingzhiCollege,ZhejiangNormalUniversity,Jinhua321004,China
To explore physiological stress response and adaptive tolerance of a stream-dwelling anuran, the giant spiny frog (Quasipaaspinosa), to extreme changes in environmental temperature, we investigated how repeated acute cold (4℃) exposure affects non-special immune responses, redox state, and heat shock protein 70 (Hsp70) mRNA expression. Acute cold exposure inhibited peripheral blood phagocytic activity (after 4 h or 12 h,P<0.05), respiratory bursts of spleen macrophages (after 4 h or 12 h,P<0.05), and gastric lysozyme activity (after 12 h,P<0.05). All immune responses increased to initial and control levels (P>0.05) after the frogs were moved back to 22℃ for 12h. Both blood phagocytic activity and spleen respiratory bursts recovered to initial and control levels (P>0.05) after 7 days of cold exposure. Acute cold stress increased hepatic and renal lipid peroxidation product malondialdehyde (MDA) content, but the degree of increase in MDA in the kidney was obviously larger than that in the liver. Hepatic superoxide dismutase (SOD) activity and glutathione (GSH) content showed acute and adaptive increases (P<0.05), while only SOD activity increased in the kidney, which suggested that anti-oxidative defense was stronger in the liver than in the kidney in this frog. The expression level of Hsp70 mRNA in liver was not acutely increased, while it was significantly inhibited (P< 0.05). In conclusion, some non-special immune functions and the hepatic oxidative defense system inQ.spinosacan adapt, to varying extents, to repeated acute cold exposure.
Quasipaaspinosa; cold exposure; immunity; antioxidative defense; Hsp70
国家自然科学基金资助项目(30800129, 31270457)
2016- 03- 29; 网络出版日期:2017- 03- 02
10.5846/stxb201603290570
*通讯作者Corresponding author.E-mail: xiezhigang@zjnu.cn
颉志刚,王永鹏,王娜,郑荣泉.棘胸蛙(Quasipaaspinosa)对重复急性冷暴露的生理应激与适应耐受.生态学报,2017,37(14):4778- 4785.
Xie Z G, Wang Y P, Wang N, Zheng R Q.Stress response and adaptive tolerance of the giant spiny frog (Quasipaaspinosa) to repeated acute cold exposure.Acta Ecologica Sinica,2017,37(14):4778- 4785.

