miR-10a在胰腺癌侵袭转移中的作用
谢荣臻,曾祥福,邓 伟,刘晓平,章新华
·论 著·
miR-10a在胰腺癌侵袭转移中的作用
谢荣臻,曾祥福,邓 伟,刘晓平,章新华
目的 探讨microRNA-10a(miR-10a)在胰腺癌侵袭转移中的作用。 方法 选取2014年1月至2016年12月在赣南医学院第一附属医院切除的胰腺癌组织标本68例,同时选取癌旁组织作为对照,采用逆转录-聚合酶链反应(RT-PCR)检测组织标本miR-10a表达;同时选取胰腺癌细胞株Capan-1细胞,以脂质体转染法将miR-10a重组正、反义真核表达质粒载体转染Capan-1细胞,采用RT-PCR检测转染细胞miR-10a表达,Transwell和Matrigel试验观察转染细胞的迁移和侵袭能力,四甲基偶氮唑盐(MTT)法检测细胞增殖能力。 结果 胰腺癌组织miR-10a相对表达量为(0.213±0.024),明显高于癌旁组织(P<0.01);中低分化胰腺癌miR-10a相对表达量为(0.212±0.011),明显高于高分化胰腺癌(P<0.01);有淋巴结转移胰腺癌miR-10a相对表达量为(0.217±0.017),明显高于无淋巴结转移胰腺癌(P<0.05);TNM分期为Ⅲ~Ⅳ期胰腺癌miR-10a相对表达量为(0.230±0.015),明显高于Ⅰ~Ⅱ期胰腺癌(P<0.01)。转染48 h后,正义组miR-10a相对表达量为(0.021±0.010),明显高于反义组、空载组和空白对照组(P<0.05);反义组miR-10a相对表达量为(0.003±0.001),明显低于空载组和空白对照组(P<0.05)。正义组24 h和48 h 光密度(OD)值分别为(0.602±0.018)和(0.753±0.041),明显高于反义组、空载组和空白对照组(P<0.05);反义组24 h和48 h OD值分别为(0.451±0.023)和(0.591±0.038),明显低于空载组和空白对照组(P<0.05)。正义组迁移和侵袭细胞数分别为(85.22±12.10)个和(140.24±30.54)个,明显高于反义组、空载组和空白对照组(P<0.05);反义组迁移和侵袭细胞数分别为(12.52±3.22)个和(20.41±8.66)个,明显低于空载组和空白对照组(P<0.05)。 结论 miR-10a过表达可对胰腺癌有生长促进、增强侵袭和迁移的作用,值得进一步研究。
miR-10a;胰腺癌;侵袭;迁移;临床病理特征;转染
胰腺癌是一种常见的恶性肿瘤,也是目前最为致命的恶性肿瘤之一,患者的预后极差,但其具体发病机制目前尚不完全清楚[1-2]。目前临床上多采用手术切除和化疗的方式治疗胰腺癌患者,但效果并不明显,而造成患者预后较差的主要原因是胰腺癌细胞的高度侵袭转移特性[3-4]。胰腺癌侵袭转移的分子机制尚不完全清楚,而研究探讨胰腺癌的高度侵袭转移特性并寻找可抑制胰腺癌侵袭转移的特异性分子靶向治疗方法对于提高治疗的效果具有重要的意义。近年来研究发现[5-6],微小RNA(miRNA)可能在基因表达调控领域中起着超乎想象的重要作用,而多种miRNAs 在肿瘤的发生、发展和转移过程中均发挥着重要的作用。为了进一步探讨miR-10a在胰腺癌侵袭转移中的作用,本研究对胰腺癌组织标本和癌旁组织的miR-10a表达水平进行了检测分析,并观察分析了转染miR-10a重组正、反义真核表达质粒载体后对胰腺癌细胞迁移、侵袭、增殖能力的影响,旨在为临床上提供一定的理论依据。
1 材料与方法
1.1 组织标本 选取2014年1月至2016年12月在我院切除的胰腺癌组织标本68例,其中男42例,女26例;年龄40~71岁,平均年龄(61.01±5.67)岁。纳入标准:①均经病理学确诊;②患者临床病理资料保存完整;③术前未行放化疗等资料。排除标准:①合并有其他原发性肿瘤;②临床病理资料不完整。同时选取同一病例癌旁组织(距癌组织边缘>1.5 cm)作为对照。
1.2 胰腺癌细胞系 人胰腺癌细胞株Canpan-1购于中国科学院上海生命科学研究院细胞资源中心。
1.3 实验方法
1.3.1 仪器与试剂 Beckman Microfuge高速冷冻离心机(美国),PCR仪(Gene Amp PCR system2400,美国),分子定量成像系统(Gel Doc 1000UV BIO-RAD公司,美国),二氧化碳培养箱(Napco-5410,美国),倒置相差显微镜、摄像设备(Olympus IX70PM-30,日本)及图像分析仪;880型酶标仪(德国)。Trizol提取试剂盒、逆转录试剂盒、RT-PCR试剂盒均购自美国Epitomics公司;胎牛血清、RMPI1640完全培养基均购自美国sigma公司;正义、反义miRNA-10a质粒载体及空载均购自上海吉玛生物制药有限公司;脂质体(Lipofectamine)2000购自Invitrogen 公司。CCK-8 试剂盒购自碧云天试剂公司;侵袭(Transwell)小室购自美国coring 公司;四甲基偶氮唑盐(MTT)购自美国BioSharp公司。
1.3.2 细胞传代培养 Canpan-1细胞株采用含10%胎牛血清(FBS)的H-DMEM液体培养基,在5%CO2、37 ℃恒温培养箱中进行培养,待细胞密度达到约80%时进行传代培养, 取指数生长期细胞进行实验。
1.3.3 脂质体转染法 采用脂质体瞬时转染法进行转染,具体方法如下:将传代培养的Canpan-1细胞株接种于6孔培养板中,加入含5%胎牛血清的RMPI1640完全培养基进行培养,待贴壁细胞生长至60%~70%融合时利用pPG-CMV-EGFPmiR-10b 重组正、反义真核表达质粒载体进行转染,并分为4组:正义组(pPG-CMV-EGFPmiR-10b 重组正义真核表达质粒载体转染)、反义组(pPG-CMV-EGFPmiR-10b 重组反义真核表达质粒载体转染)、空载组(空载体pPG-CMV-EGFP 转染)和空白对照组(未转染),具体步骤严格按照说明书进行操作,转染结束后加培养基增殖培养48 h。
1.3.4 MTT检测 分别于转染48 h后取各组细胞悬液利用胰蛋白酶进行消化,加入含10%胎牛血清的RMPI1640完全培养基进行培养,并于培养0 h、24 h和48 h时取各组细胞悬液加入MTT (5 mg/mL)孵育4 h,随后加入二甲基亚砜(DMSO)进行溶解并沉淀,利用酶标仪在490 nm波长测定各孔的光密度(OD)值,观察各组细胞增殖情况,每组实验重复3次。
1.3.5 Transwell细胞侵袭及迁移检测 先以无血清培养基在37 ℃条件润湿Transwel小室2 h,将转染48 h的细胞用胰酶消化后计数,选取1×106个细胞以无血清的RPMI-1640培养液进行重悬并接种于上室,下室中仅加入10%的完全培养基,于37 ℃、5%CO2条件下培养48 h。取出滤膜后以10%多聚甲醛固定,苏木红染色后光镜下观察,计数穿膜细胞数,取其均值代表迁移力量值。
1.3.6 实时定量PCR检测(RT-PCR) 取各组转染后培养48 h细胞,利用Trizol提取试剂盒提取总RNA,利用逆转录试剂盒逆转录为DNA,在聚合酶的作用下进行扩增,引物如下:上游:ACATCATACCCTGTAGAACCGAA;下游:GATTGGATGTTCTCCACAGTCTC。扩增条件如下:95 ℃、5 min后,以95 ℃、15 s进行变性,60 ℃、60 s进行退火,72 ℃、5 min30 s进行延伸,此为1个循环,共进行40个循环,电泳后进行实时定量PCR测定,最终得出miR-10a的表达水平,具体检测步骤严格按照试剂盒说明书进行。
取胰腺癌组织标本和癌旁组织各100 mg,采用RT-PCR法定量检测miR-10a水平,方法同转染细胞的检测方法。

2 结 果
2.1 miR-10a在胰腺癌组织中的表达 胰腺癌组织miR-10a相对表达量为(0.213±0.024),明显高于癌旁组织(0.013±0.010),差异有统计学意义(P<0.01)。
2.2 miR-10a与胰腺癌临床病理特征关系 miR-10a相对表达量与胰腺癌病理分级、淋巴结转移和TNM分期有关,中低分化胰腺癌miR-10a相对表达量明显高于高分化胰腺癌(P<0.01),有淋巴结转移胰腺癌miR-10a相对表达量明显高于无淋巴结转移胰腺癌(P<0.05),TNM分期为Ⅲ~Ⅳ期胰腺癌miR-10a相对表达量明显高于Ⅰ~Ⅱ期胰腺癌(P<0.01)。见表1。
2.3 转染后miR-10a表达水平 转染48 h后,正义组miR-10a相对表达量明显高于反义组、空载组和空白对照组(P<0.05);反义组miR-10a相对表达量明显低于空载组和空白对照组(P<0.05)。见表2。
2.4 各组增殖情况 正义组24 h和48 h OD值明显高于反义组、空载组和空白对照组(P<0.05);反义组24 h和48 h OD值明显低于空载组和空白对照组(P<0.05)。见表3。
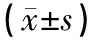

临床病理特征nmiR⁃10a相对表达量t值P值性别 男420 213±0 0130 0001 000 女260 213±0 011年龄 ≤60岁350 214±0 0180 4960 621 >60岁330 212±0 015肿瘤部位 头颈部490 213±0 0170 6630 509 体尾部190 210±0 016肿瘤大小 ≤5cm500 215±0 0190 9440 348 >5cm180 210±0 020病理分级 高分化370 203±0 014-2 9050 008 中低分化310 212±0 011淋巴结转移 有360 217±0 0172 1590 036 无320 209±0 013TNM分期 Ⅰ~Ⅱ400 201±0 016-7 5450 001 Ⅲ~Ⅳ280 230±0 015
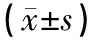

组别miR⁃10a相对表达量F值P值正义组0 021±0 010反义组0 003±0 001∗25 106<0 001空载组0 010±0 003∗#空白对照组0 009±0 001∗#与正义组比较,∗P<0 05;与反义组比较,#P<0 05
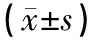

组别OD值0h24h48h正义组0 418±0 0180 602±0 018∗#△0 753±0 041∗#△反义组0 416±0 0130 451±0 023∗#0 591±0 038∗#空载组0 417±0 0170 537±0 0240 681±0 040空白对照组0 416±0 0120 536±0 0210 684±0 037F值2 10618 16620 173P值0 892<0 001<0 001与空白对照组比较,∗P<0 05;与空载组比较,#P<0 05;与反义组比较,△P<0 05
2.5 各组细胞迁移和侵袭比较 正义组迁移和侵袭细胞数明显高于反义组、空载组和空白对照组(P<0.05);反义组迁移和侵袭细胞数明显低于空载组和空白对照组(P<0.05)。见表4 和图1、图2。


组别迁移情况侵袭情况正义组85 22±12 10∗#△140 24±30 54∗#△反义组12 52±3 22∗#20 41±8 66∗#空载组45 56±9 8468 43±9 11空白对照组44 47±8 2370 23±10 41F值57 89460 136P值<0 05<0 05与空白对照组比较,∗P<0 05;与空载组比较,#P<0 05;与反义组比较,△P<0 05

a:空白对照组;b:空载组;c:反义组;d:正义组
图1 各组Transwell细胞迁移图
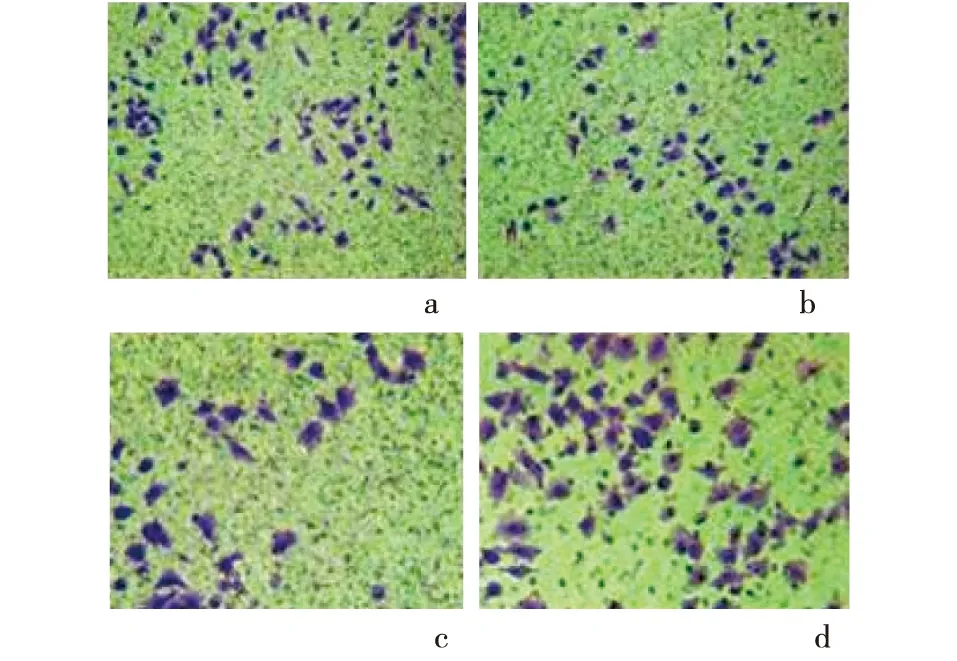
a:空白对照组;b:空载组;C:反义组;d:正义组
图2 各组Transwell细胞侵袭图
3 讨 论
胰腺癌是一种恶性程度很高、诊断和治疗都很困难的消化道恶性肿瘤,约90%为起源于腺管上皮的导管腺癌,其发病率和死亡率均较高,且近些年正在逐年上升,严重威胁着人类的生命健康[7-8]。胰腺癌的病因尚不完全清楚,其发生可能与吸烟、饮酒、高脂肪和高蛋白饮食、过量饮用咖啡、环境污染以及遗传因素有关,患者的症状多为腹痛、黄疸、消瘦、乏力、腹部包块等[9-10]。胰腺癌是预后最差的恶性肿瘤之一,其早期的确诊率不高,而手术的死亡率较高,治愈率非常低[11]。研究表明[12],胰腺癌患者预后较差的主要原因是其容易侵袭和转移,进而导致胰腺癌手术切除率低,复发率高,而研究探讨胰腺癌侵袭转移的机制并寻找控制胰腺癌侵袭转移的方法已成为目前研究的重点和难点。miRNA是一类重要的内源性单链非编码小RNA分子,可调控细胞生物的发育、增殖、分化、代谢、凋亡和应激等过程[13]。miRNA是生物体内原长度约为20~30个核苷酸的非编码小RNA,在进化上高度保守,通过与靶mRNA的互补配对而在转录后水平上对基因表达进行负调控,导致mRNA的降解和翻译抑制。也有越来越多的研究表明[14],miRNA与肿瘤的发生、发展等过程有着密切的关系,其中miRNA-10a 可能与肿瘤的侵袭和转移有关。已有研究表明[15],miR-10a与胃恶性肿瘤与胃恶性肿瘤转移有关,且能够触发乳腺癌细胞的侵袭转移,其机理与RhoC基因有关,但目前对于miR-10a在胰腺癌侵袭转移中作用的报道较少。为此,本研究检测分析了胰腺癌组织中miR-10a表达水平,并探讨分析了miR-10与胰腺癌细胞迁移、侵袭和增殖的关系。
3.1 miR-10a与胰腺癌发生和发展的关系分析 本研究通过RT-PCR定量检测胰腺癌组织和癌旁组织的miR-10a水平发现,胰腺癌组织的相对表达量明显高于癌旁组织;进一步分析发现,miR-10a相对表达量与胰腺癌病理分级、淋巴结转移和TNM分期有关,提示 miR-10a与胰腺癌的发生和发展有着密切的关系,且其表达水平与胰腺癌患者病情的严重程度有一定的关系,而miR-10a的检测可能能为胰腺癌的早期诊断提供一定的依据,但具体临床价值仍需作进一步的深入研究。
3.2 miR-10a与胰腺癌侵袭转移的关系分析 肿瘤的侵袭性生长和远处转移是导致肿瘤治疗效果不佳的主要原因之一,而过往的研究也表明,miR-10a表达量的增加与肝癌细胞系、乳腺癌细胞系、脑垂体瘤、神经胶质瘤、食管癌和鼻咽癌的侵袭和转移呈正相关。本研究以脂质体转染法将miR-10a重组正、反义真核表达质粒载体转染Capan-1细株发现,转染48 h后正义组miR-10a相对表达量明显高于反义组、空载组和空白对照组,而反义组miR-10a相对表达量明显低于空载组和空白对照组。通过MTT检测细胞增长率发现,正义组24 h和48 h OD值明显高于反义组、空载组和空白对照组,而反义组24 h和48 h OD值明显低于空载组和空白对照组,提示miR-10a高表达可促进肿瘤的增长,而下调miR-10a的表达可抑制肿瘤的增长。进一步进行侵袭实验发现,正义组迁移和侵袭细胞数明显高于反义组、空载组和空白对照组,而反义组迁移和侵袭细胞数明显低于空载组和空白对照组,提示 miR-10a与胰腺癌细胞的侵袭和迁移有着密切的关系,其高表达可促进细胞的侵袭和迁移,而通过下调miR-10a的表达可明显抑制胰腺癌细胞的侵袭和迁移。
本研究的创新之处在于探讨分析了miR-10a表达与胰腺癌发生、发展、侵袭和迁移的关系,发现高表达的miR-10a可促进胰腺癌细胞的增殖、侵袭和迁移,而下调miR-10a的表达可抑制肿瘤的增长、侵袭和迁移,这可能能为控制胰腺癌的侵袭和迁移并提高胰腺癌的治疗效果提供一条新的路径,但能否将miR-10a作为新的胰腺癌治疗靶点仍需作进一步的深入研究。
综上所述,miR-10a过表达可对胰腺癌有生长促进、增强侵袭和迁移的作用,值得进一步研究。
[1] Kleeff J, Korc M, Apte M,etal. Pancreatic cancer[J]. Nat Rev Dis Primers,2016,2(5):16022.doi: 10.1038/nrdp.2016.22.Curr Treat OPTION ON, 2016, 2(5):16022.
[2] Ueno H, Kosuge T, Matsuyama Y,etal. A randomised phase Ⅲ trial comparing gemcitabine with surgery-only in patients with resected pancreatic cancer: Japanese Study Group of Adjuvant Therapy for Pancreatic Cancer[J]. Br J Cancer, 2016, 54(6):96.
[3] 周志鹏, 谭向龙, 王维君,等. 胰头十二指肠切除术后替吉奥辅助化疗对老年胰腺癌患者预后及免疫功能影响分析[J]. 中国医学前沿杂志电子版, 2016, 8(6):172-175.
[4] 王思珍, 王新波, 李 民,等. 三维可视化指导胰十二指肠切除术治疗胰腺癌[J]. 医学研究生学报, 2017, 30(2):196-198.
[5] 闫 岩, 张春妮. 微小核糖核酸与肾细胞癌关系的研究进展[J]. 现代肿瘤医学, 2016,24(1):145-149.
[6] 兰 敏, 陈 艳, 王熙才. miR-370在肿瘤中的作用及其机制[J]. 中国肿瘤生物治疗杂志, 2016, 23(2):291-296.
[7] Melo SA, Luecke LB, Kahlert C,etal. Glypican-1 identifies cancer exosomes and detects early pancreatic cancer[J]. Nature, 2015, 523(7559):177-182.
[8] Costasilva B, Aiello NM, Ocean AJ,etal. Pancreatic cancer exosomes initiate pre-metastatic niche formation in the liver[J]. Nat Cell Biol, 2015, 17(6):816-826.
[9] 姜 新, 吕然然, 谢晓娜,等. 糖尿病与胰腺癌关系的研究进展[J]. 中国实验诊断学, 2016,20(2):338-339.
[10] 朱建伟, 熊 力, 马 望,等. 胰腺癌干细胞研究进展[J]. 中国普通外科杂志, 2015, 24(9):1304-1309.
[11] 林 芝,林秀蓉,陈 华. 晚期胰腺癌患者希望水平与负性情绪相关性研究[J]. 东南国防医药,2017,19(2):202-204.
[12] 刘 哲, 许元鸿, 龙 锦,等. FHL1在人胰腺癌族中的表达及其与胰腺癌的侵袭及转移的相关性研究[J]. 临床与病理杂志, 2015, 35(3):423-427.
[13] 张 婷,史 维. miRNA-101在肿瘤中的研究进展[J]. 肿瘤预防与治疗, 2016, 29(6):339-342.
[14] 何姝槿, 陈厚文, 熊丽霞. MicroRNA对EMT的调节作用及其与肿瘤侵袭的关系[J]. 中国生物化学与分子生物学报, 2016,32(11):1197-1205.
[15] 郭婧澜, 叶 婷. miRNA在泌尿系统肿瘤发病、诊断及治疗中的作用研究进展[J]. 山东医药,2016,56(35):108-111.
(本文编辑:叶华珍; 英文编辑:王建东)
The role of miR-10a in invasion and metastasis of pancreatic cancer
XIE Rong-zhen,ZENG Xiang-fu,DENG Wei,LIU Xiao-ping,ZHANG Xin-hua
(DepartmentofGeneralSurgery,theFirstAffiliatedHospitalofGannanMedicalUniversity,Ganzhou341000,Jiangxi,China)
Objective To investigate the role of miR-10a in invasion and metastasis of pancreatic cancer. Methods Selected 68 cases of pancreatic cancer tissue in our hospital from January 2014 to December 2016, the adjacent tissues were selected as control, MiR-10a expression in tissue specimen was detected by RT-PCR; selected pancreatic cancer cell line Capan-1 cell, used liposome transfection method, MiR-10a recombinant positive and antisense eukaryotic expression vector was transfected into Capan-1 cells, the expression of miR-10a in transfected cells was detected by RT-PCR, and the migration and invasion ability of transfected cells were observed by Transwell and Matrigel assay, the proliferation of cells was detected by MTT assay. Results The relative expression of miR-10a in pancreatic cancer tissues was (0.213±0.024), which was significantly higher than that in adjacent tissues (P<0.01); The relative expression of miR-10a in intermediate low differentiated pancreatic cancer was (0.212±0.011), which was significantly higher than that of high differentiated pancreatic cancer (P<0.01); The relative expression of miR-10a in lymph node metastasis of pancreatic cancer was (0.217±0.017), which was significantly higher than that without lymph node metastasis (P<0.05); The relative expression level of miR-10a in TNM stage III to IV pancreatic cancer was (0.230±0.015), which was significantly higher than that of stage I to II pancreatic cancer (P<0.01). After transfection of 48 h, the relative expression of miR-10a in positive group (0.021±0.010), was significantly higher than that of antisense group, empty vector group and blank control group (P<0.05); antisense miR-10a group relative expression was (0.003±0.001), significantly lower than the empty vector group and blank control group (P<0.05). Positive group 24 h and 48 h OD values were (0.602±0.018) and (0.753±0.041), were significantly higher than that of antisense group, empty vector group and blank control group (P<0.05); Antisense group 24 h and 48 h OD values were (0.451±0.023) and (0.591±0.038), and were significantly lower than that of empty vector group the blank control group (P<0.05). Positive group cell migration and invasion were (85.22±12.10) and (140.24±30.54), were significantly higher than that of antisense group, empty vector group and blank control group (P<0.05); antisense group cell migration and invasion were (12.52±3.22) and (20.41±8.66), were significantly higher than that of empty vector group and blank control group (P<0.05). Conclusion Overexpression of miR-10a can promote the growth and enhance the invasion and migration of pancreatic cancer, which is worthy of further study.
miR-10a; Pancreatic cancer; Invasion; Migration; Clinic opathological features; Transfection
赣州市指导性科技计划项目(GZ2015ZSF100)
341000赣州,赣南医学院第一附属医院普外二科
谢荣臻,曾祥福,邓 伟,等.miR-10a在胰腺癌侵袭转移中的作用[J].东南国防医药,2017,19(4):352-356.
R735.9
A
1672-271X(2017)04-0352-05
10.3969/j.issn.1672-271X.2017.04.005
2017-05-10;
2017-06-14)

