根据UGT1A4 142T>G基因多态性和丙戊酸血药浓度定量估算我国汉族癫痫儿童体内拉莫三嗪的血药浓度Δ
何艳玲,和 凡,莫小兰,李嘉丽,王雪丁,张 杰,陈 娟,温预关,尚德为,杨业春,侯连兵#(.南方医科大学南方医院药学部,广州 0;.广州市妇女儿童医疗中心药学部,广州 06;.中山大学临床药理研究所,广州 0080;.广东省中医院药学部,广州 00;.广州医科大学附属脑科医院药学部,广州070)
·精准医疗·
根据UGT1A4 142T>G基因多态性和丙戊酸血药浓度定量估算我国汉族癫痫儿童体内拉莫三嗪的血药浓度Δ
何艳玲1,2*,和 凡2,莫小兰2,李嘉丽3,王雪丁3,张 杰4,陈 娟3,温预关5,尚德为5,杨业春1,侯连兵1#(1.南方医科大学南方医院药学部,广州 510515;2.广州市妇女儿童医疗中心药学部,广州 510623;3.中山大学临床药理研究所,广州 510080;4.广东省中医院药学部,广州 510120;5.广州医科大学附属脑科医院药学部,广州510370)
目的:探讨尿苷二磷酸葡糖醛酸转移酶(UGT)1A4 142T>G基因多态性和丙戊酸(VPA)血药浓度对我国南方汉族癫痫儿童体内拉莫三嗪(LTG)血药浓度的影响,并建立定量估算LTG血药浓度的预测方程。方法:选取2010年1月-2016年9月于广州市妇女儿童医疗中心就诊的南方汉族癫痫患儿72例,均采用LTG+VPA联合治疗。采用液相色谱-串联质谱法和酶放大免疫分析法分别测定患儿体内LTG和VPA的血药浓度,采用限制性片段长度多态性聚合酶链反应法测定其UGT1A4 142T>G多态性,并考察患儿年龄、性别、VPA血药浓度、UGT1A4 142T>G多态性与LTG标准化血药浓度(CDR)的相关性,并采用多重线性回归分析建立LTG血药浓度的预测方程。结果:患儿年龄、VPA血药浓度与LTG CDR呈正相关(r分别为0.225、0.300,P<0.05);性别对LTG CDR的影响无统计学意义(P>0.05)。共检出UGT1A4 TT、TG、GG基因型各39、29、4例,各基因型频率均符合Hardy-Weinberg平衡(P>0.05);TT基因型患儿LTG CDR显著低于TG、GG基因型,差异均有统计学意义(P<0.05)。多重线性回归分析结果显示,患儿LTG剂量(x1)、体质量(x2)、VPA血药浓度(x3)、UGT1A4 142T>G多态性(x4)与LTG血药浓度有关(P<0.05);以LTG血药浓度为因变量(c),上述因素为自变量,得回归方程为c=0.794+0.032x1-0.057x2+0.010x3+0.532x4(R2=0.616,P<0.05;其中,UGT1A4 TT基因型为0,TG、GG基因型为1),且LTG预测血药浓度和实测血药浓度的相关性良好(r=0.785,P=0.001)。结论:癫痫患儿的LTG剂量、体质量、VPA血药浓度、UGT1A4 142T>G多态性可能与LTG血药浓度有关;本研究建立的预测方程可为我国南方汉族癫痫患儿的精准用药提供参考。
拉莫三嗪;丙戊酸;UGT1A4 142T>G;基因多态性;南方;汉族;儿童癫痫
在我国,每年儿童癫痫(不含热性惊厥)的发病率为151/10万,患病率为3.45‰,婴幼儿期是癫痫发病的第一个高峰期,目前70%~80%的患儿未接受正规的诊断与治疗[1-2]。拉莫三嗪(Lamotrigine,LTG)因其不影响其他联用抗癫痫药的药动学过程,且疗效肯定、安全性高,成为儿童癫痫联合用药的首选[3]。但LTG具有明显的药动学、药效学个体差异,且个体间LTG血药浓度可能相差20多倍,导致给药剂量难以把握[4]。目前,临床上常通过观察疗效、毒性反应,并结合治疗药物监测(Therapeutic drug monitoring,TDM)来调整LTG的给药剂量。但TDM的缺点是明显滞后,患儿经过长期的TDM辅助剂量调整,未必能获得良好的治疗效果,反而可能会出现病情加重,甚至致残、致死。因此,需要寻找更具有前瞻性和预测性的方法来优化给药剂量。
目前,在对LTG血药浓度的非遗传影响因素研究中发现,联合用药对LTG血药浓度的影响是最为一致的[3-5]。联合使用丙戊酸(Valproic acid,VPA)可升高LTG的血药浓度[6],但这种作用是否存在浓度或剂量依赖性目前尚无统一结论,亟待进一步研究。当前,药物代谢酶相关的基因多态性已成为解释药动学等个体差异至关重要的因素。LTG主要经尿苷二磷酸葡糖醛酸转移酶(Uridine diphosphate glucuronosyl transferase,UGT)1A4进行Ⅱ相代谢,水解为N-葡萄糖醛酸化合物[7]。UGT1A4 142T>G是编码该酶最重要的基因,也是目前临床研究最多的基因之一,但该位点基因多态性对LTG血药浓度的影响尚无一致结论[7-8],且在我国癫痫患儿人群中也缺乏定量预估LTG血药浓度的相关报道。因此,本文以使用LTG+VPA联合治疗的儿童癫痫患者为研究对象,探讨非遗传因素(联合用药、年龄、体质量、性别等)和遗传因素(UGT1A4 142T>G多态性)对LTG血药浓度的影响,并建立基于上述两种因素的血药浓度预测方程,为联用VPA和LTG的癫痫患儿的个体化治疗提供参考。
1 资料与方法
1.1 研究对象
选取2010年1月-2016年9月于广州市妇女儿童医疗中心神经内科就诊的南方汉族癫痫患儿。本研究经医院医学伦理委员会审核通过,患儿及其家属或监护人均知情同意并签署知情同意书。
1.1.1 纳入标准 (1)根据《诸福棠实用儿科学》[9]中癫痫的发作分类及癫痫和癫痫综合征分类标准确诊为癫痫;(2)年龄0~18岁;(3)头颅影像未见颅内占位性病变、血管畸形或其他进行性病变;(5)肝肾功能正常;(6)可接受常规的血药浓度监测;(7)有完整的病历资料。
1.1.2 排除标准 (1)初治不规范者;(2)慢性腹泻、肠道炎性疾病史、完全性或不完全性肠梗阻者;(3)其他重要疾病:如不稳定的心脏疾病,进入研究前6个月之内的高血压、糖尿病、肝炎、癌症,不能控制的严重感染(包括肺结核),活动性的弥散性血管内凝血;(4)观察期间输血的患者;(5)过去6个月服用乙酰唑胺等碳酸酐酶抑制剂、维生素C,以及长期服用抗酸剂或钙剂,或可能导致肾结石的药物者;(6)依从性差,导致治疗中断或终止者;(7)不能按时服药、随诊和正确填写资料者。
1.2 治疗方法
所有患儿均按医嘱规律服用拉莫三嗪片(商品名:利必通,英国The Wellcome Foundation Limitied,注册证号:H20140478,规格:50 mg/片)+丙戊酸钠缓释片[商品名:德巴金,赛诺菲(杭州)制药有限公司,批准文号:国药准字H20010595,规格:0.5 g(以丙戊酸钠计)]。所有患儿服用LTG和VPA的起始剂量分别为0.15 mg/(kg·d)和10~15 mg/(kg·d),并根据血药浓度和病情调整给药剂量;给药频次分别为每日1次和每日2次。服药至少1个月后采集血样和临床数据。
1.3 血药浓度检测及基因型分析
所有患儿均连续服用LTG同一剂量1个月以上(LTG血药浓度已达稳态),于末次给药前采集外周静脉血2.0 mL置于乙二胺四乙酸(EDTA)抗凝管中。采用液相色谱-串联质谱(LC-MS/MS)法和酶放大免疫分析法分别测定患儿体内LTG和VPA的浓度[10-11]。LTG血药浓度测定结果用标准化血药浓度(CDR)表示。
采用限制性片段长度多态性聚合酶链反应(Poly-merase chain reaction-restriction fragment length polymorphism,PCR-RFLP)法测定其基因型[12]。PCR上、下游引物分别为:5′-GTTGGGCCCATAACGAAAGGCAGTT-3′、5′-GCTCCACACAACACCTATGAAG-3′。PCR反应体系包括DNA模板2.5 μL、Ex TaqTM0.2 μL(5 U/μL)、10×Ex TaqTMBuffer 2.5 μL、dNTPs 2 μL(0.25 mmol/L)、上游引物1 μL(10 μmol/L)、下游引物1 μL(10 μmol/ L),加纯净水至25 μL。PCR反应条件为95℃预变性7 min,以下步骤进行36个循环:95℃变性30 s,62.5℃退火30 s,72℃延伸45 s,最后72℃再延伸7 min。PCR产物大小为576 bp。将PCR产物进行酶切,酶切反应体系包括内切酶StuⅠ酶1 μL、10×StuBuffer 2 μL、PCR产物10 μL,加纯净水至20 μL。于37℃水浴中放置2 h进行酶切。将酶切产物进行电泳分析,并选取部分PCR产物至上海美吉生物医药科技有限公司广州分公司进行测序验证。
1.4 数据处理与统计分析
采用Excel 2010软件录入数据,应用SPSS 21.0软件对数据进行统计分析,采用Graghpad Prism 5绘制相关图形。采用χ2检验分析患儿基因型频率是否符合Hardy-Weinberg平衡。采用单样本 Kolmogorov-Smirnov检验对数据进行正态性验证,若数据服从正态分布,以±s表示,采用t检验;若不服从正态分布,则以中位数(P25,P75)表示,采用非参数检验方法(即两组间比较采用Mann-Whitney U检验;多组间比较采用Krusacal-Wallis H检验)。血药浓度预测方程的建立采用多重线性回归分析。实测血药浓度与预测血药浓度间的相关性采用Spearman或Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 患儿的一般资料
本研究共纳入患儿72例,其中男性48例、女性24例,年龄8.7(2,14)岁,平均体质量(28.8±10.8)kg;LTG维持剂量为1.69(1.33,2.48)mg/(kg·d),LTG血药浓度为1.99(1.56,2.77)μg/mL,LTG的CDR为1.14(0.90,1.36)μg·kg/(mL·mg),VAP血药浓度为66.9(57.3,77.0)μg/mL。
2.2 非遗传因素对LTG血药浓度的影响
患儿性别对LTG CDR的影响无统计学意义(P>0.05)。年龄与LTG CDR呈正相关(r=0.225,P=0.002),即低龄患儿的CDR低于高龄患儿,且随着年龄的增长,LTG的CDR亦逐渐升高,详见图1。
患儿体内VPA血药浓度与LTG CDR呈正相关(r=0.300,P=0.001),即随着VPA血药浓度的增高,LTG的CDR亦逐渐升高,详见图2。
2.3 基因型对癫痫患儿LTG血药浓度的影响
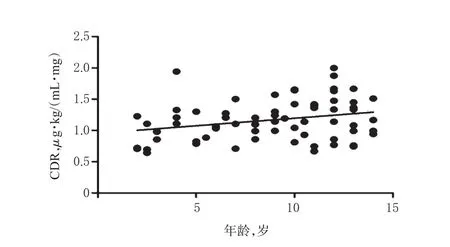
图1 年龄与LTG CDR的相关性Fig 1 Correlation between age and CDR of LTG

图2 VPA血药浓度与LTG CDR的相关性Fig 2 Correlation between blood concentration of VPA and CDR of LTG
共检出UGT1A4 TT(酶切片段大小为324、252 bp)、TG(酶切片段大小为324、252、576 bp)、GG(酶切片段大小为576 bp)基因型各39、29、4例,各基因型频率均符合Hardy-Weinberg平衡(P>0.05)。各基因型患儿年龄、性别等一般资料比较,差异均无统计学意义(P>0.05)。
本研究考察了UGT1A4 142T>G 3种基因型对LTG CDR的影响。结果显示,UGT1A4 TT、TG、GG基因型患者LTG CDR比较,差异有统计学意义(P<0.05)。其中,野生纯合子(TT基因型)携带者的CDR显著低于突变杂合子(TG基因型)和突变纯合子(GG基因型)携带者,差异均有统计学意义(P<0.05);TT基因型患者的CDR显著低于TG+GG基因型患者,差异有统计学意义(P<0.05),详见图3、图4。

图3 UGT1A4 142T>G基因型与LTG CDR的相关性Fig 3 Correlation between UGT1A4 142T>G genotype and CDR of LTG
2.4 LTG血药浓度的预测方程
对72例癫痫患儿的LTG剂量、体质量、UGT1A4 142T>G多态性、VPA血药浓度等因素进行多重线性回归,考察其对LTG血药浓度的影响。结果显示,患儿LTG剂量、体质量、UGT1A4 142T>G多态性、VPA血药浓度与LTG血药浓度相关(P<0.05),详见表1。

图4 UGT1A4 TT、TG+GG基因型与LTG CDR的相关性Fig 4 Correlation between UGT1A4 TT,TG+GG and CDR of LTG
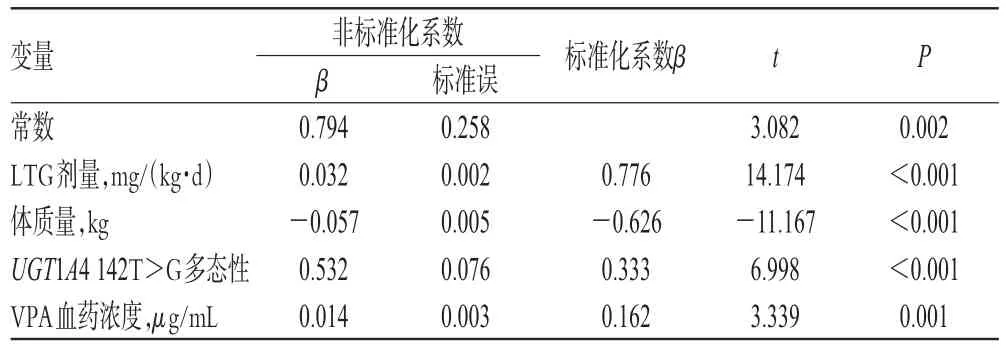
表1 LTG血药浓度相关因素的多重线性回归分析Tab 1 Multiple linear regression analysis for related factors of blood concentration of LTG
由表1可见,上述因素可解释LTG血药浓度个体差异的 61.6%(R2=0.616,P<0.05)。其中,UGT1A4 142T>G多态性能够解释53.2%的血药浓度差异。以LTG血药浓度(c)为因变量,LTG剂量(x1)、体质量(x2)、VPA血药浓度(x3)、基因多态性(x4)为自变量,得回归方程为:c=0.794+0.032x1-0.057x2+0.010x3+0.532x4(其中,UGT1A4 142T>G的3个基因型:TT基因型为0,TG和GG基因型为1)。
采用上述方程对72例患儿体内TLG血药浓度进行预测,如某患儿的日剂量为54 mg/(kg·d),体质量为20 kg,VPA血药浓度为52.7 μg/mL,UGT1A4 142T>G基因型为TG型(x4=1),得该患儿的预测血药浓度为2.333 μg/mL,而其实测血药浓度为2.524 μg/mL。本研究对所有患儿的预测血药浓度与实测血药浓度进行相关性分析,结果显示,两者相关性良好(r=0.785,P=0.001),提示该预测方程可用于患儿的个体化给药,详见图5。
3 讨论
3.1 非遗传因素对LTG血药浓度的影响
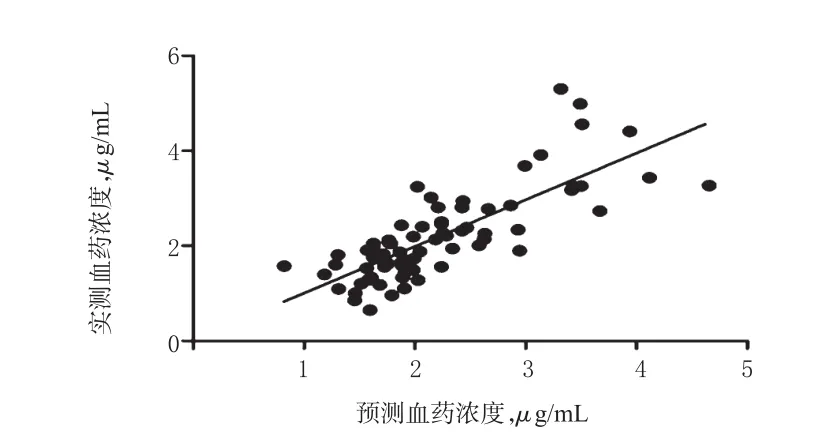
图5 LTG预测血药浓度与实测血药浓度的相关性Fig 5 Correlation between predicted blood concentration and measured blood concentration of LTG
本研究发现,患儿年龄越小,LTG血药浓度越低。一般而言,相比于成年患者,大多数抗癫痫药的清除率在儿童和少年群体中会出现上升,而在老年群体中会出现下降,这被认为是由与年龄相关的肾脏清除率和肝脏相关肝药酶代谢能力改变及血流量分布改变所致[13]。本研究还发现,VPA的血药浓度对LTG的CDR也有显著的影响,VPA血药浓度越高,LTG的CDR也越高。VPA是酶抑制剂,可通过抑制UGT酶活性,从而减少LTG的代谢,提高LTG的血药浓度[6]。此外,笔者还发现,LTG血药浓度与VPA血药浓度呈正相关。但目前VPA和LTG间相互作用是否有浓度或剂量依赖性还无一致结论。Weintraub D等[14]基于大样本量人群的研究发现,LTG的清除率与VPA的剂量和浓度存在显著相关性,并且预测了VPA和LTG相关性:LTG表观清除率(Clearance,CL)=40.47-0.384[log(VPA剂量)]。Kanner AM等[15]报道了LTG的清除率和VPA的剂量或浓度之间无相关性,这可能由于该研究的临床实际用药使得VPA代谢拮抗LTG已经到达最大效应,且其样本量亦非常有限(n=28)。另外,Gidal BE等[16]研究了不同浓度VPA对LTG药动学参数的影响,结果表明,当VPA浓度超过20 mg/L(与给药剂量为250 mg/d对应)时,对LTG清除率的抑制达到最大限度;进一步增加VPA的剂量,这种抑制作用无显著变化;而当VPA血药浓度<5.5 mg/L时,对LTG清除率的影响则会明显降低。因此,临床应用LTG治疗癫痫时,应充分考虑联用其他抗癫痫药对LTG血药浓度的影响;尤其是联用酶抑制剂如VPA时,应特别注意LTG剂量的增减、使用时机和疗程等因素。
3.2 遗传因素对LTG血药浓度的影响
影响LTG药物浓度的多种遗传因素中,目前UGT药物代谢酶的研究较为多见。UGT1A4已被证实是LTG的主要代谢酶[6]。目前,已有一系列的UGT1A4单核苷酸基因多态性(SNPs)被发现,且研究较多集中于UGT1A4外显子上的142T>G位点。当前这个SNPs对UGT1A4功能活性作用的研究尚无定论,认为其起到上调还是下调UGT1A4酶活性取决于底物的类型[17]。Mori A等[18]的研究认为,克隆表达的UGT1A4 142T>G突变型较野生型对氯氮平、丙咪嗪、赛庚啶有更强的清除率。Zhou J等[17]的研究证实,UGT1A4这个SNPs对酶活性的影响趋势(正负)取决于底物类型;同时认为,对于LTG来说,142T>G突变型将降低UGT1A4的酶活性,可减弱LTG的葡糖醛酸化代谢作用,这说明突变型理论上应有较高的血药浓度。
本研究结果显示,UGT1A4 TG和GG基因型患儿的LTG血药浓度高于UGT1A4 TT基因型患儿,这与上述功能学研究结果一致[17-18]。但是,Gulcebi MI等[7]对联用VPA的土耳其成人癫痫患者的临床研究却发现,相对于野生型患者,突变型患者体内LTG的血药浓度要低52%。最近,Liu L等[8]对我国北方癫痫患儿的研究显示,单用LTG时,未发现UGT1A4 142T>G多态性与LTG血药浓度有关,但联用VPA时,突变型患者LTG血药浓度高于野生型,与本研究结果相似。但也有研究显示,不管是LTG单用还是联用VPA,UGT1A4 142T>G基因型均与LTG的血药浓度无关[19]。由此可见,目前UGT1A4 142T>G基因型与LTG血药浓度的相关性研究尚无一致结论。导致这些差异的原因可能包括:各研究的样本量大小不同、年龄不同、联合用药不同或合并有其他代谢酶多态性等,提示应进一步按照年龄、联合用药分层深入分析。
另外,本研究经过多重线性回归分析,建立了我国南方癫痫儿童人群LTG血药浓度的预测方程。该方程提示患儿UGT1A4 142T>G基因多态性、VPA血药浓度、日剂量、体质量对LTG血药浓度均有明显的影响。相对于野生型,UGT1A4 142T>G突变型对LTG浓度有正向影响,能够解释LTG浓度差异的53.2%;联合用药中,VPA血药浓度与LTG血药浓度相关,VPA可以增加0.010倍的LTG血药浓度变化;日剂量对LTG血药浓度也具有正向影响,提示给药剂量大,则血药浓度高;而体质量对LTG血药浓度有负向影响,体质量越大,则对应的血药浓度越小。目前,已有研究建立了日本人群、高加索人群血药浓度的预测方程,这些预测方程虽然纳入了某些遗传和非遗传因素,但并未考虑联合用药的影响,尤其是未考虑联用药物的剂量或血药浓度的影响,而有些文献则未将UGT1A4 142T>G这个重要的SNPs纳入预测方程中[8,20]。本研究首次针对我国南方癫痫儿童人群建立了纳入联合用药和UGT1A4 142T>G多态性的血药浓度预测方程,且经该方程预测的血药浓度与实测血药浓度间也具有良好的相关性,可用于临床实际,指导我国南方癫痫患儿的个体化用药。
综上所述,VPA血药浓度与LTG血药浓度呈正相关,即VPA血药浓度越高,LTG血药浓度亦越高;UGT1A4野生型患儿体内LTG的血药浓度要低于突变杂合子、突变纯合子携带者。同时,本研究首次在我国南方汉族癫痫患儿中建立了基于UGT1A4 142T>G多态性和VPA血药浓度影响的LTG血药浓度预测方程,可为癫痫患儿的个体化用药提供精准的定量依据。但在后续研究中,本课题组将扩大样本量,针对LTG整个转运代谢通路上多种基因多态性展开研究。
[1] 秦炯.小儿癫痫的药物治疗原则[J].中国处方药,2006(7):44-46.
[2] 和凡,何艳玲.拉莫三嗪药代动力学及儿科临床应用的进展[J].儿科药学杂志,2010,16(4):55-57.
[3] 赵明明,孙亚欣,陈雨卉,等.拉莫三嗪的药代动力学研究进展[J].广东药学院学报,2012,28(5):578-583.
[4] Pellock JM.The clinical efficacy of lamotrigine as an antiepileptic drug[J].Neurology,1994,44(11 Suppl 8):S29-S35.
[5] Yamamoto Y,Inoue Y,Matsuda K,et al.Influence of concomitant antiepileptic drugs on plasma lamotrigine concentration in adult Japanese epilepsy patients[J].Biol Pharm Bull,2012,35(4):487-493.
[6] Rowland A,Elliot DJ,Williams JA,et al.In vitro characterization of lamotrigine N2-glucuronidation and the lamotrigine-valproic acid interaction[J].Drug Metab Dispos,2006,34(6):1055-1062.
[7] Gulcebi MI,Ozkaynakci A,Goren MZ,et al.The relationship between UGT1A4 polymorphism and serum concentration of lamotrigine in patients with epilepsy[J].Epilepsy Res,2011,95(1-2):1-8.
[8] Liu L,Zhao L,Wang Q,et al.Influence of valproic acid concentration and polymorphism of UGT1A4*3,UGT2B7-161C>T and UGT2B7*2 on serum concentration of lamotrigine in Chinese epileptic children[J].Eur J Clin Pharmacol,2015,71(11):1341-1347.
[9] 胡亚美,江载芳.诸福棠实用儿科学[M].7版.北京:人民卫生出版社,2005:1850-1858.
[10] 和凡,温预关,杨彤,等.LC-MS/MS法测定癫痫患儿血浆中拉莫三嗪的浓度[J].今日药学,2011,21(3):154-157.
[11]时海浪,王海东,宋兴发.LC-MS/MS法和EMIT法测定人血清中丙戊酸浓度的对比研究[J].中国药房,2017,28(8):1049-1052.
[12] 周亚芳,王雪丁,周列民,等.UGT1A4基因多态性的种族差异及对拉莫三嗪血药浓度的影响[J].中国临床药理学杂志,2015,31(6):439-442.
[13] Perucca E.Pharmacokinetic variability of new antiepileptic drugs at different ages[J].Ther Drug Monit,2005,27(6):714-717.
[14] Weintraub D,Buchsbaum R,Resor SR Jr,et al.Effect of antiepileptic drug comedication on lamotrigine clearance [J].Arch Neurol,2005,62(9):1432-1436.
[15] Kanner AM,Frey M.Adding valproate to lamotrigine:a study of their pharmacokinetic interaction[J].Neurology,2000,55(4):588-591.
[16] Gidal BE,Sheth R,Parnell J,et al.Evaluation of VPA dose and concentration effects on lamotrigine pharmacokinetics:implications for conversion to lamotrigine monotherapy[J].Epilepsy Res,2003,57(2/3):85-93.
[17] Zhou J,Argikar UA,Remmel RP.Functional analysis of UGT1A4(P24T)and UGT1A4(L48V)variant enzymes [J].Pharmacogenomics,2011,12(12):1671-1679.
[18] Mori A,Maruo Y,Iwai M,et al.UDP-glucuronosyltrans-ferase 1A4 polymorphisms in a Japanese population and kinetics of clozapine glucuronidation[J].Drug Metab Dispos,2005,33(5):672-675.
[19] Wang Q,Liang M,Dong Y,et al.Effects of UGT1A4 genetic polymorphisms on serum lamotrigine concentrations in Chinese children with epilepsy[J].Drug Metab Pharmacokinet,2015,30(3):209-213.
[20] Inoue K,Yamamoto Y,Suzuki E,et al.Factors that influence the pharmacokinetics of lamotrigine in Japanese patients with epilepsy[J].Eur J Clin Pharmacol,2016,72(5):555-562.
Quantitative Estimation of Blood Concentration of Lamotrigine in Chinese Han Pediatric Patients with Epilepsy Based on UGT1A4 142T>G Polymorphism and Blood Concentration of Valproic Acid
HE Yanling1,2,HE Fan2,MO Xiaolan2,LI Jiali3,WANG Xueding3,ZHANG Jie4,CHEN Juan3,WEN Yuguan5,SHANG Dewei5,YANG Yechun1,HOU Lianbing1(1.Dept.of Pharmacy,Nanfang Hospital,Southern Medical University,Guangzhou 510515,China;2.Dept.of Pharmacy,Guangzhou Women and Children’s Medical Center,Guangzhou 510623,China;3.Institute of Clinical Pharmacology,Sun Yat-sen University,Guangzhou 510080,China;4.Dept.of Pharmacy,Guangdong Provincial Hospital of TCM,Guangzhou 510120,China;5. Dept.of Pharmacy,the Affiliated Brain Hospital of Guangzhou Medical University,Guangzhou 510370,China)
OBJECTIVE:To investigate the effects of UGT1A4 142T>G polymorphism and blood concentration of valproic acid(VPA)on blood concentration of lamotrigine(LTG)in southern Chinese Han children with epilepsy,and to establish the prediction equation for quantitatively estimating blood concentration of LTG.METHODS:A total of 72 southern Chinese Han children with epilepsy selected from Guangzhou Women and Children’s Medical Center during Jan.2010-Sept.2016 were given LTG+VPA. LC-MS/MS and enzyme amplified immunoassay were adopted to determine the blood concentration of LTG and VPA.RFLP-PCR was adopted to determine UGT1A4 142T>G polymorphism.The relationships of age,gender,blood concentration of VPA,UGT1A4 142T>G polymorphism and LTG concentration-to-dose-ratio(CDR)were also investigate.The prediction equation for blood concentration of LTG was established by multiple linear regression analysis.RESULTS:Age and blood concentration of VPA were positively related to CDR of LTG(r=0.225,0.300,P<0.05);there was no statistical significance in the influence of gender on CDR of LTG(P>0.05).UGT1A4 TT,TG and GG genotypes were detected in 39,29,and 4 cases respectively;the frequencies of each genotype were in line with the Hardy-Weinberg balance(P>0.05).CDR of LTG of TT genotype was significantly lower than those of TG and GG genotype,with statistical significance(P<0.05).Results of multiple linear regression analysis showed that the dose of LTG(x1),body weight(x2),blood concentration of VPA(x3)and UGT1A4 142T>G polymorphism(x4)were all related to blood concentration of LTG(P<0.05).Using blood concentration of LTG(c)as dependent variable,above factors as independent variable,the regression equation was c=0.794+0.032x1-0.057x2+0.010x3+0.532x4(R2=0.616,P<0.05;UGT1A4 TT genotype was equal to 0,TG and GG genotype was equal to 1).There was a strong positive correlation between predicted blood concentration and measured ones(r=0.785,P=0.001).CONCLUSIONS:The dose of LTG,body weight,blood concentration of VPA and UGT1A4 142T>G polymorphism may associated with blood concentration of LTG.Established prediction equation can provide reference for precise medication in southern Chinese Han children with epilepsy.
Lamotrigine;Valproic acid;UGT1A4 142T>G;Gene polymorphisms;Southern;Han population;Pediatric epilepsy
R968
A
1001-0408(2017)20-2737-06
2017-01-20
2017-06-07)
(编辑:张元媛)
广东省科技计划项目(No.2009B060700016)
*主任药师。研究方向:药理学。电话:020-38076348。E-mail:gdheyanling@126.com
#通信作者:主任药师。研究方向:新药研发。电话:020-61642175。E-mail:hlianbing@163.com
DOI10.6039/j.issn.1001-0408.2017.20.01

