AS1411介导STAT3反义寡核苷酸靶向抗肿瘤的作用
刘宝修 黄建胜 朱乃硕
(复旦大学生命科学学院分子感染与免疫实验室 上海 200438)
AS1411介导STAT3反义寡核苷酸靶向抗肿瘤的作用
刘宝修 黄建胜 朱乃硕△
(复旦大学生命科学学院分子感染与免疫实验室 上海 200438)
目的 研究核仁素核酸适配体(AS1411)介导信号转导与转录激活因子3 (signal transduction and activator of transcription 3,STAT3)反义寡核苷酸(antisense oligonucleotide,ASO)靶向抗肿瘤的作用。方法 以RNA为耦联分子,连接靶向分子AS1411和效应分子ASO。以RNA Structure软件对预合成的不同RNA碱基耦联构建的嵌合体分子二级结构进行预测分析。以琼脂糖凝胶电泳检测嵌合体分子在血清及细胞裂解液中的稳定性。通过流式细胞术和荧光共聚焦实验检测AS1411介导STAT3 ASO进入肿瘤细胞的情况。通过CCK-8试剂盒检测STAT3 ASO对肿瘤细胞生长的抑制情况。通过RT-PCR和Western blot分析ASO对肿瘤生长相关基因表达的影响。结果 AS1411可介导STAT3 ASO高效进入肿瘤细胞,抑制C-myc、CyclinD1、Bcl-xl和PD-L1基因的转录和翻译,并能抑制Du145细胞的生长。结论 AS1411可介导STAT3 ASO靶向进入肿瘤细胞,从而发挥抗肿瘤的作用。
反义寡核苷酸; AS1411; 抗肿瘤; 靶向
肿瘤是威胁公共健康的一类严重的疾病。近年来,我国肿瘤的发病率及死亡率均逐年上升。免疫抗肿瘤疗法是近年来新兴的抗肿瘤治疗手段,主要包括以单克隆抗体介导的单抗药物疗法和嵌合抗原受体T细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy,CAR-T)[1-2],此类方法虽有良好的靶向性及较好的疗效,但由于应用范围及作用时效的限制,临床使用也存在一定的局限[3-4]。因此,研发新型低免疫原性小分子靶向药物依然十分必要。
核酸适配体是寡聚体单链DNA或RNA,可高亲和力、高特异性结合目标蛋白受体、多肽、胞内生物大分子[5]。核仁素核酸适配体AS1411为26个碱基的单链DNA,序列为5’-GGTGGTGGTGGT-TGTGGTGGTGGTGG-3’,可高度特异性结合细胞膜表面核仁素蛋白,亲和常数(Kd)为(8.37±0.75)nmol/L。由于核仁素在正常细胞表面不表达,仅在癌细胞或肿瘤相关内皮细胞表面表达,且在细胞表面与胞质之间穿梭[6-9],是非常理想的靶向药物结合点。研究表明,AS1411结合肿瘤细胞膜核仁素后,可诱导大胞饮作用(macropinocytosis)而快速进入细胞,并通过诱导EGFR、Akt、p38和Rac1活性进一步促进大胞饮作用,最终导致非凋亡性细胞死亡[10-11]。因此,AS1411作为靶向分子具有亲和力高、特异性强、相对分子质量小、无免疫原性、快速进入胞质、热稳定性强、易于合成和生产(成本低)等显著优势,是一个十分理想的靶向抗肿瘤药物载体。信号转导与转录激活因子(signal transduction and activator of transcription 3,STAT3)是一个与肿瘤高度相关的细胞内调控分子,可促进成纤维细胞在淋巴结中成瘤,被认为是一个癌基因[12-13]。它在多数癌细胞以及肿瘤微环境中浸润的T细胞中呈活性形式,而在非活化的正常细胞中呈失活状态,且不是分化细胞生存所必需的[14]。Kortylewski等[15]研究表明,通过诱导小鼠造血细胞STAT3基因敲除,可显著增强DC细胞、T细胞、NK细胞及中性粒细胞的抗肿瘤活性,对黑色素瘤及膀胱癌有明显的抑制作用。因此,STAT3被认为是一个很好的抗肿瘤靶标。本研究通过将AS1411和STAT3反义寡核苷酸(antisense oligonucleotide,ASO)耦联起来,研究该嵌合体分子在抗肿瘤中的应用,以期为肿瘤治疗提供一定的科学依据。
材 料 和 方 法
主要试剂及材料 RT-PCR引物及耦联分子由铂尚生物技术(上海)有限公司合成(表1,表2);Du145细胞购自ATCC (HTB-81TM);胎牛血清、Tripson、DMEM高糖培养基、无酶分离液购自美国Gibco公司;细胞级PBS购自加拿大Wisent公司;Trizol购自美国Invitrogen 公司;ReverTra Ace qPCR RT Master Mix和qPCR SYBR Master Mix购自日本TOYOBO公司;DAPI购自上海碧云天生物技术有限公司;氯仿、乙醇、异丙醇购自国药集团化学试剂有限公司;CCK-8 细胞活性检测试剂购自上海翊圣生物科技有限公司;SpectraMax M5多功能酶标仪购自美国Molecular Devices公司;台式高速冷冻离心机购自德国Eppendorf公司;BB16UV型CO2培养箱购自德国Heraeus公司;LSM710型高感度激光扫描共聚焦显微镜购自德国蔡司公司。
嵌合体二级结构预测 以RNA Structure软件对预合成的不同RNA碱基耦联构建的嵌合体分子二级结构进行预测分析。
嵌合体分子血清稳定性检测 以去RNA酶水溶解各嵌合体寡核酸,配制浓度为10 nmol/L;取9μL核仁素核酸适配体嵌合体溶液,加入1μL血清,37 ℃下分别孵育0.5、1、2、3和4 h;以3%琼脂糖胶电泳15 min,检测嵌合体分子的完整性。
嵌合体分子细胞裂解液稳定性检测 取Du145细胞约1×107个,以无酶分离液收集细胞;加入400μL PBS洗涤1次;加入100μL PBS重悬浮;-70 ℃反复冻溶吹打3次,使细胞破裂释放细胞质;100×g离心3 min,取上清细胞裂解液,-70 ℃保存备用;取嵌合体分子各8μL,分别加入上述细胞裂解液2μL,37 ℃下分别孵育0.5、1、2和4 h;以3%琼脂糖胶电泳15 min,检测嵌合体分子的完整性。
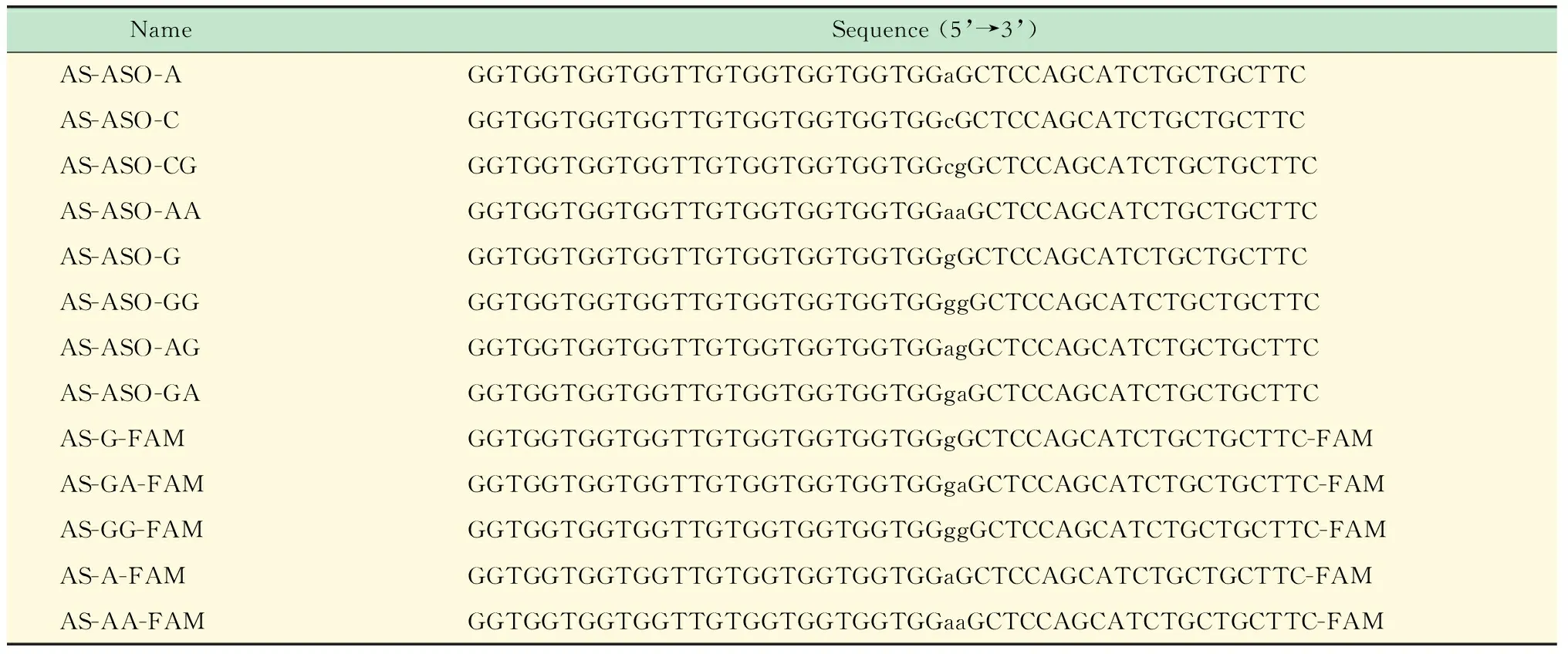
表1 嵌合体分子碱基序列及修饰
Small letter indicated RNA.
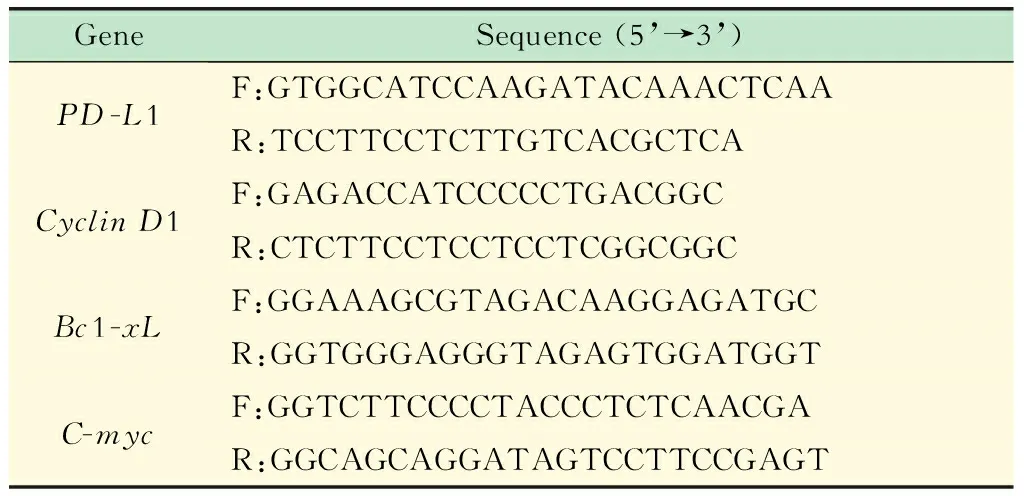
表2 RT-PCR引物
流式细胞术检测 取Du145细胞接种于12孔板(2×105/孔),加入DMEM完全培养基1 mL,5% CO2、37 ℃培养48 h。取3孔细胞,分别加入FAM荧光标记嵌合体分子、AS1411和效应分子各10μL,使其终浓度达100 nmol/L,5% CO2、37 ℃培养1 h,另取3孔细胞加入PBS作为空白对照;吸弃培养基,消化后清洗2次,PBS重悬,以流式细胞术分析FAM阳性细胞数量及其比例。
荧光共聚焦显微镜 取6孔细胞培养板,加入1 mL DMEM培养基(含10%胎牛血清,双抗);各孔加入1块无菌盖玻片,沉底,无气泡;接种适量肿瘤细胞(1 mL)于盖玻片之上,以DMEM (含10%胎牛血清),5% CO2、37 ℃培养48 h;分别加入荧光标记嵌合体分子、AS1411和效应分子各20μL,使其终浓度达100 nmol/L,5% CO2、37 ℃培养1 h;加入DAPI (100×) 10μL,5% CO2、37 ℃孵育20 min;吸弃培养基,加入1 mL PBS洗涤1次;取出盖玻片,晾干,以50%甘油(以PBS稀释)倒置吸附于载破片;高感度激光扫描共聚焦显微镜下观察结果。
细胞生长抑制实验 取Du145细胞100μL (100 个/μL)接种于96孔板,每孔10 000 个细胞,5% CO2、37 ℃培养12 h;分别加入实验组嵌合体分子、对照组嵌合体分子各1μL (使其终浓度为100 nmol/L),以及空白对照,各组重复4孔;5% CO2、37 ℃分别继续培养24、48及72 h,以检测细胞增殖;各孔分别加入5μL CCK-8试剂,5% CO2、37 ℃继续培养3 h;以Spectrum M5检测450 nm下各孔细胞的吸光度值(D)。
RT-PCR检测 运用real-time PCR的方法检测Du145细胞中C-myc、CyclinD1、Bcl-Xl和PD-L1基因mRNA的表达。以Trizol法抽提总的RNA,逆转录成cDNA。20μL反应体系包括:qPCR SYBR Master Mix 10μL、cDNA模板3μL、上下游引物各1μL、ddH2O 4μL。PCR反应条件为:95 ℃,3 min;95 ℃,30 s;58 ℃,30 s;72 ℃,1 min;循环40次。
Western blot检测 运用Western blot检测Du145细胞中C-myc、Cyclin D1、Bcl-xL和PD-L1蛋白质水平。将Du145细胞裂解,提取组织蛋白质,定量并分离,转膜后分别与相应蛋白质抗体孵育并显色。
结 果
嵌合体分子的二级结构 在本研究中,设计通过RNA碱基耦联核仁素核酸适配体AS1411和STAT3 ASO构建嵌合体分子,从而介导高度靶向特异性给药。为明确耦联分子是否影响AS1411二级结构及是否结合核仁素,以RNA Structure软件分析耦联分子二级结构。如图1所示,C、G连接的AS-ASO二级结构基本一致,但A耦联的AS-ASO结构有所不同。但无论哪种连接,核酸适配体AS1411 5’端大部分DNA呈单链状态,仅在16个碱基后有3~4个碱基构成的碱基对,且并非完全匹配。因此,认为RNA碱基(A、C、G)单碱基或双碱基耦联的AS-ASO嵌合体分子二级结构基本一致,不会对AS1411核仁素的亲和力造成大的影响。
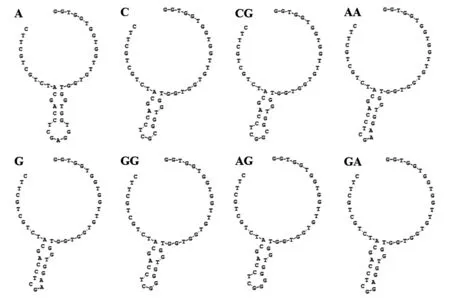
图1 嵌合体分子二级结构
嵌合体分子在血清中的稳定性 合成的嵌合体分子若能在血清中稳定存在,而进入细胞后又可快速分离,那就不会在血液循环系统中过早释放效应分子而造成药物毒性作用和不良反应。考虑到嘧啶碱基稳定性更差,因此实验设计为:分别以RNA单碱基A、C、G或双碱基AA、AG、GA、GG、CG耦联核仁素核酸适配AS1411和STAT3 ASO,分别以未耦联的AS1411 (N)和DNA耦联的嵌合体分子(P)作对照(图2)。AS-ASO-C及AS-ASO-CG在10%血清中孵育0.5 h即有大量降解,到4 h时已基本完全降解,提示嘧啶碱基极易被降解;AS-ASO-A、AS-ASO-G在4 h后有少许降解;AS-ASO-AA、AS-ASO-AG、AS-ASO-GA随时间延长逐渐降解,而AS-ASO-GG在4 h后基本与开始时一致,无降解。结果提示,嘌呤RNA双碱基可在血清中稳定存在较长时间。因此,若该RNA连接可在细胞内被快速降解,则可作为理想的耦联分子连接AS1411和效应分子。
嵌合体分子在细胞裂解液中的稳定性 进一步分析AS-ASO-AA、AS-ASO-AG、AS-ASO-GG、AS-ASO-GA在细胞裂解液中的稳定性。如图3所示,上述嵌合体分子在20%细胞裂解液中孵育30 min即出现2条条带,2 h后则大部分裂解,而4 h后几乎完全裂解释放ASO。结合血清稳定性实验结果,说明以腺嘌呤RNA双碱基耦联构建的嵌合体分子可在血清中稳定存在至少4 h,而进入细胞后则在0.5 h内即开始裂解释放效应分子。这提示以腺嘌呤RNA双碱基耦联构建嵌合体分子可能介导靶向特异性而高效抗肿瘤。由于各嵌合体稳定性无显著差异,因此以gg (RAN)偶联嵌合体进行后续研究。
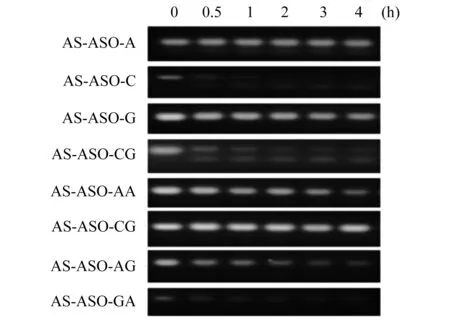
图2 嵌合体分子在10%血清中的稳定性
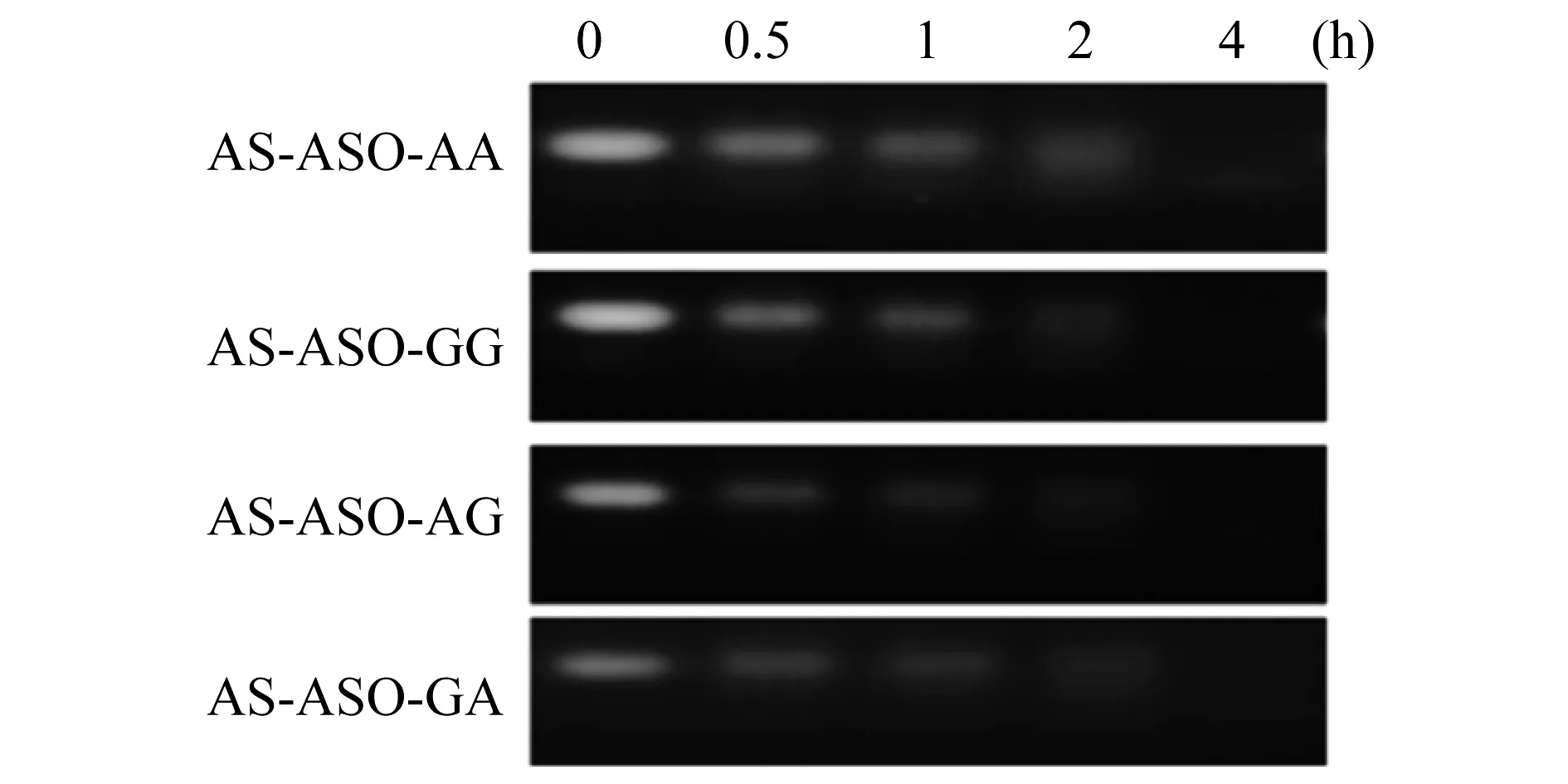
图3 嵌合体分子在细胞裂解液中的稳定性
嵌合体分子可高效进入肿瘤细胞 为验证核仁素核酸适配体AS1411是否可有效介导ASO进入细胞,以荧光染料FAM标记ASO,首先通过流式细胞术予以验证。以FAM标记的AS1411 (AS1411-FAM)为阳性对照,以FAM标记的效应分子ASO (ASO-FAM)为阴性对照。结果如图4所示,阳性对照组AS1411细胞FAM平均荧光强度值(mean fluorescence intensity,MFI) 显著提高,是ASO-FAM组的1.44倍(P<0.01);嵌合体分子AS-ASO-GG组与阳性对照组结果基本一致,是ASO-FAM组的1.33倍(P<0.01)。该结果说明AS1411耦联的嵌合体分子可以高效介导寡核苷酸ASO进入肿瘤细胞。
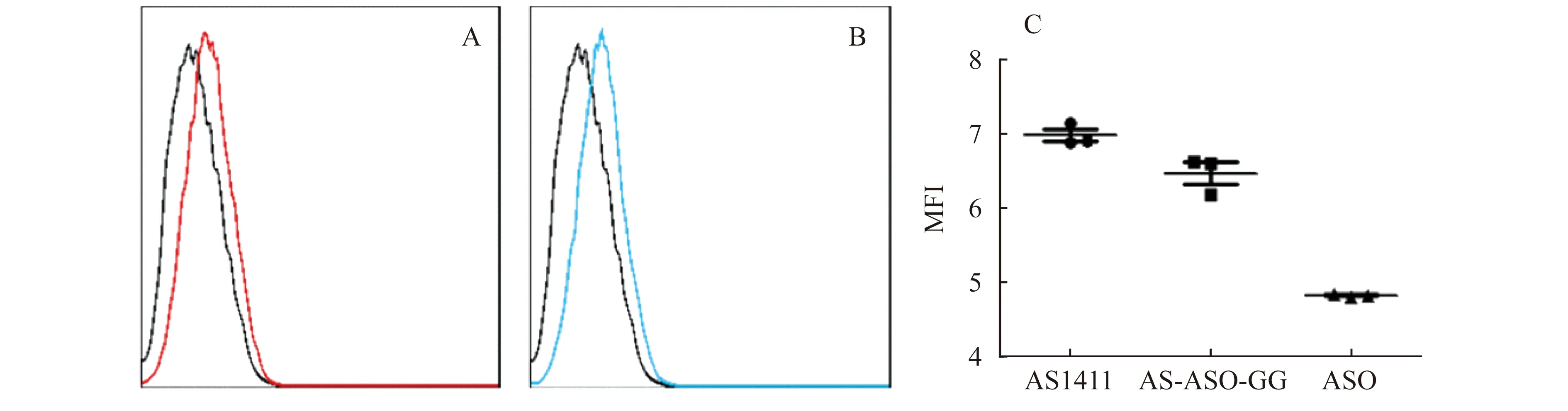
A:Results of positive control.The black curve showed ASO-FAM negative (control) and the red curve showed AS1411-FAM (positive control).B:Results of chimeric molecule.The black curve showed ASO-FAM (control) and the blue curve showed AS-ASO-GG-FAM (positive control).C:Statistical analysis of MFI.The MFI levels of AS1411 and AS-ASO-GG were higher than ASO-FAM (P<0.01).MFI:Mean fluorescence intensity.
图4 嵌合分子的流式细胞实验分析结果
Fig 4 Results of chimeric molecules analyzed by flow cytometry
荧光共聚焦实验验证嵌合体分子进入肿瘤细胞为进一步验证上述流式细胞术结果,再次通过荧光共聚焦实验予以验证。同样以AS1411-FAM和ASO-FAM为对照。图5为共聚焦荧光显微镜检测结果,其中蓝色为核仁DAPI染色结果,绿色为FAM染色结果。由图5可见,AS1411组绿色荧光多在细胞核中富集而胞质中较少;AS-ASO-GG组则相反,胞质中较多而核仁中较少;对照ASO组则基本无荧光。该结果提示AS1411高效结合核仁素,可介导耦联的效应分子高效进入Du145细胞;AS-ASO-GG在胞质中荧光强而核仁中弱,提示嵌合体分子进入细胞后快速裂解而使ASO滞留在胞质中。上述结果说明,以AS1411为靶向分子,通过双嘌呤RNA碱基(GG)耦联ASO嵌合体分子,可高效进入靶细胞,并且在胞质中释放效应分子ASO。
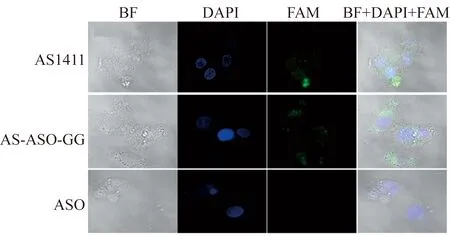
图5 嵌合分子的共聚焦荧光显微镜检测结果(400×)
AS-ASO-GG抑制细胞生长 为验证构建的嵌合体分子是否可以有效抑制肿瘤细胞生长,实验以空白组为对照,通过CCK-8试剂盒检测给药24 h后450 nm处的D值,分析RNA双碱基gg (RNA)耦联AS1411和单独AS1411在不同浓度下对Du145细胞的生长抑制作用(图6)。可见,单独AS1411和空白对照组对Du145生长无显著影响;AS-ASO-GG嵌合体仅在5μmol/L时可显著抑制肿瘤细胞生长,是单独AS1411的68.0%,且显著低于空白对照组。结果提示,耦联ASO构建的嵌合体分子在较高浓度下才能有效抑制肿瘤细胞生长,这可能与该ASO对STAT3沉默活性有限有关。
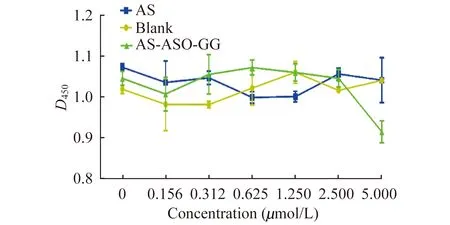
图6 AS-ASO-GG抑制Du145细胞生长
RT-PCR检测AS-ASO-GG抑制肿瘤细胞生长相关基因的表达 为验证AS-ASO-GG (5μmol/L)是否有效抑制Du145细胞肿瘤生长相关基因的表达,以RT-PCR分析给药48 h后,肿瘤相关基因Bcl-xl、CyclinD1、C-myc和PD-L1的mRNA相对水平。以单独AS1411和空白为对照(图7),mRNA相对定量检测结果显示,相对于空白对照组,AS-ASO-GG组C-myc、CyclinD1、Bcl-xl、和PD-L1的mRNA相对水平分别下调66.2%、54.5%、49.8%和61.3% (P<0.05);而单独AS1411无显著差异。说明AS-ASO-GG可以有效抑制肿瘤相关基因表达。
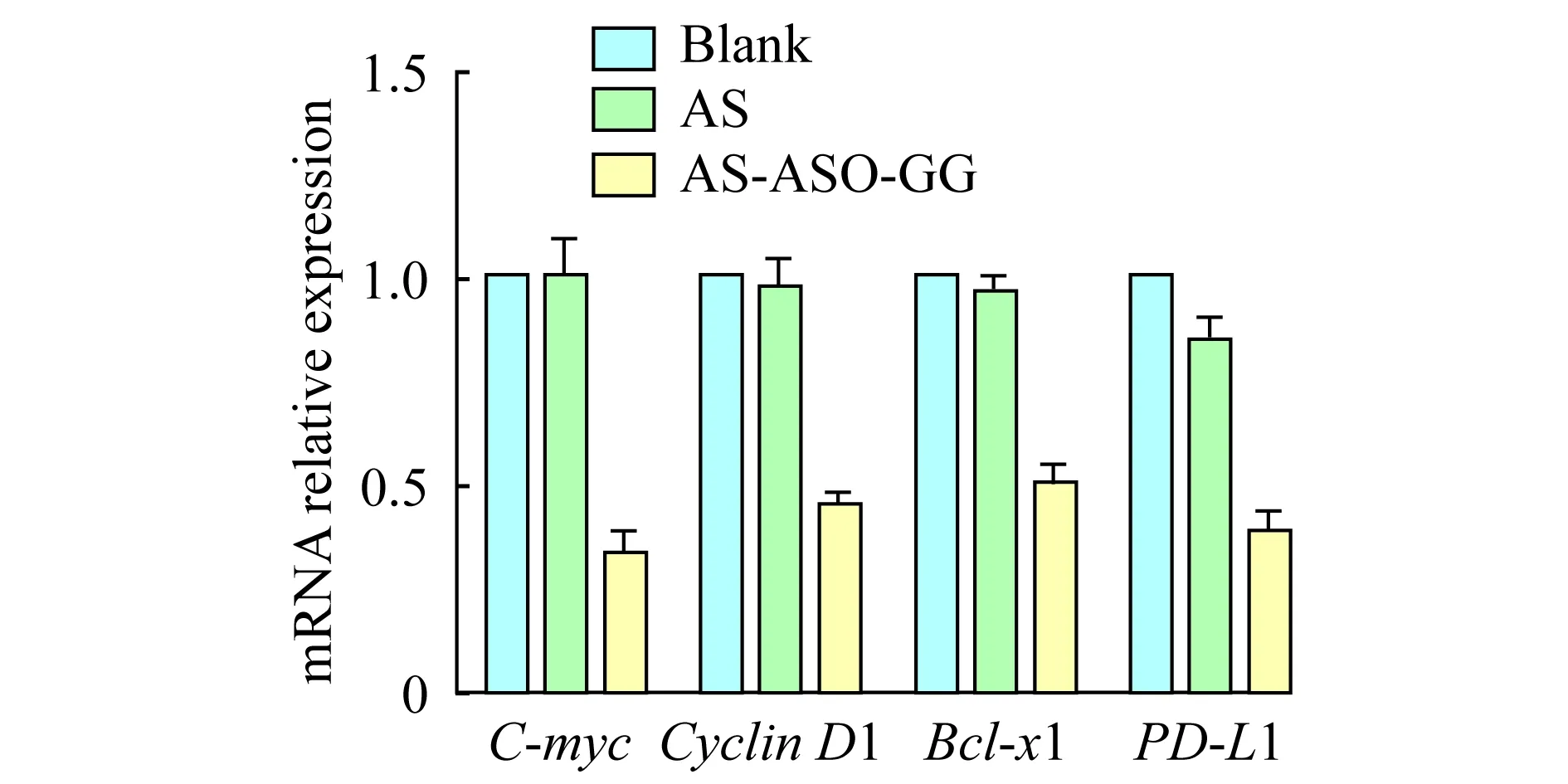
图7 AS-ASO-GG抑制肿瘤相关基因的转录
Western blot检测AS-ASO-GG抑制肿瘤细胞生长相关基因表达 为了进一步在蛋白质水平验证AS-ASO-GG (5μmol/L) 抑制Du145细胞肿瘤生长相关基因的表达情况,以Western blot分析给药48 h后,肿瘤相关基因Bcl-xl、CyclinD1、C-myc和PD-L1的蛋白质水平。以单独AS1411和空白为对照(图8),相对于空白组,AS-ASO-GG肿瘤相关基因的蛋白质水平明显下降,而单独AS1411组则无明显差异。这说明AS-ASO-GG可有效降低肿瘤相关基因的蛋白质水平。
讨 论
靶向特异性是当前精准医学研究的重要特征,尤其对于新型抗肿瘤治疗药物,更是先决条件。目前比较常用的治疗方法中,缺乏特异性的化疗、放疗和手术治疗常伴有严重的毒性作用和不良反应,严重破坏免疫系统功能,给患者带来更大的痛苦[16]。因此开发具有靶向功能并特异性杀灭肿瘤细胞的药物是精准医学研究的重要方向。目前开发的新型抗肿瘤疗法,如单克隆抗体药物、CAR-T细胞等都显著提高了其抗肿瘤治疗靶向性,但也都存在一定的局限性,因此开发新的、靶向性更高的药物迫在眉睫[1-2]。
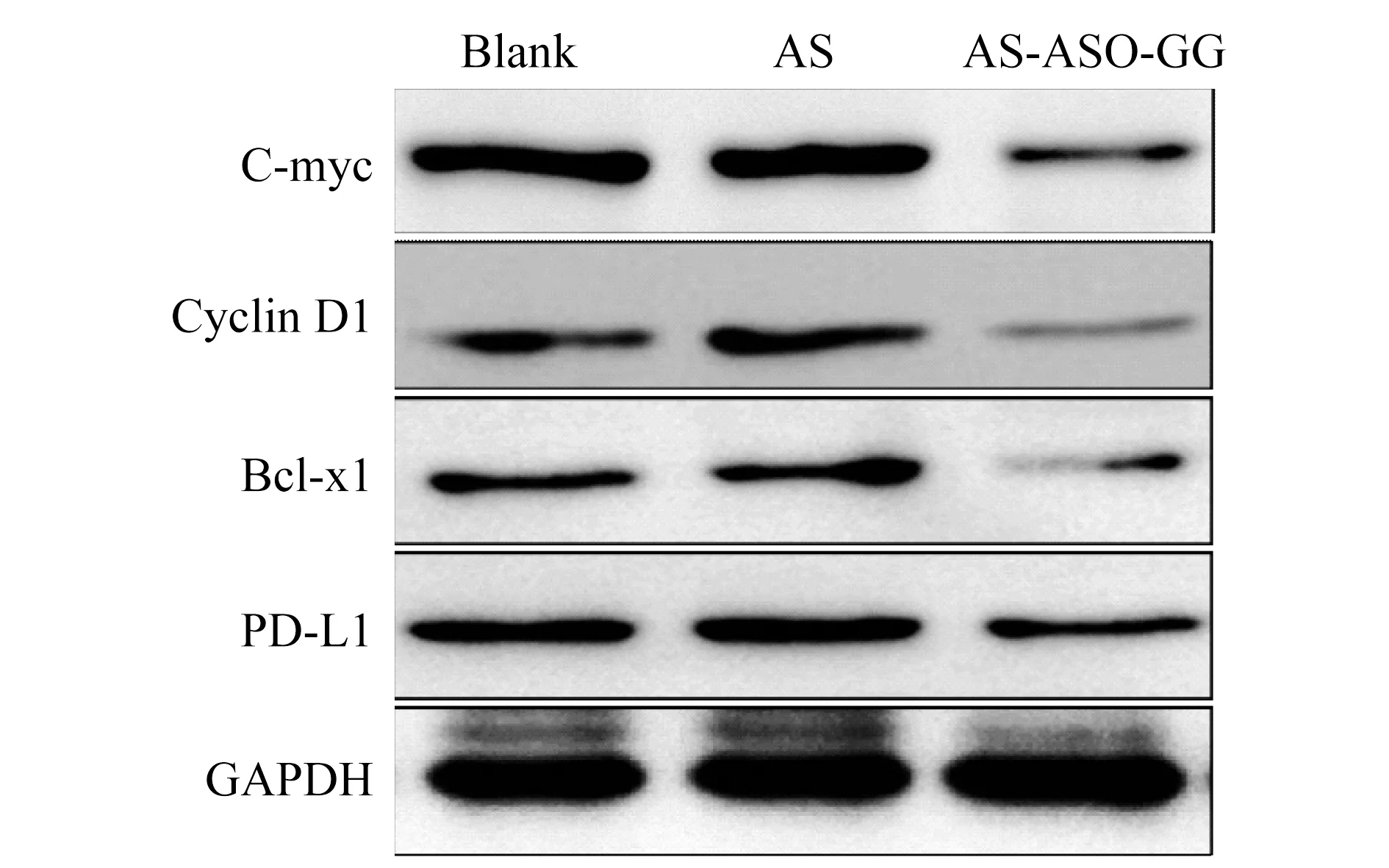
图8 AS-ASO-GG抑制肿瘤相关基因的表达
核酸适配体为单链DNA或RNA寡核苷酸,与目标蛋白受体、多肽、胞内生物大分子等具有高亲和力、高特异性的结合[17-19]。相比于蛋白质抗体,核酸适配体不但具有更高的亲和力和靶向特异性[5],还具有如下显著优点:(1)分子量小,在体内更容易通过组织障碍到达病灶部位;(2)无免疫原性,不易刺激机体产生抗体;(3)热稳定性强,具有稳定的空间结构;(4)可以方便快速大规模工业化合成;(5)生产成本低廉[5,17]。因此,核酸适配体是理想的精准抗肿瘤治疗药物。尤其是核仁素核酸适配体AS1411,可高特异性、高亲和力结合癌细胞表面的核仁素而对正常细胞无亲和力,是十分理想的抗肿瘤药物靶向分子[6-9]。
目前核仁素核酸适配体AS1411已经在抗肿瘤研究中获得广泛应用,主要包括作为阻断剂直接抗肿瘤治疗和作为载体介导药物靶向杀伤肿瘤细胞。作为载体是AS1411更重要的作用,也是目前靶向抗肿瘤研究的重点手段,但各方法均存在一定的缺陷。Oh等[20]利用点击化学技术以PEG将阿霉素耦联至AS1411,从而靶向并有效减少药物毒性作用和不良反应,但该方法仅限于含有羧基结构的特殊药物。利用核酸适配体AS1411耦联纳米颗粒或脂质体,可增加靶向性、提高装载药物的抗肿瘤活性并降低毒性作用和不良反应,表现出更强的靶向特异性杀伤肿瘤效果[21-22],但这同时加剧了脂质体的不稳定性,且其靶向性依然欠佳。采用碱基互补配对是构建AS1411嵌合体的另一种方式。Subramanian等[23]利用该原理将存活蛋白脱氧核酶耦联至AS1411,实现了特异性靶向药物投递,但活性不佳,并且以该方法构建的嵌合体热稳定性很差,依然具有免疫原性等不足。
本研究设计的AS1411-RNA-ASO嵌合体分子,以AS1411为靶向分子,利用RNA碱基耦联效应分子ASO,从而使ASO能够靶向进入核仁素阳性的肿瘤细胞。实验结果表明,以RNA双碱基gg耦联的嵌合体分子可在血清中较长时间稳定存在,而在胞质中快速分解释放耦联的效应分子。荧光共聚焦实验证明,AS1411可快速进入肿瘤细胞并在核仁富集,而绝大部分荧光标记的效应分子却滞留在胞质中,说明嵌合体分子进入细胞后可迅速释放耦联的效应分子。进一步的生长抑制实验表明,嵌合体分子 AS-ASO-GG可有效抑制Du145细胞生长,并抑制Bcl-xL、CyclinD1、C-myc和PD-L1基因的转录与翻译。
本研究利用AS1411介导STAT3 ASO靶向给药,可显著提高药物投递效率,尤其是STAT3 ASO具有很强的抗肿瘤活性。相比于其他方法,以RNA碱基耦联AS1411和STAT3 ASO构建的嵌合分子具有肿瘤靶向性强、活性高、稳定强、进入肿瘤细胞后起效快的特点。且由于AS1411和STAT3 ASO本身均为核酸类小分子抗肿瘤药物,而对正常细胞无显著的毒性作用[18,24],因此构建的嵌合体分子还具有低毒性作用、弱免疫原性及适合长期给药等优势。
综上所述,以RNA双嘌呤碱基(gg)耦联核仁素核酸适配体AS1411和ASO构建的嵌合体分子可高效进入肿瘤细胞,并在细胞中快速释放ASO。其中AS-ASO-GG嵌合体可显著下调Bcl-xL、CyclinD1、C-myc和PD-L1的mRNA和蛋白质水平并抑制Du145细胞生长,为进一步的精准抗肿瘤治疗提供了实验依据。
[1] 陈雪静,常亮,高健.抗肿瘤抗体药物的研究进展[J].中国生物制品学杂志,2015,28(1):84-90.
[2] 张鸿声.嵌合抗原受体T细胞肿瘤治疗的前生、今世和将来[J].转化医学杂志,2014(3):129-133.
[3] GRUPP SA,KALOS M,BARRETT D,etal.Chimeric antigen receptor-modified T cells for acute lymphoid leukemia[J].NEnglJMed,2013,368(16):1509-1518.
[4] BRENTJENS RJ,DAVILA ML,RIVIERE I,etal.CD19-targeted T cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia[J].SciTranslMed,2013,5(177):177ra38.
[5] WHITE RR,SULLENGER BA,RUSCONI CP.Developing aptamers into therapeutics[J].JClinInvest,2000,106(8):929-934.
[6] SRIVASTAVA M,POLLARD HB.Molecular dissection of nucleolin′s role in growth and cell proliferation:new insights[J].FASEBJ,1999,13(14):1911-1922.
[7] SVEN C,JAN P,AKERMAN ME,etal.Nucleolin expressed at the cell surface is a marker of endothelial cells in angiogenic blood vessels[J].JCellBiol,2003,163(4):871-878.
[8] SOUNDARARAJAN S,WANG L,SRIDHARAN V,etal.Plasma membrane nucleolin is a receptor for the anticancer aptamer AS1411 in MV4-11 leukemia cells[J].MolPharmacol,2009,76(5):984-991.
[9] BATES PJ,LABER DA,MILLER DM,etal.Discovery and development of the G-rich oligonucleotide AS1411 as a novel treatment for cancer[J].ExpMolPatho,2009,86(3):151-164.
[10] REYES-REYES EM,TENG Y,BATES PJ.A new paradigm for aptamer therapeutic AS1411 action:uptake by macropinocytosis and its stimulation by a nucleolin-dependent mechanism[J].CancerRes,2010,70(21):8617-8629.
[11] REYES-REYES EM,SALIPUR FR,SHAMS M,etal.Mechanistic studies of anticancer aptamer AS1411 reveal a novel role for nucleolin in regulating Rac1 activation[J].MolOncol,2015,9(7):1392-1405.
[12] SIVEEN KS,SIKKA S,SURANA R,etal.Targeting the STAT3 signaling pathway in cancer:Role of synthetic and natural inhibitors[J].BbA-RevCancer,2014,1845(2):136-154.
[13] SUI Q,ZHANG J,SUN X,etal.NK cells are the crucial antitumor mediators when STAT3-mediated immunosuppression is blocked in hepatocellular carcinoma[J].JImmunol,2014,193(4):2016-2023.
[14] ROSMORDUC O,DESBOIS-MOUTHON C.Targeting STAT3 in hepatocellular carcinoma:sorafenibagain[J].JHepatol,2011,55(5):957-959.
[15] KORTYLEWSKI M,KUJAWSKI M,WANG T,etal.Inhibiting Stat 3 signaling in the hematopoietic system elicits multicomponent antitumor immunity[J].NatMed,2005,11(12):1314-1321.
[16] GAO Q,WANG XY,QIU SJ.etal.Overexpression of PD-L1 significantly associates with tumor aggressiveness and postoperative recurrence in human hepatocellular carcinoma[J].ClinCancerRes,2009,15(3):971-979.
[17] XIANG D,SHIGDAR S,QIAO G,etal.Aptamer-mediated cancer gene therapy[J].CurrGeneTher,2015,15(2):109-119.
[18] SUN H,ZHU X,LU PY,etal.Oligonucleotide aptamers:new tools for targeted cancer therapy[J].MolTherNuclAcids,2014,3(8):e182.
[19] SUNDARAM P,KURNIAWAN H,BYRNE ME,etal.Therapeutic RNA aptamers in clinical trials[J].EurJPharmSci,2013,48(1-2):259-271.
[20] OH SS,LEE BF,LEIBFARTH FA,etal.Synthetic aptamer-polymer hybrid constructs for programmed drug delivery into specific target cells[J].JAmChemSoc,2014,136(42):15010-15015.
[21] ARAVIND A,JEYAMOHAN P,NAIR R,etal.AS1411 aptamer tagged PLGA-lecithin-PEG nanoparticles for tumor cell targeting and drug delivery[J].BiotechnolBioeng,2012,109(11):2920-2931.
[22] LI L,HOU J,LIU X,etal.Nucleolin-targeting liposomes guided by aptamer AS1411 for the delivery of siRNA for the treatment of malignant melanomas.[J].Biomaterials,2014,35(12):3840-3850.
[23] SUBRAMANIAN N,KANWAR JR,AKILANDESWARI B,etal.Chimeric nucleolin aptamer with survivinDNAzyme for cancer cell targeted delivery.[J].ChemCommun,2015,51(32):6940-6943.
[24] ROSENBERG JE,BAMBURY RM,VAN ALLEN EM,etal.A phase II trial of AS1411 (a novel nucleolin-targeted DNA aptamer) in metastatic renal cell carcinoma[J].InvesNewDrug,2014(32):178-187.
A preliminary study of AS1411 mediated STAT3 antisense oligonucleotide targeting tumor cells
LIU Bao-xiu, HUANG Jian-sheng, ZHU Nai-shuo△
(LaboratoryofMolecularInfectionandImmunology,SchoolofLifeSciences,FudanUniversity,Shanghai200438,China)
Objective To observe the effect of AS1411-mediated signal transduction and activator of transcription 3 (STAT3) antisense oligonucleotide (ASO) targeting tumor cells. Methods RNA was used as coupling molecules to link the targeting molecules AS1411 and effector molecules ASO.Prediction and analysis of the secondary structure of the pre-synthesis of chimeric molecules by RNA Structure software.Agarose gel electrophoresis was used to test the stability of chimeric molecules in serum and cell lysis solution.Using flow cytometry and confocal fluorescence microscope were used to estimate the internalization of AS1411-mediated STAT3 ASO.Inhibitory effect of ASO on the growth of tumor cells was detected by CCK-8 kit.RT-PCR and Western blot was used to measure the expression levels of tumor related genes.Results STAT3 ASOs mediated by AS1411 can enter tumor cells efficiently to inhibit the transcription and translation ofC-myc,CyclinD1,Bcl-xlandPD-L1 gene,and also can inhibit the growth of Du145 cells. Conclusions AS1411-mediated STAT3 ASO can enter tumor cells and act as anti-tumor medicine.
antisense oligonucleotide; AS1411; anti-tumor; targeting
国家自然科学基金(30901315,30970144);国家863计划重大课题(2011AA02A114);上海市科委支撑项目(13431900602)
R73-36
A
10.3969/j.issn.1672-8467.2017.04.005
2016-10-31;编辑:段佳)
△Corresponding author E-mail:nzhu@fudan.edu.cn
*This work was supported by the National Natural Science Foundation of China (30901315,30970144),the National High Technology Research and Development Program of China (2011AA02A114) and the Project Supported by Shanghai Committee of Science and Technology (13431900602).

