花生壳中黄酮含量比较及工艺优化
姜红宇,谭捷雄,殷素芳,吴茗,张婷婷,王宗成,*
(1.湖南科技学院化学与生物工程学院,湖南永州425199;2.湖南科技学院湖南省银杏工程技术研究中心,湖南永州425199;3.湖南科技学院湘南优势植物资源综合利用湖南省重点实验室,湖南永州425199)
花生壳中黄酮含量比较及工艺优化
姜红宇1,2,3,谭捷雄1,殷素芳1,吴茗1,张婷婷1,王宗成1,2,3,*
(1.湖南科技学院化学与生物工程学院,湖南永州425199;2.湖南科技学院湖南省银杏工程技术研究中心,湖南永州425199;3.湖南科技学院湘南优势植物资源综合利用湖南省重点实验室,湖南永州425199)
为合理利用废弃物花生壳,比较3个品种的花生壳黄酮含量差异和不同加工方法的花生壳黄酮含量差异,并采用响应面法优化其提取工艺。结果表明:江永小壳型花生壳含量较高,且生花生壳含量最高,最佳工艺条件为:料液比1∶10(g/mL)、乙醇体积分数71%、提取温度61℃、提取时间1.6 h,该条件下,黄酮得率为38.50 mg/g。
花生壳;总黄酮;提取工艺;含量测定
花生年产量1 450万吨以上,每年产生花生壳约450万吨[1],花生壳大部分被当成废渣弃去或用作燃料,利用率极低[2],只有一小部分用于蘑菇培养基、农用肥料、制造塑料填料、胶合剂、人造板、活性炭及作为饲料添加物,其利用价值未充分发挥[3-8]。花生壳中主要是粗纤维,此外还含有大量的碳水化合物、蛋白质等,并且含有多酚、黄酮类物质和甾体类化合物等有效成分[9],其中木犀草素含量较高[10]。研究表明花生壳具有抗氧化[11]、增加冠状动脉流量等多种药理活性[12],其中黄酮类化合物和木犀草素发挥了主要作用[13]。目前花生壳中黄酮类化合物的提取工艺研究较多[14-16],但是湖南永州花生壳的研究未见报道,为了进一步开发废弃物花生壳的利用价值,本研究比较3个品种的花生壳黄酮含量差异和不同加工方法的花生壳黄酮含量差异,并且采用了响应面法优化了其提取工艺,以期更好的合理开发利用花生壳。
1 材料与方法
1.1 原料与仪器
1.1.1 原料与试剂
不同品种的花生壳选取永州江永小壳型生花生壳、永州零陵中壳型生花生壳、河南郑州大壳型生花生壳;不同加工方法的花生壳选取生花生壳、炒熟花生的壳和普通盐煮花生的壳均为江永小壳型花生品种;工艺优化选取江永小壳型生花生壳;所有花生壳都为现剥现用,干燥、粉碎后备用;芦丁为标准品:中国药品生物制品检定所;乙醇、氢氧化钠、亚硝酸钠、硝酸铝等(均为分析纯):天津市科密欧化学试剂有限公司。
1.1.2 仪器设备
UV2800S型分光光度计:上海舜宇恒平科学仪器有限公司;RE-201D旋转蒸发仪:上海亚荣生化仪器厂;SHZ-DC循环水式多用真空泵、集热式磁力搅拌器:郑州长城科工贸有限公司;TE124S电子天平:北京赛多利斯仪器系统有限公司;中兴FW-200高速万能粉碎机:北京中兴伟业仪器有限公司;。
1.2 试验方法
1.2.1 标准曲线的绘制
参照课题组已有经验[17],配置0.1 mg/mL芦丁标准溶液,以不加入芦丁标准溶液为空白对照,在λ=510 nm下分别测定0.01mg/mL~0.06 mg/mL芦丁标准溶液的吸光度,绘制标准曲线,得回归方程为:A=17.272c+ 0.028 1,R2=0.995 1,说明具有良好的线性关系。
1.2.2 不同品种花生壳黄酮含量差异
称取永州江永小壳型生花生壳粉、永州零陵中壳型生花生壳粉、河南郑州大壳型生花生壳粉各1.0 g,加入50 mL石油醚在55℃下加热回流2 h,再进行抽滤留残渣,用70%乙醇50 mL浸提残渣30 min,然后在50℃、超声功率100 W的条件下进行超声波辅助提取,重复3次(每次提取20 min),每次提取后进行抽滤,合并3次滤液浓缩再以70%乙醇作为溶剂定容至100 mL,按照芦丁标准曲线方法测定吸光度,通过标准曲线方程计算不同品种花生壳黄酮含量。

(c代表稀释后的浓度,mg/mL;V表示初次定容的体积,mL;D表示稀释倍数,g;m表示花生壳质量,g)
1.2.3 不同加工方法花生壳黄酮含量差异
称取永州江永小壳型生花生壳粉、炒熟花生的壳粉和普通盐煮花生的壳粉各1.0 g,参照1.2.2提取方法和含量测定方法,计算不同加工方法花生的壳中黄酮含量。
1.2.4 花生壳黄酮乙醇回流提取与含量测定方法
称取江永小壳型生花生壳粉5.0 g,采用乙醇回流提取法,分别考察提取温度40℃~90℃、乙醇体积分数40%~90%、提取时间30 min~150 min、提取次数1次~3次、料液比1∶6(g/mL)~1∶14(g/mL)对总黄酮提取的影响,收集提取液,用蒸馏水稀释定容至500 mL,作为花生壳黄酮待测溶液,按照芦丁标准曲线方法测定吸光度,计算花生壳黄酮含量及黄酮得率。
1.2.5 响应面设计优化
在单因素试验结果的基础上,在固定提取次数为2次,进一步考察其他因素对花生壳总黄酮提取的影响[17-19],以花生壳中总黄酮的得率为响应值,进行四因素三水平响应面试验来确定花生壳总黄酮提取的最佳工艺[17-19],其中心组合设计因素与水平如表1。
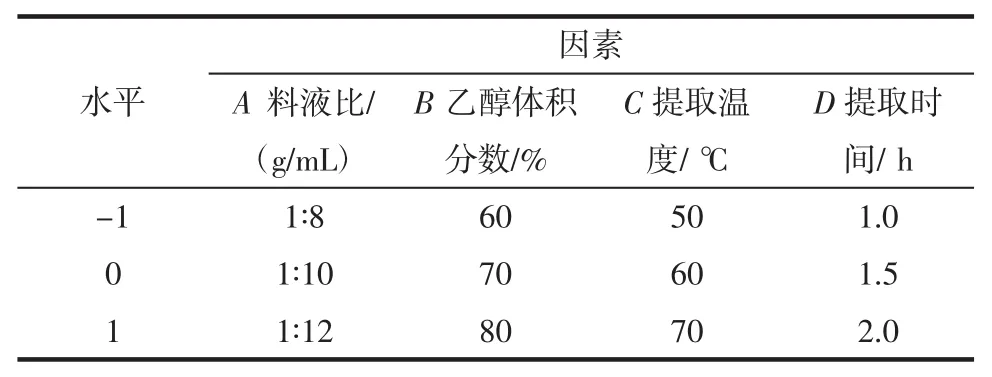
表1 响应面试验设计表Table 1 Response surface design
2 结果与分析
2.1 不同品种花生壳黄酮含量差异
不同品种花生壳黄酮含量见图1。
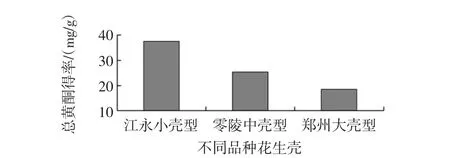
图1 不同品种花生壳黄酮含量Fig.1 Flavonoids content of peanut hulls from different cultivars
如图1所示,永州江永小壳型花生壳、永州零陵中壳型花生壳、河南郑州大壳型花生壳中黄酮含量差异较大,分别为38.79、27.39、19.64 mg/g,可见江永小壳型花生壳含量更高,因此进一步研究江永小壳型花生壳不同加工过程中花生壳中黄酮含量变化。
2.2 不同加工方法花生壳黄酮含量差异
不同加工方法花生壳黄酮含量见图2。
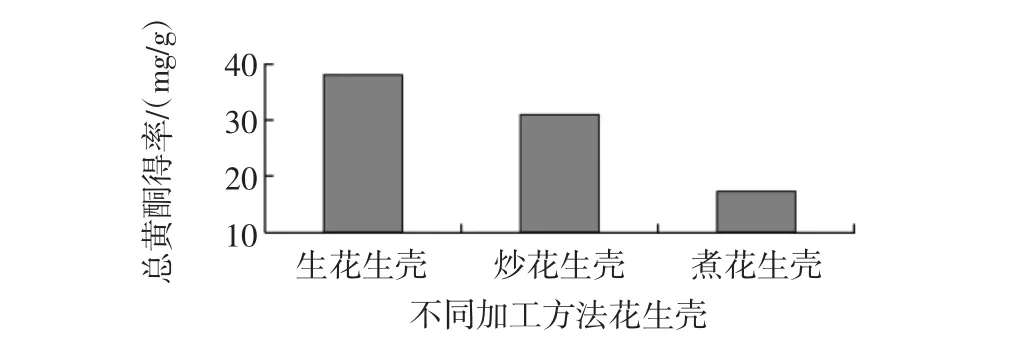
图2 不同加工方法花生壳黄酮含量Fig.2 Flavonoids content of peanut hulls from different processed methods
如图2所示,江永小壳型花生经炒熟和盐煮熟获得熟花生过程中花生壳中黄酮含量变化亦较大,发现生花生壳中黄酮含量高于炒熟花生壳,含量由38.79 mg/g下降到31.02 mg/g,而经过盐煮熟的花生壳中黄酮含量最低,为17.34 mg/g,因此在花生壳黄酮提取工艺中,应该选用生花生壳。
2.3 单因素试验
2.3.1 料液比对得率的影响
分别加入料液比为1∶6(g/mL)~1∶14(g/mL)的60%乙醇溶液,在70℃下回流提取2 h,重复1次,考察料液比对得率的影响[17]。料液比对得率的影响见图3。
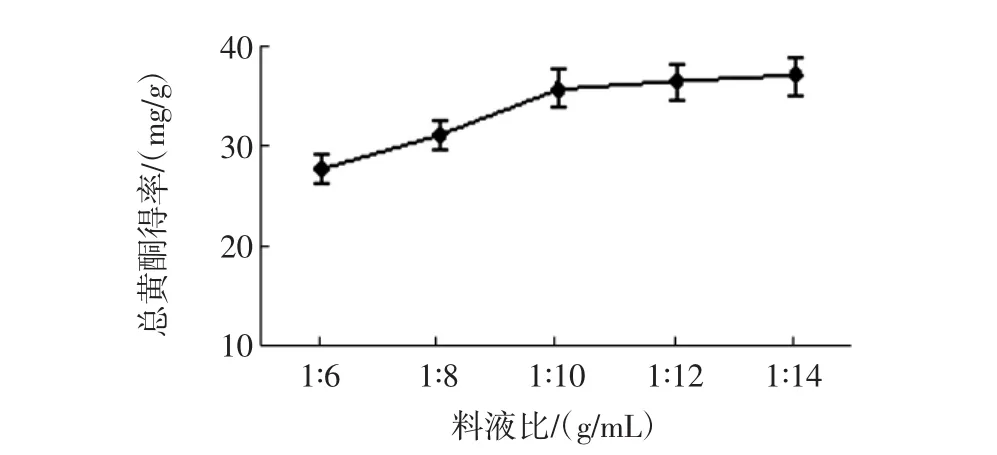
图3 料液比的影响Fig.3 Effect of solid-liquid ratio
如图3所示,料液比为1∶6(g/mL)~1∶10(g/mL)时,随着溶剂量的增加,花生壳中总黄酮的提取量也随着增加,料液比为1∶10(g/mL)时得率为35.86 mg/g,但当溶剂用量继续增加时,所得总黄酮得率相差无几。在实际生产中加大溶剂用量可以提高黄酮提取量,但也会增加能耗,考虑到工业化生产,所以选择料液比为1∶10(g/mL)。
2.3.2 乙醇体积分数对得率的影响
按料液比1∶10(g/mL)分别加入乙醇体积分数为40%~90%的乙醇溶液,于70℃回流提取2 h/次,提取2次,考察乙醇体积分数对江永小壳型花生壳总黄酮得率的影响[17]。乙醇体积分数对得率的影响见图4。
如图4所示,当乙醇为70%时得率接近最大值为36.52 mg/g,以乙醇为70%时为临界点,此点之前,随乙醇体积分数的增大得率增加明显,而后得率不增反而略有减小,可能因为乙醇体积分数升高,一些醇溶性物质与黄酮类物质竞争同乙醇-水分子结合,导致黄酮溶解度下降[17],考虑到生产成本及较优的提取得率,优选70%乙醇。
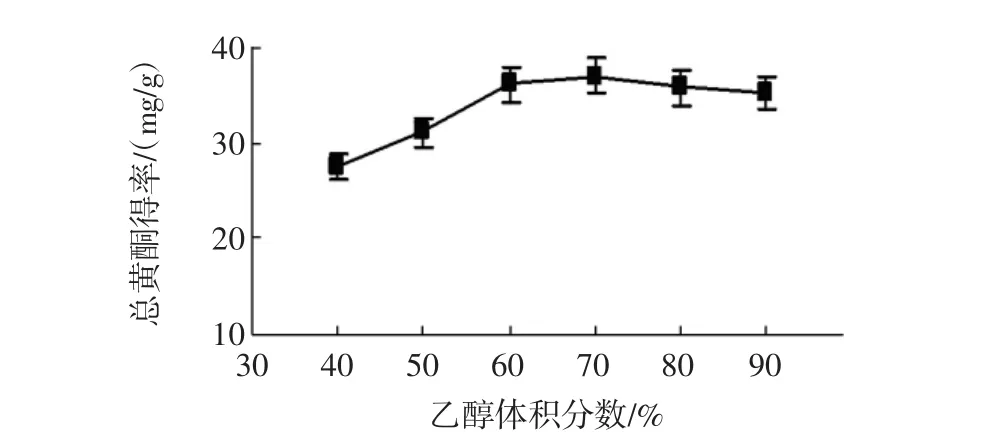
图4 乙醇体积分数的影响Fig.4 Effect of ethanol concentration
2.3.3 提取温度对得率的影响
按料液比1∶10(g/mL)加入70%的乙醇溶液,分别于40℃~90℃回流提取2 h/次,提取2次,考察提取温度对江永小壳型花生壳总黄酮得率的影响[17]。提取温度对得率的影响见图5。
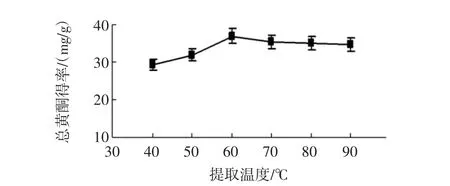
如图5所示,在提取温度为60℃时得率为最大值为36.95 mg/g,在60℃之前得率随温度的升高而升高,在60℃之后得率随着提取温度的升高反而下降,可能是温度过高,溶剂挥发严重,提取效果下降,此外可能是黄酮类化合物氧化,得率下降[17]。
2.3.4 提取次数对得率的影响
按料液比1∶10(g/mL)加入70%的乙醇溶液,于60℃回流提取2 h/次,分别提取1、2、3、4次,考察提取次数对江永小壳型花生壳总黄酮得率的影响[17]。提取次数对得率的影响见图6。
如图6所示,随着提取次数越多得率越大,提取次数为4次时得率最高为37.21 mg/g。可以看出,提取2次时花生壳总黄酮已基本溶出完全为36.04 mg/g,从工业成本和提取周期角度来考虑,提取2次最适宜[17]。
2.3.5 提取时间对得率的影响
按料液比1∶10(g/mL)加入70%的乙醇溶液,分别在60℃回流提取0.5 h/次~2.5 h/次,提取2次,考察提取时间对江永小壳型花生壳总黄酮得率的影响[17]。提取时间对得率的影响见图7。
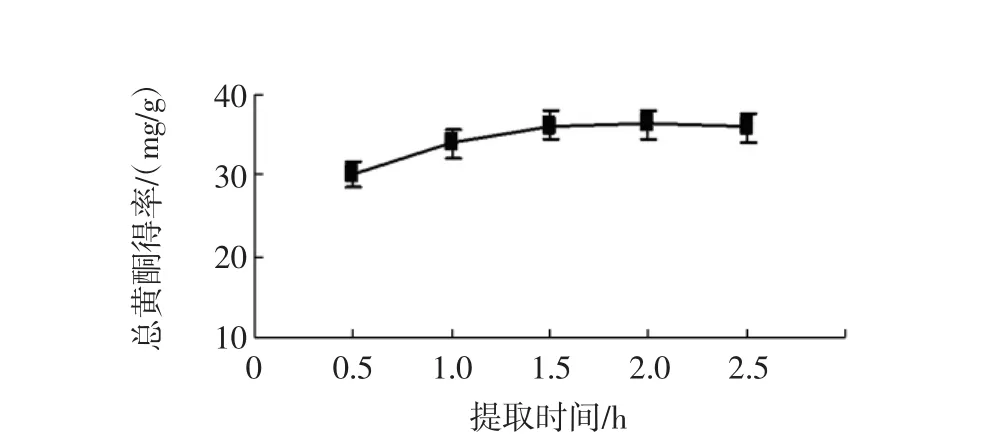
图7 提取时间的影响Fig.7 Effect of extraction time
如图7所示,在0.5 h~1.5 h之间,提取时间对江永小壳型花生壳总黄酮得率的总体影响较大,提取时间达1.5 h达到最大得率为36.23 mg/g,可以看出对江永小壳型花生壳的最佳提取时间为1.5 h。
2.4 响应面试验结果及分析
2.4.1 设计方案及试验结果
通过响应面试验,考察各因素对花生壳黄酮得率的影响[17-19],试验方案及结果见表2。

表2 试验设计及结果Table 2 Experimental design arrangement and results
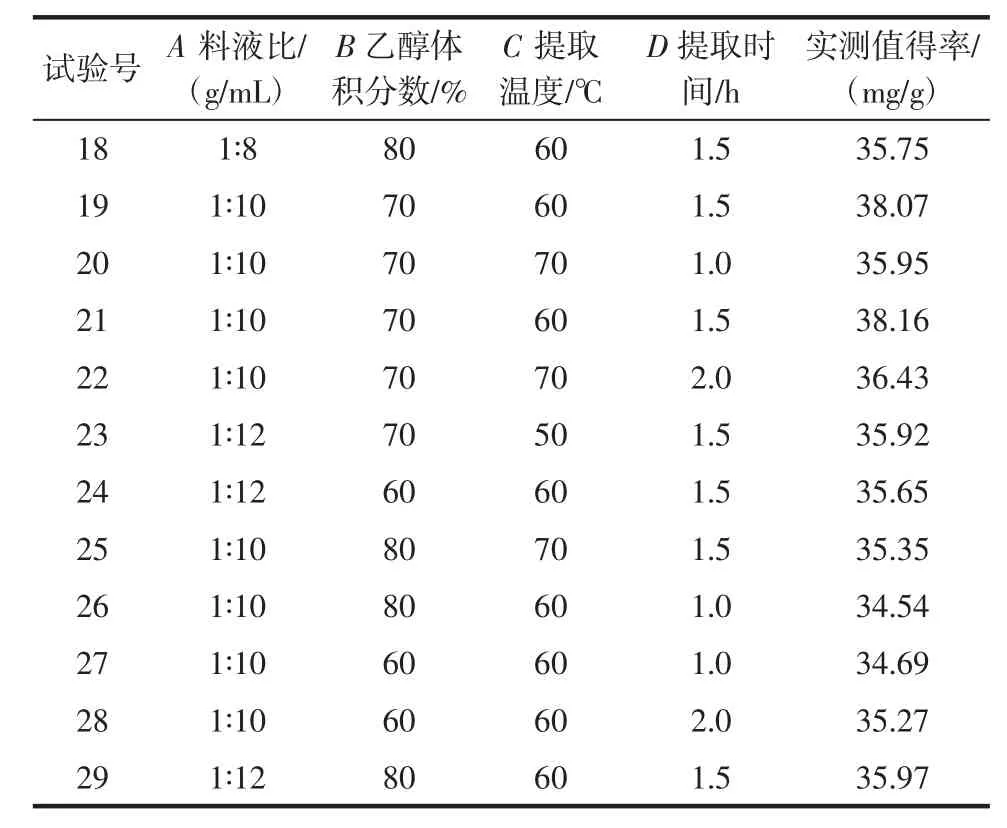
续表2 试验设计及结果Table 2 Experimental design arrangement and results
采用Design expert 8.0.6软件对试验数据进行多项拟合回归,得花生壳黄酮得率(Y)的二次回归方程为:Y=38.19+0.055A+0.28B+0.45C+0.56D-0.050AB-0.36AC+0.14AD-0.21BC+0.41BD-0.29CD-0.66A2-1.81B2-1.50C2-1.05D2。
2.4.2 响应面回归模型的方差分析
为进一步确定各因素对黄酮得率的影响程度,对回归模型进行了方差分析[17-20],结果见表3。
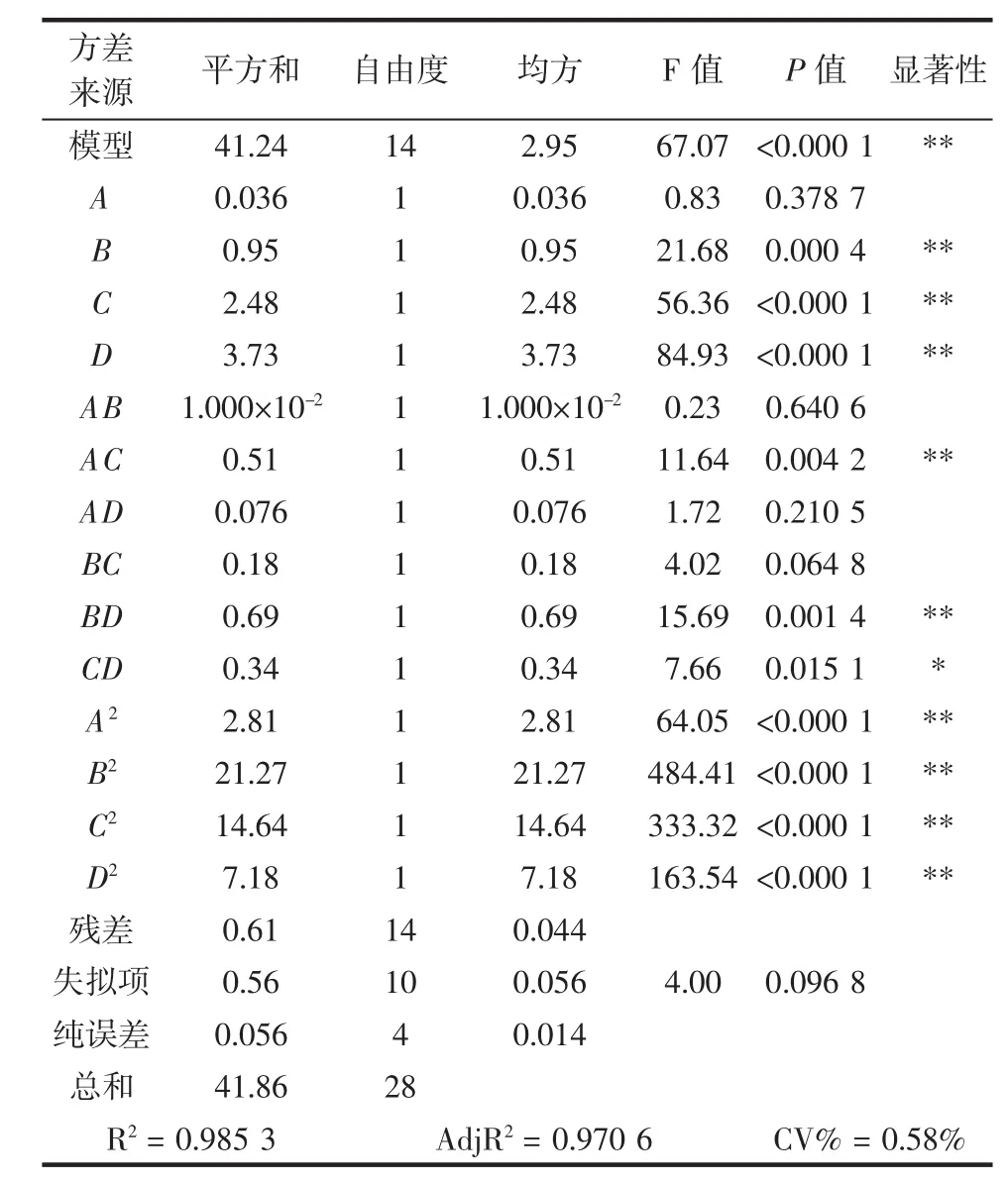
表3 回归方程的方差分析Table 3 ANOVA for quadratic model
从表3可以看出,模型的F=67.07、P<0.0001,说明本试验所采用的二次模型是很显著的。B、C、D、AC、BD、CD、A2、B2、C2、D2的P值均小于0.05,说明除料液比外的其他一次项、料液比与提取温度的交互项、乙醇体积分数与提取时间的交互项、提取温度与提取时间的交互项以及4个因素的二次项都对花生壳黄酮得率有明显影响[17-20];而料液比和其他交互项显著性较差。在被选取因素的水平范围内,各因素的效应关系为:D(提取时间)>C(提取温度)>B(乙醇体积分数)>A(料液比)。相关系数R2=0.985 3和调整系数AdjR2= 0.970 6也表明模型拟合程度较好,得率与各因素之间的回归方程是可靠的[18-19]。变异系数(CV)为0.58%说明试验的重现性好,可稳定地用于花生壳黄酮提取工艺条件的优化[18-19]。
响应曲面表明响应值对于操作条件改变时的敏感程度[17]。其中料液比与提取温度的交互作用、乙醇体积分数与提取时间的交互作用曲面较陡峭,见图8~图10。
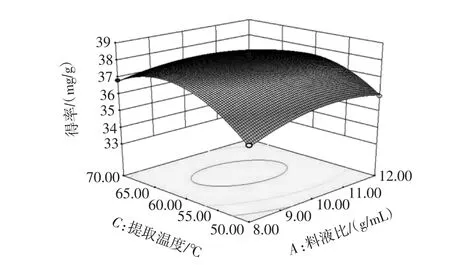
图8 料液比与提取温度的交互作用Fig.8 Interaction effect of solid-liquid ratio and extraction temperature
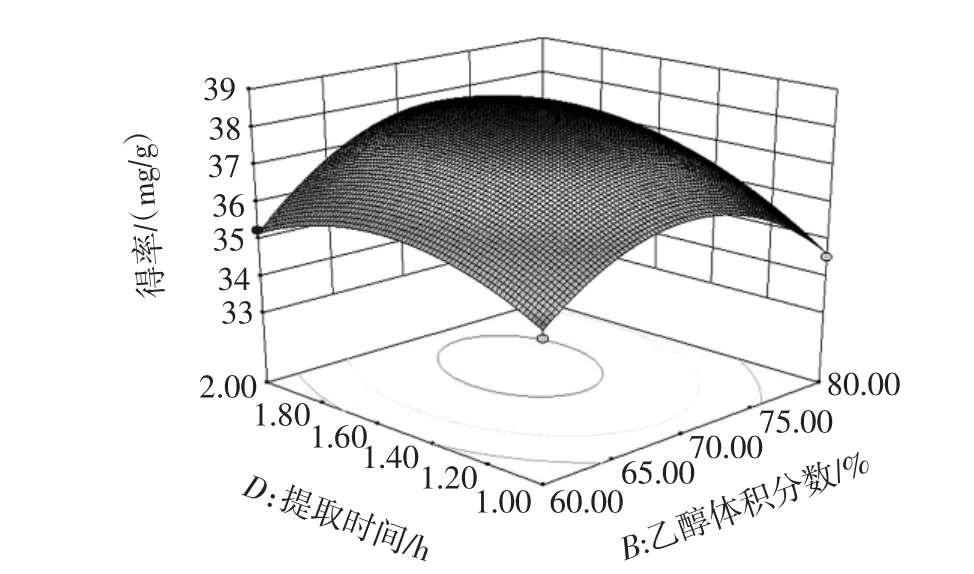
图9 乙醇体积分数与提取时间的交互作用Fig.9 Interaction effect of concentration of ethanol and extraction time
如图8~图9,说明交互作用对黄酮得率的影响极显著(P<0.01),提取温度与提取时间的交互作用曲面也比较陡峭。如图10,说明交互作用对黄酮得率的影响显著(P<0.05),与方差分析一致。
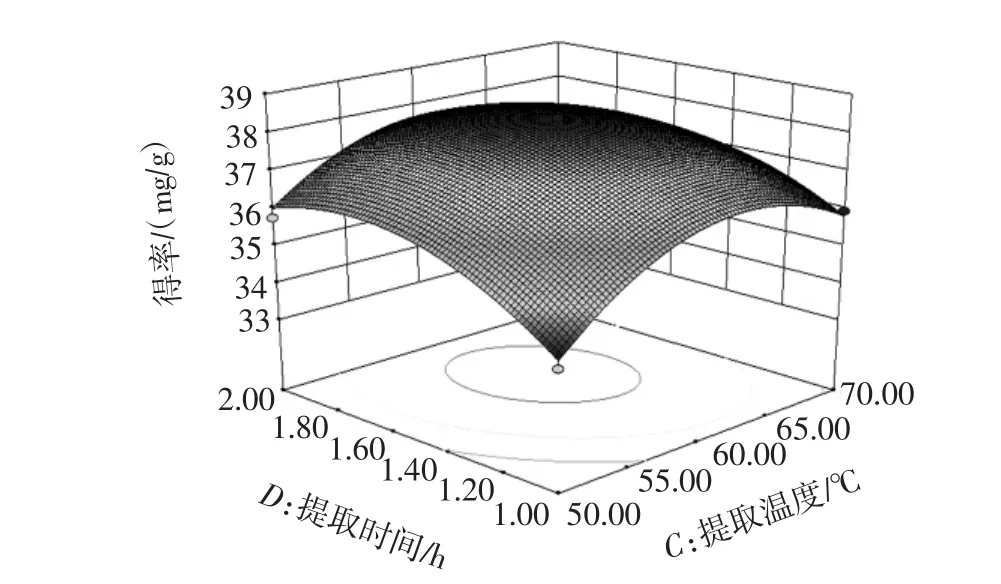
图10 提取温度与提取时间的交互作用Fig.10 Interaction effect of extraction temperature and extraction time
2.4.3 最佳工艺条件
用Design-expert 8.0.6软件设计优化得出最佳的提取条件为料液比1∶10.07(g/mL)、乙醇体积分数71.02%、提取温度61.14℃、提取时间1.64 h,预测得率为38.31 mg/g。为方便实际操作,花生壳黄酮的提取工艺修正为:料液比1∶10(g/mL)、乙醇体积分数71%、提取温度61℃、提取时间1.6 h。
2.4.4 验证性试验
对上述最终修正的提取工艺条件进行验证试验,设置4次平行试验,黄酮得率分别为:38.45、38.58、38.26、38.72 mg/g,得到江永小壳型生花生壳黄酮得率平均值为38.50 mg/g,与理论值38.31 mg/g相差较小,说明得到的工艺条件稳定,具有应用价值。
3 结论
通过比较3个品种的花生壳黄酮含量差异得到江永小壳型花生壳含量最高,然后比较了不同加工方法的花生壳黄酮含量差异得到生花生壳含量高,然后采用单因素试验和响应面法优化了江永小壳型生花生壳黄酮提取工艺,得到其最佳工艺条件为:料液比1∶10(g/mL)、乙醇体积分数71%、提取温度61℃、提取时间1.6 h,该条件下,黄酮得率为38.50 mg/g,该工艺操作简便,提取效果好,工艺稳定,适合于工业化生产,为更好的合理利用废弃物花生壳及为江永花生壳的综合开发利用提供理论参考。
[1]胡明明.花生壳多酚的提取、纯化及其抗氧化、抑菌活性研究[D].南昌:南昌大学,2012
[2]徐苏,严滨,陶永贵,等.基于正交设计的花生壳颗粒燃料成型配比研究[J].可再生能源,2013,31(4):74-77
[3]潘嘉平,刘淑艳,姜楠,等.花生壳培养基对杏鲍菇菌丝生长的影响[J].菌物研究,2011,9(1):50-53
[4]Zhang G W,Hu M M,He L,et al.Optimization of microwaveassisted enzymatic extraction of polyphenols from waste peanut shells and evaluation of its antioxidant and antibacterial activities in vitro[J].Food&Bioproducts Processing,2013,91(2):158-168
[5]方志锋,陈复生,刘昆仑,等.表面活性剂辅助微波-NaOH预处理花生壳乙醇化工艺研究[J].食品与机械,2013,29(4):145-148
[6]Ahmad M,Lee S S,Dou X M,et al.Effects of pyrolysis temperature on soybean stover-and peanut shell-derived biochar properties and TCE adsorption in water[J].Bioresource Technology,2012,118(8):536-544
[7]彭禹,张后虎,蔡邦成,等.微波辐照制备花生壳活性炭研究[J].环境工程,2015,33(5):42-47
[8]穆瑞荷.花生壳综合利用研究[J].现代农业科技,2010(4):374-376
[9]左爱学,孙赟,钱绍祥,等.花生壳化学成分研究 [J].中药材, 2015,38(2):302-304
[10]杨洋,聂静然,关红艳,等.花生壳木犀草素的提取及其抑菌性能研究[J].食品科技,2009(12):211-216
[11]邓斌,王存嫦,徐安武.微波辅助提取花生壳黄酮类化合物及其抗氧化性研究[J].中国油脂,2009,34(3):54-57
[12]张慧清,孙忠文,鞠建明,等.花生壳降血脂有效部位的研究[J].时珍国医国药,2011,22(1):148-149
[13]牛丹丹,刘彩霞,刘绣华,等.高速逆流色谱法分离制备花生壳中的黄酮类化合物[J].天然产物研究与开发,2011,23(1):110-113
[14]曾超珍,刘志祥.响应面优化酶法提取花生壳黄酮类化合物的工艺研究[J].湖北农业科学,2016,55(6):1532-1537
[15]毕海丹,万照东,崔旭海,等.花生壳总黄酮提取工艺优化及其抑菌活性研究[J].江苏农业科学,2015,43(7):297-299
[16]范金波,周素珍,郑立红,等.微波辅助提取花生壳总黄酮工艺参数的优化[J].中国食品学报,2013,13(11):55-60
[17]王宗成,蒋玉仁,刘小文,等.响应面优化生姜茎叶总黄酮提取工艺及其抗氧化活性研究 [J].天然产物研究与开发,2015,27(9):1582-1588
[18]张良晨,王波,石太渊,等.超声波辅助提取高粱壳黄酮色素工艺的研究[J].食品工业,2016(12):5-8
[19]陈洪彬,郑金水,蔡英卿,等.紫苏叶中总黄酮的超声波辅助提取工艺优化[J].食品与机械,2014,30(5):232-236
Contents Comparatives and Optimization of Extraction Technology of Flavonoids of Peanut Hulls
JIANG Hong-yu1,2,3,TAN Jie-xiong1,YIN Su-fang1,WU Ming1,ZHANG Ting-ting1,WANG Zong-cheng1,2,3,*
(1.College of Chemical and Biological Engineering,Hunan University of Science and Engineering,Yongzhou 425199,Hunan,China;2.Hunan Provincial Engineering Research Center for Ginkgo Biloba,Hunan University of Science and Engineering,Yongzhou 425199,Hunan,China;3.Hunan Key Laboratory of Comprehensive Utilization of Advantage Plants Resources of Southern Hunan,Hunan University of Science and Engineering,Yongzhou 425199,Hunan,China)
To utilize waste peanut shell,contents comparison of flavonoids of peanut hulls from the three Cultivars and different processed methods were analyzed,and the response surface method was used to optimize the extraction technology.The results showed that flavonoids content of the small shell type peanut shells from Jiangyong highest,and the best extraction technology conditions for:solid-liquid ratio 1:10(g/mL),ethanol concentration 71%,extracting temperature 61℃,extracting time 1.6 h.Under this condition,the extraction yield of total flavonoids was 38.50 mg/g.
peanut hulls;total flavonoids;extraction technology;content determination
2017-05-22
湖南省高校科技创新团队支持计划(2012-318);湖南科技学院生物工程重点学科资助;永州市科技计划项目[永科发(2016)27号-8]
姜红宇(1971—),男(汉),讲师,博士,主要从事药物合成及天然产物开发。
*通信作者:王宗成(1983—),男,讲师,主要从事天然产物的利用与开发。
10.3969/j.issn.1005-6521.2017.16.009

