酪氨酸激酶3对赫赛汀耐药的卵巢癌细胞株SKOV3/H增殖和成瘤能力的影响
耿介
(郑州大学第二附属医院 妇产科,河南 郑州 450014)
酪氨酸激酶3对赫赛汀耐药的卵巢癌细胞株SKOV3/H增殖和成瘤能力的影响
耿介
(郑州大学第二附属医院 妇产科,河南 郑州 450014)
目的探索erb-b2受体酪氨酸激酶3(HER-3)对卵巢癌耐药细胞株SKOV3/H的体外增殖和体内成瘤能力的影响。方法采用赫赛汀浓度递增法构建SKOV3耐药细胞株(赫赛汀起始浓度为5 mg/L,经5~8次浓度递增,每次提高50%)。实时荧光定量聚合酶链反应(qRT-PCR)检测HER-3在15对非耐药卵巢癌组织和耐药卵巢癌组织中的表达(SKOV3和SKOV3/H细胞中的表达)。MTT实验验证分别转染sh-HER-3及其对照质粒vector对SKOV3/H细胞增殖能力的影响。将包含sh-HER-3的重组慢病毒质粒及其阴性对照慢病毒空载体质粒vector(均带egfp荧光标签)分别以病毒/细胞数量=15的比例感染SKOV3/H细胞,加入2.0 μg/ml的嘌呤霉素筛选,构建稳定转染sh-HER-3或vector的SKOV3/H细胞,将2株细胞分别注射到裸鼠皮下,复制卵巢癌裸鼠移植瘤模型,观察体内成瘤情况。结果成功构建卵巢癌SKOV3耐赫赛汀细胞株SKOV3/H,且SKOV3/H的群体倍增时间为SKOV3细胞的1.4~1.9倍。HER-3在耐药卵巢癌组织中的表达水平高于非耐药癌组织(P<0.05),且HER-3在耐药细胞株SKOV3/H中的表达水平也高于非耐药卵巢癌细胞株SKOV3(P<0.05)。转染sh-HER-3后,SKOV3/H细胞的增殖能力低于阴性对照组(P<0.05)。转染sh-HER-3后,耐药细胞株SKOV3/H的裸鼠体内成瘤能力降低(P<0.05)。结论HER-3参与卵巢癌的赫赛汀耐药,并正向影响耐药细胞株SKOV3/H的增殖和体内成瘤能力。
卵巢癌;赫赛汀耐药;HER-3;增殖;体内成瘤
Abstract:ObjectiveTo explore the role of HER-3 in ovarian cancer and Herceptin resistant ovarian cancer,and the effect of HER-3 on the proliferation abilities in vitro and tumorigenicity abilities in vivo of Herceptin-resistant ovarian cancer cell SKOV3/H.MethodsHerceptin concentration was gradually increased to construct resistant cell lines (C0=5 mg/L,increased 5 to 8 times,each time increased by 50%).qRT-PCR was used to detect the expression of HER-3 in 15 pairs of ovarian cancer tissues which were non-resistant or resistant to Herceptin,and the expression of HER-3 in SKOV3 and SKOV3/H cells.MTT experiment was used to detect the proliferation of SKOV3/H after infected with sh-HER-3 or vector.KOV3/H cells infected with sh-HER-3 or vector were subcutaneously injected into nude mice to build the ovarian cancer xenografts.Tumor formation was observed in vivo situation.ResultsSuccessfully constructed the Herceptin-resistant ovarian cancer cell line SKOV3/H,the Td of SKOV3/H was 1.4 to 1.9 times of SKOV3.The expression levels of HER-3 was significantly higher in Herceptin resistant ovarian cancer tissues(P<0.05),and HER-3 expression levels were also significantly higher in SKOV3/H cells (P<0.05).After transfected with sh-HER-3,theproliferation and tumorigenicity abilities of SKOV3/H were significantly lower than vector group(P<0.05).The tumorigenicity ability of SKOV3/H in mice was significantly reduced (P<0.05).ConclusionsHER-3 is involved in the Herceptin resistant of ovarian cancer and affects the proliferation and in vivo tumorigenicity of SKOV3/H.
Keywords:ovarian cancer;herceptin resistant;HER-3;proliferation;tumorigenesis in vivo
卵巢癌是严重影响女性生殖健康的常见恶性肿瘤之一,其致死率长期处于女性恶性肿瘤的首位,其中约90%的卵巢癌为上皮性卵巢癌,由于其发病症状不明显,大多数患者被确诊时已属于晚期卵巢癌,易复发转移,治疗预后差,5年生存率低[1]。
目前,临床用于治疗卵巢癌的药物主要有化疗药物铂类(如顺铂、卡铂),紫杉醇等,靶向药物吉非替尼、西妥昔单抗、贝伐单抗、曲贝替定及曲妥珠单抗等[2]。其中曲妥珠单抗又称赫赛汀,为表皮生长因子受体家族成员(human epidermal growth factor receptor,EGFR)抑制剂[3],主要作用靶点为细胞膜(erb-b2)受体酪氨酸激酶2(human epidermal growth factor receptor-2,HER-2)。人表皮生长因子受体家族主要包括EGFR、HER-2、HER-3和HER-4 4个成员[4]。EGFR家族的异常表达与许多人类恶性肿瘤的发生、发展相关,例如乳腺癌、卵巢癌和胃癌等[5-7]。在卵巢癌中,赫赛汀可用于HER2过表达型卵巢癌的治疗[8]。研究表明,许多卵巢癌患者在赫赛汀初始治疗时即可出现耐药,也有患者在赫赛汀治疗1年后出现获得性耐药[9],而目前的卵巢癌治疗中,赫赛汀靶向HER-2的耐药机制尚不明确,作为HER-2同家族的HER-3,近年来常有研究报道显示,HER-3与HER-2共表达,乳腺癌中HER3的表达与赫赛汀的耐药密切相关[10]。因此,本研究拟从HER-3的角度,探究HER-3在卵巢癌中的作用,HER-3在卵巢癌赫赛汀耐药中的作用,HER-3对卵巢癌耐药细胞株(SKOV3/H)的增殖和体内成瘤能力的影响。以期望为卵巢癌患者的早期诊断和治疗提供更加完善、精准的治疗方案,改善卵巢癌患者的预后及生存。
1 材料与方法
1.1 主要材料
LipofectamineTM2000和Trizol试剂(购于美国Invitrogen公司),核糖核酸(ribonucleic acid,RNA)抽提试剂盒(购买于美国Applied Biosystems公司),Taq Man逆转录试剂盒(英国Life Technologies公司),qSYBR-Green-containing PCR kit(美国Qiagen公司),赫赛汀(美国Gh公司)。血细胞计数板(16×25格),Thermo Multiskan Ascent酶标仪,型号 413 MBY042078(美国萨默飞世尔公司)。
1.2 细胞培养
SKOV3细胞(来源于中国科学院上海生命科学院生化细胞所),细胞培养于含10%胎牛血清(fetal bovine serum,FBS)(美国 Gibco公司)和 100 u/ml青霉素和0.1 mg/ml链霉素(美国Invitrogen公司)双抗的RPMI 1640培养基(美国Sigma公司)中,细胞放置于37℃、含5%二氧化碳CO2的细胞培养箱内孵育。建立卵巢癌耐药细胞株SKOV3/H:用含10%胎牛血清和双抗的RPMI 1640培养基培养卵巢癌细胞SKOV3,0.5%胰蛋白酶消化传代。在细胞生长密度达80%~90%时,加入赫赛汀5 mg/L,作用1 h后更换培养基,第2天约50%左右的细胞死亡。细胞逐渐恢复且生长密度达80%~90%时,继续重复该步骤5~8次,逐步提高赫赛汀浓度,每次提高50%。直到某一浓度时,细胞基本无死亡、耐药指数(resistant index,RI)>3.0、能保持传代3个月仍维持类似耐药性。此时即成功建立卵巢癌耐药细胞株SKOV3/H。
1.3 稳定表达sh-HER-3重组慢病毒质粒及其对照质粒载体细胞株的建立
包含sh-HER-3的重组慢病毒质粒及其阴性对照慢病毒空载体质粒载体(均带egfp的荧光标签)(美国Gene Copoeia公司构建),将2种质粒分别以病毒/细胞数量=15的比例感染SKOV3/H细胞,感染3 d后观察荧光的表达量,并加入2.0 μg/ml的嘌呤霉素,继续培养,直到所有细胞均可观察到荧光的表达。此时即构建了稳定表达sh-HER-3的细胞株及其阴性对照。
1.4 临床样本及RNA提取
选取2013年6月-2015年6月本院病理科确诊并进行手术切除的赫赛汀耐药卵巢癌组织15例,与赫赛汀耐药组的患者对应年龄、性别及病理状态的非耐药卵巢癌组织15例。其中两组患者的平均年龄分别为(40±16.03)和(39.98±16.00)岁,两组均为已婚9例,未婚6例,绝经8例,未绝经7例。患者的所有临床病理学数据均被妥善保存且可随时查阅。实验的所有过程遵从赫尔辛基宣言,该研究得到我院伦理委员会的支持,且与所有患者签署了知情同意书,研究方案经我院伦理委员会批准。该15例赫赛汀耐药卵巢癌组织和非耐药卵巢癌组织均保存于液氮中用于提取RNA。
取液氮保存的耐药卵巢癌组织和非耐药卵巢癌组织各100 mg,各加入700 ml Trizol试剂,充分研磨(SKOV3和SKOV3/H细胞系总RNA提取则6孔板中各加入100μl Trizol,其他试剂按比例递减)。室温放置5min,加入140ml氯仿,剧烈震荡15 s。室温放置 5min,12000r/min,4℃离心 15min。吸取上层液体到另一干净离心管,按0.5 ml异丙醇 Trizol的比例加入异丙醇,混匀,室温放置10 min,离心去除上清液。加入1 ml 75%乙醇洗涤沉淀,7 500 r/min,4℃离心5 min,弃上清液,室温干燥,加入30 μl无核糖核酸酶水溶解,取1μl测RNA浓度和纯度,剩余RNA立即放入-20℃冰箱冷冻保存备用。
1.5 实时荧光定量聚合酶连反应检测
以1.4中提取的组织和细胞总RNA为模板,按逆转录试剂盒说明书进行操作,逆转录生成互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA),以cDNA为模板,按 qSYBR-Green-containing PCR kit说明书进行操作,Bio Rad IQTM5 Multicolor实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)系统检测(美国伯乐生命医学产品公司)。HER-3引物由(美国Invitrogen公司)合成,正向引物:5'-AGGCACGAGGAA CAAGCTCAC-3';反向引物:5'-ATGAGGACATAACC AGCCACC-3'。β-actin为内参,正向引物:5'-CTCC ATCCTGGCCTCGCTGT-3',反向引物:5'-GCTGTCAC CTTCACCGTTCC-3'。2-ΔΔCT用于计算相对表达量,ΔΔCT=(CTmiRNA-CTβ-actin)target-(CTmiRNA CTβ-actin)control。反应体系为 20 μl,每组实验设置3个复孔。
1.6 细胞生长曲线绘制
将SKOV3和SKOV3/H细胞0.25%胰酶消化后调整细胞密度至1×103个/ml,接种至24孔板,每孔600 μl,细胞计数(血细胞计数板读出细胞数,16×25格血球计数板计算公式:1 ml细胞数=每小格细胞数×400×104×稀释倍数),4 d/次,连续 28 d,并取其对数值-3,绘制细胞生长曲线,Patterson公式计算细胞在对数生长期的群体倍增时间(Td)=T[lg2/lg(N/N0)](T=天数,N=实际细胞数,N0=初始细胞数)。
1.7 MTT实验
将实验分成sh-HER-3组和阴性对照组。将稳定转染的sh-HER-3和阴性对照组的SKOV3/H细胞接种到96孔板,每组设置5个复孔,细胞汇合度接近90%时,在每孔加入灭菌MTT液30 μl(其浓度为5 mg/ml)。37℃孵育4 h后向每孔中加入150 μl DMSO,低速振荡10 min,随后选择570 nm波长,酶标仪(Thermo Multiskan Ascent酶标仪,型号413MB Y042078)测定各孔的吸光值并记录结果,每组实验重复3次。
1.8 裸鼠移植瘤模型
将裸鼠分两组,每组3只,将构建的稳定转染sh-HER-3及其阴性对照的SKOV3/H细胞分别皮下注射到裸鼠体内,注射量为每只6×106个/ml,共100 μl。每4天观测1次裸鼠体内瘤体的体积与大小,裸鼠体内瘤体的体积(V)=(长径×短径2)/2,4周后处死小鼠并解剖,取出瘤体,所有操作均符合动物伦理学。
1.9 统计学方法
数据分析采用SPSS 15.0统计软件,计量资料以均数±标准差(±s)表示,两组资料取正态分布的总体,并满足方差齐性,两组数据比较t检验,多组比较用单因素方差分析,多时点观测资料则用重复测量方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 赫赛汀诱导卵巢癌细胞株生长情况
短梭形SKOV3细胞在赫赛汀诱导后,细胞形态改变且体积变大,边缘有树突状分支且呈星型,胞浆内形成空泡和颗粒,该现象在给药1 d时最明显,5 d后恢复最初状态,此时SKOV3和SKOV3/H形态差异无统计学意义(见图1A)。SKOV3/H生长速度低于SKOV3,根据Patterson公式计算细胞在对数生长期的群体倍增时间(Td)=T[lg2/lg(N/N0)](T=天数,N=实际细胞数,N0=初始细胞数),其中SKOV3/H细胞的群体倍增时间为(28.33±2.12)h,SKOV3细胞的Td值为(46.52±2.71)h,SKOV3/H细胞的Td为SKOV3细胞的1.4~1.9倍,差异有统计学意义(P<0.05)。见图 1B。
2.2 HER-3在卵巢癌耐药组织和细胞系中的表达
qRT-PCR检测了HER-3在15例卵巢癌耐药和非耐药癌组织中的表达,与非耐药癌组织比较,HER-3在耐药癌组织中表达上调[(0.773±0.235)vs(1.358±0.464)],差异有统计学意义(P<0.05)(见图2A)。随后分别检测HER-3在非耐药细胞株SKOV3和耐药细胞株SKOV3/H中的表达,与SKOV3细胞比较,耐药细胞株SKOV3/H中HER-3的表达上调[(1.037±0.119)vs(1.540±0.089)],差异有统计学意义(P<0.05)(见图 2B)。
2.3 靶向HER-3抑制卵巢癌细胞株SKOV3/H的增殖能力
分别转染HER-3的shRNA和阴性对照到SKOV3/H细胞中,qRT-PCR结果显示,转染sh-HER-3后,SKOV3/H细胞中HER-3的mRNA表达水平较阴性对照组降低(阴性对照组:1.032±0.013,sh-HER-3 组:0.346±0.004)(P<0.05)(见图 3A),即转染成功。
MTT实验共分两组,分别转染sh-HER-3和阴性对照到SKOV3/H细胞中。转染48 h后,与阴性对照转染组比较,sh-HER-3转染组SKOV3/H细胞的增殖能力被抑制 [抑制率的数值阴性对照组:(97.67±2.08)%,sh-HER-3 组:(45.00±15.00)%],差异有统计学意义(P<0.05)。见图3B。
2.4 靶向HER-3抑制卵巢癌细胞株SKOV3/H的体内成瘤能力
为评估HER-3对卵巢癌耐药细胞株SKOV3/H体内成瘤能力的影响,将复制的稳定转染sh-HER-3和阴性对照SKOV3/H细胞株,皮下注射到裸鼠体内(每组3只),复制裸鼠荷人卵巢癌移植瘤模型,4周后处死裸鼠并取出瘤体组织,结果显示sh-HER-3组裸鼠成瘤体积小于阴性对照组(P<0.05)(见图4)。
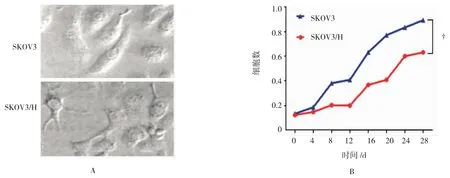
图1 卵巢癌耐药细胞株SKOV3/H的检测结果
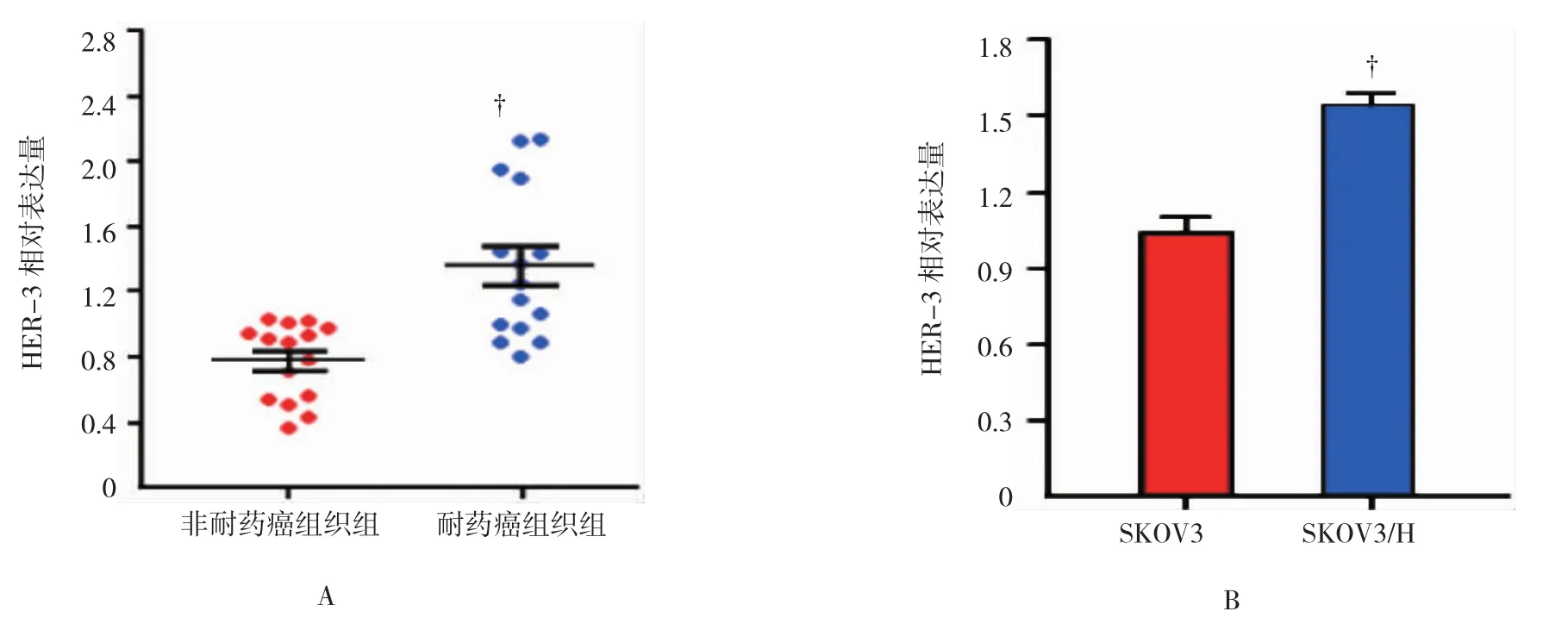
图2 HER-3在卵巢癌耐药和非耐药组织及细胞系中的表达水平

图3 抑制HER-3对SKOV3和SKOV3/H细胞增殖能力的影响

图4 抑制HER-3对SKOV3/H裸鼠体内成瘤能力的影响
3 讨论
卵巢癌是临床上常见的女性恶性肿瘤之一,其致死率居于女性恶性肿瘤的首位,其中尤以上皮性卵巢癌的致死率最高[11]。目前卵巢癌的主要治疗方案有手术治疗、一线化疗、腹腔化疗、新辅助化疗、靶向治疗、基因治疗、免疫治疗、内分泌治疗和中医治疗等[12]。其中靶向治疗是一种以标准化生物标志物识别是否存在某种疾病特定的控制肿瘤生长的基因或基因谱,以确定针对特异性靶点的治疗方法,又被称为“生物导弹”,可靶向肿瘤特异性组织,而不对正常组织造成损伤,因此其在卵巢癌治疗中运用较为广泛[13]。
EGFR是与卵巢癌靶向治疗密切相关的重要受体,其在多种恶性肿瘤中均存在过表达的现象[14]。EGFR家族包括erbB1/HER-1/EGFR,erbB2/HER-2、erbB3/HER-3和erbB4/HER-4共4个成员,目前针对HER-2的研究较多,但与HER-3相关的研究却较少,并且观点并不统一,有学者认为HER-3在癌中高表达,与患者的生存无关;有学者认为,HER-3和HER-2的过度表达高度相关,且HER-3阳性与阴性患者OS差异有统计学意义[15]。目前以EGFR家族为主要靶点的药物研发已成为近年来靶向药物研发的重点,临床常用的卵巢癌靶向治疗药物以EGFR抑制剂为主,包括吉非替尼(作用靶点EGFR)、西妥昔单抗(作用靶点EGFR)和曲妥珠单抗(赫赛汀,作用靶点 HER-2)等[16]。
药物耐药是导致肿瘤治疗转移和复发,并最终导致治疗失败的主要原因之一。研究表明,HER-2阳性的卵巢癌患者在接受赫赛汀治疗后,仍然有约60%的患者产生药物抵抗或复发转移,最终导致治疗失败[17]。目前,针对卵巢癌的赫赛汀耐药尚无有效的预防及改善措施,因此寻找卵巢癌患者赫赛汀耐药的内在机制,减少或逆转赫赛汀的耐药,将为卵巢癌的治疗和预防带来较大的益处。
本研究成功构建对赫赛汀耐药的卵巢癌耐药细胞株SKOV3/H,检测SKOV3/H和SKOV3细胞、赫赛汀耐药和非耐药的卵巢癌组织中HER-3的表达水平,笔者发现HER-3在卵巢癌的赫赛汀耐药细胞株和组织中均存在过表达的现象,本研究结果与HER-3在多种癌组织中存在过表达的现象相一致,如HER-3在低分化的乳腺癌中高表达[18]。由于HER-3的过表达可促进肿瘤的发生发展,使肿瘤细胞具有更强的侵袭性和转移性[19],抑制HER-3的表达,可抑制胃癌细胞的增殖、迁移和存活能力[20],因此推测在赫赛汀耐药的SKOV3/H细胞中抑制HER-3的表达,将可能降低SKOV3/H细胞的恶性程度。
笔者转染sh-HER-3及其对照质粒到耐药细胞株SKOV3/H中,采用MTT和体内成瘤实验来验证猜想,结果与猜想一致,即抑制耐药细胞株SKOV3/H中HER-3的表达,可抑制SKOV3/H细胞的体外增殖和体内成瘤能力。而关于该抑制作用的实现过程,研究显示HER-3可先通过HER-2介导而发生磷酸化,并与磷脂酰肌醇-3-激酶(PI-3K)结合,随后激活与细胞的增殖、生长和迁移等密切相关的PI-3K通路,从而促进肿瘤的发生发展[21]。另外,PI-3K/Akt信号通路还与表皮生长因子受体(EGFR、HER-2)的靶向药物耐药相关,该过程可经HER-3激活[22]。关于HER-3对EGFR或HER-2靶向药物产生耐药性的内在机制,有研究认为与HER-3的过表达密切相关[23],而笔者在卵巢癌的赫赛汀耐药细胞株和组织中观察到该现象,研究显示临床常用的EGFR家族的分子靶向药物吉非替尼或赫赛汀,对HER-2阳性患者产生耐药性的原因可能是HER-3在组织和细胞内存在重排的现象[24],可用于解释HER-3在卵巢癌的赫赛汀耐药细胞株和组织中存在过表达现象的原因。
综上所述,HER-3与卵巢癌治疗中的赫赛汀耐药密切相关,靶向抑制HER-3可抑制赫赛汀耐药细胞株的增殖和体内成瘤能力,研发靶向HER-3的药物将大大提高赫赛汀在卵巢癌临床治疗和和预防中的作用。
[1]EBELL M H,CULP M B,RADKE T J.A systematic review of symptoms for the diagnosis of ovarian cancer[J].American Journal of Preventive Medicine,2016,50(3):384-394.
[2]DONG A,LU Y,LU B.Genomic/Epigenomic alterations in ovarian carcinoma:translational insight into clinical practice[J].Journal of Cancer,2016,7(11):1441-1451.
[3]TEPLINSKY E,MUGGIA F.Targeting HER2 in ovarian and uterine cancers:challenges and future directions[J].Gynecol Oncol,2014,135(2):364-370.
[4]CHUANG J C,SHRAGER J B,WAKELEE H A,et al.Concordant and discordant EGFR mutations in patients with multifocal adenocarcinomas:implications for EGFR-targeted therapy[J].Clinical Therapeutics,2016,38(7):1567-1576.
[5]LI J,LIU J,GUO N,et al.Reversal of multidrug resistance in breastcancerMCF-7/ADR cellsbyh-R3-siMDR1-PAMAM complexes[J].International Journal of Pharmaceutics,2016,511(1):436-445.
[6]LI D,WU Q J,BI F F,et al.Effect of the BRCA1-SIRT1-EGFR axis on cisplatin sensitivity in ovarian cancer[J].American Journal of Translational Research,2016,8(3):1601-1608.
[7]PARK J S,KIM H S,BAE Y S,et al.Prognostic significance and frequency of EGFR expression and amplification in surgically resected advanced gastric cancer[J].Japanese Journal of Clinical Oncology,2016,46(6):507-516.
[8]ELMLUND L,KACK C,AASTRUP T,et al.Study of the interaction of trastuzumab and SKOV3 epithelial cancer cells using a quartz crystal microbalance sensor[J].Sensors,2015,15(3):5884-5894.
[9]LI X,DUAN Y,QIAO C,et al.Anti-HER3 monoclonal antibody inhibits acquired trastuzumab-resistantgynecologic cancers[J].Technology in Cancer Research&Treatment,2016,15(4):573-582.
[10]CRAFTER C,VINCENTJ P,TANG E,etal.Combining AZD8931,a novel EGFR/HER2/HER3 signalling inhibitor,with AZD5363 limits AKT inhibitor induced feedback and enhances antitumour efficacy in HER2-amplified breast cancer models[J].International Journal of Oncology,2015,47(2):446-454.
[11]张恒,王宇平,谷杨,等.不同给药途径的新辅助化疗在晚期上皮性卵巢癌的疗效观察[J].现代生物医学进展,2015,15(1):96-99.
[12]丁滨.卵巢癌治疗研究进展[J].人民军医,2011,54(3):237-239.
[13]WANG M,MA H.Paired box gene 2 is associated with estrogen receptor alpha in ovarian serous tumors:potential theory basis for targeted therapy[J].Molecular& Clinical Oncology,2016,5(2):323-326.
[14]JACCA S,ROLIH V,QUAGLINO E,et al.Bovine herpesvirus 4-based vector delivering a hybrid rat/human HER-2 oncoantigen efficiently protects mice from autochthonous Her-2mammary cancer[J].Oncoimmunology,2015,5(3):e1082705.
[15]REVILLION F,LHOTELLIER V,HORNEZ L,et al.ErbB/HER ligands in human breast cancer,and relationships with their receptors,the bio-pathological features and prognosis[J].Annals of Oncology,2008,19(1):73-80.
[16]FUCHS I,VORSTEHER N,BUHLER H,et al.The prognostic significance of human epidermal growth factor receptor correlations in squamous cell cervical carcinoma[J].Anticancer Research,2007,27(2):959-963.
[17]DAMASCENO K A,FERREIRA E,ESTRELA-LIMA A,et al.HER-2 and EGFR mRNA expression and its relationship with versican in malignant matrix-producing tumors of the canine mammary gland[J].PLoS One,2016,11(8):e0160419.
[18]STEELMAN L S,FITZGERALD T,LERTPIRIYAPONG K,et al.Critical roles of EGFR family members in breast cancer and breast cancer stem cells:targets for therapy[J].Current Pharmaceutical Design,2016,22(16):2358-2388.
[19]KANG J C,POOVASSERY J S,BANSAL P,et al.Engineering multivalent antibodies to target heregulin-induced HER3 signaling in breast cancer cells[J].MAbs,2014,6(2):340-353.
[20]张挺丽,王彬,吴锦昌,等.HER3在乳腺癌中的表达及临床意义[J].肿瘤防治研究,2012,39(5):538-541.
[21]OZKAVRUK E N,AKTAS S,OZGUR H,et al.The role of p95HER2 in trastuzumab resistance in breast cancer[J].Journal of Buon Official Journal of the Balkan Union of Oncology,2016,21(2):382-389.
[22]SERVIDEI T,RICCARDI A,MOZZETTI S,et al.Chemoresistant tumor cell lines display altered epidermal growth factor receptor and HER3 signaling and enhanced sensitivity to gefitinib[J].International Journal of Cancer,2008,123(12):2939-2949.
[23]王崇伟,马振海,赵永福,等.HER-3在乳腺癌组织中的表达及其临床意义[J].中国普外基础与临床杂志,2013,20(2):45-48.
[24]SERGINA N V,RAUSCH M,WANG D,et al.Escape from HER-family tyrosine kinase inhibitor therapy by the kinase-inactive ER3[J].Nature,2007,445(7126):437-441.
Effect of HER-3 on proliferation and tumorigenicity abilities of Herceptin-resistant ovarian cancer cell line SKOV3/H
Jie Geng
(Department of Gynecology,the Second Affiliated Hospital of Zhengzhou University,Zhengzhou,Henan 450014,China)
R737.31
A
10.3969/j.issn.1005-8982.2017.15.005
1005-8982(2017)15-0022-07
2016-12-26

