整合素β1-黏附斑激酶在心肌纤维化中的作用及机制*
林传钦,翟秀丽,邓托
(1.海南省农垦三亚医院 急诊科,海南 三亚 572000;2.海南省三亚市三林医院 防治科,海南 三亚 572025)
整合素β1-黏附斑激酶在心肌纤维化中的作用及机制*
林传钦1,翟秀丽2,邓托1
(1.海南省农垦三亚医院 急诊科,海南 三亚 572000;2.海南省三亚市三林医院 防治科,海南 三亚 572025)
目的初步探讨整合素β1-黏附斑激酶(integrin β1-FAK)在心肌细胞纤维化中的作用与机制。方法将培养的心肌细胞随机分为对照组、血清脂肪酶(LPS)处理组、integrin β1抑制组、黏附斑激酶(FAK)抑制组及integrinβ1阻断+FAK抑制组。免疫荧光双标法检测原代心肌细胞纯度,逆转录聚合酶链反应(RT-PCR)与实时荧光定量聚合酶链反应(qRT-RCR)检测基质金属蛋白酶9(MMP-9)、转化生长因子β1(TGF-β1)、Ⅰ型胶原(Col1A1)、Ⅲ型胶原(Col3A1)和整合素β1(integrin β1)mRNA水平的变化,Western blot检测FAK的表达。结果①与对照组比较,LPS能够刺激心肌细胞上调MMP-9、TGF-β1、Col1A1、Col3A1及integrin β1表达;②与LPS组比较,integrin β1阻断可以抑制LPS诱导的TGF-β1、MMP-9、Col1A1及Col3A1信使核糖核酸(mRNA)的上调(P<0.05),并阻断LPS诱导的磷酸化FAK的激活(P<0.05);③FAK蛋白抑制剂PF-573228可抑制LPS诱导的TGF-β1和MMP-9 mRNA上调水平,同时加入integrin β1封闭性抗体显示相似的效果。结论Integrin β1阻断能抑制FAK的磷酸化,下调TGF-β1、MMP-9、Col1A1及Col3A1的表达,从而改善在持续炎症刺激条件下心肌细胞的纤维化反应进程,为未来临床治疗拓展新思路。
心肌纤维化;整合素;黏附斑激酶;血清脂肪酶
Abstract:ObjectiveTo study the effects and mechanisms of integrin β1-FAK on myocardial fibrosis.MethodsCells were randomly divided into five groups:the blank control group,the LPS-stimulated group,integrin β1blocking group,FAK blocking group,blocking integrin β1and FAK group.Double-immunostaining was used to test the purity of myocardial cells.RT-PCR and q-PCR were used to detect the gene expression of MMP-9,TGF-β,Col1A1,Col3A1 and integrin β1.Western blot method was used to detect the expression of FAK protein.ResultsCompared with those in the control group,the LPS-treated cells exhibited a significant increase of MMP-9,TGF-β,Col1A1,Col3A1 and integrin β1,while blocking the integrin β1prevented the increase in LPS-induced up-regulation of MMP-9,TGF-β,Col1A1,Col3A1 and integrin β1and inhibited the FAK phosphorylation.Furthermore,when the cells were treated with the FAK agonist,the expression of MMP-9 and TGF-β decreased,and it had similar effect with blocking integrin β1.ConclusionsOurstudy suggeststhatinhibition ofintegrin β1suppresses the FAK phosphorylation,and decreasesexpressons of MMP-9,TGF-β,Col1A1,Col3A1,which contributes to alleviate the development of myocardial fibrosis under the condition of continuous inflammation stimulation and provides new ideas for the future clinical treatment stimulated H9c2 cardiomyocytes.
Keywords:myocardial fibrosis;integrin;focal adhesion kinase;lipase
心肌纤维化(myocardial fibrosis,MF)是以胶原过度沉积以及细胞外基质增多为特征的慢性病理过程,其发展在一定程度上影响着心肌梗死、高血压病、肥厚性心肌病及心力衰竭等多种心血管疾病的预后及转归[1-2]。尽管目前已有许多研究试图去揭示心肌纤维化的形成机制及所涉及的相关信号通路,例如心肌张力/压力的改变,转化生长因子β1(transforming growth factor-beta 1,TGF-β1)信号通路的激活等[3-5],但是总体而言,心肌纤维化的机制仍未完全明了,尚需进一步研究阐明。目前已有研究表明,心肌纤维化涉及到细胞外基质(extracellular matrixc,ECM)的产生[6]。而整合素(Integrin)作为介导细胞外环境与细胞相互作用的重要信号转导分子,其与细胞周围ECM蛋白质的结合对细胞黏附、功能传递、增殖及分化等具有重要的调控作用[7-9]。然而,目前关于integrin β1受体是否是介导心肌纤维化,整合素β1(beta-1 integrins,integrin β1)激活后又是通过何种信号通路来调控心肌纤维化等并不清楚。基于以上问题,本研究拟探讨integrin β1在心肌纤维化中的作用与相关机制。
1 材料与方法
1.1 材料
杜氏磷酸盐缓冲液(Dulbecco's phosphate buffered saline,D-PBS)、胎牛血清、DMEM/F12 细胞培养液及L-谷氨酰胺(购自美国Hyclone公司),兔抗磷酸化黏附斑激酶抗体(anti-phospho-focal adhesion kinase,Anti-P-FAK)、Anti-FAK、心肌肌钙蛋白 T(cardiac troponin T,cTnT)、α-Sarcomeric Alexa Fluor 488及水溶性荧光染料(cyanine dye 3,Cy3)(购自美国Abcam公司),Anti-GAPDH兔抗和辣根过氧化物酶标记(horse radish peroxidase,HRP)的羊抗兔二抗(购自美国的Cell Signaling Technology公司),DMEM、胎牛血清及胰酶消化液(Trypsin-EDTA)(购自美国Gibco公司),聚氰基丙烯酸正丁酯(Butyleyanoacrylate,BCA)蛋白定量检测试剂盒(购自陕西省西安飞扬生物科技有限公司),RIPA裂解液(radio immunoprecipitation assay,RIPA)(购自上海碧云天生物技术有限公司,逆转录聚合酶链反应(re verse transcription polymerase chain reaction,RT-PCR)试剂盒(购自美国Thermo Scientific公司),抗体(购自美国Abcam公司),其他试剂为国产分析纯,荧光倒置显微镜(购自日本奥林巴斯株式会社),酶联免疫检测仪、Power PacTM电泳仪、Trans-blot电转仪、凝胶成像系统Chemi Doc XRS(购自美国Bio-Rad公司)。
1.2 方法
1.2.1 原代心肌细胞分离 取新生48 h内的(ICR)小鼠,断颈处死,75%乙醇浸泡5 min取出。在超净工作台中将鼠腹面向上放置,用眼科剪剪开小鼠胸腔,充分暴露心脏。将获取的心脏放入含有冰的DPBS液中,剪去心房,反复洗涤,至心室内无血渍。然后将心室肌剪碎(<1 mm3)并转移到离心管中,800 r/min离心5 min,弃去磷酸盐缓冲液(phosphate buffered saline,PBS)后,加入 5 ml 0.5%胶原酶Ⅱ的消化液,37℃水浴并振荡消化10 min;吸取上层混悬液,加入等量的心肌培养基终止反应;剩余沉淀物再加胶原酶Ⅱ消化液消化3~5次,直至组织块完全消化。200目双重不锈钢细胞滤网过滤,收集滤液,800 r/min离心5 min;弃上清液,加入心肌培养基培养,用滴管反复、缓慢吹打,使细胞重浮,调整细胞密度,接种到培养皿中,置37℃、5%二氧化碳CO2饱和湿度培养箱中培养换液。
1.2.2 免疫细胞化学鉴定原代心肌细胞 将灭菌的盖玻片放入6孔培养板中,以3×104个/孔密度接种细胞,培养48 h后用PBS洗涤细胞,之后加入4%多聚甲醛固定10 min,用PBS漂洗3次,1%Trixon-100通透细胞10 min,PBS漂洗3次,5%牛血清白蛋白(albumin from bovine serum,BSA)室温封闭30min,加入一抗(cTnT和 α-Sarcomeric actinin),放置 4℃孵育过夜。PBS洗涤3次×5 min,加入二抗488和Cy3,37℃孵育1 h。PBS洗涤3次,DAPI(1∶1 000)孵育15 min,PBS洗涤3次,封片剂封片,荧光显微镜下观察。
1.2.3 实验分组 所有组细胞采用含0.5%血清的DMEM/F12高糖培养基同化24 h后,进行分组。①对照组(control):不作任何处理;②LPS 组:使用1μg/ml LPS处理心肌细胞24 h;③integrin β1阻断组:使用10μg/ml integrin β1封闭性抗体[HMβ1-1(美国BD pharmingen公司)]预处理细胞2 h后,再加入1 μg/ml LPS处理24h;④FAK抑制组:使用1μmol PF-573228预处理细胞2 h,与LPS处理组同一时间加入相同浓度LPS处理细胞24h;⑤integrin β1阻断+FAK抑制组:使用10μg/ml integrin β1封闭性抗体和1μmol的FAK抑制剂PF-573228预处理细胞2 h后,再加入1μg/ml LPS处理24 h。
1.2.4 RT-PCR各处理组细胞 用Trizol裂解细胞后提取总核糖核酸(ribonucleic acid,RNA),终样品测定OD260/280确定RNA浓度,进行RT-PCR。RT-PCR反应以总体积20 μl,RNA样品500 ng的体系,参照试剂盒[oligo(dT)18 primer and a Revet AidTMFirst Strand互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA)Synthesis Kit]反应条件进行逆转录,合成cDNA。聚合酶链反应(polymerase chain reaction,PCR)检测基因(TGF-β1:正向 5'-CCGCAACAACGCAATCTATG-3',反向 5'-GC CCTGTATTCCGTCTCCTT-3';MMP-9:正向 5'-TCTG CCTGCACCACTAAAGG,反向5'-CAGGCTGTACCCT TGGTCTG-3';Col1A1:正向 5'-CAAGGTCCTTCTGGA TCAAGTG-3',反向 5'-CCTTTATGCCTCTGTCACCTT G-3';Col3A1:正向 5'-GACCAAAAGGTGATGCTGGA CAG-3',反向5'-CAAGACCTCGTGCTCCAGTTAG;integrin β1:正向 5'-TCTCACCAAAGTAGAAAGCAG GGA-3',反向 5'-ACGATAGCTTCATTGTTGCCATTC-3';GAPDH:正向 5'-TGTGTCCGTCGTGGATCTGA-3',反向5'-TTGCTGTTGAAGTCGCAGGAG-3')的表达。
1.2.5 实时萤光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)测定各处理组细胞,用Trizol裂解细胞后提取总RNA,以总体积20 μl,RNA样品500 ng的体系,参照试剂盒(oligo(dT) 18 primer and a Revet AidTMFirst Strand cDNA Synthesis Kit)反应条件进行qRT-PCR反应,合成cDNA。然后参照试剂盒(Thermo Scientific Maxima SYBR Green qPCR Master Mixes)进行qRT-PCR测定相关基因的表达情况。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为对照,通过 2-△△Ct算法进行分析。
1.2.6 Western blot检测 提取心肌细胞总蛋白,测定蛋白含量。每孔道加入50 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PACE)并将蛋白质转移到聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上。然后于50 g/L脱脂奶粉TBST(tris buffered saline with tween)缓冲液下室温封闭2 h,分别加入1∶1 000兔抗p-FAK和FAK,4℃振摇孵育过夜。TBS洗膜 10 min×3次,加入二抗(1∶6 000),室温下振摇90 min并洗膜。然后加入ECL试剂发光,采用Image-Pro Plus 6.0软件进行数据分析。
1.3 统计学方法
数据分析采用SPSS 13.0软件统计,计量资料以均数±标准差(±s)表示,采用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 原代心肌细胞的鉴定
原代心肌细胞接种24 h后在显微镜下呈梭形或不规则扁平状,并逐渐铺展伸出伪足,相互交织成网,形成自发收缩细胞单层或细胞簇。对其进行心肌标志蛋白cTnT,α-actinin免疫荧光染色,结果显示几乎所有细胞cTnT染色呈阳性,且cTnT阳性细胞同时表达α-actinin蛋白(红色),证实分离所得原代心肌细胞纯度可达≥90%。见图1。
2.2 LPS诱导小鼠心肌细胞中基质金属蛋白酶9、TGF-β1mRNA的表达
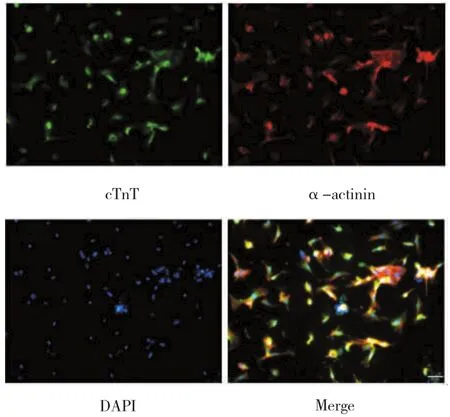
图1 免疫荧光检测心肌细胞标志物cTnT和α-actinin
在没有LPS的诱导下,心肌细胞会有基础性的基质金属蛋白酶 9(matrix metallopeptidase 9,MMP-9)和 TGF-β1表达,而在加入 0.1、0.5、1.0 和2.0μg/ml的LPS作用 24h,各组 MMP-9、TGF-β1表达比较,经方差分析,差异有统计学意义(MMP-9:F=54.784,P=0.000;TGF-β1:F=33.540,P=0.000)。随着LPS浓度的提升,MMP-9和TGF-β1表达均成梯度增加,并于LPS浓度1.0 μg/ml时均达到一个较高峰值(与 0 μg/ml LPS 比较,0.1 μg/ml LPS:tMMP-9=3.980,PMMP-9=0.016;tTGF-β1=4.214,PTGF-β1=0.014;0.5μg/ml LPS:tMMP-9=10.400,PMMP-9=0.000;tTGF-β1=4.923,PTGF-β1=0.008;1.0μg/ml LPS:tMMP-9=14.080,PMMP-9=0.000;tTGF-β1=16.625,PTGF-β1=0.000;2.0μg/mlLPS:tMMP-9=9.368,PMMP-9=0.001;tTGF-β1=12.612,PTGF-β1=0.000)。见图2。
2.3 LPS诱导小鼠心肌细胞中Ⅰ型、Ⅲ型胶原和integrin β1受体的表达
RT-PCR和qRT-PCR结果显示,LPS 1.0 μg/ml作用24 h后,各组mRNA表达比较,经方差分析,差异有统计学意义(Col1A1:F=89.769,P=0.001;Col3A1:F=411.429,P=0.000;integrin β1:F=43.891,P=0.003)。LPS 组 Col1A1、Col3A1、integrin β1mRNA表达水平均高于对照组,差异有统计学意义(与对照 组 比 较 ,tCol1A1=9.475,PCol1A1=0.001;tCol3A1=20.284,PCol3A1=0.000;tintegrinβ1=6.625,Pintegrinβ1=0.003)。见图3。
2.4 阻断integrin β1抑制LPS诱导的H9c2心肌 细 胞 中 TGF-β1、MMP-9、Col1A1、Col3A1 和integrin β1mRNA的表达
笔者采用10μg/ml的integrin β1封闭性抗体处理细胞2 h,之后用1μg/ml的LPS孵育细胞24 h,各组mRNA表达经方差分析,差异有统计学意义(MMP-9:F=89.214,P=0.000;TGF-β1:F=81.536,P=0.000;Col1A1:F=272.390,P=0.000;Col3A1:F=113.352,P=0.000;integrin β1:F=69.780,P=0.000)。结果显示:加入integrin β1阻断剂预处理后,integrinβ1阻断剂可以抑制LPS诱导的TGF-β1和MMP-9 mRNA上调水平(LPS组与对照组比较:tMMP-9=11.711,PMMP-9=0.000;tTGF-β1=12.105,PTGF-β1=0.000;tCol1A1=21.559,PCol1A1=0.000;tCol3A1=14.473,PCol3A1=0.000;tintegrinβ1=11.525,Pintegrinβ1=0.000;LPS 组与 integrin β1阻断后比较:tMMP-9=11.0461,PMMP-9=0.000;tTGF-β1=9.576,PTGF-β1=0.000;tCol1A1=18.525,PCol1A1=0.000;tCol3A1=10.831,PCol3A1=0.000;tintegrinβ1=8.010,Pintegrinβ1=0.000)。见图4。
2.5 阻断integrin β1抑制LPS诱导的H9c2心肌细胞中FAK蛋白的磷酸化情况
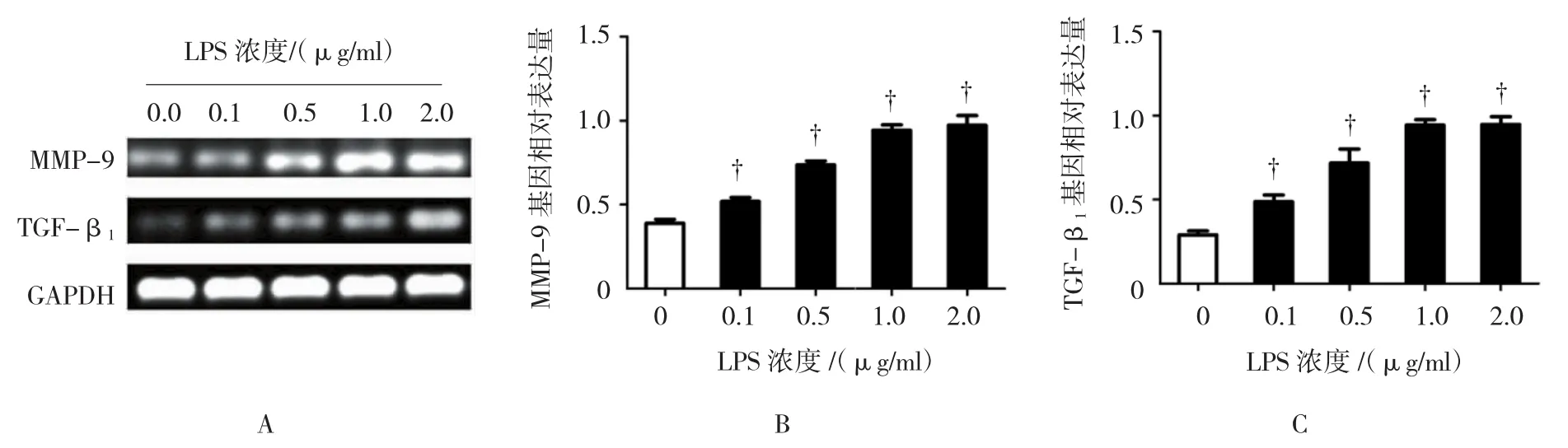
图2 PCR检测不同浓度LPS时MMP-9和TGF-β1的表达情况
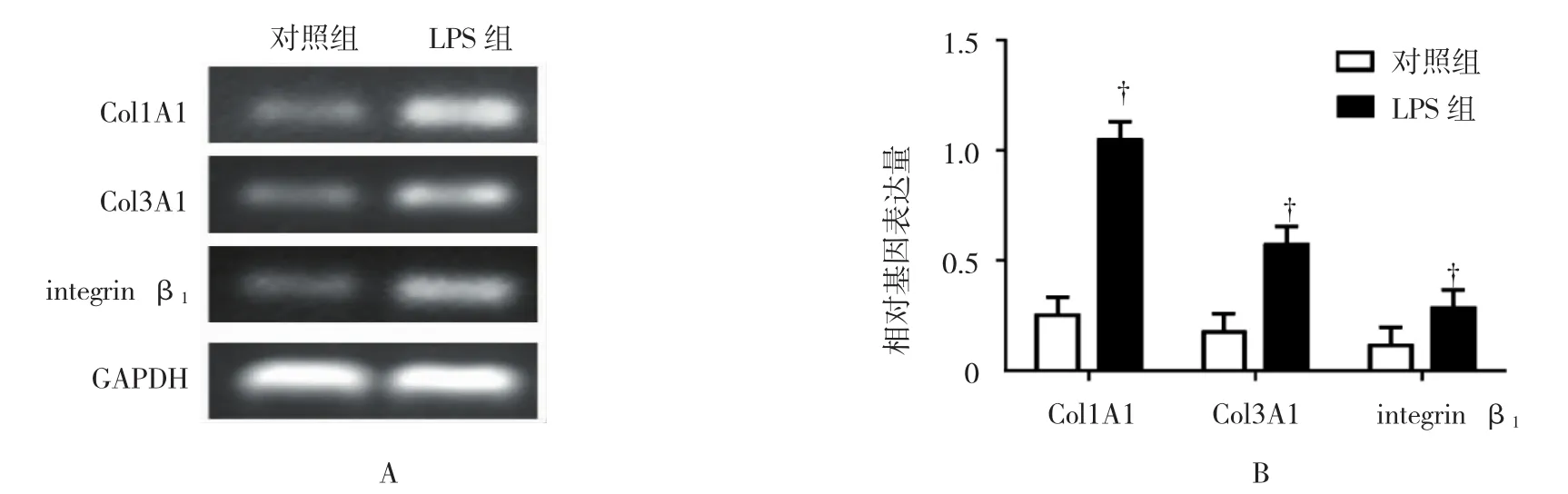
图3 RCR检测Ⅰ型、Ⅲ型胶原和integrin β1受体的表达
各组mRNA表达及FAK蛋白活化水平,经方差分析,差异有统计学意义(FAK:F=21.050,P=0.000;MMP-9:F=34.633,P=0.000;TGF-β1:F=87.251,P=0.000)。结果显示,LPS可以使磷酸化FAK蛋白表达上调,而阻断integrin β1抑制LPS诱导的憐酸化FAK蛋白的上调(见图5A)。分别加入integrin β1封闭性抗体和FAK蛋白抑制剂PF-573228可以抑制LPS诱导的TGF-β1和MMP-9 mRNA上调水平,但同时加入integrin β1封闭性抗体和FAK蛋白抑制剂PF-573228,与单独integrin β1抑制和FAK抑制相比并未显示出进一步的抑制(LPS)组与对照组比较:tFAK=8.503,PFAK=0.000;tMMP-9=10.366,PMMP-9=0.000;tTGF-β1=15.548,PTGF-β1=0.000;LPS 组与 integrin β1抑制比较:tFAK=5.715,PFAK=0.000;tMMP-9=8.1111,PMMP-9=0.000;tTGF-β1=11.494,PTGF-β1=0.000;LPS 与 FAK 抑制比较:tFAK=6.238,PFAK=0.000;tMMP-9=8.645,PMMP-9=0.000;tTGF-β1=14.080,PTGF-β1=0.000)。见图5。
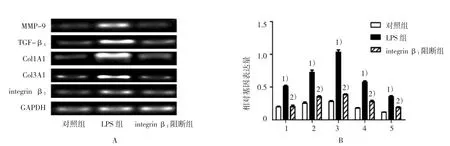
图4 RCR 检测 integrin β1阻断后 TGF-β1、MMP-9、Col1A1、Col3A1 及 integrin β1的表达
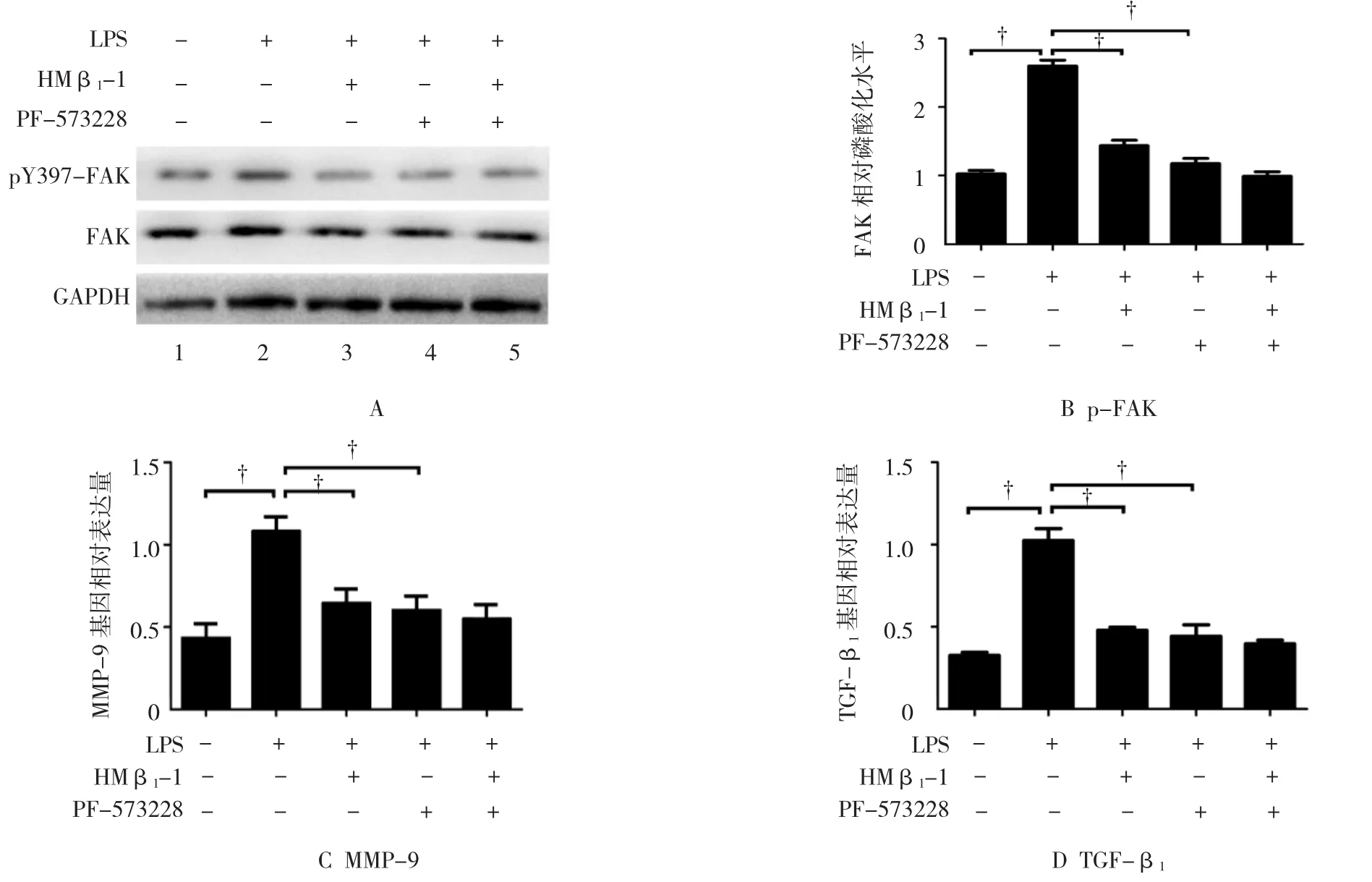
图5 integrin β1FAK通过FAK调节纤维化因子MMP-9和 TGF-β1的表达
3 讨论
心肌纤维化是高血压、心肌梗死及心力衰竭等多心血管疾病发展到一定阶段的共同病理改变,是心肌重构的主要表现之一[1]。细胞内胶原合成代谢与降解代谢失衡,Col1A1与Col3A1合成比率升高,基质金属蛋白酶的表达和活性降低,最终导致胶原合成增加、降解降低,从而产生心肌的纤维化,心脏舒张与收缩功能下降,致使心力衰竭、心律失常等的发生[10]。
Integrin是由约220 kD的糖基化蛋白组成的异二聚体,包括α、β两种亚基[11]。其表达于细胞表面,介导细胞外环境与细胞相互作用的重要信号转导分子,对于细胞黏附、细胞功能传递、细胞增殖及分化等具有重要的调控作用[12]。Integrin β1作为主要的Ⅰ型和Ⅲ胶原受体,目前受到广泛关注。在本实验中,原代心肌细胞在LPS刺激诱导24 h,心肌纤维化标志基因(TGF-β1和MMP-9)表达上调,心肌纤维化程度增加,并伴随着细胞Col1A1、Col3A1及integrin β1表达的增加,而联合给予integrin β1封闭性抗体处理后,integrin β1表达减少,同时细胞Col1A1、Col3A1 表达下调,TGF-β1和 MMP-9 表达减弱,提示integrin β1信号可能成为治疗心肌纤维化的一种潜在靶点。
Integrin不具有酶活性,必须通过激活下游分子来向细胞内传递信号[13]。FAK作为Integrin的主要下游作用分子,在Integrin介导细胞迁移中起着必不可少的作用[14]。整合素与ECM蛋白质接触可导致FAK的酪氨酸磷酸化,从而激活FAK[15]。本实验结果显示,原代心肌细胞在LPS刺激诱导24 h,p-FAK的表达上调,分别加入integrin β1封闭性抗体和FAK蛋白抑制剂PF-573228均可以抑制LPS诱导的TGF-β1和MMP-9 mRNA的上调水平,但同时加入integrin β1封闭性抗体和FAK蛋白抑制剂PF-573228,与单独加入integrin β1阻断组比较,并未有进一步抑制,表明integrin β1主要通过激活FAK参与心肌细胞纤维化的发生与发展。
综上所述,阻断integrin β1能抑制FAK的磷酸化,进而减少Col1A1与Col3A1合成,下调相关纤维化因子TGF-β1和MMP-9的表达,从而改善在炎症刺激条件下心肌细胞的纤维化进程,为未来临床治疗拓展新思路。
[1]KONG P,CHRISTIA P,FRANGOGIANNIS N G.The pathogenesis of cardiac fibrosis[J].Cellular and Molecular Life Sciences,2014,71(4):549-574.
[2]李淑梅,钟世顺,吴平生.氯沙坦对自发性高血压大鼠心脏局部醛固酮的合成及其心肌纤维化的影响[J].中国现代医学杂志,2006,16(4):539-542.
[3]ZHANG M,PAN X,ZOU Q,et al.Notch3 Ameliorates cardiac fibrosis after myocardial infarction by inhibiting the TGF-beta1/Smad3 pathway[J].Cardiovasc Toxicol,2016,16(4):316-324.
[4]ZHANG J,CHENG Y,GU J,et al.Fenofibrate increases cardiac autophagy via FGF21/SIRT1 and prevents fibrosis and inflammation in the hearts of type 1 diabetic mice[J].Clinical Science,2016,130(8):625-641.
[5]ZHANG F,DANG Y,LI Y,et al.Cardiac contractility modulation attenuate myocardial fibrosis by inhibiting TGF-beta 1/Smad3 signaling pathway in a rabbit model of chronic heart failure[J].Cell Physiol Biochem,2016,39(1):294-302.
[6]MACKENNA D,SUMMEROUR S R,VILLARREAL F J.Role of mechanical factors in modulating cardiac fibroblast function and extracellular matrix synthesis[J].Cardiovascular Research,2000,46(2):257-263.
[7]WANG H,ZHU Y,ZHAO M,et al.miRNA-29c suppresses lung cancer cell adhesion to extracellular matrix and metastasis by targeting integrin beta 1 and matrix metalloproteinase 2(MMP2)[J].PLoS One,2013,8(8):e70192.
[8]ROY D C,HOCKING D C.Recombinantfibronectinmatrix mimetics specify integrin adhesion and extracellular matrix assembly[J].Tissue Engineering Part A,2013,9(3/4):558-570.
[9]RIOPEL M M,LI J,LIU S,et al.β1 integrin-extracellular matrix interactions are essential for maintaining exocrine pancreas architecture and function[J].Lab Invest,2013,93(1):31-40.
[10]刘兵,谢增柱.慢性低氧致大鼠右心室心肌纤维化作用及其机制的研究[J].中国现代医学杂志,2015,15(13):1941-1944.
[11]CAMPER L,HOLMVALL K,W魧NGNERUD C,et al.Distribution of the collagen-binding integrin alpha10beta1 during mouse development[J].Cell&Tissue Research,2001,306(1):107-116.
[12]HEINO J.The collagen receptor integrins have distinct ligand recognition and signaling functions[J].Matrix Biology,2000,19(4):319-323
[13]MIRANTI C K,BRUGGE J S.Sensing the environment:a historical perspective on integrin signal transduction[J].Nature Cell Biology,2002,4(4):83-90.
[14]SCHLAEPFER D D,HUNTER T.Integrin signalling and tyrosine phosphorylation:just the FAKs[J].Trends in Cell Biology,1998,8(4):151-157.
[15]ZHAO X K,CHENG Y,CHENG M L,et al.Focal adhesion kinase regulates fibroblast migration via integrin beta-1 and plays a central role in fibrosis[J].Scientific Reports,2016,14(6):19276.
Role and mechanism of integrin β1-FAK on myocardial fibrosis*
Chuan-qin Lin1,Xiu-Li Zhai2,Tuo Deng1
(1.Department of Emergency,Hainan Province NongKen Sanya Hospital,Sanya,Hainan 572000,China;2.Department of Prevention and Health Care,Sanya Sanlin Hospital,Sanya,Hainan 572025,China)
R284.1
A
10.3969/j.issn.1005-8982.2017.15.002
1005-8982(2017)15-0005-06
2016-12-08
三亚市医疗科技创新项目(No:YW1214)

