滇龙胆香叶醇10-羟化酶基因的克隆与表达分析
张晓东,李彩霞,李 爽,刘倩倩,王元忠,王家金*
(1.玉溪师范学院资源环境学院,云南 玉溪 653100;2.云南省农业科学院药用植物研究所,云南 昆明 650223)
滇龙胆香叶醇10-羟化酶基因的克隆与表达分析
张晓东1,李彩霞1,李 爽1,刘倩倩1,王元忠2,王家金2*
(1.玉溪师范学院资源环境学院,云南 玉溪 653100;2.云南省农业科学院药用植物研究所,云南 昆明 650223)
【目的】克隆滇龙胆香叶醇10-羟化酶基因GrG10H(geraniol 10-hydroxylase),分析其生物信息学特征、基因结构、蛋白表达和组织表达情况,为龙胆苦苷生物合成途径解析提供理论依据。【方法】通过RT-PCR及基因克隆方法,从滇龙胆总RNA中克隆得到基因GrG10H及其基因组序列;使用生物信息学方法分析其DNA序列及其编码蛋白特性,使用Clustal X2.1软件对GrG10H蛋白质及其同源序列做序列比对,使用MEGA7.0软件进行系统发育树构建;利用定量PCR技术分析GrG10H基因在滇龙胆根茎叶中的表达水平。【结果】使用RT-PCR方法从滇龙胆叶片中克隆得GrG10H基因全长为1834 bp,包含2外显子和1内含子,ORF 1548 bp,将序列提交至GenBank,得到序列号KJ418410。生物信息学分析表明,该基因编码515个氨基酸,分子量为57.74 kD,理论等电点为9.02;该蛋白属于细胞色素P450超家族成员,定位于内质网,其N端含一跨膜螺旋(21~43),其中1~20氨基酸残基位于膜内,44~515位于膜外。该蛋白无信号肽,为亲水稳定蛋白,主要由无规则卷曲(44.85%)和α-螺旋(40.58%)构成。GrG10H蛋白与川西獐牙菜SmG10H蛋白具有较高的相似性(87%),且亲缘关系最近。原核表达结果表明,GrG10H基因在大肠杆菌中表达的重组蛋白相对分子质量约为83.74 kD (含GST标签26.00 kD),与预期蛋白大小一致。组织特异性表达分析结果表明GrG10H基因主要在叶中表达。【结论】克隆到滇龙胆GrG10H基因,并成功在大肠杆菌中表达,推测其在主要叶片中起作用。
滇龙胆;香叶醇10-羟化酶;基因克隆;表达分析
【研究意义】滇龙胆为云南省道地药材。近年来,由于其市场需求量急剧增加,野生滇龙胆遭到人为过度采挖,导致其野生资源匮乏,现已被列为国家三级重点保护植物[1]。龙胆苦苷是滇龙胆的主要药用成分,要解决市场上滇龙胆植物原料问题,需要搞清龙胆苦苷的合成途径和调控机制[2],为生产龙胆苦苷创造新途径。在龙胆苦苷生物合成途径中,10-羟香叶醇(10-hydroxygeraniol)是重要的中间产物[3-4]。【前人研究进展】在川西獐牙菜(Swertiamussotii)中,细胞色素P450单加氧酶(CYP)香叶醇10-羟化酶(geraniol 10-hydroxylase,SmG10H,EC 1.14.14.1)能够催化香叶醇(geraniol)生成10-羟香叶醇[5-7],该反应需要NADP、H+和氧的参与;茉莉酸甲酯(MeJA)能够通过诱导该基因的表达,促进獐牙菜苦苷(swertiamarin)的累积[8]。目前,香叶醇10-羟化酶基因G10H已经从萝芙木[5]、金鸡纳树[5]、长春花[9]、川西獐牙菜[8]、秦艽[10-11]、蓝星花[5]、小蔓长春花[5]、喜树[12]和金银花[5]等多种植物分离。Canto-Canché等以长春花CrG10H蛋白为免疫原,注射兔子后成功地获得了适合多种植物G10H蛋白检测的多克隆抗血清[9]。CrG10H基因的表达具有组织特异性,并受植物激素的影响。如在转基因烟草幼苗中,CrG10H基因仅在叶和根尖活跃生长的细胞中表达;在转基因长春花毛状根和转基因烟草幼苗中,真菌诱导子和茉莉酸甲酯均能诱导CrG10H基因的表达[13]。在长春花CrG10H基因启动子中,其潜在的增强子分别位于-191到-147、-266到-188和-318到-266[13]。研究还表明,香叶醇10-羟化酶是单萜吲哚生物碱生物合成的速度限制步骤[9]。在长春花细胞中,CrG10H基因表达与长春质碱和文多灵的含量有显著的正相关[14]。在川西獐牙菜中,过表达SmG10H基因可同时增加10-羟香叶醇和獐牙菜苦苷的含量[8]。在长春花毛根中同时过表达CrDXS和CrG10H,导致单萜类吲哚生物碱阿吗碱(ajmalicine)、洛柯定碱(lochnericine)和它波宁的含量分别增加16%、31%和13%[15]。最新研究表明,长春花中的香叶醇10-羟化酶CrG10H在萜类和类黄酮合成中均起作用[16],在短小蛇根草毛状根中过表达长春花CrG10H基因能够极大地提高喜树碱的产量[17]。【本研究切入点】截止到现在,由于远源杂交、基因组庞大等引起的基因组杂合性、生长时间长和重要农艺性状遗传信息缺少,导致龙胆基因组资源相当匮乏[18]。前期研究表明GrG10H基因是龙胆苦苷生物合成的关键酶基因,但在滇龙胆还未被克隆和研究。【拟解决的关键问题】本研究根据前期滇龙胆转录组测序获得的GrG10H基因序列,设计一对特异性引物,通过TA克隆获得GrG10H基因,进行基因及其编码蛋白的序列分析、原核表达和根茎叶表达特异性分析,为阐明滇龙胆主要药效成分龙胆苦苷的生物合成途径和调控机理奠定基础。
1 材料与方法
1.1 材料
1.2 方法
1.2.1 RNA提取和GrG10H基因克隆 根据植物总RNA提取试剂(Takara)说明书提取组培苗幼叶的总RNA,依照逆转录试剂盒PrimeScript II 1st Strand cDNA Synthesis Kit(Takara)说明书合成第一链cDNA。根据GrG10H基因序列和原核表达载体pGEX-4T-1多克隆位点,设计基因特异引物GrG10HXhoI-R与GrG10HBamHI-F(表1)。采用高保真酶(全氏金)酶进行DNA扩增,PCR条件为:94 ℃ 3 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 90 s,扩增30个循环;72 ℃ 7 min。PCR扩增产物通过电泳分离,切胶后采用DNA胶回收试剂盒(百泰克)对目的DNA片段进行回收,然后将其连接到T载体上,转化E.Coli. DH5α(全氏金)化学感受态细胞,涂布于含Amp(Takara)+ X-Gal(Takara)+ IPTG(Takara)固体LB平板,37℃过夜培养,然后挑12个阳性菌斑,250 r/min、37℃恒温培养过夜后,提取质粒,从质粒大小检测正确的里面选取3~5个,通过酶切鉴定后送公司进行测序,获得pMD19-GrG10H重组载体。
1.2.2GrG10H基因gDNA序列的克隆 使用基因组提取试剂盒MiniBEST Plant DNA Fragment Purification Kit Ver.4.0(Takara)从滇龙胆叶片中提取基因组DNA(gDNA),然后使用引物GrG10HBamHI-F和GrG10HBamHI-R进行PCR反应,程序为:94 ℃ 3 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 3 min,扩增30个循环;72 ℃ 7 min。扩增产物经电泳分离后,进行胶回收、TA克隆和测序。

表1 GrG10H克隆和qPCR分析的引物序列
1.2.3GrG10H原核表达载体构建和原核表达 分别对质粒pMD19-GrG10H和pGEX-4T-1(Amersham)进行BamH I和XhoI双酶切,分别回收GrG10H基因和pGEX-4T-1载体,进行连接,获得质粒pGEX-4T-1-GrG10H。纯化质粒送生工生物工程(上海)股份有限公司进行DNA测序,以确保没有发生移码。使用42℃热激45 s的方法将质粒pGEX-4T-1-GrG10H转化EcoliRosetta(DE3)感受态细胞(全氏金)后,挑单菌落接种于LB液体培养基(含100 mg/L氨苄青霉素)中,250 r/min、37 ℃培养过夜。然后以菌种∶LB培养基 = 1∶100的比例转接到新鲜LB液体培养基(不含抗生素)中,250 r/min、37 ℃培养约3 h使OD600≈ 0.6-0.8,在1 mmol/L IPTG终浓度、37 ℃恒温诱导下进行表达,以完全相同条件的空载体转化菌作为对照。诱导分别为0、2、4和6 h,集菌2 mL。10 000 r/min、4 ℃下离心30 s,倒掉上清液,加入ddH2O 100 μl、蛋白Loading 25 μl,悬菌混匀,100 ℃煮5 min。12 000 r/min、4 ℃离心6 min。吸取蛋白上清液20 μl上样,进行电泳检测。
1.2.4GrG10H基因序列分析 参照张晓东等人的方法[19],分别进行DNA和蛋白质序列的生物信息学分析。基因内含子和外显子分析方法为:将GrG10H基因的ORF序列与其gDNA序列进行比对,再结合内含子GT-AG规则,来确定内含子和外显子序列。
1.2.5GrG10H基因的qPCR分析 取3年生盆栽滇龙胆的叶、茎和根,分别抽提总RNA,然后使用DNase I(Takara)去除可能污染的基因组DNA。采用逆转录试剂盒(Takara)合成cDNA。选择GrGAPDH基因作为内参[20]。根据GrG10H基因的cDNA序列设计特异性引物GrG10H-F和GrG10H-R(表1)。采用实时荧光定量PCR试剂盒(天根)进行反应,反应条件设为:95℃变性3 min,95℃变性15 s,60℃退火延伸31s。每个PCR反应重复3次。qPCR反应在ABI7000 qPCR仪(Applied Biosystems)上进行,软件自动生成扩增曲线、溶解曲线和标准曲线。采用内参基因校准后,分别计算GrG10H基因在叶、茎和根中的相对表达量。定量数据分析处理采用 “2-△△Ct” 比较Ct值的方法。
2 结果与分析
2.1GrG10H基因克隆
第六,信息披露不及时。如上已述,格鲁吉亚的群体性事件很大程度上缘起于人民群众不清楚苏共二十大决议的内容。身处莫斯科的中央高层领导应该知道:揭露斯大林的所谓“暴政”,民众会产生怎样的反应。为了避免其过激反应,“应该往格鲁吉亚派出有经验的宣传人员,向群众解释所发生的一切”。[11](P132-133)问题是,官僚主义十足的高层领导们压根儿没有这样做。如果这样做了,那么,可以相信:“很多第比利斯的居民都能够理解二十大的决议,这种震动了整个加盟共和国的风潮和不必要的牺牲都是可以避免的。”[11](P133)
使用基因特异性引物、滇龙胆gDNA和cDNA模板,分别扩增出约2000和1500 bp的DNA片段(图1A、图1B)。通过克隆的方法获得质粒pMD19-GrG10H(gDNA)和pMD19-GrG10H(cDNA),酶切检测正确后,送公司进行DNA测序。测序结果表明GrG10H基因(GenBank登录号:KJ418410)长1834 bp,而其ORF序列长1548 bp(图1C)。
2.2GrG10H基因的生物信息学分析
利用DNAMAN 7软件对GrG10H基因的gDNA序列和其ORF序列进行比对,再结合内含子的GT-AG规则进行分析,结果显示GrG10H基因包含2个外显子(1-942,1229-1834)和1个内含子(943-1228)(图1C),这与川西獐牙菜SmG10H基因结构类似[8];该基因ORF为1548 bp,编码氨基酸515个。
采用NCBI数据库中的BLASTp对GrG10H蛋白序列进行分析,结果表明滇龙胆GrG10H蛋白与川西獐牙菜SmG10H相似性最高,为86.26 %,与茄子SmCYP76A2相似性较低,为36.14 %。使用DNAMAN 8将滇龙胆GrG10H蛋白与GenBank中相似性较高的蛋白进行多序列比对,结果显示GrG10H与已知G10H蛋白序列保守性很高(图2)。利用Mega 7将GrG10H蛋白与相似性较高的G10H蛋白进行系统进化分析,结果表明GrG10H蛋白与川西獐牙菜SmG10H蛋白位于同一进化枝(图3),表明他们的亲缘关系很近。
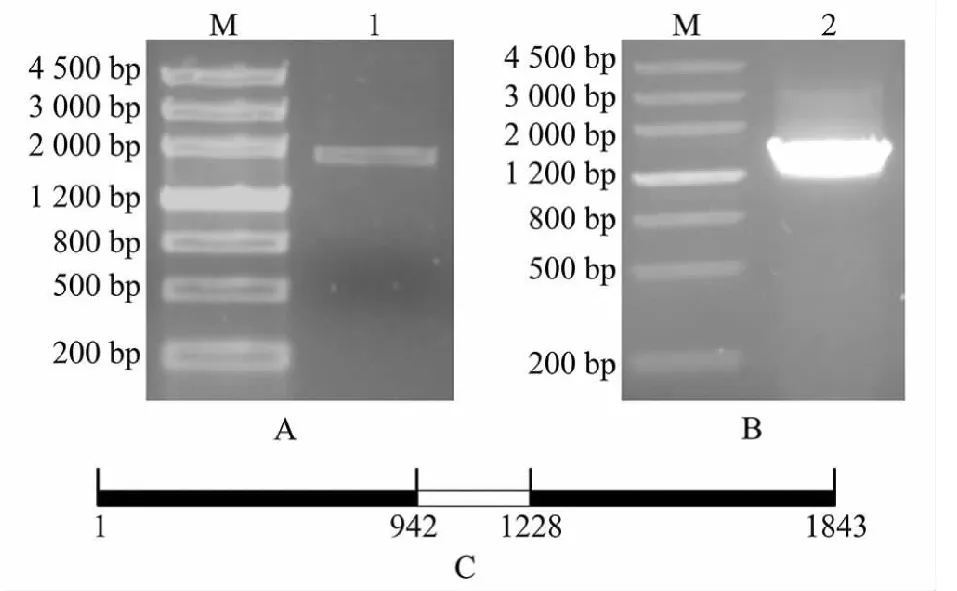
M:Marker III;A:GrG10H基因gDNA序列;B:GrG10H基因ORF序列;C中数字表示碱基数目M:Marker III; A: gDNA sequence of GrG10H; B: ORF of GrG10H; The number in C indicate the number of base pair(s)图1 滇龙胆GrG10H基因的基因组序列(A),ORF序列(B)的PCR扩增和基因结构(C)Fig.1 PCR amplification and structure of GrG10H gene in G. rigescens

黑色:相似性为100%;粉红:75%≤相似性<100%;浅蓝:50%≤相似性<75%Black: homology = 100%; pink: 75% ≤ homology < 100%; light blue: 50% ≤ homology < 75%图2 滇龙胆GrG10H蛋白多序列比对结果Fig.2 Multiple sequence alignment of GrG10H protein in G. rigescens

数值代表从1 000次重复计算得到的bootstrap百分比值The bootstrap percentage values calculated from 1 000 replications were represented by numbers图3 滇龙胆GrG10H蛋白的系统发育分析Fig.3 Phylogenetic tree of GrG10H protein in G. rigescens
采用ProtParam软件对GrG10H蛋白进行分析,结果显示GrG10H蛋白分子量为57.74 kDa,化学方程式为:C2601H4127N707O735S21;不稳定指数较低(38.64),属稳定性蛋白;脂肪指数较低(91.65),属于亲水蛋白。GrG10H蛋白的氨基酸组成中,亮氨酸含量最高(12 %);其次分别为赖氨酸、丙氨酸和丝氨酸(7.2 %、7.0 %、7.0 %);色氨酸和半胱氨酸含量最低(1.4 %)。
使用SSpro方法进行α-螺旋(H)、无规则卷曲(C)和延伸带(E)等二级结构的分析,结果显示GrG10H蛋白中H占40.58 %, C占44.85 %, E占14.56 %。利用Phyre2预测GrG10H蛋白的三级结构,结果如图4,该模型以穴兔微体细胞色素P450 2C5酶[d1nr6a]为模板,在第51~514氨基酸处建模,序列相似度为89.00 %,可信度为100 %;结果还表明该蛋白主要是由α螺旋和无规则卷曲构成的(图4)。采用InterPro工具及相关文献预测GrG10H蛋白保守结构域,结果表明GrG10H蛋白具有1个P450超家族结构域,在其N端具有富含脯氨酸的区域PPGPVPLP,C端具有血红素结合部位PFGAGRRICPG,中间具有保守区AGTDTT。

图4 滇龙胆GrG10H蛋白3D结构预测Fig.4 Prediction of 3D structure of GrG10H protein in G. rigescens
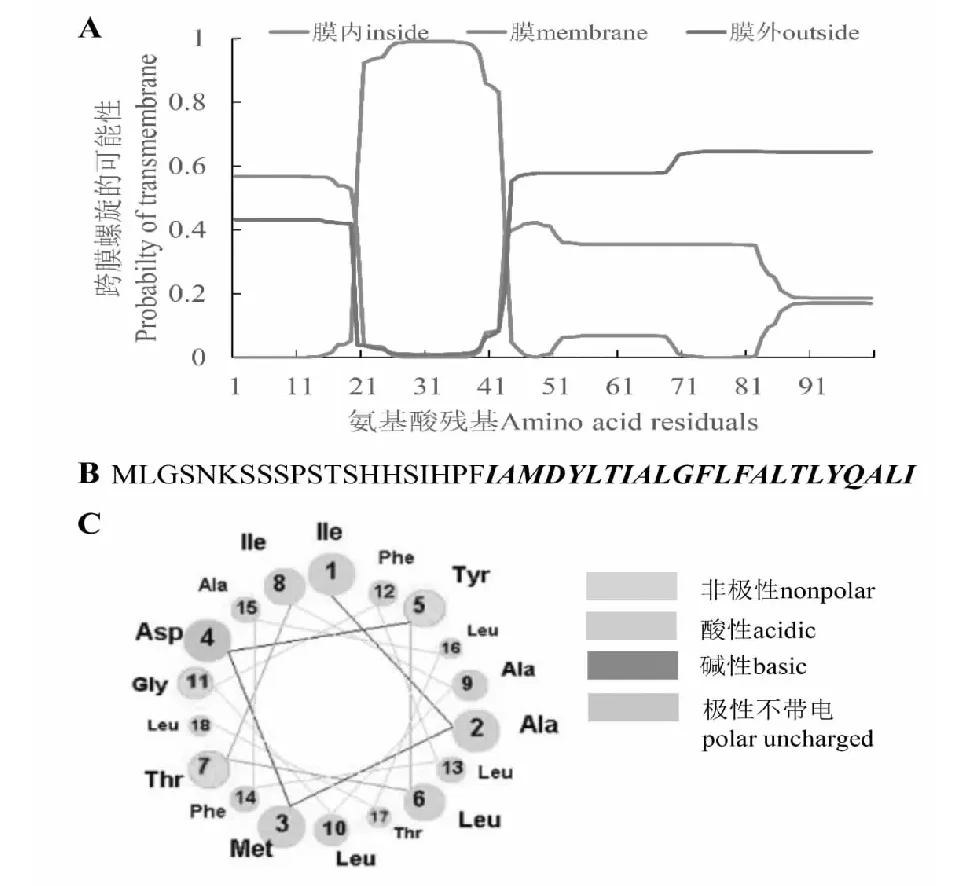
A:GrG10H蛋白跨膜螺旋预测;B:斜体表示可能的跨膜螺旋序列;C:预测螺旋轮的投射A: Prediction of transmembrane helix in GrG10H; B: Italics showed the likely transmembrane helix; C: Projection of the predicted helical wheel图5 滇龙胆GrG10H蛋白N末端跨膜螺旋预测Fig.5 Prediction of a likely transmembrane helix at the N-terminal of GrG10H in G. rigescens
使用SignalP服务器对GrG10H蛋白进行分析,没有发现信号肽,表明GrG10H为非分泌型蛋白。GrG10H跨膜螺旋区预测结果表明该蛋白为膜蛋白,这与长春花中的CrG10H蛋白相一致[21]。GrG10H蛋白的第1~20氨基酸残基处于膜内,第21~43氨基酸为跨膜螺旋区域,含酸性氨基酸残基(Asp),剩余的氨基酸残基在膜外(图5)。采用ChloroP软件对GrG10H蛋白叶绿体转运肽进行预测,结果显示该蛋白不包含叶绿体转运肽。
稀有密码子预测结果表明,GrG10H稀有密码子占1.36 %,且不存在二联、三联稀有密码子,所以可选用E.coli. BL21或E.coli. Rosetta(DE3)进行GrG10H蛋白的原核表达。
2.3GrG10H基因的原核表达载体构建
使用限制酶BamH I和XhoI分别对pGEX-4T-1和pMD19-GrG10H进行双酶切,回收载体和目的基因,连接后,获得重组质粒pGEX-4T-1-GrG10H。双酶切质粒pGEX-4T-1-GrG10H,能够切出目的基因GrG10H片段和载体(图6),单酶切获得线性质粒,其大小为双酶切产生的2个片段之和,表明pGEX-4T-1-GrG10H质粒已成功构建。测序结果表明,没有移码现象发生。
2.4GrG10H基因的原核表达
将测序检测正确的pGEX-4T-1-GrG10H质粒转化Ecoli. Rosetta(DE3)后,使用IPTG进行诱导表达。在1 mmol/L IPTG终浓度和37 ℃恒温条件下,共诱导表达6 h,期间每隔2 h取样1次,抽提细菌总蛋白跑SDS-PAGE进行检测。结果显示,与未加IPTG的pGEX-4T-1对照(泳道1)相比,IPTG诱导后的pGEX-4T-1菌出现GST标签蛋白(泳道2);与未加IPTG的pGEX-4T-1-GrG10H的对照(泳道3)相比较,转化菌pGEX-4T-1-GrG10H经过诱导后,在相对分子质量约83.74 kDa处有1条显著的差异条带(泳道4、5、6),而且蛋白含量随着诱导时间的增加而增加,说明pGEX-4T-1-GrG10H质粒在Ecoli. Rosetta(DE3)中已成功诱导表达出马达蛋白GrG10H。GrG10H蛋白适宜的表达条件为:37 ℃、诱导表达6 h、1 mM IPTG(图7),此条件下诱导表达的蛋白,可用于蛋白纯化。

M:DNA分子量标准;1-2:Bam H I和Xho I双酶切、XhoI单酶切质粒pGEX-4T-1-GrG10H的结果;3:负对照M: DNA standard; 1-2: The results of pGEX-4T-1-GrG10H digestions by Bam H I and Xho I, Xho I; 3: Negative control图6 pGEX-4T-1-GrG10H质粒酶切鉴定Fig.6 Identification of plasmid pGEX-4T-1-GrG10H by enzyme digestions

M:蛋白标准;1-2:1 mmol/L IPTG终浓度、37 ℃下空载体分别诱导0和6 h的总蛋白;3-6:相同条件下工程菌分别诱导0、2、4和6 h的总蛋白M: Protein standard; 1-2: The expressed product of empty vector induced by 1 mmol/L IPTG for 0 and 6 h at 37 ℃; 3-6: The expressed product of engineering bacteria induced by 1 mmol/L IPTG for 0, 2, 4 and 6 h at 37 ℃图7 37 ℃下诱导时间对GrG10H表达量的影响Fig.7 Effect of induction time on the expression amount of GrG10H at 37 ℃

以根为参照,设定其中的表达量为1Root was the reference, and its expression was designated as 1图8 滇龙胆GrG10H基因在不同组织中的相对表达Fig.8 Relative expression of GrG10H gene in different tissues in G. rigescens
2.5GrG10H在根茎叶中的表达分析
取3年生盆栽滇龙胆的根茎叶,通过qRT-PCR检测GrG10H基因在根茎叶中的表达情况。结果显示,GrG10H基因表达量最高的组织是叶,其表达量大约是根和茎中的2855和13倍;其次是茎,表达量最低的是根(图8)。这与川西獐牙菜SmG10H基因在根茎叶中的表达模式非常类似[8]。这些结果暗示叶是龙胆苦苷生物合成的主要场所。然而,在长春花中,CrG10H基因主要在根和叶中表达[22];在秦艽中,GmG10H基因则主要在花和根中表达。这可能是因为植物中G10H基因存在不同家族成员,而不同成员具有组织表达特异性所导致[11]。
3 讨 论
龙胆苦苷是滇龙胆的主要药效成分,属于裂环烯醚萜类化合物,目前龙胆苦苷生物合成途径还不清楚。研究表明,在环烯醚萜类生物合成中,香叶醇的氧化被认为是第一个限速反应步骤,而此反应由香叶醇10-羟化酶催化[8]。早在1999年,Collu等人就发明了HPLC技术检测G10H蛋白活性的方法[23]。本研究以作者实验室所建立的滇龙胆转录组数据库为基础,从滇龙胆幼叶中克隆到一条GrG10H基因,其编码蛋白与川西樟牙菜SmG10H基因的同源性达86.26 %;系统发育分析中二者处于同一进化枝,且GrG10H蛋白具有CYP450结构域,属于CYP76B亚家族成员,这些结果表明所克隆的基因的确为G10H基因。
不同植物的G10H蛋白大小也有差异。Wang等从川西獐牙菜克隆的SmG10H基因,在大肠杆菌中表达后蛋白大小为55 500[8],长春花的G10H蛋白大小为56 500,而本研究GrG10H基因表达后大小为57 740,原因是GrG10H蛋白比前两者多出19个氨基酸(图2),这暗示着滇龙胆的GrG10H蛋白与这2种植物的G10H蛋白存在结构或功能上的差异。
在滇龙胆中,不同组织器官的龙胆苦苷含量存在很大差别,以根的含量为最高[24]。前期转录组测序结果显示,滇龙胆基因组中至少包含2个GrG10H基因。所以,探究GrG10H基因在根茎叶中的表达特异性对于阐明其参与的龙胆苦苷生物合成途径具有重要意义。本研究中,GrG10H基因在根中表达量远远低于其在叶中的表达量,这预示着GrG10H基因主要在叶中参与萜类的生物合成。事实上,龙胆苦苷的主要累积部位是根[24],这暗示着在滇龙胆中龙胆苦苷在叶中合成,然后在根中累积的过程。接下来需要对龙胆苦苷生物合成途径晚期基因进行克隆和表达分析,以阐明龙胆苦苷的主要合成部位与具体途径。
4 结 论
通过基因克隆方法获得滇龙胆香叶醇10-羟化酶基因,该基因包含2个外显子和1个内含子,编码515个氨基酸。GrG10H蛋白属于细胞色素P450超家族成员,可能定位于内质网,能够在大肠杆菌中表达。GrG10H基因主要在叶中表达。
[1]杨 雁, 邵爱娟, 金 航,等. 云贵高原滇龙胆不同居群形态特征变异研究[J]. 中草药, 2012, 43(8): 1604-1610.
[2]张晓东, 李彩霞, 王连春, 等. 滇龙胆GrSLS1基因的克隆和原核表达[J]. 西北植物学报, 2014, 34(7): 1311-1317.
[3]Jensen S R, Schripsema J. Chemotaxonomy and pharmacology of Gentianaceae, in Gentianaceae-systematics and natural history[M]. Cambridge: Cambridge University Press, 2002: 573-631.
[4]Inouye H. Biosynthesis of Iridoid-and Secoiridoid Glucosides, in Pharmacognosy and Phytochemistry[M]. Berlin: Springer, 1971: 290-313.
[5]Salim V, Yu F, Altarejos J, et al. Virus-induced gene silencing identifiesCatharanthusroseus7-deoxyloganic acid-7-hydroxylase, a step in iridoid and monoterpene indole alkaloid biosynthesis[J]. Plant J., 2013, 76(5): 754-765.
[6]Asada K, Salim V, Masada-Atsumi S, et al. A 7-deoxyloganetic acid glucosyltransferase contributes a key step in secologanin biosynthesis in Madagascar periwinkle[J]. Plant Cell, 2013, 25(10): 4123-4134.
[7]Zhao Y J, Cheng Q Q, Su P, et al. Research progress relating to the role of cytochrome P450 in the biosynthesis of terpenoids in medicinal plants[J]. Appl. Microbiol. Biotechnol., 2014, 98(6): 2371-2383.
[8]Wang J, Liu Y, Cai Y, et al. Cloning and functional analysis of geraniol 10-hydroxylase, a cytochrome P450 fromSwertiamussotiiFranch[J]. Biosci. Biotechnol. Biochem., 2010, 74(8): 1583-1590.
[9]Canto-Canché B B, Meijer A H, Collu G, et al. Characterization of a polyclonal antiserum against the monoterpene monooxygenase, geraniol 10-hydroxylase fromCatharanthusroseus[J]. J. Plant Physiol., 2005, 162(4): 393-402.
[10]Hua W, Zheng P, He Y, et al. An insight into the genes involved in secoiridoid biosynthesis inGentianamacrophyllaby RNA-seq[J]. Mol. Biol. Rep., 2014, 41(7): 4817-4825.
[11]化文平, 王喆之. 秦艽香叶醇-10羟化酶(G10H)基因的克隆及序列分析[J]. 基因组学与应用生物学, 2013, 32(4): 510-515.
[12]Sun Y, Luo H, Li Y, et al. Pyrosequencing of theCamptothecaacuminatatranscriptome reveals putative genes involved in camptothecin biosynthesis and transport[J]. BMC Genomics, 2011, 12(1): 533.
[13]Suttipanta N, Pattanaik S, Gunjan S, et al. Promoter analysis of theCatharanthusroseusgeraniol 10-hydroxylase gene involved in terpenoid indole alkaloid biosynthesis[J]. Biochim. Biophys. Acta-Gene Struct. Expr., 2007, 1769(2): 139-148.
[14]陈 雨, 孙小芬, 赵静雅, 等. 长春花萜类吲哚生物碱含量测定及相关基因的表达分析[J]. 天然产物研究与开发, 2010, 22(1): 93-97.
[15]Peebles C A, Sander G W, Hughes E H, et al. The expression of 1-deoxy-D-xylulose synthase and geraniol-10-hydroxylase or anthranilate synthase increases terpenoid indole alkaloid accumulation inCatharanthusroseushairy roots[J]. Metab. Eng., 2011, 13(2): 234-240.
[16]Sung P H, Huang F C, Do Y Y, et al. Functional expression of geraniol 10-hydroxylase reveals its dual function in the biosynthesis of terpenoid and phenylpropanoid[J]. J. Agric. Food Chem., 2011, 59(9): 4637-4643.
[17]Cui L, Ni X, Ji Q, et al. Co-overexpression of geraniol-10-hydroxylase and strictosidine synthase improves anti-cancer drug camptothecin accumulation inOphiorrhizapumila[J]. Sci. Rep., 2015(5): 8227.
[18]Nakatsuka T, Yamada E, Saito M, et al. Construction of the first genetic linkage map of Japanese gentian (Gentianaceae)[J]. BMC Genomics, 2012, 13: 672.
[19]张晓东, 李彩霞, 王元忠. 滇龙胆GrCMS基因的克隆与表达分析[J]. 植物研究, 2016, 36(2): 258-265.
[20]张海晨, 张晓东, 李彩霞, 等. 滇龙胆1-脱氧-D-木酮糖5-磷酸合酶基因的克隆与表达分析[J]. 生物技术通报, 2016, 32(4): 128-136.
[21]Meijer A, Pennings E, De Waal A, et al. Purification of cytochrome P-450-dependent geraniol-10-hydroxylase from a cell suspension culture ofCatharanthusroseus, in Progress in Plant Cellular and Molecular Biology[M]. Netherlands: Springer, 1990: 769-774.
[22]Burlat V, Oudin A, Courtois M, et al. Co-expression of three MEP pathway genes and geraniol 10-hydroxylase in internal phloem parenchyma ofCatharanthusroseusimplicates multicellular translocation of intermediates during the biosynthesis of monoterpene indole alkaloids and isoprenoid-derived primary metabolites[J]. The Plant J., 2004, 38(1): 131-141.
[23]Collu G, Bink H H J, Moreno P R H, et al. Determination of the activity of the cytochrome p450 enzyme geraniol 10-hydroxylase in plants by high-performance liquid chromatography[J]. Phytochem. Analysis, 1999, 10(6): 314-318.
[24]杨美权, 张金渝, 沈 涛,等. 不同栽培模式对滇龙胆中龙胆苦苷含量的影响[J]. 江苏农业科学, 2011(1): 287-289.
(责任编辑 王家银)
Cloning and Expression Analysis of Geraniol10-hydroxylase Gene inGentianarigescens
ZHANG Xiao-dong1, LI Cai-xia1, LI Shuang1, LIU Qian-qian1, WANG Yuan-zhong2, WANG Jia-jin2*
(1.College of Resources and Environment, Yuxi Normal University, Yunnan Yuxi 653100, China; 2.Institute of Medicinal Plants, Yunnan Academy of Agricultural Sciences, Yunnan Kunming 650223, China)
【Objective】The objective of this study is to clone gentian geraniol 10-hydroxylase geneGrG10H, to analyze its bioinformatics characters, gene structure, prokaryotic expression and tissue expression, and to provide a theoretical base for elucidation of getiopicroside biosynthesis pathway. 【Method】RT-PCR and gene cloning were adopted to isolate the geneGrG10Hfrom the leaves ofGentianarigescens. Bioinformatics tools were used to analyze the characters of both DNA sequence and its coding protein. Clustal X2.1 software was used to make the multiple sequence alignments between the GrG10H protein and their homologous sequences, and the phylogenetic tree of homologous species was constructed by MEGA6.0. The real-time fluorescent quantitative RT-PCR was applied to analyze the expression ofGrG10Hin root, stem and leaf. 【Result】GrG10Hgene was obtained fromG.rigescensleaves by RT-PCR, and was deposited into GenBank (accession number: KJ418410). The results of bioinformatics analysis showed thatGrG10Hgene had a length of 1834 bp containing two exons and one intron. Its ORF (open reading frame) was 1548 bp coding for 515 amino acids. Its relative molecular weight was 57.74 kD with the isoelectric point of 9.02. GrG10H protein was the member of cytochrome P450 superfamily and may localize in endoplasmic reticulum; there was a transmembrane region in N-terminal (21-43), while the first 20 amino acids resided within the membrane and that of 44-515 were out of membrane; GrG10H was a hydrophilic stable protein without signal peptide and composed of mainly α-helix (40.58%) and irregular coils (44.85%). GrG10H protein was close to SmG10H ofSwertiamussotii. The results of prokaryotic expression ofGrG10Hgene inE.colishowed that the recombinant protein was approximately 83.74 kD (containing GST tag protein 26.00 kD), which was consistent with the theoretical size. The tissue-specific expression results indicated thatGrG10Hgene was primarily expressed in leaf. 【Conclusion】GrG10Hgene was cloned and expressed inE.coli. successfully, and it may mainly functioned in leaves.
Gentianarigescens; Geraniol 10-hydroxylase; Gene cloning; Expression analysis
1001-4829(2017)7-1499-08
10.16213/j.cnki.scjas.2017.7.006
2015-06-08
云南省教育厅重点项目(2015Z171);云南省大学生创新项目(201511390005)
张晓东(1980-),男,博士,主要从事植物代谢基因工程研究,E-mail: zxd95@126.com。*为通讯作者:王家金(1963-),男,主要从事药用植物资源评价与利用研究,E-mail: 2354665275@qq.com。
Q786
A

