兔VX2肝癌模型改良制作及TAE前后CT与DSA影像学评估*
安徽医科大学合肥第三临床学院(合肥市第三人民医院)影像中心(安徽 合肥 230022)
余 梁 含 笑 周丽芬王国亮 吴鸿峰 胡茂能
兔VX2肝癌模型改良制作及TAE前后CT与DSA影像学评估*
安徽医科大学合肥第三临床学院(合肥市第三人民医院)影像中心(安徽 合肥 230022)
余 梁 含 笑 周丽芬王国亮 吴鸿峰 胡茂能
目的 进一步完善兔VX2肝癌模型的制作方法,并应用CT及DSA检查对肿瘤TAE前后进行影像学评估。方法 制作兔VX2肝癌模型20只并保种传代,于接种后第7、14日行CT平扫+增强扫描;第15日行开腹门静脉直接穿刺造影及经导管股-肝动脉造影检查,肿瘤供血动脉行碘油栓塞;第21日再次行CT平扫+增强扫描;第22天开腹行门静脉及肝动脉直接穿刺DSA检查。结果 种植2周时肝区肿瘤可全部清楚的展示,CT平扫可见肝区结节状低密度病灶,增强扫描肿瘤在动脉期可呈明显环形强化,门脉期呈低密度。3周时肿瘤坏死明显。DSA显示肿瘤富血供。结论 兔VX2肝癌模型改良制作成功率较高。TAE前后CT与DSA表现一致,且肿瘤的血供主要来自肝动脉,门静脉不参与供血。
VX2肿瘤;肝癌模型;CT
原发性肝癌是临床上最常见的恶性肿瘤之一,大多数很难早期诊断而失去手术机会[1],经肝动脉介入治疗是不能手术切除的肝癌患者首选治疗方式,而CT增强扫描是肝癌介入手术前后的重要诊断和评价依据。临床研究发现,肝癌经肝动脉栓塞术(TAE)后,常伴随着大量的肿瘤新生血管,导致肿瘤复发或进展,其机制仍不十分明确。兔VX2肝肿瘤模型其生长特性和血供与人类肝癌相似,并具有与人肝细胞癌类似的影像学表现[2],适用于肿瘤影像学评价及介入诊疗研究。本实验用改良方法接种兔VX2肝癌,建立动物模型,探讨TAE前后肿瘤新生血管及残癌组织血流变化。
1 材料与方法
1.1 材料
1.1.1 实验动物:后腿皮下荷VX2瘤新西兰种兔1只(购自苏州大学第一附属医院)。健康新西兰大白兔20只(安徽医科大学实验动物中心提供),体重约1.8~2.5公斤,雌雄不限,普通饲料喂养。
1.1.2 主要设备、器材及实验药品:GE Bright Speed Elite多排螺旋CT,GE INNOVA-3100IQ DSA,自制兔手术台,苯巴比妥钠,超液态碘化油,碘佛醇,眼科剪,眼科镊,动脉夹,穿刺针,经皮肝穿扩张鞘管,微导管微导丝。
1.2 实验兔接种方法荷瘤种兔经耳缘静脉推注苯巴比妥钠(100mg/Kg)全麻后,切开表皮,剥离后肢皮下实体性肿块,将周围坏死组织剔除干净,取肿块边缘生长旺盛的鱼肉样组织,分割为2mm3大小的瘤块,同时以眼科镊取2~3粒瘤块送至健康兔后腿皮下,以保种传代。将实验兔用苯巴比妥钠耳缘静脉推注全麻后,固定在自制手术台上,备皮、消毒并铺巾,于剑突下正中偏左侧纵向切开腹腔,暴露肝脏,以针头刺破肝左叶包膜,将1~2粒瘤块植入后即刻以明胶海绵条封闭穿刺通道,局部纱布压迫,检查无出血及瘤块脱出后回纳肝脏,缝合腹部切口。于术后连续3日肌注青霉素80万单位预防感染。
1.3 CT扫描及DSA检查方法实验兔20只,于接种后第7日、第14日行CT平扫+增强扫描;第15日行开腹门静脉直接穿刺造影及经导管股动脉-肝动脉造影检查,肿瘤供血动脉行碘油栓塞;于第21日再次行CT平扫+增强扫描;第22天开腹行门静脉及肝动脉直接穿刺DSA检查。
1.3.1 CT扫描:扫描条件为120KV,200mA,螺距1.375:1,层厚2.5mm,FOV25。增强扫描经耳缘静脉连接高压注射器,造影剂总量为10mL(7mL碘佛醇+3mL生理盐水),注药速率1mL/s。扫描完毕后将数据传入ADW工作站行后期重建,了解肝癌瘤体一般情况及CT表现。
1.3.2 经股动脉选择性肝动脉造影:将实验兔全麻后固定在手术台,备皮、消毒、铺巾,切开右侧腹股沟皮肤,游离股动脉约2cm长度,用丝线提拉近端暂时阻断血流,远端用眼科剪剪开一小口,插入微导管,在微导丝指引下将导管超选至肝总动脉,连接高压注射器,造影剂总量5~6mL、速度2~3mL/s行DSA,造影结束后根据实验设计要求超选择至靶血管行碘油栓塞。最后结扎股动脉并缝合切口。
1.3.3 门静脉直接穿刺造影:打开兔上腹部,暴露腹腔,显示门静脉后用弯折的5号输液针头直接穿刺并固定,连接高压注射器,造影剂总量8~10mL、速度3~5mL/s行DSA。
1.3.4 肝动脉直接穿刺造影:术前准备完善后开腹,暴露腹腔,小心游离出肝固有动脉,血管夹夹闭近端血管,用弯折的5号输液针头直接穿刺并固定,连接高压注射器,造影剂总量5~6mL、速度2~3mL/s行DSA。
2 结 果
2.1 实验兔接种结果接种新西兰大白兔20只,建立肿瘤模型全部成功,CT检查均可见肝区移植肿瘤形成。其中2只于碘油栓塞后死亡,有1只在CT影像及剖腹探查时发现腹水,1只出现肝内转移征象。
2.2 肿瘤CT特点肿瘤于接种后生长迅速,1周时经CT扫描可发现大部分病灶,病灶直径较小,一小部分病灶于第2周回顾性读片时亦可诊断。2周时肝区肿瘤可全部清楚的展示:平扫可见肝区结节状低密度病灶,边界清,部分病灶可见分叶征象。增强扫描肿瘤在动脉期可呈明显环形强化,中央坏死区呈低密度,无明显强化,病灶与周围肝实质对比,分界更加清晰(见图1);门脉期肿瘤为低密度。行碘油栓塞肿瘤供血血管后于第3周扫描,肿瘤直径进一步增大,病灶中央可见典型的低密度的坏死区域,碘油呈不规则环状及小片状致密沉积,肿瘤残存区域未见碘油存留,增强扫描可见肿瘤周边由肝动脉发出新生的细小供血血管。
2.3 肿瘤DSA特点第1、2周肝动脉造影均可见肝区肿瘤染色征象,基本表现为肿瘤周边环状强化向中央部位过渡,部分可见肿瘤呈结节状染色。肿瘤血供较为丰富,局部供血动脉杂乱、血管网增多,伴大量细小的异常血管,一起勾画出肿瘤轮廓(见图2)。碘油栓塞后于第3周肝动脉直接穿刺造影,肿瘤供血血管较前明显减少,部分可见截断征象,但与栓塞前对比,肿瘤周边可见一些细小新生血管形成,部分新生血管绕过碘油区域包绕肿瘤。经门静脉造影显示门静脉走行及分支正常,未见明显异常征象(图3)。
3 讨 论
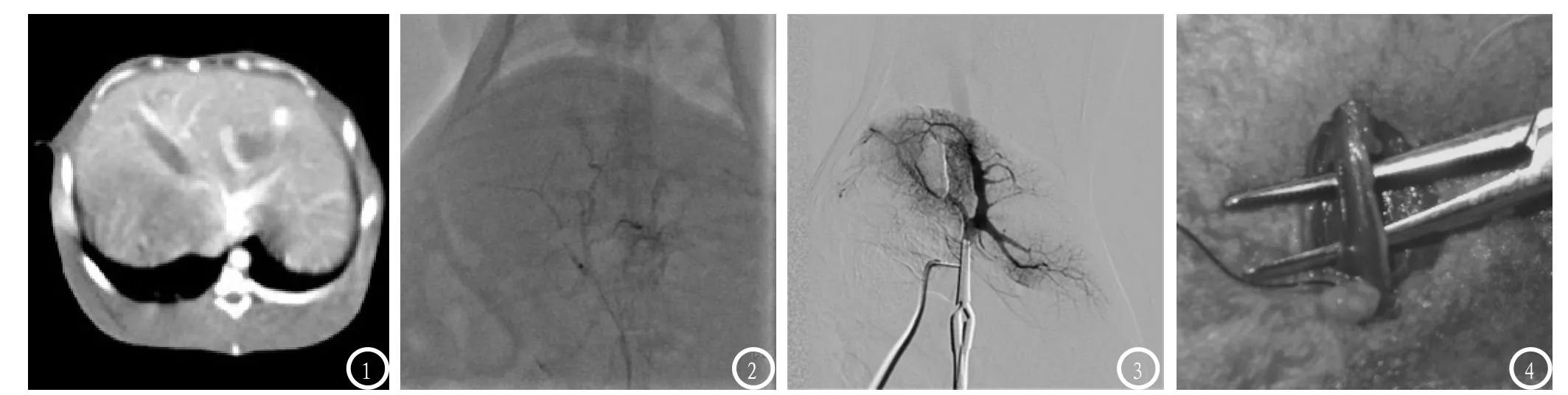
图1 VX2瘤兔行CT增强扫描,肿瘤在动脉期明显强化。图2 行DSA检查,肿瘤血供丰富,局部供血动脉增多、杂乱,可见肿块染色征象。图3 经门静脉造影,显示门静脉及分支走行正常。图4 外科分离肌肉及筋膜,见股动、静脉及股神经三者伴行于肌间。
兔VX2肝癌模型病理上与人类原发性肝癌类似,且血供丰富,适合作为肿瘤影像学评价及介入诊疗研究的动物模型。目前兔VX2肿瘤模型的制作方法主要分为瘤细胞悬液接种法与瘤块接种法,包括经皮穿刺及开腹接种两种途径[3-5]。前者存在的主要问题是悬液为液体,种植过程中悬液流动有可能造成肿瘤向四周的广泛种植。经皮穿刺一般是影像设备引导下直接穿刺种植,但因兔肝脏较小,实际操作过程中有可能造成肝外种植,影响实验结果。我们采用的是开腹直接接种,利用经皮肝穿扩张鞘管,以45°钝性刺入肝叶中心较厚部位,并用泰尔茂血管鞘套装中交换导丝的柔软端,将预填入鞘管中的瘤块及明胶海绵条推入。此种方法避免了刺穿肝叶造成出血或瘤块脱落,另外明胶海绵条可封堵穿刺点,避免瘤块逸出造成异位种植,将瘤块种植在肝叶深部,易于获得良好的血供。同时肺转移的发生率和死亡率也大大降低[6]。关于经股动脉选择性肝动脉造影,因兔股动脉细小,操作不慎有可能造成血管撕裂导致大出血。根据我们的经验,切开腹股沟皮肤后钝性分离肌肉及筋膜,可以看到股动静脉及股神经三者伴行于肌间(图4),此时应钝性游离,切不可粗暴操作;插管前将眼科镊垫于股动脉下方,用眼科剪尖端小心剪出一小口,看到血液溢出即可,切口不可过大,以免推送导管时造成血管断裂。
目前,对兔VX2肝癌模型的影像学监测手段主要有CT、MR、DSA及超声。CT扫描是肝脏肿瘤首选检查方法。结合CT多期对比剂增强扫描,可确定肿瘤生长的位置、大小、形状、血供情况及中心有无坏死,用以区分病灶的良恶性、评价肿瘤血管及对疗效的反应[7]。DSA通过血管内直接注射对比剂,形成良好的组织对比,通过染色征象显示肿瘤血管特征,对肝脏肿瘤的供血血管及TAE后新生血管展示清晰、直观。
肝癌具有很强的诱导血管生成能力,其血管生成程度与肿瘤的生长、转移及预后密切相关[8-9]。临床研究发现,肝癌经肝动脉栓塞术(TAE)后,残癌组织周围常生成大量的新生血管,导致肿瘤复发或进展,其机制仍不十分明确。血管内皮细胞生长因子(VEGF)可能与肿瘤血管生成即肿瘤微血管密度(MVD)、肿瘤的浸润及转移有关。有学者认为[10]术后肿瘤细胞VEGF表达明显上升,VEGF与MVD呈正相关;而另一些研究[11]通过CT灌注扫描研究则表明栓塞治疗后肿瘤灌注参数、VEGF表达及MVD计数均降低。本研究主要从影像学角度探讨TAE前后肿瘤新生血管及残癌组织血流变化:TAE前后CT与DSA影像学表现基本一致,主要表现为由肝动脉供血的肝区肿块,增强扫描可有明显的强化表现,肿瘤内含丰富滋养血管,无明显的血窦腔,直径较大的肿瘤中央常伴较明显的坏死灶,DSA造影显示肿瘤染色丰富,据此我们认为主要为肝动脉供血的富血供肿瘤。国内部分研究结果也表明兔VX2肝癌为富血供肿瘤[12-13]。DSA下门静脉造影显示门静脉分支及走行正常,未见明显染色征象,提示无明显门静脉参与肿瘤供血。碘油栓塞后肿瘤周边可见杂乱细小的新生血管形成,表现为肿瘤周围不规则的染色,无明显门静脉参与供血征象,与人原发性肝癌的DSA表现相[14]。
本实验通过改良的模型制作及对瘤兔介入性操作方法,经CT及DSA影像学评估,证实兔VX2肝癌TAE前后及残存肿瘤组织血供主要来自肝动脉。同时可以从不同角度对介入治疗恶性肿瘤做出较为准确的评估,有利于真实反映肿瘤的血供情况,对介入治疗效果做出全面评估,并进一步指导完善介入操作,提出针对性改进意见。
[1]Y u H,Z h u G Y,X u R Z,e t a1.Arterial embolization hyperthermia using As203 nanoparticles in VX2 carcinomainduced liver tumors[J].PLoS One,2011,6(3):e17926.
[2]魏强,方亮,杨继金,等.兔肝脏、肌肉、皮下VX2肿瘤模型的建立和对比研究[J].介入放射学杂志,2013,(11):931.
[3]Lin WY Chen J,Lin Y,et a1.Implantation of VX2 carcinoma into the liver of rabbits:a comparison of three direct-injection methods[J].Vet Med Sci,2002,64(7):649-652.
[4]承凯,梁惠民,李欣,等.实验兔V X 2肝肿瘤模型制作及动脉插管技术探讨[J].介入放射学杂志,2006,15(2):101.104.
[5]朱光宇,滕皋军,牛焕章,等.兔VX2肝癌模型建立方法的比较及股动脉插管方法的应用[J].中国医学影像技术,2006,22(12):1785-1788.
[6]梁明辉,王晓东,夏力丁,等.兔后肢和肝脏接种V X 2肿瘤方法的研究[J].哈尔滨医科大学学报,2011,45(4):323-326.
[7]曹雪峰,董国礼.兔VX2肝癌模型的建立及其影像学特点[J].川北医学院学报,2013,(1):85-88.
[8]徐宏刚,徐波,陈亮,等.高能聚焦超声治疗后兔VX2肝癌MR灌注加权成像与微血管密度比较[J].中国CT和MRI杂志,2011,38(3):43-45.
[9]孙伟,李忱瑞.CT对肝癌TACE术后疗效及其残灶活性的评估作用分析[J].中国CT和MRI杂志,2011,38(3):77-79.
[10]陈昆涛,何健垣,刘建民,等.兔VX2肝癌化疗栓塞前后CT灌注特征与肿瘤血管生成相关性研究[J].实用医技杂志,2006,13(19):3344-3347.
[11]王滨,徐辉,曹贵文,等.肝动脉化疗栓塞对肝癌肿瘤新生血管生成及血管内皮细胞生长因子表达的影响[J].中华放射学杂志,2005,39(2):204-206.
[12]陈晟,邓钢,牛焕章,等.兔VX2肝种植肿瘤模型制作的完善及综合影像学评价[J].介入放射学杂志,2007,(1):48.
[13]王耀普,杨康健,赵思源,等.兔肝癌模型的改良接种及其D S A影像分析[J].介入放射学杂志,2010,19(3):214-216.
[14]鲁东,吕维富,高斌,等.兔VX2肝癌肝动脉栓塞术后肿瘤新生血管的变化与分析[J].中国介入影像与治疗学,2010,7(3):305-308.
(本文编辑:谢婷婷)
Improvement of Rabbit VX2 Liver Cancer Model and Imaging Evaluation of CT and DSA Before and After TAE*
YU Liang, HAN Xiao, ZHOU Li-fen, et al., Department of Image Center, Hefei Third People's Hospital, Hefei Third Clinical College, Medical University Of Anhui, Hefei 230022, Anhui Province, China
ObjectiveTo improve the production methods of rabbit VX2 liver cancer model, and applications of DSA and CT before and after tumor TAE radiologic evaluation. Methods Production and storage of rabbit VX2 liver cancer model 20 batches.In7,14 days after inoculation CT scan and enhanced scan. 15th of line open portal vein puncture angiography and directly after catheter-hepatic artery angiography examination, the tumor blood supply artery iodine oil embolization. 21 days CT scan and enhanced scanning again. 22 days open lines of portal vein and hepatic artery puncture DSA examination directly. Results When planting 2 weeks liver area tumor can all show clearly, CT scan shows nodular liver area low density lesions, enhanced scanning tumor in can show clear ring arterial enhancement,portal venous phase in low density. 3 weeks when tumor necrosis is obvious. DSA shows the rich blood supply of the tumor. Conclusion Improved the rabbit VX2 liver cancer model success rate is higher. CT and DSA was consistent before and after TAE, and the flow of blood to the tumor mainly comes from the hepatic artery, the portal vein is not involved in blood supply.
VX2 Tumor; Liver Cancer Model; CT; DSA
R73;R97
A
合肥市第四届医学重点专科建设基金,编号:卫科(2014-239号)
10.3969/j.issn.1672-5131.2017.08.025
2017-07-11
胡茂能

