浅谈美国FDA高风险医疗器械审批要求的最新调整思路
周良彬沈建如伍倚明*
1 广东省医疗器械质量监督检验所 (广东 广州 510663)
2 广州金域医学检验中心有限公司 (广东 广州 510320)
浅谈美国FDA高风险医疗器械审批要求的最新调整思路
周良彬1沈建如2伍倚明1*
1 广东省医疗器械质量监督检验所 (广东 广州 510663)
2 广州金域医学检验中心有限公司 (广东 广州 510320)
介绍2014-2015年美国FDA完成的战略重点项目——对需PMA医疗器械的回顾性审核,解析其最新的高风险医疗器械监管思路。
高风险医疗器械 审批要求 调整思路
为取得医疗器械注册所需上市前和上市后数据要求的最佳平衡,促进和加快高风险医疗器械发展和审核,作为2014~2015年战略重点项目(2014-2015 Strategic Priorities:Strike the Right Balance Between Premarket and Postmarket Data Collection),FDA的设备仪器与放射健康中心(Center for Devices and Radiological Health,CDRH)对目前已上市的、需要上市前审批(PMA)的Ⅲ类高风险医疗器械(以下简称已上市PMA器械)进行了全面的回顾性审核——基于这些产品临床研究、非临床数据以及实际临床表现等信息,评估上市前/上市后数据要求对于其安全性的影响水平,并针对不同情况提出了相应的调整方案[1]。
1.项目概述
作为2014~2015战略重点,FDA分两阶段实施了该项目,其计划和完成情况如下。
1.1 第一阶段
计划:到2014年12月31日为止,完成50%已上市PMA器械的回顾性审核,以确定是否需要将一些上市前数据要求更改为上市后相关设定或进行重新分类,并将相关决定向公众发布[1]。
结果:在2014年,CDRH完成了69%已上市PMA器械的回顾性审核。
1.2 第二阶段
计划:到2015年12月31日为止,完成全部已上市PMA器械的审核,已确定是否需要将一些上市前数据要求更改为上市后相关设定或进行重新分类,并将相关决定向公众发布[2]。
结果:在2015年,CDRH完成了剩余部分已上市PMA器械的回顾性审核。

表1. 拟降为Ⅱ类的医疗器械
2.调整方案
FDA官方网站分别于2015年4月和2016年1月对审核结果进行了在线发布。在其发布的审核结论中,分为四种处理思路:
(1)拟降为Ⅱ管理(见表1):2014年确定拟降为Ⅱ类的共21项,到2017年1月为止,仅唾液系统刺激器(LTF)于2015被重新分为Ⅱ类,其他尚未发布重新分类文件;2015年确定拟降为Ⅱ类的共11项,到2017年1月为止,尚未有相关重新分类文件发布。
(2)保持管理类别,拟更改数据要求:共27项,其中FAF/MLV/NRZ/MEQ/MMY/MNB共六项为2015年完成部分,如表所示,主要拟采取的措施有:①部分上市前临床数据要求改为上市后临床数据要求;②性能标准或非临床测试替代某些临床试验;③依靠上市后控制降低上市前要求;④参考实际情况,减少上市后研究;⑤其他方式降低或减少上市前临床数据要求,比如将需要大量患者的单组研究改为有预设结束点、需要较少患者的对照研究。其中MJP/MKQ/MNM三个产品的要求变更已于2015年完成(见表2)。
(3)回顾性审核期间,已减少或更改数据要求和/或重新分类:2014年完成3项,2015年完成5项,共8项。见表3。
(4)保持Ⅲ类,数据要求不做更改:共涉及产品148个,2014年确定96个,2015年确定52个,部分产品见表4。
3.思路解析
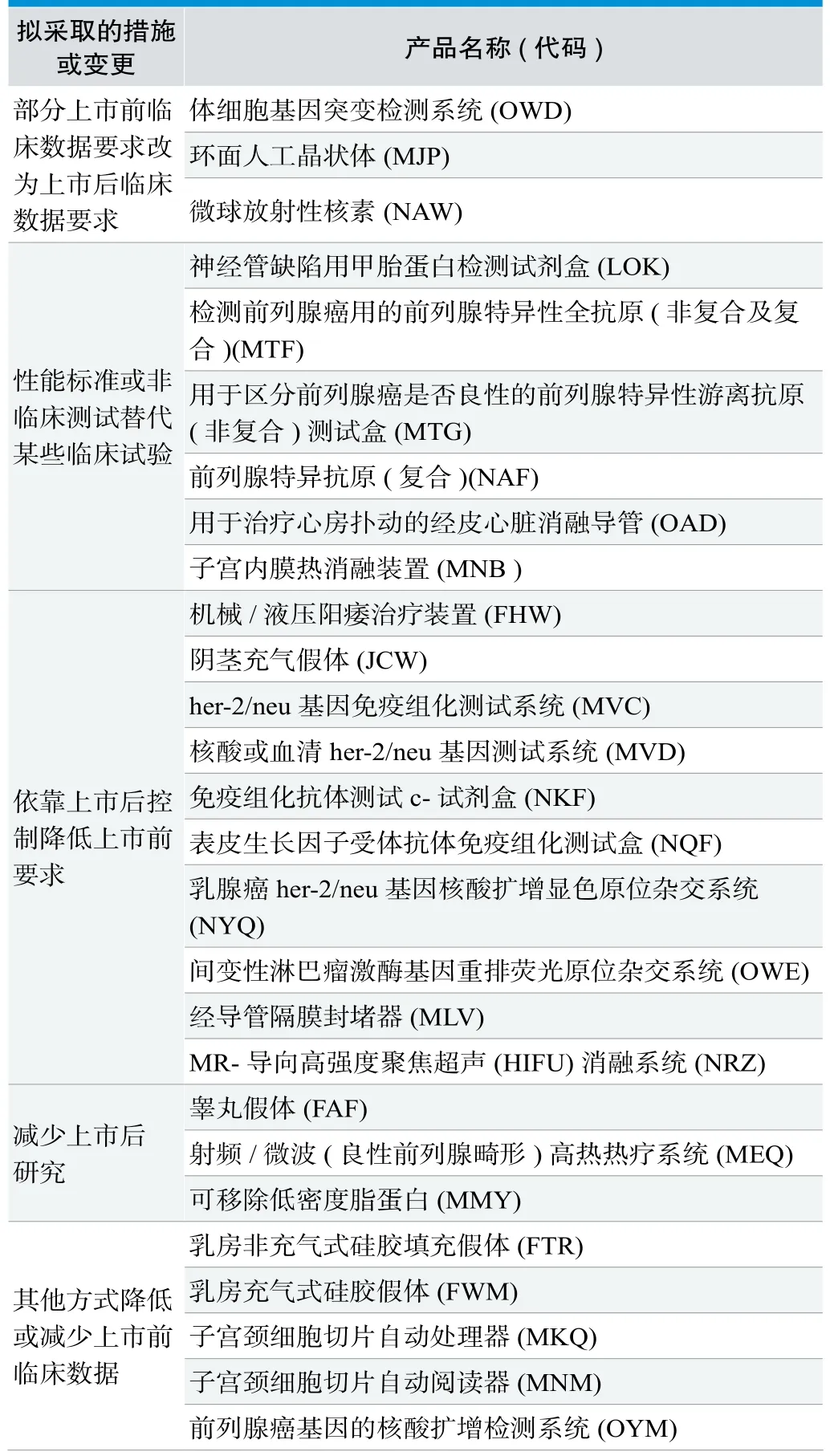
表2. 拟变更上市前数据要求的医疗器械及措施
美国FDA的医疗器械监管一向以严格见称,其监管水平获得了全球范围的认可。实际上,确实因其严格的准入措施防止或减少了很多医疗事故在美国发生,FDA曾撰文“Unsafe and Ineffective Devices Approved in the EU that were Not Approved in the US[3]”,对该类事件进行了介绍,文中总结了一系列近年来在EU市场发生严重不良事件的器械,而在美国由于其严格准入,这些器械尚未获批上市,或者已被拒绝进入美国市场。

表3. 已变更上市前数据要求和/或重新分类的医疗器械及措施
一直以来,在获得广泛赞誉的同时,美国FDA这样的监管尺度也面临来自各方面的巨大压力。这种压力主要是来自于行业、消费者对其注册程序繁杂、审批过程过于漫长的抱怨和不满,反对者认为这样的要求使阻碍了医疗器械行业创新和发展,使其成本增加、入市时间延长。相比欧洲地区的患者,美国患者为获得新型医疗器械往往需要等待更长的时间。

表4. 决定保持管理类别,数据要求不做更改的部分医疗器械
为缓解这些压力,FDA一直致力于在保障安全性的同时,以科学监管手段提高审批效率,降低企业的合规成本,本次对PMA产品的回顾性审核充分体现了这样的思路和出发点:在对器械临床应用情况进行收集分析的基础上,不断对监管手段的效率、必要性进行探讨,从而做出更为科学合理的调整,使其监管要求更贴近实际,产生更好的社会综合效益。
[1] U. S. Food and Drug Administration. Results of 2014 - 2015 Strategic Priorities:Strike the Right Balance Between Premarket and Postmarket Data Collection[Z]. 2015-04-15 (update).
[2] U. S. Food and Drug Administration. Results of 2014 - 2015 Strategic Priorities:Strike the Right Balance Between Premarket and Postmarket Data Collection[Z]. 2016-01-13 (update).
[3] U. S. Food and Drug Administration. Unsafe and Ineffective Devices Approved in the EU that were Not Approved in the US[Z]. 2012-05.
Introduction to New Changes of U.S. FDA High-Risk Medical Device Approval Requirements
ZHOU Liang-bin1SHEN Jian-ru2WU Yi-ming1*
1 Guangdong Medical Device Quality Surveillance and Test Institute (Guangdong Guangzhou 510663)
2 Guangzhou Kingmed Ctr for Clin Lab Co. Ltd (Guangdong Guangzhou 510320)
Introduce 2014-2015 Strategic Priorities of U.S FDA—a retrospectively review of PMA medical device, and analyze its latest regulatory concept of high-risk medical devices.
high-risk medical device, approval requirement, new change
1006-6586(2017)11-0052-03
R197.39
A
2017-02-10
周良彬,生物医学工程学博士,工程师,从事有源医疗器械检测及标准化工作;伍倚明,通讯作者,硕士研究生,高级工程师,从事医疗器械检测及标准化工作,E-mail:13922138935@139.com。

