一次性使用注射器用活塞溶血试验的探讨
严小莉 王莎莎 刘茜 高静贤江苏省医疗器械检验所 (江苏 南京 210022)
一次性使用注射器用活塞溶血试验的探讨
严小莉 王莎莎 刘茜 高静贤*江苏省医疗器械检验所 (江苏 南京 210022)
本文依据YY/T 0243-2016一次性使用注射器用活塞的行业标准,选择了三个厂家送检的一次性使用注射器用活塞进行了溶血试验方法的探讨。试验结果表明,不同的浸提液制备条件,试验结果存在显著差异。
一次性使用注射器用活塞 溶血试验 标准
一次性使用注射器用活塞属于间接与血液接触的医疗器械产品,依据医疗器械分类表,其属于半体外用间接接触血液的A类医疗器械[1]。按照ISO10993.1-2009医疗器械生物学评价试验指南,一次性使用注射器用活塞需进行细胞毒性、致敏、皮肤或皮内刺激、全身急性毒性和血液相容性共5项生物试验[2]。本文依据YY/T 0243-2016一次性使用注射器用活塞的行业标准,选择了三个厂家送检的一次性使用注射器用活塞进行了溶血试验方法的探讨[3]。2016版的行业标准中溶血试验体系是将样品制备成浸提液后进行评价,引用了GB/T 16886.12中浸提液的制备方法。依据GB/T 16886.12标准,选取了其中两种浸提液方法制备浸提液,旨在研究不同的浸提试验方法对溶血试验结果的影响[4]。
1.资料与方法
1.1 一般材料
试验样品:选用三个厂家送检的同批次一次性使用无菌注射器用活塞。
试验主要仪器:紫外可见分光光度计(北京普析,型号:Tu-1901);多管架自动平衡离心机(长沙湘仪,型号:TDZ5-WS);电热恒温水浴锅(Thermo,型号:HWS-26);高温高压灭菌锅(TOMY,型号:SX-500)。
1.2 方法
1.2.1 样品制备
取三个厂家一次性使用注射器用活塞样品,剪碎,按照0.2g/mL的浸提比例加入生理盐水,依据浸提条件分别分成两组:A组(37˚C±1˚C,24h±2h);B组(121˚C±2˚C,1h±0.1h)。A组在试验前一天置于恒温培养箱中;B组在试验当天高温高压121˚C,1h,冷却后备用。
1.2.2 对照品制备
阳性对照组每管加入10mL蒸馏水;阴性对照组每管加入10mL生理盐水。
1.2.3 稀释抗凝兔血制备
采取家兔心脏血液8mL(2%草酸钾溶液1:9抗凝),与10mL生理盐水稀释混匀。
1.2.4 试验步骤
浸提液制备好后,分别加至试管中,每管10mL浸提液,阴性对照组加入10mL生理盐水,阳性对照组加入10mL蒸馏水,各组设3个平行管。将全部试管置于恒温水浴(37±1)˚C保温30min后,每支试管中加入0.2mL稀释抗凝兔血,轻轻混匀后(37±1)˚C水浴中继续保温60min。取上清液,置于离心机中800g离心5min,观察各管上清颜色变化,用分光光度计在545nm波长处测定吸光度。各组分别取3管平均值,并按照以下公式计算溶血率:溶血率=(供试品组吸光度-阴性对照组吸光度)/(阳性对照组吸光度-阴性对照组吸光度)×100%。
2.结果
离心后,肉眼观察B组上清颜色明显高于A组。由表1可看出,三个厂家的一次性使用注射器用活塞经两种浸提方法处理后,其溶血率均有显著的差异。依据YY/T 0243-2016标准的要求:活塞的溶血率应小于5%,因而三个厂家的B组均不符合标准要求。
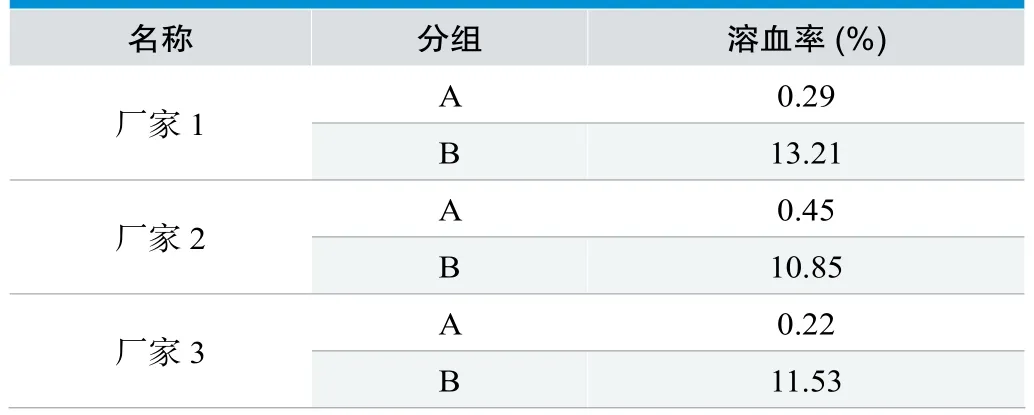
表1. 一次性使用注射器用活塞的溶血率
3.讨论
一次性使用无菌注射器用活塞作为一次性使用注射器的重要组件,在使用中直接接触药液,属于间接与血液接触类的器械,所以其生物相容性的评价直接关系到一次性使用注射器的生物安全性。王文佳等[5]曾对一次性使用无菌注射器用活塞的细胞毒性试验检测进行了报道,何华红等[6]也对一次性使用无菌注射器用活塞工艺影响其细胞毒性的方面进行了探讨,但对于其溶血试验方面的研究报道还鲜而有之。
溶血试验其原理是将样品浸泡于生理盐水中直接与血细胞接触,通过检测溶液中血红蛋白的含量来评价供试品的溶血率[7]。现行标准中包含详细方法的溶血试验检验依据是GB/T14233.2-2005医用输液、输血、注射器具检验方法第2部分:生物学试验方法标准。在实际的检验过程中,不管是企业提供的产品技术要求还是生物学评价委托书,大部分引用的都是YY/T 0243一次性使用注射器用活塞的行业标准,而此行业标准中溶血试验是引用的标准GB/ T14233.2。2016年3月,国家食品药品监督管理总局颁布了2016版的YY/T 0243的标准,并于2017年1月1日开始实施。相较于2003版的行业标准,2016版的标准中对溶血试验的试验体系进行了较大的改动:标准条款中规定了依据GB/T 16886.12,按照0.2g/mL的浸提比例制备浸提液用于溶血试验,而2003版中是直接引用的GB/T14233.2-2005,其是将样品直接与血液接触以测定溶血率。因而,依据2016版的行业标准对一次性注射器使用活塞进行溶血试验,选择浸提液的制备条件就极其关键。GB/T 16886.12是医疗器械生物学评价第12部分:样品制备与参照样品,该标准对样品浸提液制备条件进行了规定,共列出了5个常规制备条件。本试验中选取了其中两个常规制备条件即A(37˚C±1˚C,24h±2h)和B(121˚C±2˚C,1h±0.1h),试验结果表明,这两种浸提条件的试验结果截然不同。三个厂家的B组溶血率均大于5%,不符合标准要求。因而在实际检测中,对于一次性使用无菌注射器用活塞而言,如何选择合适的样品浸提方法,更科学、更准确的评判其生物性能有待进一步的研究和明确。
[1] 奚廷斐. 医疗器械生物学评价[M]. 北京:中国标准出版社, 2012:4-9.
[2] BS Institution. ISO 10993-12:2012.Biological evaluation of medical devices -Part 12:Sample preparation and reference materials[S]. 2012.
[3] YY/T0243-2016.一次性使用注射器用活塞[S]. 2016.
[4] GB/T 16886.12-2005.医疗器械生物学评价第12部分:样品制备与参照样品[S]. 2005.
[5] 王文佳, 何华红, 李薇, 等. 不同厂家一次性使用医用注射器及活塞体外细胞毒性的质量考察[J]. 中国医疗器械信息, 2013,19(10):39-41.
[6] 何华红, 李薇, 吴婷. 一次性使用医用注射器活塞体外细胞毒性检测[J]. 中国医疗器械杂志, 2010,34(2):123-125.
[7] GB/T14233.2-2005.医用输液、输血、注射器具检验方法第2部分:生物学试验方法[S]. 2005.
Hemolysis Test of Plunger Seal of Syringes for Single Use
YAN Xiao-li WANG Sha-sha LIU Qian GAO Jing-xian*Jiangsu Province Medical Instrument Testing Institute (Jiangsu Nanjing 210022)
According to the standard of YY/T 0243-2016 Plunger seal of Syringes for Single Use, we performed hemolysis test on the Plunger seal of Syringes for Single Use from three different manufactures. The results showed: there were signifcant differences in the different extraction conditions.
plunger seal of syringes for single use, hemolysis test, standard
1006-6586(2017)11-0032-02
TH446
A
2017-03-20
高静贤,通讯作者,高级工程师,江苏省医疗器械检验所生物学评价中心主任。

