miR-139-5p调控KRAS突变结直肠癌细胞增殖、迁移和侵袭的功能与机制研究
曹田宇,杜 风,李婷宇,卢瑗瑗,赵晓迪
(第四军医大学西京消化病医院,肿瘤生物学国家重点实验室,西安 710032;*通讯作者,E-mail:leedyzhao@fmmu.edu.cn;#共同通讯作者,E-mail:luyuandreamer@aliyun.com)
miR-139-5p调控KRAS突变结直肠癌细胞增殖、迁移和侵袭的功能与机制研究
曹田宇,杜 风,李婷宇,卢瑗瑗#,赵晓迪*
(第四军医大学西京消化病医院,肿瘤生物学国家重点实验室,西安 710032;*通讯作者,E-mail:leedyzhao@fmmu.edu.cn;#共同通讯作者,E-mail:luyuandreamer@aliyun.com)
目的 建立结直肠癌KRAS突变细胞DKO-1的miR-139-5p功能获得模型,探讨miR-139-5p对KRAS突变结直肠癌细胞恶性表型的影响及可能的分子机制。 方法 利用real-time PCR检测miR-139-5p在KRAS突变同源细胞系中表达;通过瞬时转染建立miR-139-5p功能获得细胞模型;通过绘制MTT生长曲线和集落形成实验检测miR-139-5p对DKO-1细胞生长增殖的影响;通过细胞划痕实验和Transwell侵袭实验检测miR-139-5p对DKO-1细胞生长迁移侵袭的影响;通过生物信息学分析miR-139-5p的下游靶基因,利用双荧光酶报告基因实验验证miR-139-5p与靶基因的直接结合情况。 结果 miR-139-5p在KRAS突变结直肠癌细胞中表达降低(P<0.01);过表达miR-139-5p能够抑制DKO-1细胞的生长能力(P<0.01)、集落形成能力(P<0.01)、迁移和侵袭能力(P<0.01);miR-139-5p能够直接结合FOS基因的3′-UTR区(P<0.01)。 结论 miR-139-5p能够抑制DKO-1细胞的增殖、迁移和侵袭能力,其机制可能与抑制FOS基因表达有关。
结直肠癌; miR-139-5p; KRAS突变; 细胞增殖; 迁移; 侵袭
结直肠癌是最常见的消化道恶性肿瘤之一,其发病率和病死率在全球范围内均居第3位[1]。在我国,结直肠癌的发病率和死亡率逐年上升,其中死亡率已跃居第5位[2]。近年来,以抗表皮生长因子(EGFR)为代表的分子靶向治疗的出现,丰富和发展了结直肠癌的综合治疗手段。大量研究表明,分子靶向药物联合化疗能有效提高结直肠癌患者的生存率[3],其中KRAS基因状态是影响疗效的重要因素。KRAS基因是EGFR信号通路中的重要分子,其编码的KRAS蛋白为EGFR通路下游的一种G蛋白分子。KRAS基因突变后导致EGFR信号通路异常活化,从而对EGFR单抗治疗失效[4]。因此,研究结直肠癌细胞中KRAS突变后在分子、通路及调控网络水平的改变,有望为KRAS突变的结直肠癌患者寻找新的治疗靶点。
miRNA是一类19-24个核苷酸的非编码小RNA分子,通过靶向mRNA的3′末端非编码区(3′-UTR)实现对下游靶基因的负性调节。miRNA通过与促癌基因和抑癌基因相互作用,可发挥抑癌基因或促癌基因的双重功能,在调控肿瘤细胞增殖、凋亡、耐药和转移等过程中发挥重要作用。研究表明,miRNA表达异常是肿瘤发生和发展过程中的普遍现象,且呈现高度的特异性[5]。近年来,miRNA在结直肠癌中的研究不断增多,揭示了其在调控结直肠癌发生发展中的重要作用[6,7]。然而,结直肠癌KRAS基因突变与细胞内miRNA表达异常是否直接相关还有待研究;KRAS下游的受控的miRNA及其功能和机制仍有待进一步研究。本研究关注KRAS突变同源细胞系中差异表达基因miR-139-5p,通过建立功能获得细胞模型,明确了miR-139-5p在调控KRAS突变结直肠癌细胞增殖、迁移和侵袭中发挥的功能,初步探讨了miR-139-5p抑制FOS基因调控KRAS突变结直肠癌细胞恶性表型分子机制。
1 材料和方法
1.1 细胞株与主要试剂
人结直肠癌细胞系DLD-1、DKs-8和DKO-1引自美国范德堡大学医学中心胃肠病学系Robert Coffey教授实验室;DMEM培养液、胎牛血清、抗生素及胰酶(Gibco,美国);转染试剂Lipofectamine 2000、miR-139-5p模拟物及阴性对照(Invitrogen,美国);miRNA提取试剂盒(Qiagen,美国),miR-139-5p引物、逆转录试剂盒及real-time PCR试剂盒(Applied Biosystems,美国);MTT、二甲基亚砜(Sigma,美国);Transwell小室(Millipore,美国),Matrigel基质胶(Corning,美国);RIPA蛋白裂解液(江苏碧云天),BCA蛋白定量试剂盒、ECL化学发光试剂(美国Thermo,美国);c-FOS抗体、β-actin抗体(Cell Signaling,美国),山羊抗鼠、抗兔二抗(北京中杉);双荧光素酶报告基因检测试剂盒(Promega,美国)。
1.2 细胞培养与转染
DLD-1、DKs-8和DKO-1细胞均用含10%胎牛血清、1%抗生素(青霉素、链霉素和丝裂霉素)的DMEM培养基,在37 ℃、5%CO2条件下培养,取对数生长期的细胞进行实验。将DKO-1细胞接种于6孔板,当细胞融合度达50%时按Lipofectamine 2000转染试剂说明书,将20 nmol/L阴性对照和miR-139-5p模拟物(miR-139-5p mimic,miR-139-5p)分别转染细胞,转染后48 h收集细胞进行后续实验。
1.3 RNA提取与实时定量PCR
收集对数生长期细胞,使用miRNA提取试剂盒抽提细胞RNA并测量RNA浓度及A260/A280比值。使用逆转录试剂盒说明书将mRNA反转录为cDNA,设置反应体系为20 μl,设置逆转录反应程序为:16 ℃,30 min;42 ℃,30 min;85 ℃,5 min。使用PCR试剂盒说明书检测miR-139-5p在各细胞系中的表达,设置反应体系为20 μl,设置PCR反应程序为:95 ℃,20 s;95 ℃,1 s;60 ℃,20 s;60个反应循环。以U6 snRNA基因为内参,通过2-ΔΔCt方法分析实时定量PCR数据。
1.4 MTT实验
收集对数生长期细胞,制备单细胞悬液,接种至5块48孔板,按分组每组设置5个重复,每孔细胞数约为3×103个。每24 h取出其中1块48孔板,每孔加入20 μl MTT溶液(5 mg/ml)后置于细胞培养箱孵育4 h。移除每孔中的液体,加入150 μl二甲基亚砜;室温轻微震荡10 min以溶解甲臜产物。使用酶标仪于波长570 nm测定各孔吸光度值;以时间为横轴、吸光度值为纵轴绘制细胞生长曲线。
1.5 集落形成实验
收集对数生长期细胞,制备单细胞悬液,接种至6孔板,按分组每组设置3个重复,每孔细胞数约为1×103个,轻微摇晃培养板使细胞均匀分布。在细胞培养箱中连续培养直至形成肉眼可见集落。移除培养基,PBS漂洗3次;每孔加入甲醇2 ml,固定15 min;移除甲醇,PBS漂洗3次。每孔加入结晶紫染色液2 ml,染色15 min;移除结晶紫染色液,PBS冲洗,在清洁空气中干燥。计数每孔集落形成数量并照相。
1.6 细胞划痕实验
收集对数生长期细胞,接种至6孔板。待细胞生长融合度约90%-95%时,用20 μl枪头垂直于6孔板制造细胞划痕,吸去细胞培养液,用PBS冲洗划痕产生的细胞碎片。加入无血清培养基,将培养板放入培养箱培养,每隔24 h取出拍照。
1.7 细胞侵袭实验
将Matrigel基质胶置于4 ℃过夜,次日将液化的Matrigel与培养基以1 ∶6的比例稀释。将滤膜孔径为8 μm的Transwell小室放入24孔板中,在小室内加入50 μl Matrigel稀释液包被滤膜。将培养板置于孵箱中4 h使包被液晾干。收集对数生长期细胞,使用含10%BSA的培养基重悬细胞,调整细胞密度为1×106/ml。在小室外加入600 μl含10%血清的培养基,在小室内加入100 μl细胞悬液,放入孵箱培养48 h。取出小室,用PBS漂洗3次后置于95%乙醇中固定5 min,在0.5%结晶紫染色液中染色10 min;用PBS漂洗去除未结合细胞的染色液。用棉签轻拭去小室滤膜上层的细胞,在显微镜下观察滤膜下层细胞,每个样本随机选取10个视野拍照并计数。
1.8 蛋白提取与Western blot检测
收集对数生长期细胞,加入约200 μl细胞裂解液(含Cocktail蛋白酶抑制剂和磷酸酶抑制剂),置于冰上裂解20 min;离心收集上清,用Bradford法进行蛋白定量。取40 μg蛋白加入上样缓冲液,经100 ℃、5 min变性后用10%的SDS-PAGE分离。蛋白质半干转移至NC膜。10%脱脂牛奶室温封闭2 h。移除封闭液,分别加入c-FOS(1 ∶500)和β-actin(1 ∶2 000)一抗,置于4 ℃孵育过夜。TBST洗涤3次后加入相应二抗(1 ∶2 000),室温孵育1 h。TBST洗涤后,使用ECL化学发光液,在Bio-Rad ChemiDox XRS凝胶成像系统中显影。
1.9 载体构建与双荧光素酶报告基因实验
通过TargetScan等数据库,确定FOS基因3′UTR上的miR-139-5p的结合位点核苷酸序列。PCR扩增获得含有miR-139-5p结合位点的FOS基因序列,克隆到psiCHECK-2载体的XhoⅠ与NotⅠ的酶切位点之间,构建荧光报告基因载体。测序鉴定后,用荧光报告基因载体分别和miR-139-5p或NC共转染细胞。48 h后Reporter lysis buffer裂解细胞,使用Luminometer荧光发光仪检测荧光素酶活性。
1.10 统计学分析

2 结果
2.1 miR-139-5p在KRAS突变同源细胞系中表达降低
在亲本细胞DLD-1以及由DLD-1衍生出的两株分别包含野生型和G13D突变体KRAS等位基因的DKO-1(仅含突变的KRAS等位基因)和DKs-8(仅含野生型KRAS等位基因)等3株细胞系中检测miR-139-5p的表达水平。实时定量PCR结果表明:miR-139-5p在DKs-8细胞中的表达较DLD-1明显升高(P<0.01,见图1A),在DKO-1细胞中则较DLD-1有所降低(P<0.01,见图1A),提示miR-139-5p表达水平与结直肠癌细胞KRAS等位基因的突变状态密切相关。为研究miR-139-5p在不同KRAS基因突变状态的结直肠癌细胞中的功能,利用miR-139-5p模拟物(miR-139-5p mimic)瞬时转染DKO-1细胞建立miR-139-5p功能获得细胞模型。通过实时定量PCR方法检测miR-139-5p的表达,结果表明:与阴性对照相比,转染miR-139-5p mimic后DKO-1细胞中miR-139-5p的表达水平明显升高(P<0.01,见图1B),提示成功建立miR-139-5p功能获得模型。

与DKs-8和DKO-1比较,**P<0.01 与阴性对照组比较,**P<0.01 A.不同突变状态细胞中表达 B.DKO-1细胞中miR-139-5p转染效率图1 miR-139-5p在不同KRAS突变状态的结直肠癌细胞中的表达及在DKO-1细胞中的转染效率Figure 1 The expression of miR-139-5p in isogenic colon cancer cells harbor different KRAS mutation status and transfection efficiency of miR-139-5p mimic in DKO-1 cells
2.2 过表达miR-139-5p抑制KRAS突变细胞增殖和生长
为观察miR-139-5p对KRAS突变结直肠癌细胞增殖表型的影响,我们对miR-139-5p过表达细胞模型分别进行了细胞生长曲线和集落形成能力的检测。利用MTT法检测miR-139-5p对细胞体外增殖的影响,结果表明:上调miR-139-5p后DKO-1细胞的存活率低于对照组(P<0.01,见图2)。进一步通过集落形成实验,结果表明:上调miR-139-5p后DKO-1细胞的集落形成数明显少于对照组(P<0.01,见图3)。上述结果表明,miR-139-5p能抑制体外KRAS突变肠癌细胞的增殖和生长能力。
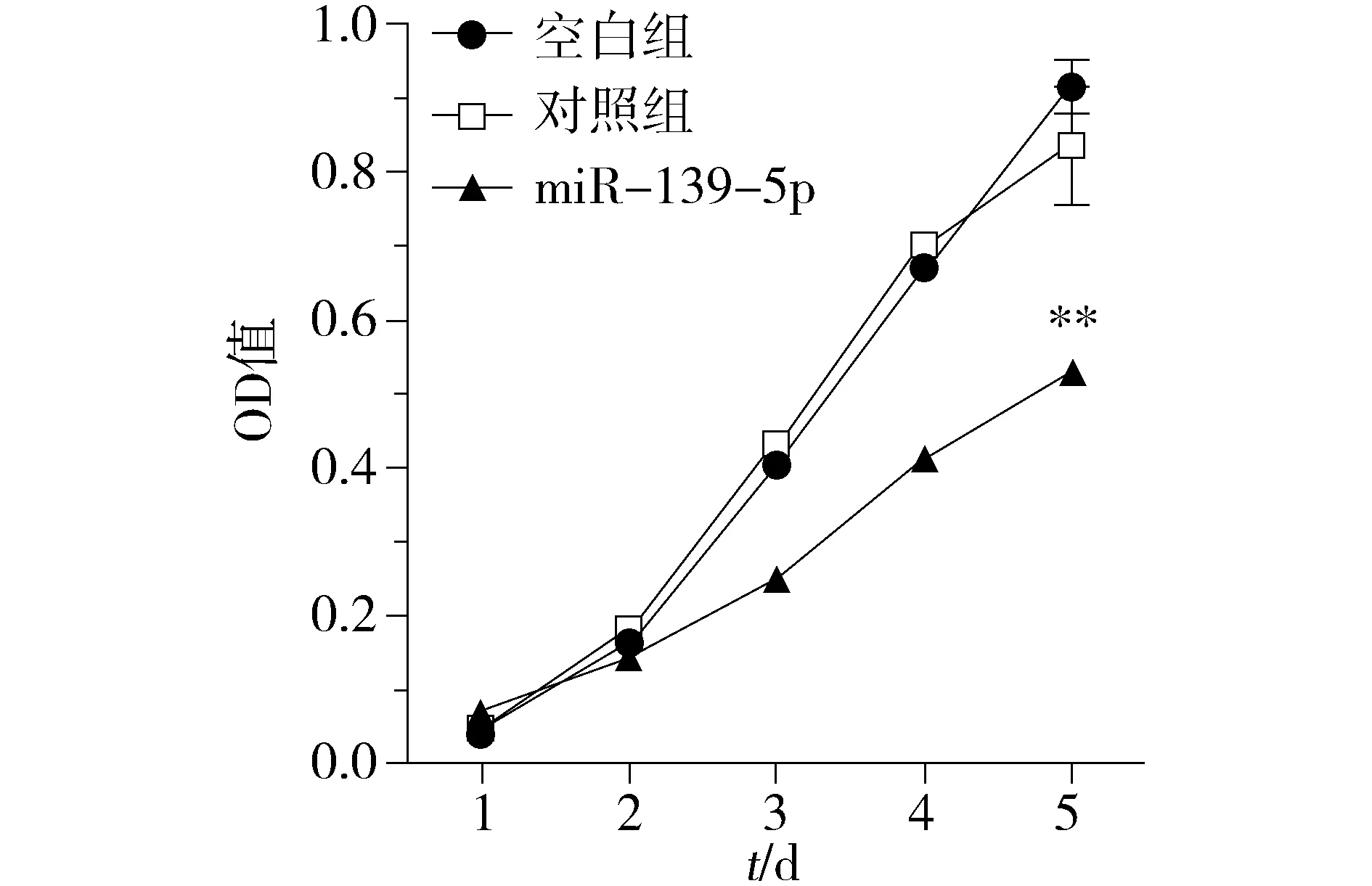
与对照组比较,**P<0.01图2 miR-139-5p对DKO-1细胞生长增殖的影响Figure 2 The effects of miR-139-5p on proliferation in DKO-1 cells
2.3 过表达miR-139-5p抑制KRAS突变细胞迁移和侵袭
为进一步观察miR-139-5p对KRAS突变肠癌细胞转移表型的影响,分别利用划痕实验和Transwell侵袭实验,检测miR-139-5p过表达细胞模型的迁移和侵袭能力。划痕实验和Transwell侵袭实验结果表明:上调miR-139-5p后,DKO-1细胞迁移的能力明显降低(见图4),DKO-1细胞侵袭的数量也明显下降(P<0.01,见图5)。上述实验表明,miR-139-5p能在体外抑制KRAS突变结直肠癌细胞的迁移和侵袭能力。
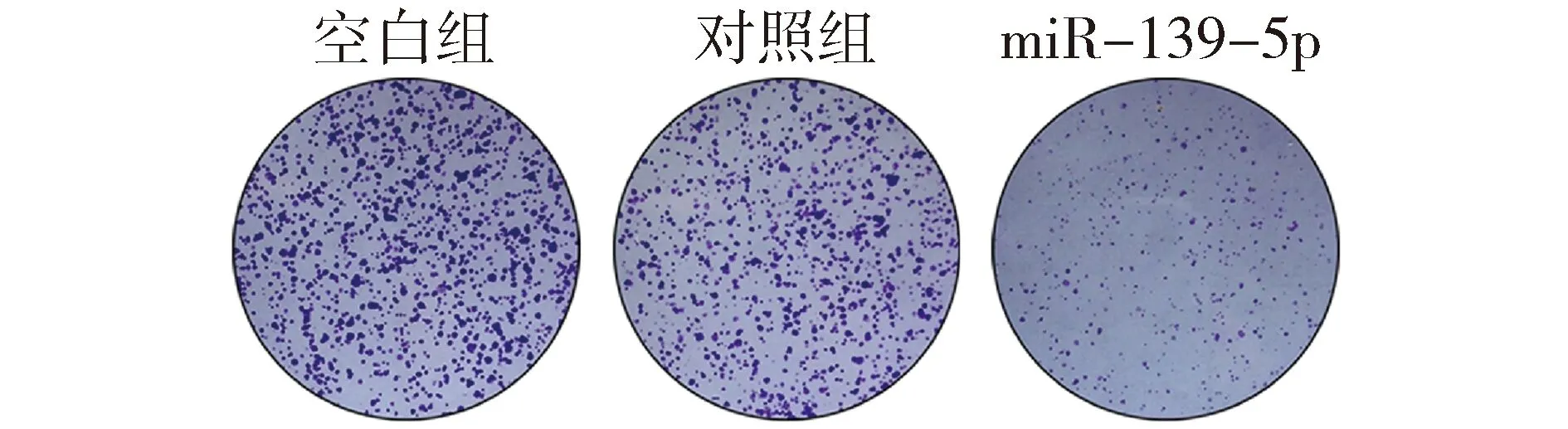
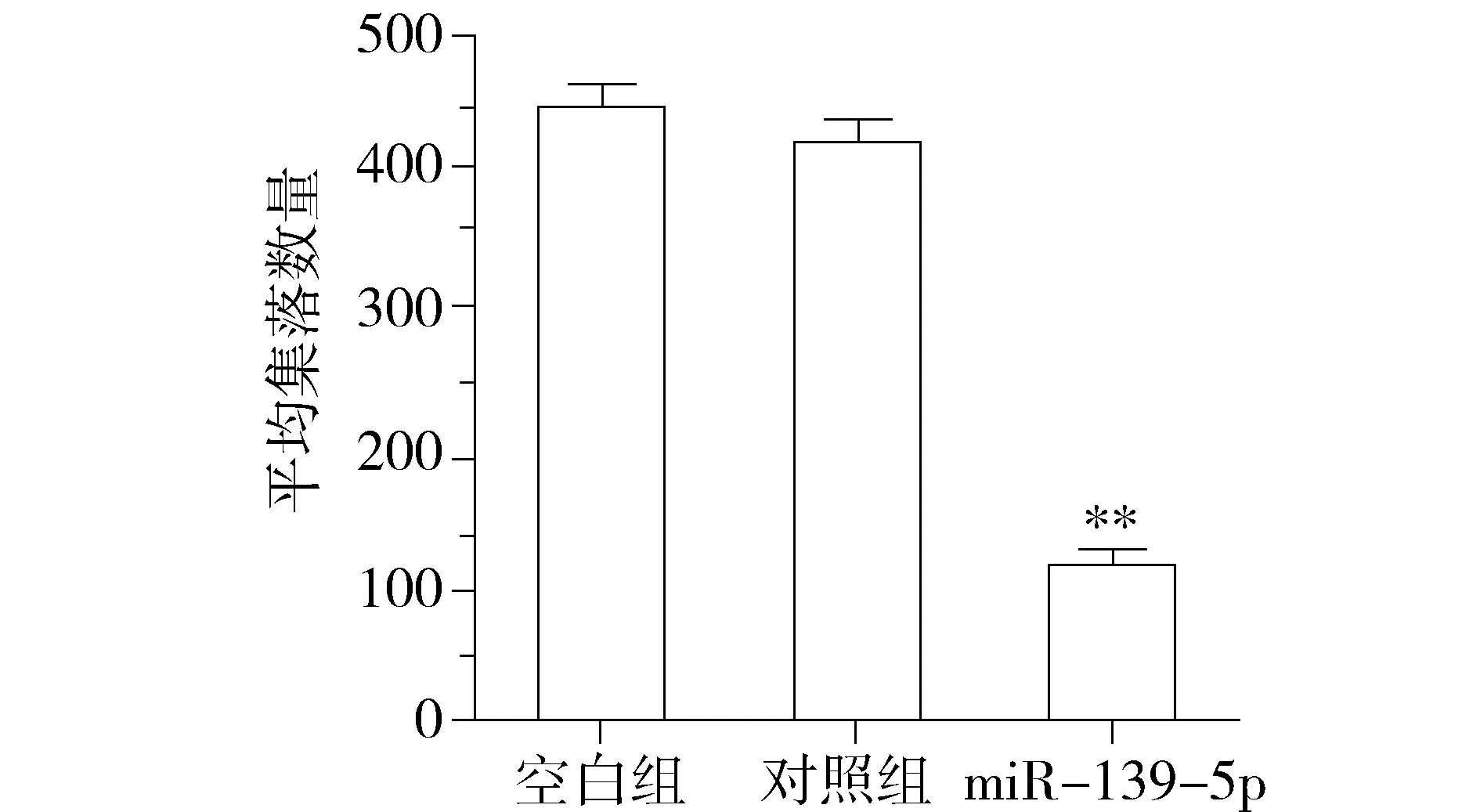
与对照组和空白组比较,**P<0.01图3 miR-139-5p对DKO-1细胞集落形成能力的影响Figure 3 The effects of miR-139-5p on colony formation in DKO-1 cells

图4 miR-139-5p对DKO-1细胞划痕迁移能力的影响Figure 4 The effects of miR-139-5p on migration of DKO-1 cells
2.4 miR-139-5p在结直肠癌细胞中靶基因的预测和鉴定
为探讨miR-139-5p抑制KRAS突变结直肠癌细胞生长和转移表型的分子机制,利用TargetScan、PicTar和miRanda等公共数据库对miR-139-5p与靶基因3′-UTR区的结合位点进行生物信息学分析。分析表明,FOS基因的3′-UTR的96-102和526-432段碱基序列分别含有miR-139-5p的2个结合位点(见图6A)。利用Western blot检测DLD-1、DKO-1和DKs-8细胞中FOS基因的表达,结果表明:与DLD-1细胞相比,FOS蛋白在DKs-8中表达降低,在DKO-1细胞中表达则明显升高(图6B),提示FOS蛋白表达水平与KRAS基因的突变状态密切相关。分别构建包含野生型和突变型miR-139-5p结合位点的FOS基因3′-UTR的荧光素酶报告基因载体,通过双荧光素酶报告基因实验,结果表明:上调miR-139-5p可抑制含有其结合位点的FOS野生型3′-UTR报告基因的荧光强度,而对于突变型质粒的荧光强度则无明显影响(P<0.01,图6C)。上述实验表明,miR-139-5p能通过与FOS的3′-UTR区域上的结合位点直接结合,FOS是miR-139-5p在结直肠癌细胞中的直接靶分子。
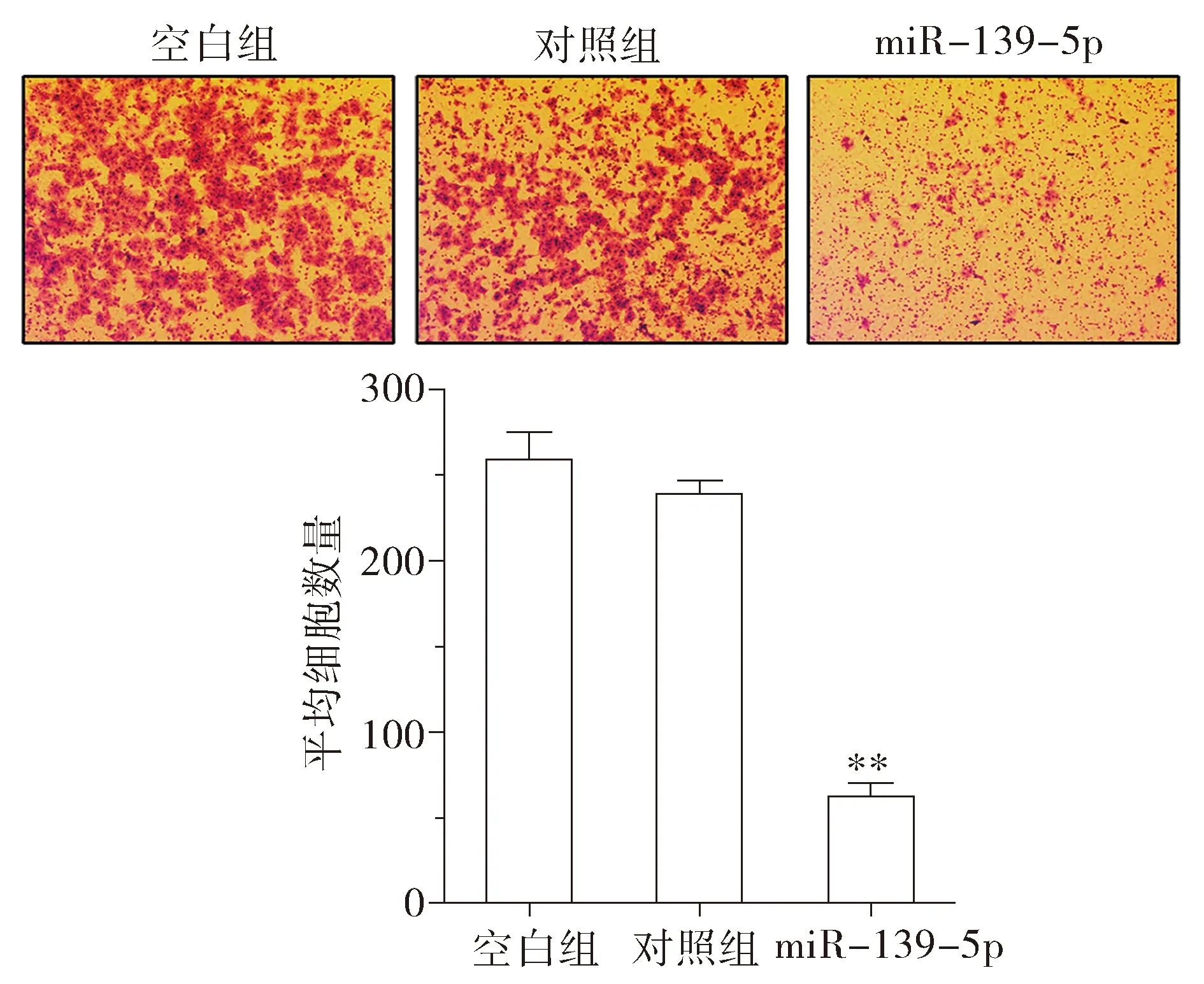
与对照组比较,**P<0.01图5 miR-139-5p对DKO-1细胞侵袭能力的影响Figure 5 The effects of miR-139-5p on invasion in DKO-1 cells
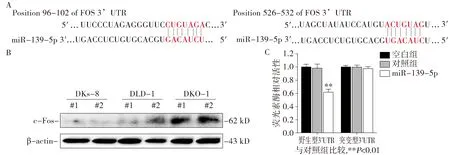
A.FOS基因3’UTR区上的miR-139-5p结合位点示意;B.c-Fos蛋白在不同KRAS突变状态的结直肠癌细胞中的表达;C.荧光素酶报告基因实验观察miR-139-5p对FOS基因的抑制图6 miR-139-5p对KRAS突变结直肠癌细胞中靶基因的预测和FOS蛋白的影响Figure 6 Effect of miR-139-5p on the prediction of target genes and the gene and protein expression of FOS in isogenic colon cancer cells harbor different KRAS mutation status
3 讨论
KRAS基因是RAS基因家族的重要组成成员,含有4个编码外显子和1个5′端非编码外显子,共同编码含189个氨基酸组成的KRAS蛋白[8]。作为小G蛋白,KRAS蛋白通过GTP/GDP的相互转化调节多条信号通路的活性,在细胞生长分化中发挥关键作用。KRAS基因突变后,RAS蛋白始终处于GTP结合的活化形式,刺激细胞生长增殖,导致细胞发生恶性转化。KRAS基因突变与多种肿瘤的发生发展密切相关。在结直肠癌中,KRAS基因突变发生率为30%-60%[1]。多项研究表明,KRAS基因突变可预测西妥昔单抗治疗转移性大肠癌的疗效且与预后不良相关[9,10]。尽管KRAS基因突变可以作为抗EGFR治疗的参考依据,但是KRAS基因是否能为结直肠癌的预后提供参考依据存在争议,尚有证据显示KRAS基因突变并不影响预后[11-13]。KRAS基因在结直肠癌的发生发展中究竟发挥多大的关键性作用? 不同KRAS基因型如何影响结直肠癌细胞的恶性表型?上述问题仍有待深入研究。本研究利用结直肠癌细胞DLD-1(含野生型KRAS等位基因和G13D突变体KRAS等位基因)及其衍生出的DKO-1细胞(仅G13D突变体KRAS等位基因)和DKs-8细胞(仅野生型KRAS等位基因)作为模型,以排除不同遗传背景对KRAS突变基因作用机制的影响。此外,由于结直肠癌患者KRAS基因突变多发生于2号外显子上的12、13号密码子,尤其在微卫星不稳定的结直肠癌及非家族遗传性息肉病中以G13D突变最为常见,因此仅含G13D突变体的DKO-1细胞代表了临床典型的KRAS基因突变亚型,为后续研究提供了理想的细胞模型。
miRNA-139的表达异常在肺癌、结直肠癌、前列腺癌、乳腺癌、急性粒细胞淋巴瘤等多种肿瘤中均有报道[14,15]。在结直肠癌中,Li等[16]发现miR-139-5p在癌组织的表达显著低于正常组织,且与肿瘤分期相关;上调miR-139-5p可通过EMT和BLC凋亡通路影响结直肠癌细胞的转移潜能和药物抵抗。Cao等[17]发现结直肠癌细胞中miR-139-5p表达可导致细胞内PDE4D下调和cAMP上调,导致BIM介导的细胞生长阻滞,从而抑制肿瘤生长。本研究中利用real-time PCR检测miR-139-5p在KRAS突变同源细胞系中表达,明确miR-139-5p在KRAS突变结直肠癌细胞中表达降低;进一步过表达miR-139-5p能够抑制DKO-1细胞的生长增殖、迁移和侵袭能力,提示miR-139-5p可抑制KRAS基因突变后的恶性表型。
由于miRNA通过负向调控下游靶基因发挥其功能,因此分析和鉴定靶分子是研究miR-139-5p功能的基础。利用生物信息学对miR-139-5p与靶基因3′-UTR区的结合位点进行分析发现,FOS基因含有miR-139-5p的2个结合位点。Fos癌基因家族由4个成员组成:FOS,FOSB,FOSL1和FOSL2,这些基因编码亮氨酸拉链蛋白,与JUN家族的蛋白质二聚化形成转录因子复合物AP-1,调节细胞增殖、分化和细胞凋亡[18]。FOS基因作为经典的癌基因家族,与多种肿瘤的发生发展密切相关。与癌旁组织相比,侵袭性宫颈癌中c-FOS表达水平明显升高。在骨肉瘤和子宫内膜癌中,c-FOS基因表达升高与肿瘤高级别病理分级及不良预后相关[18]。乳腺癌相关研究发现,c-FOS表达水平可作为独立预测危险因子[19]。在本研究中,FOS蛋白在突变KRAS细胞系的表达明显高于野生KRAS细胞系,提示FOS基因过表达可能与KRAS突变细胞系的恶性表型相关。通过双荧光素酶报告基因实验,证实FOS基因为miR-139-5p的直接靶分子,受miR-139-5p的负性调控。基于上述结果,我们推测,在结直肠癌细胞中,KRAS突变使miR-139-5p表达下降,使得后者对FOS基因的负性调控解除,FOS升高则进一步促进KRAS突变细胞系的恶性生物学表型。应当指出,KRAS与miR-139-5p的间的表达调控关系尚不明确,有待进一步研究阐明。
综上,本研究明确了miR-139-5p在KRAS突变结直肠癌细胞增殖、迁移和侵袭表型中发挥抑制作用的基因的功能,并提出miR-139-5p通过抑制FOS调控KRAS突变结直肠癌细胞恶性表型分子机制,本研究将为KRAS突变结直肠癌患者寻找新的治疗靶点提供实验依据。
[1] Siegel RL,Miller KD,Jemal A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1):7-30.
[2] Chen W,Zheng R,Baade PD,etal.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[3] Moroni M,Veronese S,Benvenuti S,etal.Gene copy number for epidermal growth factor receptor(EGFR)and clinical response to antiEGFR treatment in colorectal cancer:a cohort study[J].Lancet Oncol,2005,6(5):279-286.
[4] Diaz LA Jr,Williams RT,Wu J,etal.The molecular evolution of acquired resistance to targeted EGFR blockade in colorectal cancers[J].Nature,2012,486(7404):537-540.
[5] Chen X,Ba Y,Ma L,etal.Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases[J].Cell Res,2008,18(10):997-1006.
[6] Akao Y,Nakagawa Y,Naoe T.let-7 microRNA functions as a potential growth suppressor in human colon cancer cells[J].Biol Pharm Bull,2006,29(5):903-906.
[7] Bu P,Chen KY,Chen JH,etal.A microRNA miR-34a-regulated bimodal switch targets Notch in colon cancer stem cells[J].Cell Stem Cell,2013,12(5):602-615.
[8] O’Brien SJ,Nash WG,Goodwin JL,etal.Dispersion of the ras family of transforming genes to four different chromosomes in man[J].Nature,1983,302(5911):839-842.
[9] Taylor BS,Schultz N,Hieronymus H,etal.Integrative genomic profiling of human prostate cancer[J].Cancer Cell,2010,18(1):11-22.
[10] Lievre A,Bachet JB,Le Corre D,etal.KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer[J].Cancer Res,2006,66(8):3992-3995.
[11] Mitsudomi T,Yatabe Y.Epidermal growth factor receptor in relation to tumor development:EGFR gene and cancer[J].FEBS J,2010,277(2):301-308.
[12] Giusti RM,Cohen MH,Keegan P,etal.FDA review of a panitumumab(Vectibix)clinical trial for first-line treatment of metastatic colorectal cancer[J].Oncologist,2009,14(3):284-290.
[13] Saltz LB,Meropol NJ,Loehrer PJ Sr,etal.Phase II trial of cetuximab in patients with refractory colorectal cancer that expresses the epidermal growth factor receptor[J].J Clin Oncol,2004,22(7):1201-1208.
[14] Wong CC,Wong CM,Tung EK,etal.The microRNA miR-139 suppresses metastasis and progression of hepatocellular carcinoma by down-regulating Rho-kinase 2[J].Gastroenterology,2011,140(1):322-331.
[15] Shen K,Liang Q,Xu K,etal.MiR-139 inhibits invasion and metastasis of colorectal cancer by targeting the type I insulin-like growth factor receptor[J].Biochem Pharmacol,2012,84(3):320-330.
[16] Li Q,Liang X,Wang Y,etal.miR-139-5p inhibits the epithelial-mesenchymal transition and enhances the chemotherapeutic sensitivity of colorectal cancer cells by downregulating BCL2[J].Sci Rep,2016,6:27157.
[17] Cao B,Wang K,Liao JM,etal.Inactivation of oncogenic cAMP-specific phosphodiesterase 4D by miR-139-5p in response to p53 activation[J].Elife,2016,7(5):e15978.
[18] Greenberg ME,Ziff EB.Stimulation of 3T3 cells induces transcription of the c-fos proto-oncogene[J].Nature,1984,311(5985):433-438.
[19] Langer S,Singer CF,Hudelist G,etal.Jun and Fos family protein expression in human breast cancer:correlation of protein expression and clinicopathological parameters[J].Eur J Gynaecol Oncol,2006,27(4):345-352.
The miR-139-5p regulates proliferation,migration and invasion in KRAS-mutated colon cancer cells
CAO Tianyu,DU Feng,LI Tingyu,LU Yuanyuan#,ZHAO Xiaodi*
(XijingHospitalofDigestiveDiseases,StateKeyLaboratoryofCancerBiology,FourthMilitaryMedicalUniversity,Xi’an710032,China;*Correspondingauthor,E-mail:leedyzhao@fmmu.edu.cn;#Co-correspondingauthor,E-mail:luyuandreamer@aliyun.com)
ObjectiveTo explore the effect of miR-139-5p on the malignant phenotype of KRAS mutant colon cancer cells and its potential molecular mechanisms.MethodsReal-time PCR was performed to detect the expression of miR-139-5p in KRAS isogenic cell lines.Gain-of-function cell model was established by transient transfection with miR-139-5p mimics.MTT growth curve and colony formation assay were conducted to determine the effect of miR-139-5p on growth and proliferation of DKO-1 cells.Would healing and Transwell invasion assays were used to investigate the effect of miR-139-5p on migration and invasion of DKO-1 cells.Bioinformatic analysis was employed to predict downstream target genes of miR-139-5p.Dual luciferase reporter assay was used to verify direct interaction between miR-139-5p and its target gene.ResultsThe miR-139-5p was down-regulated in KRAS mutant colon cancer cells(P<0.01).The miR-139-5p overexpression significantly inhibited the proliferation,migration and invasion of DKO-1 cells(P<0.01).The miR-139-5p was directly bound to the 3′-UTR of the FOS gene.ConclusionThe miR-139-5p could inhibit the proliferation,migration and invasion of DKO-1 cells via inhibiting expression of FOS gene.
colorectal cancer; miR-139-5p; KRAS mutation; proliferation; migration; invasion
国家自然科学基金资助项目(81602641;81572929)
曹田宇,男,1993-05生,在读本科,第四军医大学学员一旅,E-mail:15249261543@163.com
2017-01-10
R735.3
A
1007-6611(2017)04-0322-07
10.13753/j.issn.1007-6611.2017.04.005

