高脂饮食影响小鼠体内能量代谢的性别差异
崔 菊,陈爱群,庞 婧,李 瑾,李云炫,张铁梅,蔡剑平
(北京医院,国家老年医学中心,卫生部北京老年医学研究所,卫生部老年医学重点实验室,北京 100730;*通讯作者,E-mail:tmzhang126@126.com;#共同通讯作者,E-mail:caijp51@vip.sina.com)
高脂饮食影响小鼠体内能量代谢的性别差异
崔 菊,陈爱群,庞 婧,李 瑾,李云炫,张铁梅*,蔡剑平#
(北京医院,国家老年医学中心,卫生部北京老年医学研究所,卫生部老年医学重点实验室,北京 100730;*通讯作者,E-mail:tmzhang126@126.com;#共同通讯作者,E-mail:caijp51@vip.sina.com)
目的 比较高脂喂饲小鼠影响体内能量代谢的性别差异,探讨其可能机制。 方法 C57BL/6小鼠分为4组,雌、雄鼠各两组,每组各10只。其中一组雄鼠和一组雌鼠喂饲正常饲料,另外一组雄鼠和一组雌鼠喂饲60%高脂饲料12周。观察各组小鼠的体质量、血清生化水平、24 h内能量消耗的改变;采用Western blot检测小鼠棕色脂肪组织中解偶联蛋白1(UCP1)和马达蛋白KIF5B的表达水平。 结果 与雌鼠比较,高脂喂饲条件下,雄鼠的体质量增长(P<0.05);葡萄糖耐受水平降低(P<0.05);空腹血糖、血清胰岛素、瘦素和肿瘤坏死因子-α水平均显著上升(P<0.05);血清甘油三酯、总胆固醇和脂联素水平无统计学差异(P>0.05);能量消耗显著下降(P<0.05),呼吸熵和活动能力没有统计学差异(P>0.05);棕色脂肪组织中UCP1和KIF5B的表达下降。 结论 雄性小鼠在高热量饮食下更容易肥胖,雌鼠棕色脂肪组织通过较强的产热功能,消耗多余能量,维持机体能量代谢平衡。
高脂饮食; 能量代谢; 性别差异; 马达蛋白
随着人们生活方式的改变和人口老龄化,肥胖和2型糖尿病已经成为危害人类健康和生活质量的主要疾病,而肥胖等代谢性疾病存在显著的性别差异[1]。虽然社会和文化环境等因素被认为构成男女之间的肥胖差异,但是生物差异的影响更加重要[2]。对性别差异的更广泛了解将为基于证据的具体干预提供基础[3]。
迄今为止,已有许多研究探讨了与肥胖有关的性别差异因素,包括体脂分布[4]、活动量[3]、代谢率[5]、性激素[6]、脂肪因子信号通路[7]和食欲调节[8]。然而在对肥胖的易感性因素中,性别所起的作用尚未完全了解。一些研究表明,雄性较雌性动物更容易肥胖[9]。然而与之相反的研究结果也有报道,这可以通过种属和性别之间的差异以及动物营养状态的差异来解释[10]。已有研究表明,能量代谢存在性别二态性,特别是在白色组织棕色化及棕色组织产热能力存在显著的差异[11,12]。
近年来,在基础与临床研究中发现,马达蛋白介导的胞内运输失调可能直接影响细胞功能和疾病的病理生理过程。KIF5B是人体各个组织中普遍表达的驱动蛋白重链(ubiquitous kinesin heavy chain, uKHC)的同源基因。本课题组前期研究结果发现,脂肪组织中特异性敲除Kif5b加重了高脂诱导的肥胖程度,KIF5B通过调节脂肪因子分泌、胰岛素信号通路、线粒体生成和功能从而在糖代谢、脂代谢和能量代谢中发挥重要作用[13],是一种潜在的治疗代谢疾病的新药靶。
本研究旨在比较高脂喂饲对雌、雄小鼠体内能量代谢以及棕色脂肪组织中UCP1和KIF5B的蛋白表达水平的影响差异,探讨导致代谢紊乱性疾病的性别差异的可能机制。
1 材料与方法
1.1 小鼠及饲养
8周龄SPF级C57BL/6雌、雄小鼠各20只购自北京维通利华公司。C57BL/6小鼠饲养于具有恒定环境温度的12 h光/暗循环房间中。实验小鼠分为4组,雌、雄鼠各两组,每组10只,其中一组雄鼠和一组雌鼠喂饲正常饲料,另外一组雄鼠和雌鼠喂饲高脂饲料12周。每周对小鼠体重进行称量。所有动物护理和实验方案由国家老年医学中心和北京老年医学研究所的机构动物护理和使用委员会批准。
1.2 小鼠饲料和主要试剂
小鼠饲养正常饲料(12.8%脂肪,21.6%蛋白质,65.6%碳水化合物)和高脂饲料(60%脂肪,20%蛋白质和20%碳水化合物)购自北京华阜康公司;血糖试纸购自Johnson公司;血清甘油三酯(TG)、总胆固醇(TC)试剂盒购于南京建成生物工程研究所;检测血清胰岛素(insulin)、脂联素(Acrp)、瘦素(Acrp)和肿瘤坏死因子-α(TNF-α)的ELISA剂盒分别购于ALPCO公司、Millipore公司和Raybiotech公司;兔源KIF5B抗体由香港大学黄建东教授提供;兔源β-Actin抗体购自康为世纪公司。
1.3 葡萄糖耐量试验
小鼠禁食16 h,自由饮水,腹膜内注射浓度为2 mg/g体重的葡萄糖。葡萄糖注射之前30 min和注射后15,30,60和120 min,葡萄糖试纸监测血糖水平。
1.4 血清指标检测

1.5 代谢笼实验
通过代谢笼实验检测高脂饮食对小鼠体内代谢的影响。将5月龄小鼠单独饲养在代谢笼(OxyletPro呼吸能量饮食饮水代谢检测系统,西班牙Panlab公司)中,自由获得饮食和水。适应24 h,检测每个笼子的代谢参数(包括能量消耗、呼吸熵)。通过活性传感器检测小鼠的动态活动。使用SMART3.0软件(代谢v2.2)自动记录和计算所有数据。
1.6 Western blot检测棕色脂肪组织中UCP1和KIF5B的表达情况

1.7 统计学分析
2 结果
2.1 高脂饲料诱导雌、雄小鼠体重变化差异
实验开始时,正常饲料喂饲的雄性组小鼠体质量[(24.00±1.23)g]与高脂饲料喂饲的雄性组小鼠体质量[(24.60±0.55)g]没有统计学差异(P>0.05,见图1)。正常饲料喂饲的雌性组小鼠体质量[(20.67±1.66)g]与高脂饲料喂饲的雌性组小鼠体质量[(19.67±2.05)g]也不存在统计学差异(P


同周龄与Female⁃HFD组比较,∗P<005;同周龄与Male⁃SCD组比较,#P<001A.各组小鼠体质量变化曲线同周龄与雌鼠比较,∗P<005,∗∗P<001;SCD:正常饲料;HFD:高脂饲料B.实验开始及喂饲12周各组小鼠体质量比较
图1 正常饲料和高脂饲料喂饲的雌、雄小鼠的体质量比较
Figure 1 Comparison of the body weights of mice beween female and male after fed with standard chow diet or high fat diet >0.05,见图1)。喂饲3周,高脂喂饲的雄性组小鼠体质量[(30.60±1.14)g]显著高于正常饲料喂饲的雄性组小鼠[(25.8±1.78)g,P<0.05,见图1A]。喂饲5周,高脂饲料喂饲的雌性组小鼠体质量[(24.22±1.98)g]与正常饲料喂饲的雌性组小鼠体质量[(22.42±1.98)g]差异有统计学意义(P<0.05,见图1A)。喂饲12周,高脂饲料喂饲的雄性组小鼠平均体质量比正常饲料喂饲的雄性组小鼠高30%,高脂饲料组的雌性组小鼠平均体质量比正常饲料喂饲的雌性组小鼠高10%(见图1B)。
2.2 高脂饮食对雌、雄小鼠糖代谢的影响差异
为了研究高脂饮食对雌雄小鼠糖代谢的影响,检测了各组小鼠的血糖情况。正常饲料喂饲的雄性组小鼠的血糖[(5.48±0.14)mmol/L]与雌性组小鼠的血糖水平[(5.2±0.21)mmol/L]差异无统计学意义(P>0.05,见图2)。持续12周的高脂饮食,雌、雄小鼠的空腹血糖水平均升高(P<0.05,见图2A)。伴随着血糖水平的升高,血清胰岛素水平也升高(P<0.05,见图3C)。雄鼠的空腹血糖[(8.64±0.17)mmol/L]、血清胰岛素[(0.62±0.06)ng/ml]水平显著高于雌鼠血糖[(6.48±0.19)mmol/L]和血清胰岛素[(0.37±0.18)ng/ml]水平(P<0.05,见图2A和3C)。高脂饲料喂饲的雌、雄小鼠的葡萄糖耐受水平均下降(图2B,2C)。雄鼠的葡萄糖耐受能力受损更为严重,腹腔注射葡萄糖2 h,高脂喂饲的雄性组小鼠较高脂喂饲的雌性组小鼠的血糖水平高0.5倍(见图2B)。
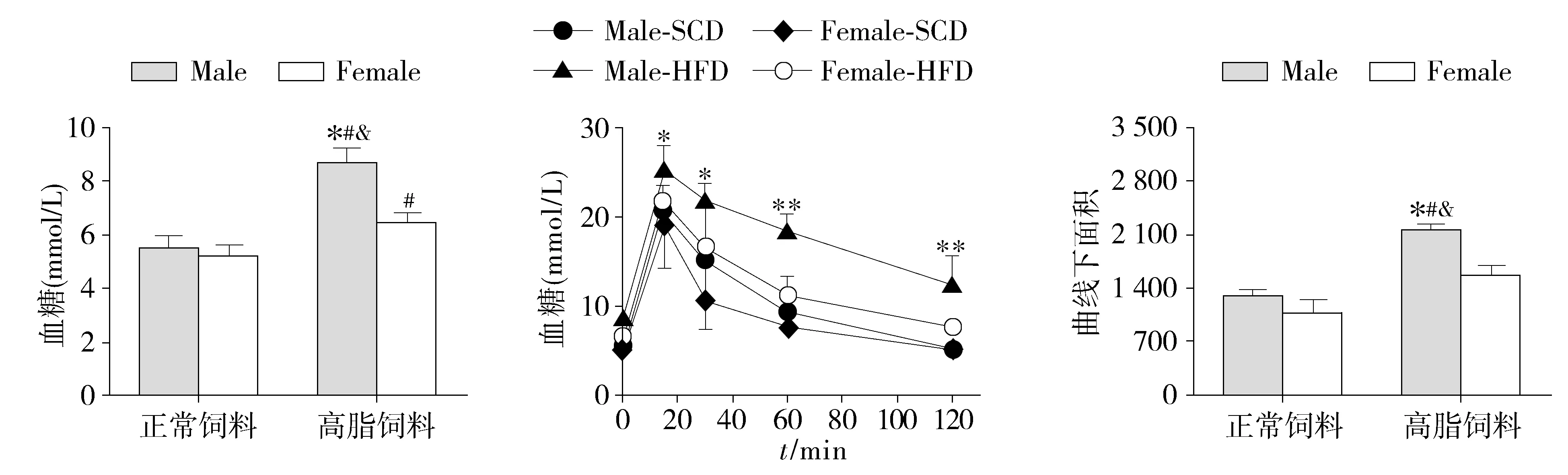

与正常饲料雄鼠组比较,∗P<005;与正常饲料雌鼠比较,#P<005;与高脂饲料雌鼠比较,&P<005A.小鼠空腹血糖水平与Female⁃HFD组比较,∗P<005,∗∗P<001;SCD:正常饲料;HFD:高脂饲料B.葡萄糖耐受实验中全血葡萄糖浓度变化曲线与正常饲料雄鼠组比较,∗P<005;与正常饲料雌鼠比较,#P<005;与高脂饲料雌鼠比较,&P<005C.葡萄糖耐受实验中血糖变化曲线下面积
图2 高脂饮食对雌、雄小鼠糖代谢的影响
Figure 2 Effects of high fat diet on glucose metabolism in male and female mice
2.3 高脂饮食对雌、雄小鼠脂代谢、血清脂肪因子水平的影响差异
为了观察高脂饮食对雌、雄小鼠脂代谢的影响差异,检测了血清甘油三酯和总胆固醇的水平。小鼠的血清甘油三酯水平在饮食和性别方面没有统计学差异(P>0.05,见图3A)。正常饲料喂饲小鼠的血清总胆固醇水平不存在性别差异(P>0.05)。高脂饮食诱导雄、雌小鼠均产生高胆固醇血症,其血清总胆固醇水平分别达到(2.92±0.41)mmol/L和(3.09±0.55)mmol/L(见图3B),但是雌、雄小鼠的血清总胆固醇水平仍差异没有统计学意义(P>0.05,见图3B)。高脂饲料喂饲的雌、雄组小鼠分别较正常饲料喂饲的雌、雄组小鼠的血清脂联素水平偏低,差异没有统计学意义(P=0.095 3,0.153 8)。在任何饮食状况下,小鼠的脂联素水平均不存在性别差异(P>0.05,见图3D)。正常饲料喂饲小鼠的血清瘦素水平不存在性别差异(P>0.05)。高脂饮食诱导血清瘦素水平升高,雄性组小鼠的血清脂联素水平达到(10.40±4.5)ng/ml,雌性小鼠的血清脂联素水平上升到(1.98±0.87)mmol/L。雄性小鼠血清中瘦素水平升高较雌性小鼠更为明显(P<0.05,见图3E)。正常饲料组雌、雄小鼠血清中肿瘤坏死因子-α(TNF-α)浓度不存在性别差异(P>0.05)。高脂饲料喂饲3个月,雄性小鼠血清中TNF-α浓度增加2倍(P<0.05),雌鼠血清TNF-α浓度增加差异无统计学意义(P=0.297 8,见图3F)。
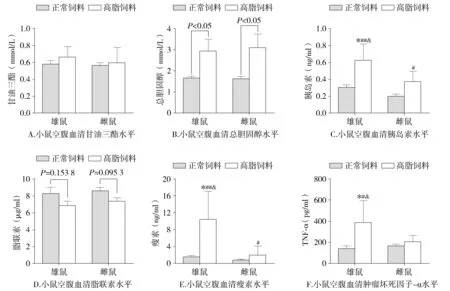
与正常饲料雄鼠组比较,*P<0.01;与正常饲料雌鼠比较,#P<0.05,##P<0.01;与高脂饲料雌鼠比较,&P<0.05图3 高脂饮食对雌、雄小鼠血清生化指标的影响Figure 3 Comparison of serum biochemical parameters between female and male mice fed with standard chow diet or high fat diet
2.4 高脂饮食对雌、雄小鼠能量代谢的影响差异
由于高脂饮食对雌、雄小鼠体质量增长存在差异,通过Panlab公司呼吸能量饮食饮水代谢检测系统检测了小鼠的能量消耗(energy expenditure)、呼吸熵(RER)和活动能力(ambulatory activity),进而评估其能量代谢的差异。正常饲料喂饲的雌、雄小鼠的24 h能量消耗无性别差异(P>0.05,见图4),高脂饲料喂饲的雄、雌小鼠的24 h能量消耗显著低于正常饲料喂饲的同性别小鼠(P<0.05,见图4A),并且高脂饲料喂饲的雌性组小鼠的能量消耗显著高于高脂饲料喂饲的雄性组小鼠(P<0.05)。高脂饮食使小鼠呼吸熵显著降低(P<0.05),但不存在性别差异(P>0.05,见图4B)。小鼠的活动能力无性别和饮食的差异(见图4C)。
2.5 高脂饮食对雌、雄小鼠棕色脂肪组织中UCP1和KIF5B蛋白表达水平的影响差异
能量消耗的减少通常伴有棕色脂肪组织功能的障碍。棕色脂肪细胞的线粒体内的解耦联蛋白1(UCP1)使葡萄糖和脂肪酸分解产生的能量不转化为ATP,而只能转化为热能[14]。为了探讨UCP1和KIF5B蛋白水平与雌、雄小鼠能量代谢差异的相关性,棕色脂肪组织中UCP1和KIF5B的蛋白表达水平通过Western blot来检测。结果显示,正常饲料喂饲的雌性组小鼠的棕色脂肪组织中UCP1和KIF5B的蛋白表达量较正常饲料喂饲的雄性组小鼠高(见图5)。高脂饲料喂饲3个月,雌、雄小鼠棕色脂肪组织中UCP1和KIF5B的蛋白表达量均下降,但是雌性小鼠棕色脂肪组织中的UCP1和KIF5B的蛋白表达量仍高于雄性小鼠。


A.小鼠能量消耗比较B.小鼠呼吸熵比较C.小鼠活动能力比较
与正常饲料雄鼠组比较,*P<0.05;与正常饲料雌鼠比较,#P<0.05;
与高脂饲料雌鼠比较,△P<0.05;SCD:正常饲料;HFD:高脂饲料
图4 高脂饮食对雌、雄小鼠体内能量代谢的影响
Figure 4 Comparison of energy expenditure, respiratory quotient and ambulatory activities between female and male mice fed with standard chow diet/high fat diet

SCD:正常饲料;HFD:高脂饲料图5 KIF5B和UCP1蛋白在小鼠棕色脂肪组织中的表达Figure 5 Western blot analysis of KIF5B and UCP1 levels in brwon adipose of mice
3 讨论
肥胖是一种慢性代谢性疾病,可引起严重的并发症,包括2型糖尿病,内分泌失调,心脑血管疾病,甚至加速衰老和死亡[15]。肥胖是由热量的摄入和能量消耗的长期失衡,这导致脂肪细胞增殖和体积变大[16]。动物体内存在白色脂肪组织和棕色脂肪组织,这两种脂肪组织都参与调节能量代谢平衡[17]。白色脂肪细胞的胞质包含一个大单房脂滴,其主要以甘油三酯的形式储存能量[18]。棕色脂肪细胞含有丰富的线粒体和小脂滴,它可以将甘油三酯分解产热来调节体内脂质比例[19]。
本研究比较了高脂饮食对雌、雄小鼠体内能量代谢的影响差异。结果显示,与雌性小鼠比较,高脂饮食诱导雄性小鼠体质量增加更为明显。肥胖与代谢紊乱直接相关。在高脂饲料喂饲的情况下,雄鼠较雌鼠的血糖和胰岛素水平上升更为显著,表明高脂饮食对雄性小鼠的糖代谢平衡影响更为严重。普遍认为,高脂饮食能够诱导甘油三酯血症[20]。本研究结果显示,3个月高脂饮食并没有增加雌、雄小鼠体内的血清甘油三酯水平,表明C57BL/6J小鼠动物模型和人体代谢途径存在差异。白色脂肪组织不仅是一个被动的储存能量的器官,它还是一个内分泌器官,能够分泌脂肪因子从而调节代谢平衡[18]。本研究结果显示,小鼠在高脂饲料喂饲下,脂联素的血清水平降低,瘦素和TNF-α的血清水平升高。脂联素的血清水平不存在性别差异,但是高脂饮食诱导雄鼠的瘦素和TNF-α的血清水平显著高于雌鼠。这一结果表明,高脂诱导的炎症反应存在性别差异。本研究结果显示,高脂饮食下,雄鼠的24 h能量消耗显著低于雌鼠。已有研究表明,能量消耗的减少通常伴有棕色脂肪组织功能的障碍[19]。本研究结果进一步显示,高脂饮食诱导小鼠棕色脂肪组织中UCP1和KIF5B的表达下降,而雄鼠棕色脂肪组织中UCP1和KIF5B的表达水平下降较雌鼠更为明显。本课题组已发表的研究结果显示,KIF5B通过调节线粒体生成和功能从而在能量代谢中发挥重要作用[13]。雌鼠棕色脂肪中UCP1和KIF5B高表达加强了机体的产热功能,进而维持机体能量代谢平衡。因此,深入了解KIF5B的表达调控机制有助于为肥胖等代谢相关疾病的预防和治疗提供新的途径。
[1] Legato MJ. Gender-specific aspects of obesity[J]. Int J Fertil Womens Med, 1997, 42 (3):184-197.
[2] Smith E, Sweeting H, Wright C.‘Do I care?’ Young adults’ recalled experiences of early adolescent overweight and obesity: a qualitative study[J]. Int J Obes (Lond), 2013, 37(2):303-308.
[3] Kautzky-Willer A, Handisurya A. Metabolic diseases and associated complications: sex and gender matter[J]. Eur J Clin Invest, 2009, 39(8): 631-648.
[4] Zillikens MC, Yazdanpanah M, Pardo LM,etal. Sex-specific genetic effects influence variation in body composition[J]. Diabetologia, 2008, 51(12):2233-2241.
[5] Lee HJ, Yang SJ. Aging-related correlation between serum sirtuin 1 activities and basal metabolic rate in women, but not in men[J]. Clin Nutr Res, 2017, 6(1):18-26.
[6] Allan CA, Strauss BJ, Burger HG,etal. Testosterone therapy prevents gain in visceral adipose tissue and loss of skeletal muscle in nonobese aging men[J]. J Clin Endocrinol Metab, 2008, 93(1):139-146.
[7] Cheung OK, Cheng AS. Gender differences in adipocyte metabolism and liver cancer progression[J]. Front Genet, 2016, 7:168.
[8] Wang GJ, Volkow ND, Telang F,etal. Evidence of gender differences in the ability to inhibit brain activation elicited by food stimulation[J]. Proc Natl Acad Sci U S A, 2009, 106(4):1249-1254.
[9] Hong J, Stubbins RE, Smith RR,etal. Differential susceptibility to obesity between male, female and ovariectomized female mice[J]. Nutr J, 2009, 8:11.
[10] Rodriguez AM, Palou A. Uncoupling proteins: gender dependence and their relation to body weight control[J]. Int J Obes Relat Metab Disord, 2004, 28(2):500-502.
[11] Rodriguez-Cuenca S, Pujol E, Justo R,etal. Sex-dependent thermogenesis, differences in mitochondrial morphology and function, and adrenergic response in brown adipose tissue[J]. J Biol Chem, 2002, 277 (45):42958-42963.
[12] Kim SN, Jung YS, Kwon HJ,etal. Sex differences in sympathetic innervation and browning of white adipose tissue of mice[J]. Biol Sex Differ. 2016 7:67.
[13] Cui J, Pang J, Lin YJ,etal. Adipose-specific deletion of Kif5b exacerbates obesity and insulin resistance in a mouse model of diet-induced obesity[J]. FASEB J, 2017,31(6):2533-2547.
[14] Biswas HM. Effect of adrenocorticotropic hormone on UCP1 gene expression in brown adipocytes[J]. J Basic Clin Physiol Pharmacol, 2017,28(3):267-274.
[15] Ma RC, Tsoi KY, Tam WH,etal. Developmental origins of type 2 diabetes: a perspective from China[J]. Eur J Clin Nutr, 2017:Epub ahead of print.
[16] Rosen ED and Spiegelman BM. Adipocytes as regulators of energy balance and glucose homeostasis[J]. Nature, 2006, 444:847-853.
[17] Klaus S. Functional differentiation of white and brown adipocytes[J]. Bioessays, 1997, 199(3):215-223.
[18] Scherer PE. Adipose tissue: from lipid storage compartment to endocrine organ[J]. Diabetes, 2006, 55(6): 1537-1545.
[19] Chechi K, Carpentier AC, Richard D.Understanding the brown adipocyte as a contributor to energy homeostasis[J]. Trends Endocrinol Metab, 2013, 24(8):408-420.
[20] Yang X, Wang Q, Pang ZR,etal. Flavonoid-enriched extract from hippophae rhamnoides seed reduces high fat diet induced obesity, hypertriglyceridemia, and hepatic triglyceride accumulation in C57BL/6 mice[J]. Pharm Biol, 2017, 55(1):1207-1214.
Difference of energy metabolism between male and female mice exposed to high fat diet
CUI Ju,CHEN Aiqun,PANG Jing,LI Jin,LI Yunxuan,ZHANG Tiemei
*,CAI Jianping#(MOHKeyLaboratoryofGeriatrics,BeijingHospital,NationalCenterofGerontology,Beijing100730,China;*Correspondingauthor,E-mail:tmzhang126@126.com;#Co-correspondingauthor,E-mail:caijp51@vip.sina.com
ObjectiveTo compare the difference of energy metabolism between male and female mice, and to explore the possible mechanism of gender difference in metabolic disorders.MethodsThe C57BL/6 mice were divided into 4 groups(n=10 each): two groups of male mice and two groups of female mice. The mice in one male group and one female group were fed with standard chow diet, and the mice in the other groups were fed with 60% high fat diet for 12 weeks. The body weight, serum biochemical levels and 24 h energy consumption in the mice were observed. Western blot was used to detect the expression of KIF5B and UCP1 in brown adipose tissues.ResultsAfter fed with high fat diet, the body weight gain was significantly higher in the male mice than that of female mice(P<0.05), and the levels of fating blood glucose, serum insulin, leptin, and TNF-α were also significantly higher(P<0.05), while the glucose tolerance level was lower(P<0.05). There was no statistical difference in the levels of serum triglyceride, total cholesterol and adiponectin between male and female mice after fed with high fat diet(P>0.05). The energy expenditure was significantly lower in the male mice compared with the female mice after fed with high fat diet(P<0.05). There was no statistical difference in the respiratory quotient and ambulatory activities between the male mice and female mice after fed with high fat diet(P>0.05). Western blot results revealed that the expression levels of KIF5B and UCP1 in brown adipose were higher in male mice than that in female mice after fed with high fat diet.ConclusionCompared with female mice, male mice have a higher susceptibility to obese on the condition of high fat diet. The brown adipose of the female mice have stronger thermogenice function which can help the body to consume excess energy and maintain energy metabolic balance.
high fat diet; energy metabolism; gender difference; KIF5B
国家自然科学基金青年项目(31400995);北京医院“科技新星”项目(BJ-2016-034)
崔菊,女,1983-10生,博士,副研究员,E-mail:juzi.cui@gmail.com
2017-03-21
R589.2
A
1007-6611(2017)07-0658-07
10.13753/j.issn.1007-6611.2017.07.005

