猪流行性腹泻病毒与圆环病毒2型复合PCR方法的建立
龚双燕,李小璟,陈瑛琪,蔡 瑶,李雨濛,徐逸飞,朱 玲,b,徐志文,b,*
(四川农业大学 a.动物医学院; b.动物疫病与人类健康四川省重点实验室,四川 成都 611130)
猪流行性腹泻病毒与圆环病毒2型复合PCR方法的建立
龚双燕a,李小璟a,陈瑛琪a,蔡 瑶a,李雨濛a,徐逸飞a,朱 玲a,b,徐志文a,b,*
(四川农业大学 a.动物医学院; b.动物疫病与人类健康四川省重点实验室,四川 成都 611130)
为研究猪流行性腹泻病毒(PEDV)、猪圆环病毒2型(PCV2)在腹泻仔猪中的感染状况,建立一种能同时检测 PEDV与PCV2混合感染的复合PCR方法。根据GenBank已发表的PEDV、PCV2的基因序列,选择保守区域分别设计、合成1对特异性引物,扩增目的片段分别为530和278 bp。经反应条件优化,建立了特异性检测PEDV、PCV2的复合PCR方法。应用本试验所建复合PCR方法,对2016年4—8月采自四川省乐山、宜宾、广元和遂宁等地区的67份腹泻仔猪样品(肠系膜淋巴结、肠道黏膜及其内容物混合)进行检测。结果显示:PEDV、PCV2单一感染阳性率分别为34.33%、73.13%;PEDV+PCV2复合感染率为16.42%。经与特异性检测PCV2的PCR法和PEDV的RT-PCR法检测结果进行比较分析,符合率均为100%。
流行性腹泻病毒;圆环病毒2型;复合PCR
猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)会引发以呕吐、腹泻和脱水为特征的急性、接触性、高度传染性猪消化道疾病。近年,猪流行性腹泻(porcine epidemic diarrhea, PED)在全球范围暴发流行,表现为高发病率和7 d以内新生仔猪感染后高死亡率,给我国乃至世界养猪业造成了严重损失[1]。猪圆环病毒2型(porcine circovirus type 2, PCV2)感染可引起断奶猪多系统衰竭综合征、猪皮炎与肾炎综合征、猪呼吸道综合征等多种病型[2-4]。该病毒因可侵害感染猪免疫系统引起免疫抑制,降低机体抵抗力[5-6],导致继发、并发其他病原而表现为临床混合感染[7]。有报道显示,PCV2感染可能加重PEDV所致的仔猪病毒性腹泻病理损伤,导致死亡率提高。为进一步研究PCV2在腹泻仔猪中感染状况与疾病损害间关系,本试验建立了同时检测PCV2和PEDV的复合PCR方法,以期为开展以上病毒诊断提供灵敏、快速、特异的方法,科学分析其混合感染状况,为制定仔猪PEDV、PCV2的综合防控措施提供依据。
1 材料与方法
1.1 病毒、病料和菌株的来源
猪伪狂犬病病毒(pseudo rabies virus, PRV)、猪细小病毒(porcine parvovirus virus, PPV)、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)、猪瘟病毒(classical swine fever virus, CSFV)、猪传染性胃肠炎(transmissible gastroenteritis of swine virus, TGEV)、猪轮状病毒(rotavirus, RV)、猪流行性腹泻病毒和猪圆环病毒2型均由四川农业大学动物生物技术中心保存;病料(肠道、肠系膜淋巴结、肠道内容物)采自四川省乐山、宜宾、广元和遂宁等地区。
1.2 主要试剂
DL2000 DNA Marker、10×buffer(Mg2+free)、dNTP Mix、MgCl2、TaKaRaTaqHs、ddH2O、pMD19-T载体、DH5α大肠埃希菌感受态细胞、质粒(Plasmid)DNA小量纯化试剂盒均购自宝生物工程(大连)有限公司。DNA胶回收试剂盒购自Omega公司。
1.3 引物设计与合成
根据GenBank已发表的PEDV(Accession: KR011756.1)、PCV2(Accession: KT336601.1)基因的核苷酸序列,分别设计1对特异引物PEDV-F、PEDV-R和PCV2-F、PCV2-R,预计扩增产物大小分别为530 bp和278 bp,由生工生物工程(上海)股份有限公司合成(表1)。
1.4 样品处理及病毒核酸的提取
67份腹泻病料,样品编号1—67。病料处理:取病猪的肠道、肠系膜淋巴结、肠道内容物混合在一起,放进研钵加入适量的液氮磨碎成粉末状,加入适量生理盐水形成研磨液,反复冻融3次备用。
DNA的提取:采用传统的酚-氯仿法提取病料研磨液的总DNA,-20 ℃保存备用。
RNA的提取和反转录:采用TrizoL法提取病料研磨液的总RNA。将提取的RNA利用反转录试剂盒反转录成为cDNA,反应体系(10 μL)如下:模板RNA 3.0 μL;5×PrimeScript Buffer 2.0 μL;Primer script RT Enzyme mix Ι 0.5 μL;Oligo dT primer 0.5 μL;Random 6 mers 0.5 μL;RNase free H2O 3.5 μL。放入PCR仪,经37 ℃反转录15 min,85 ℃灭活5 s,-20 ℃保存备用。
1.5 单项PCR的扩增
以1.4节制备的DNA和cDNA为模板,参照本实验室检测所用PCR反应体系,及所设计引物的Tm值,优化PCR反应温度。选出两对引物的最佳反应退火温度。本实验室常规PCR反应总体系25 μL∶10×buffer(Mg2+free) 2.5 μL;dNTP Mix 2.0 μL(2.5 mmol·L-1);MgCl22.0 μL(25 mmol·L-1);TaKaRaTaqHs 0.2 μL(5 U·μL-1);上游和下游引物各1.0 μL(10 pmol·μL-1);DNA或cDNA模板1.0 μL;其余用ddH2O补足。单项PCR扩增过程:95 ℃预变性5 min;95 ℃ 30 s,63 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃延伸7 min。取PCR产物6 μL经1.5%琼脂糖凝胶电泳检测。
表1 复合PCR所用引物序列
Table 1 Primer sequences for the multiplex PCR
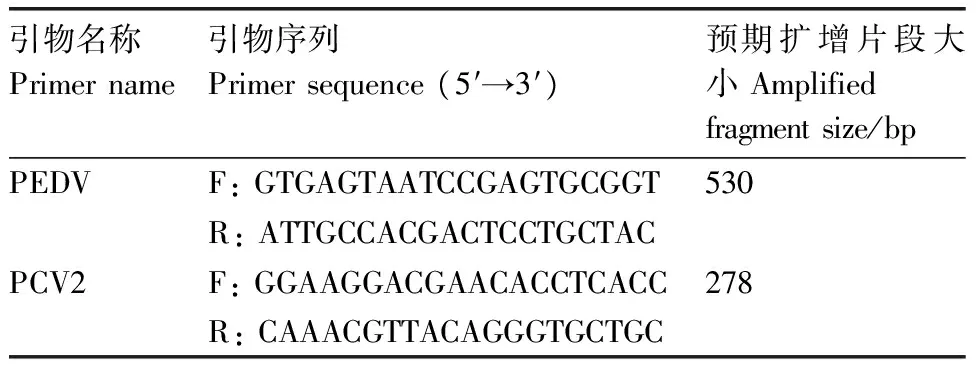
引物名称Primername引物序列Primersequence(5′→3′)预期扩增片段大小Amplifiedfragmentsize/bpPEDVF:GTGAGTAATCCGAGTGCGGT530R:ATTGCCACGACTCCTGCTACPCV2F:GGAAGGACGAACACCTCACC278R:CAAACGTTACAGGGTGCTGC
1.6 目的片段克隆与测序
使用DNA胶回收试剂盒回收单项PCR目的片段,连接pMD19-T载体,转化入DH5α克隆宿主菌中。将阳性克隆交由擎科生物公司测序,将测序正确的样品扩大培养,用质粒小提试剂盒提取2种含有不同目的片段的质粒作为复合PCR的反应模板。
1.7 复合PCR方法的建立与反应条件的优化
1.7.1 dNTP Mix、Mg2+、TaqHs用量优化
在单项PCR基础上,对PCV2、PEDV复合PCR中 dNTP Mix、Mg2+、TaqHs酶用量进行优化。PCR反应总体系25 μL。每试验优化单一变量,其余参数仍使用未优化浓度与剂量(见1.5节)。分别只改变 dNTP Mix、Mg2+、TaqHs的用量,其梯度分别为dNTP Mix∶1.0、1.5、2.0、2.5 μL;Mg2+:1.0、1.5、2.0、2.5 μL;TaqHs∶0.2、0.3、0.4、0.5 μL,进行复合PCR扩增,反应程序同单项PCR,根据扩增条带的效果差异逐步筛选出各自组分的最佳用量。
1.7.2 PCV2、PEDV复合PCR反应引物的优化
在单项PCR基础上,进行复合PCR实验(25 μL复合PCR优化体系),按不同引物用量(PCV2、PEDV分别为0.5、0.8、1.0、1.5、1.8、2.0 μL)进行试验,筛选出最佳引物量。
1.7.3 PCV2、PEDV复合PCR反应退火温度优化
在单项PCR基础上,确定25 μL复合PCR优化体系,然后梯度选取10个退火温度(56.6、57.5、58.6、60.0、61.7、63.0、64.2、65.2、65.7、66.0 ℃),选出最佳反应退火温度。
1.8 复合PCR 的特异性试验
利用已建立的复合PCR,取等量的PRV、PPV病毒的DNA,及CSFV、PRRSV、TGEV、RV病毒RNA反转录成的cDNA为模板进行PCR扩增,同时以ddH2O做阴性对照进行检测,扩增产物经1.5%的琼脂糖凝胶电脉拍照分析。
1.9 重复性试验
将PCV2、PEDV阳性病料抽提出的DNA和RNA反转录的cDNA作为模板,以初步建立的该检测方法,分别进行批间、批内重复性试验,检验该方法的稳定性。
1.10 敏感性试验
取鉴定阳性的PEDV、PCV2基因克隆,通过试剂盒抽提质粒,用核酸蛋白仪测量PEDV、PCV2的阳性重组质粒的浓度,分别对两者进行10倍梯度稀释(100~106),然后取同一稀释度的2种病毒核酸各1 μL混合,用以上优化好的反应体系和程序进行复合PCR扩增,确定出现阳性反应条带模板的最高稀释倍数,推算出其最低检出浓度。
1.11 临床应用
从四川乐山、宜宾、广元和遂宁等地区采集腹泻病料,按照本试验建立的复合PCR 扩增体系和扩增条件进行检测,并设立阴阳性对照,取PCR产物6 μL在1.5%的琼脂糖凝胶中进行电泳后判定结果。
2 结果与分析
2.1 单一PCR扩增
将1.6节所提取的2种质粒作为模板,用各自特异性引物进行扩增,并对PEDV和PCV2进行复合PCR扩增,扩增产物经1.5% 琼脂糖凝胶电泳。单项PCR(体系见1.5节)产物大小分别与预期的530 bp和278 bp相符合。将产物送至擎科生物公司测序,NCBI Blast比对结果显示,核苷酸序列同源性均为99%,表明扩增片段分别为各自病毒的特异性条带(图1)。
2.2 dNTP Mix、Mg2+、TaqHs酶用量优化
优化单一变量,其余参数仍使用未优化浓度与剂量,分别只改变dNTP Mix(1.0、 1.5、 2.0、 2.5 μL)、Mg2+(2.5、 2.0、 1.5 、1.0 μL)、TaqHs(0.5、 0.4、 0.3、 0.2 μL)的用量,结果显示,在25 μL反应体系中,当dNTP Mix、Mg2+、Taq Hs酶用量分别为2.0、1.5和0.2 μL时扩增的2条条带最清晰(分别见图2、图3、图4)
2.3 引物浓度和退火温度的优化
结果显示,引物的最佳使用量分别为PCV2、PEDV各1.0 μL(图5);63 ℃为最佳退火温度(图6)。
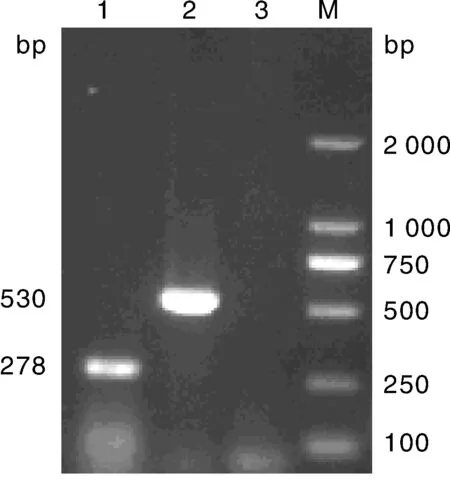
M, DNA 分子质量标准; 1, PCV2; 2, PEDV; 3, 阴性对照M, DL2000 DNA Marker; 1, PCV2; 2, PEDV; 3, Negative control图1 单一PCR检测结果Fig.1 Single PCR test result
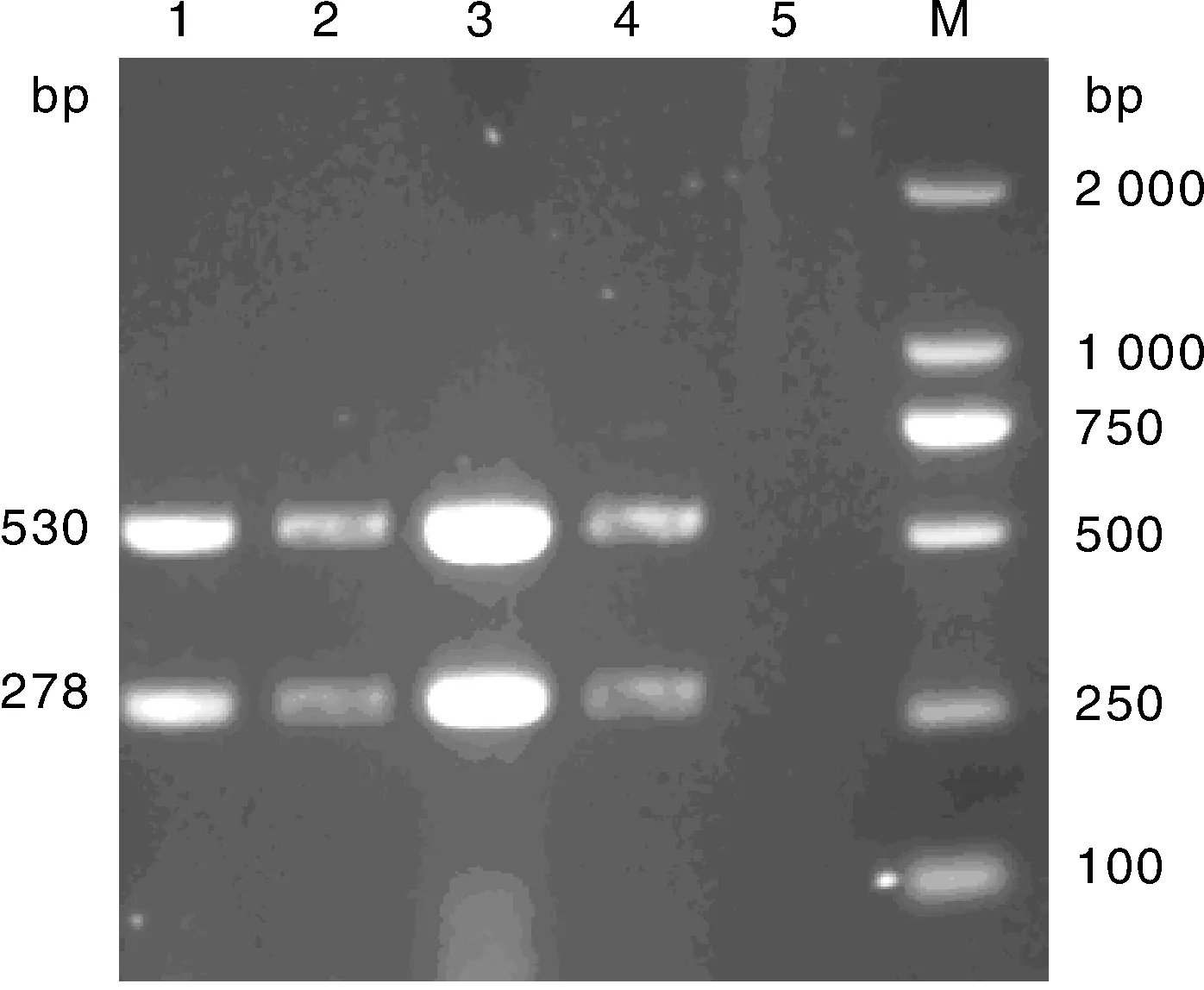
M, DNA 分子质量标准; 1、2、3、4,dNTP Mix 1.0、1.5、2.0、2.5 μL; 5, 阴性对照M, DL2000 DNA marker; 1, 2, 3, 4, dNTP mix 1.0, 1.5, 2.0, 2.5 μL, respectively; 5, Negative control图2 不同浓度的dNTP mix的复合PCR扩增Fig.2 Multiplex PCR amplification result with different concentrations of dNTP mix
2.4 复合PCR扩增及体系的优化
反应体系25 μL: 10×buffer(Mg2+free) 2.5 μL,dNTP Mix 2.0 μL,MgCl21.5 μL,TakaraTaqHs 0.2 μL,上游和下游引物各1.0 μL,DNA或cDNA模板1.0 μL,其余用ddH2O补足。反应程序为:95 ℃预变性5 min;95 ℃ 30 s,63 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃延伸7 min。在此条件下,反应结果最佳。
2.5 特异性检测
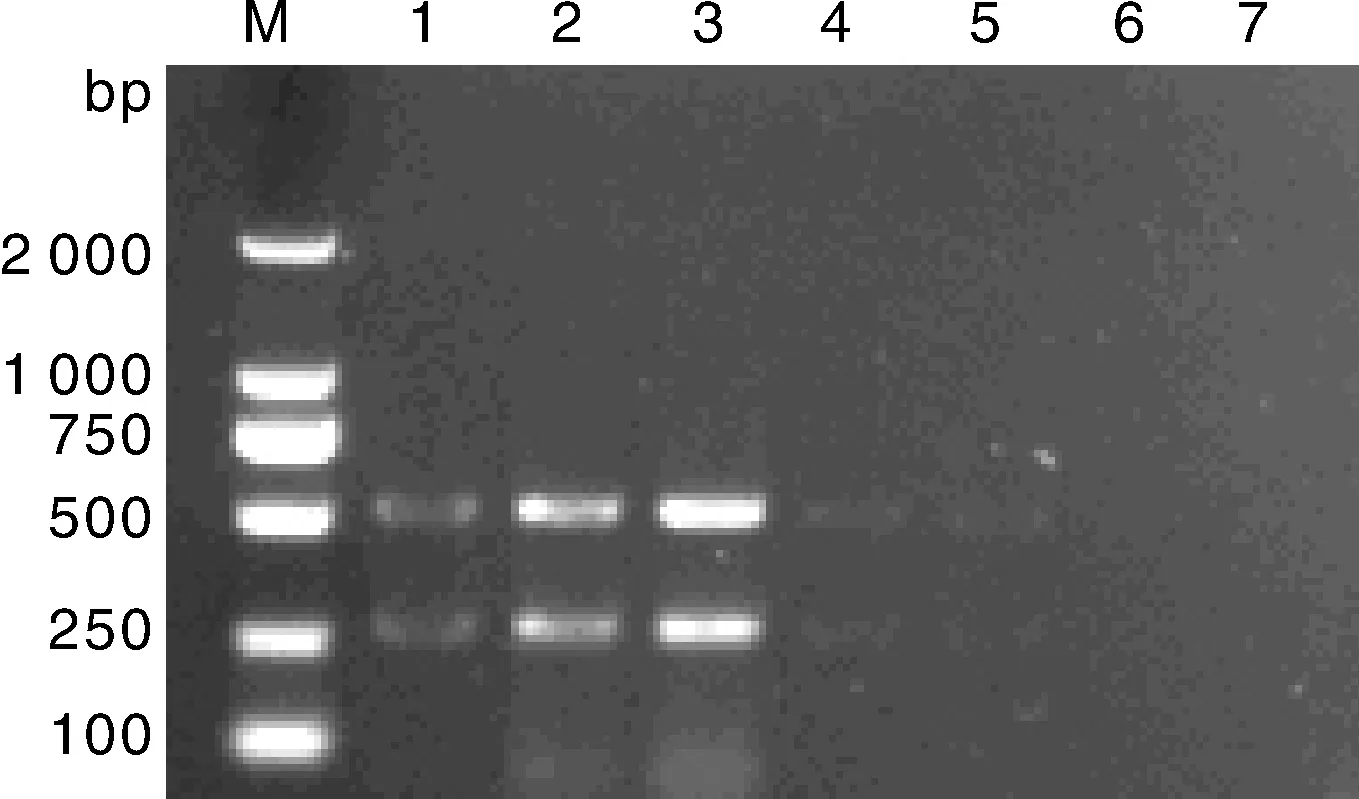
利用已建立的复合PCR,以1.6节所提取的2种质粒作为模板,进行复合PCR扩增,电泳检测结果显示,复合PCR能特异性扩增PEDV和PCV2,产物大小分别约为530 bp和278 bp。分别以PRV、PPV病毒的DNAs,及PRRSV等病毒RNA反转录成的cDNA为模板,在已优化的反应条件下进行复合PCR扩增,同时以ddH2O做阴性对照进行检测,其扩增产物能够被明显的区分开来,并且不会出现非特异性扩增,证实了PCR扩增的特异性(图7)。
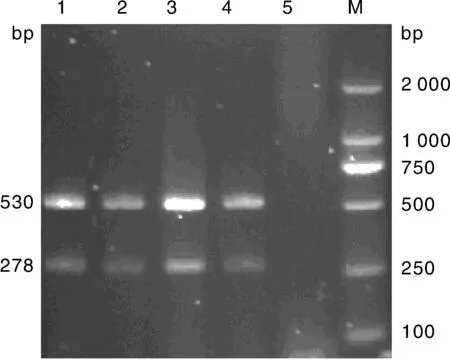
M, DNA 分子质量标准; 1、2、3、4, Mg2+ 2.5、2.0、1.5、1.0 μL; 5, 阴性对照M, DL2000 DNA marker, 1, 2, 3, 4, Mg2+ 2.5, 2.0, 1.5, 1.0 μL, respectively; 5, Negative control图3 不同浓度的Mg2+的复合PCR扩增Fig.3 Multiplex PCR amplification result with different concentrations of Mg2+
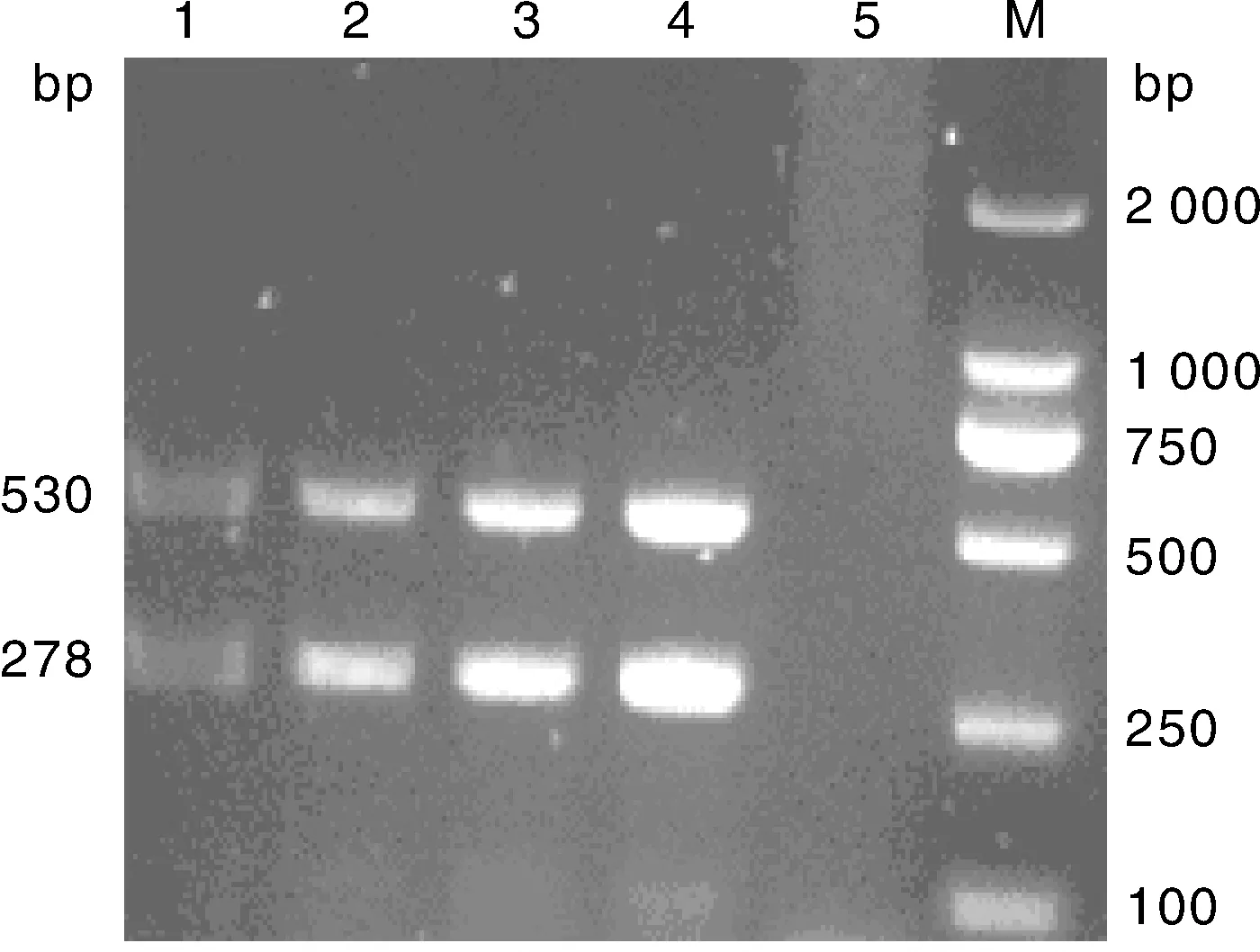
M, DNA 分子质量标准; 1、2、3、4, Taq Hs 0.5、0.4、0.3、0.2 μL; 5, 阴性对照M, DL2000 DNA marker; 1, 2, 3, 4, Taq Hs 0.5, 0.4, 0.3, 0.2 μL, respectively; 5, Negative control图4 不同浓度的Taq Hs酶的复合PCR扩增Fig.4 Multiplex PCR amplification result with different concentrations of Taq Hs
2.6 重复性试验
M, DNA 分子质量标准;1, 56.6 ℃;2, 57.5 ℃;3, 58.6 ℃;4, 60.0 ℃;5, 61.7 ℃;6, 63.0 ℃;7, 64.2 ℃;8, 65.2 ℃;9, 65.7 ℃;10, 66.0 ℃;11, 阴性对照M, DL2000 DNA marker;1, 56.6 ℃;2, 57.5 ℃;3, 58.6 ℃;4, 60.0 ℃;5, 61.7 ℃;6, 63.0 ℃;7, 64.2 ℃;8, 65.2 ℃;9, 65.7 ℃;10, 66.0 ℃;11, Negative control图5 不同退火温度的复合PCR扩增Fig.5 Multiplex PCR amplification result with different annealing temperature
M, DNA 分子质量标准;1、2、3、4、5、6, PCV2 和PEDV各 0.5、0.8、1.0、1.5、1.8、2.0 μL;7, 阴性对照M, DL2000 DNA marker; 1, PCV2 0.5 μL and PEDV 0.5 μL; 2, PCV2 0.8 μL and PEDV 0.8 μL; 3, PCV2 1.0 μL and PEDV 1.0 μL; 4, PCV2 1.5 μL and PEDV 1.5 μL; 5, PCV2 1.8 μL and PEDV1.8 μL; 6, PCV2 2.0 μL and PEDV 2.0 μL; 7, Negative control图6 不同引物浓度的复合PCR扩增Fig.6 Multiplex PCR amplification result with different primer concentration
M, DNA 分子质量标准; 1, PRV; 2, PRRSV; 3, PPV; 4, CSFV; 5, TGEVV; 6, RV; 7, 阴性对照; 8, PCV2; 9, PEDV; 10, PCV2+PEDVM, DL2000 DNA marker; 1, PRV; 2, PRRSV; 3, PPV; 4, CSFV; 5, TGEVV; 6, RV; 7, Negative control; 8, PCV2; 9, PEDV; 10, PCV2+PEDV图7 复合PCR的特异性试验Fig.7 Specificity test result of multiplex PCR
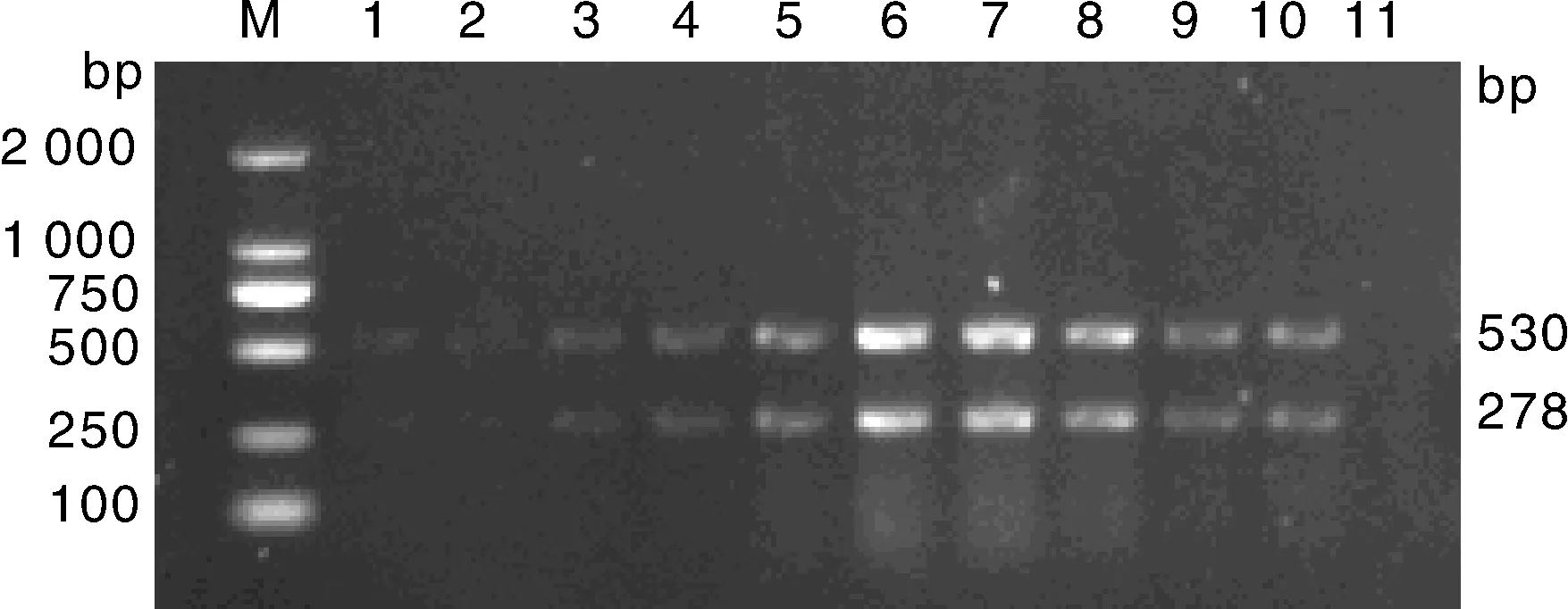
应用复合PCR方法对阳性模板进行批间与批内重复性检测,所有试验结果一致,表明本试验方法的重复性良好(图8)。
2.7 敏感性试验
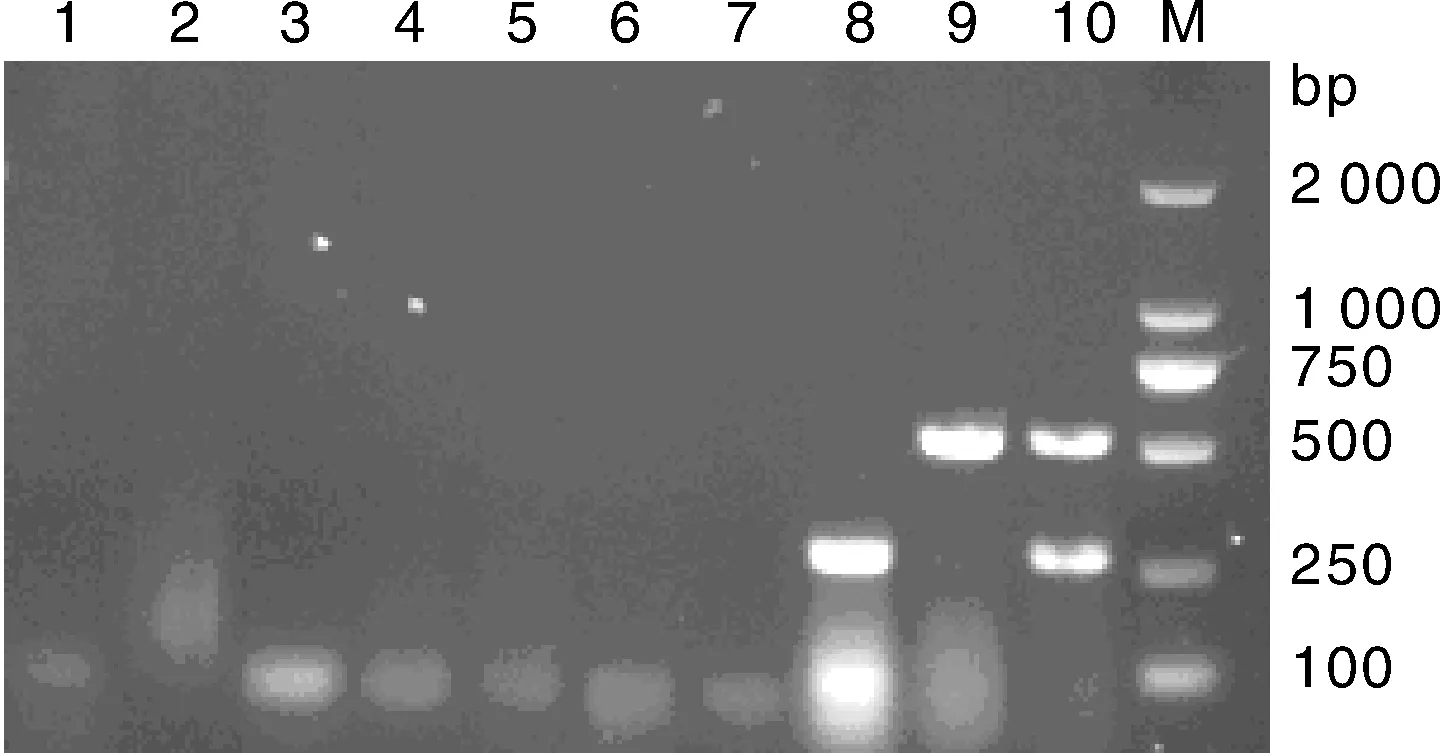
采用复合PCR扩增条件来扩增倍比稀释的PCV2、PEDV的质粒浓度混合模板,扩增结果如图9所示,推算出PCV2、PEDV的最低检出量分别为4.38×104copies·μL-1和3.30×104copies·μL-1。
2.8 临床应用
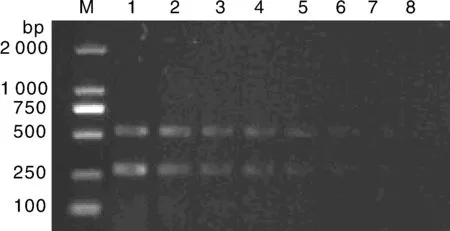
从四川乐山、宜宾、广元和遂宁等地采集的67份腹泻病料提取病料中总RNA、DNA,按照本试验建立的复合PCR 扩增体系和扩增条件进行检测,并设立阴阳性对照,取PCR产物6 μL在1.5%的琼脂糖凝胶中进行电泳后判定结果:PEDV单一感染阳性率为34.33%,PCV2单一感染阳性率为73.13%;PEDV+PCV2复合感染率为16.42%(表2)。复合PCR 扩增与单一的特异性检测PCV2的PCR 和检测PEDV 的RT-PCR检测结果进行比较分析,符合率均为100%(表3)。
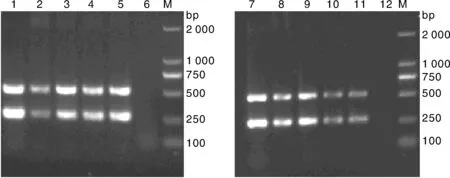
M: DNA 分子质量标准;1~5: 批间重复性试验;6, 阴性对照;7~11, 批内重复性试验;12,阴性对照M, DL2000 DNA marker; 1-5, Inter batch repeatability test;6, Negative control; 7-11, Intra batch repeatability test; 12, Negative control图8 复合PCR的批间、批内重复性试验结果Fig.8 Repeatability test of the multiplex PCR of inter batch and intra batch
M, DNA 分子质量标准;1~7, 模板的稀释度分别为100、10-1、10-2、10-3、10-4、10-5、10-6;8, 阴性对照M, DL2000 DNA marker; 1-7, The dilutions of plasmid were 100, 10-1, 10-2, 10-3, 10-4, 10-5, 10-6; 8, Negative control图9 复合PCR的敏感性试验Fig.9 Sensitivity test of multiplex PCR
3 讨论
近年来由腹泻所导致疾病给各大猪场造成了严重的经济损失,不同猪群死亡率差异较大,其中以仔猪腹泻最为突出。在临床中常见PPV、PRV、PRRSV、CSFV、TGEV、RV、PCV2等疾病混合
表2 PEDV和PCV2的检测结果
Table 2 Detection results of PEDV and PCV2

检测内容Testcontents检测样品数量TotalsampleNo.测出阳性样品数PositivesampleNo.阴性样品数NegativesampleNo.阳性率Positiverate/%PEDV6723443433PCV26749187313PEDV+PCV26711561642
表3 单项PEDV RT-PCR、PCV2 PCR与复合PCR对临床病料检测结果比较
Table 3 Detection results of multiplex PCR compared with PEDV RT-PCR and PCV2 PCR

病毒种类Virusspecies检测样品数量Totalsamplenumber单项检测阳性数positivecountstestedbyPEDVRT⁃PCRandPCV2PCR复合PCR检测阳性数PositivecountstestedbyMultiplexPCR阳性符合率Positivecoincidencerate/%PEDV672323100PCV2674949100PEDV+PCV2671111100
感染以致疫情加剧。随着我国养猪业规模化集约化的发展,猪群之间接触的概率增大,患病猪群多呈现混合感染现象,猪群死亡率大幅度上升,PED也会因为PCV2的垂直传播而变得易发,使得二者的混合感染更加严重,病症更加明显,病情更加严重[8-11]。笔者认为,造成疫情严重的主要原因在于免疫接种的重视程度差异、饲喂方式差异、胎次差异等。根据本试验检测结果显示,在临床表现为腹泻的仔猪病料中,PEDV、PCV2两种导致腹泻病毒的抗原检测有较高的阳性检出率,PEDV、PCV2混合感染猪场相较单独感染PEDV、PCV2的猪场而言死亡率增加30%左右。对此应引起高度重视,故本试验建立的这种快速有效检测这两种疾病的复合PCR方法意义重大。
以往实验室常规使用的单一PCR[12]或RT-PCR[13]检测方法,需要分别使用不同引物单独扩增,分别鉴定,耗时长、检测成本高,而本试验可以节约一半以上的时间及成本。与李维华等[14]研究报告相比,本方法可根据临床病症以及季节性特征对PEDV、PCV2这2种疾病的可疑病料进行针对性的检测,具有省时、省力、不浪费检测试剂去检测其余不相关病毒病,从而降低检测成本的优点。根据2病毒的标准参考株的保守序列设计特异性引物,以抽提的DNA和RNA反转录的cDNA为模板进行复合PCR方法的构建与优化,发现在退火温度为63 ℃时其扩增效果最好,没有任何非特异扩增条带。研究中所设计的2对引物长度分别为530 bp 、278 bp,在特异性试验中,本方法能扩增出特异的阳性条带,且本试验检测的所有其他易引起腹泻的病毒(猪伪狂犬病病毒、猪细小病毒、猪繁殖与呼吸综合征病毒、猪瘟病毒、猪传染性胃肠炎、猪轮状病毒等)和阴性对照均未出现非特异性扩增,说明该方法特异性良好。在敏感性试验中,本方法与普通PCR相比较敏感性更高。在对临床样品的检测比较中,笔者发现这种同时检测PEDV、PCV2两种疾病的复合PCR的方法与单项PCR、RT-PCR检测的符合率达到100%,说明该方法在临床上具有重要的应用前景。
[1] CHEN J F, WANG C B, SHI H Y, et al. Molecular epidemiology of porcine epidemic diarrhea virus in China[J].ArchivesofVirology, 2010, 155(9):1471-1476.
[2] 殷震, 刘景华. 动物病毒学 [M]. 北京:科学出版社, 1997: 562-571.
[3] 陆承平. 兽医微生物学[M]. 北京:中国农业出版社,20014:72.
[4] MEEHAN BM, MCNEILLY F, MCNAIR I, et al. Isolation and characterization of porcine circovirus 2 from cases of sow abortion and porcine dermatitis and nephropathy syndrome[J].ArchivesofVirology, 2001, 146(4):835-842.
[5] TISCHER I, GEIDERBLOM H, VETTERMANN W, et al. A very small porcine virus with circular single-stranded DNA[J].Nature, 1982, 295(5844):64-66.
[6] NICHOL S T, BEATY B J, ELLIOTT R M, et al. Virus Taxonomy: Classification and Nomenclature of Viruses [M]// FAUQUET C M, MAYO M A, MANILOFF J, et al. Virus Taxonomy, 8th Report of the International Committee for the Taxonomy of Viruses. Oxford, UK: Academic Press, 2005: 695-716.
[7] DARWICH L, MATEU E. Immunology of porcine circovirus type 2(PCV2)[J].VirusResearch, 2012, 164(1/2):61-67.
[8] KIM J, HA Y, JUNG K, et al. Enteritis associated with porcine circovirus 2 in pigs[J].CanadianJournalofVeterinaryResearch, 2004, 68(3):218-221.
[9] JUNK K, KIM J, HA Y, et al. The effects of transplacental porcine circovirus type 2 infection on porcine epidemic diarrhea virus-induced enteritis in pre-weaning piglets[J].TheVeterinaryJournal, 2006, 171(3):445-450.
[10] JUNK K, HA Y, HA S K, et al. Identification of porcine circovirus type 2 in retrospective cases of pigs naturally infected with porcine epidemic diarrhea virus[J].TheVeterinaryJournal, 2006, 171(1):166-168.
[11] LUO Y, LI S, SUN Y, et al. Classical swine fever in China: a mini review[J].VeterinaryMicrobiology, 2014. 172(1/2):1-6.
[12] 蒋成砚,谢昆,田婷. 猪圆环病毒2型PCR检测方法的建立及应用[J]. 黑龙江畜牧兽医,2012(12):83-85. JIANG C Y, XIE K, TIAN T. Establishment and application of PCR detection method for porcine circovirus type 2[J].HeilongjiangAnimalScienceandVeterinaryMedicine, 2012(12):83-85.(in Chinese)
[13] 杜坚,白安斌,李斌,等. 应用RT-PCR检测猪流行性腹泻病毒[J]. 动物科学与动物医学,2005,22(12):22-23. DU J, BAI A B, LI B, et al. Detection of porcine epidemic diarrhea virus by RT-PCR[J].AnimalScienceandAnimalMedicine, 2005, 22(12):22-23.(in Chinese)
[14] 李维华,任慧英,刘文华,等. PCV2、PPV、PRV、PRRSV和CSFV复合PCR的应用研究[J]. 西北农业学报,2008,17(3):12-15. LI W H, REN H Y, LIU W H, et al. Application of the multiplex PCR detecting PCV2, PPV, PRV, PRRSV and CSFV[J].ActaAgriculturaeBoreali-occidentalisSinica, 2008, 17(3):12-15.(in Chinese with English abstract)
(责任编辑 卢福庄)
Establishment of a multiplex PCR for porcine epidemic diarrhea virus and porcine circovirus type 2
GONG Shuangyana, LI Xiaojinga, CHEN Yingqia, CAI Yaoa, LI Yumenga, XU Yifeia, ZHU Linga,b, XU Zhiwena,b,*
(a.CollegeofVeterinaryMedicine; b.KeyLaboratoryofAnimalDiseaseandHumanHealthofSichuanProvince,SichuanAgriculturalUniversity,Chengdu611130,China)
In order to study the infection status of porcine epidemic diarrhea virus (PEDV) and porcine circovirus type 2 (PCV2) in diarrhea piglets, a multiplex PCR method for simultaneous detection of PEDV and PCV2 mixed infection was established. According to the published sequence of PEDV and PCV2 in GenBank, 2 pairs of specific primers were designed and synthesized for the conserved region, and the amplified fragments were 530 and 278 bp, respectively. The multiplex PCR method for the specific detection of PEDV and PCV2 was established by optimizing the reaction conditions. A total of 67 diarrhea samples (mixed mesenteric lymph nodes, intestinal mucosa and their contents) were collected from Leshan, Yibin, Guangyuan and Suining of Sichuan Province from April to August, 2016, and were detected by multiplex PCR. The results showed that the single infection positive rates of PEDV and PCV2 was 34.33% and 73.13%, respectively. The combined infection rate of PEDV and PCV2 was 16.42%. The coincidence rates of the multiplex PCR method and the specific detection methods of PCV2 PCR and PEDV RT-PCR were all 100%.
porcine epidemic diarrhea virus; porcine circovirus type 2; multiplex PCR
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2017.07.05
2016-12-27
四川省科技支撑计划(2017NZ0038);“十二五”农村领域国家科技计划课题(2015BAD12B04-2.3)
龚双燕(1994—),女,重庆开县人,硕士研究生,主要从事动物传染病病原分子生物学研究。E-mail: 654392857@qq.com
*通信作者,徐志文,E-mail: abtcxzw@126.com
S855.3
A
1004-1524(2017)07-1086-07
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(7): 1086-1092
龚双燕,李小璟,陈瑛琪,等. 猪流行性腹泻病毒与圆环病毒2型复合PCR方法的建立[J].浙江农业学报,2017,29(7): 1086-1092.

