烟草NtKAT3基因克隆、序列和表达分析
黄路平,刘 仑,鲁黎明,李立芹
(四川农业大学 农学院,四川 成都 625014)
烟草NtKAT3基因克隆、序列和表达分析
黄路平,刘 仑,鲁黎明,李立芹*
(四川农业大学 农学院,四川 成都 625014)
钾离子通道对植物体具有重要的生理功能,利用同源克隆的策略从烟草品种K326中获得一个钾离子通道基因,该基因全长1 989 bp,蛋白编码662个氨基酸,分子量75.6 ku,等电点7.2。同源性分析结果显示,该基因与绒毛烟草钾离子通道基因KAT3、林烟草钾离子通道基因KAT3等具有较高的同源性,所以命名为NtKAT3。根据生物信息学分析,NtKAT3具有5个跨膜区,是一个疏水蛋白。基因表达分析表明,NtKAT3在根中的表达量最高,其次是叶、茎和花;烟草幼苗在低钾处理后NtKAT3的表达量先升高后降低,NtKAT3的表达量在12 h时达到最高值,在48 h达到最低值;200 mmol·L-1NaCl处理后,NtKAT3基因表达量在6 h达到最低值,24 h达到最高值,说明该基因表达量受到低钾和盐胁迫诱导。
烟草;钾离子通道;基因克隆
钾离子是植物细胞中含量最丰富的阳离子之一,对生物体具有重要的生理生化功能,例如调节各种酶的活性和细胞膨压,维持细胞内外电荷平衡,参与蛋白质的合成转运和植物的光合作用,提高代谢能力,介导气孔的张开和闭合、叶片的运动[1-5]。1992年Sentenac等[6]从拟南芥中克隆出了K+转运体基因AKT1;与此同时Anderson等[7]也从拟南芥中克隆出了K+通道基因KAT1。到目前为止,已得到克隆的植物K+转运体基因有两大类,分别是K+转运体基因和K+离子通道基因[8]。K+通道基因主要包括Shake家族和KCO家族,其中Shaker K+通道家族的重要特点之一是能形成异源四聚体结构,可以使植物调节不同细胞中的K+转运活性,这种调节在每个器官或组织中是独立的,并与环境条件相关[9-10]。Dreyer等[11]在拟南芥中克隆了K+通道基因AKT1,KAT1和AtKAT3(又称AtkC1),将K+通道基因不同组合导入非洲爪蟾卵母细胞检测拟南芥中,结果显示K+通道基因的不同α亚基是非选择性的,能产生不同的四聚体通道蛋白。Geoffrey等[12]的研究表明,在拟南芥中KAT3基因表达的α亚基不能形成四聚体从而导致KAT3基因的沉默,但是可以结合AKT1基因产生的亚基形成不同的K+通道蛋白,从而调控K+的吸收和转运;同时Dietmar等[13]证明了KAT3在低钾条件下促进拟南芥根的KAT1对K+的吸收;最新研究表明,KAT3还可与其他家族的基因CIPK2/3协同调控AKT1对K+的吸收[14]。
钾对烟草生理生化、品质和抗逆性具有重要的作用,是评判烟叶品质的重要标准,缺钾是世界范围内常见的导致烟草生长受抑和产量减少的重要原因[15-16]。烟草K+通道基因也有了巨大的发展,为更好解决烟草缺钾问题提供了可能。郭兆奎等[17]克隆和分析了黄花烟草K+通道NKC1基因,研究表明NKC1与黄花烟草SKT1的同源性最高,NKC1在烟草的幼根、叶片和花朵中均有表达。曲平治等[18]克隆了普通烟草K+通道基因NKT4,报道了NKT4主要在烟草主根和侧根中表达, 其次在烟草叶片中有少量表达。靳义荣等[19]在林烟草中克隆NKT6基因,NKT6主要在林烟草的茎和腋芽中表达,定位于细胞膜和核膜附近的内质网。Reintanz等[20]从拟南芥中克隆出AtKAT3基因,研究结果表明其主要在根部表达。
本试验从烟草K326中克隆到一个Shake钾离子通道(NtKAT3)的cDNA,并运用生物信息手段分析NtKAT3所编码的蛋白,预测NtKAT3编码的蛋白性质、结构和表达部位,同时利用荧光定量PCR分析NtKAT3基因在组织中的特异性,分析NtKAT3基因在低钾诱导和高盐胁迫下的表达情况,旨在为烟草K+吸收转运的分子机制奠定基础。
1 材料与方法
1.1 材料及试剂
本试验选择的烟草品种为K326,首先选择籽粒饱满、大小相同的K326烟草种子,种子经过20%次氯酸钠溶液消毒30 min后,用无菌水清洗6~7次,均匀分布到有MS培养基的无菌培养皿中,平均每个培养皿上分布50粒种子为宜,然后放置于25 ℃,16 h/8 h(L/D)的光照培养箱,15 d后即得烟草无菌苗。选择长势一致的烟草幼苗,并转移至低钾和200 mmol·L-1NaCl培养基上,分别处理0、6、12、24、48 h,并对烟草幼苗进行整株取样。
其他试剂:大肠埃希菌感受态和DNA凝胶纯化回收试剂盒购自天根公司;Trizol试剂、载体PMD19-T、高保真Pfu酶、cDNA 合成试剂盒、PrimeScript RT reagent Kit Perfect Real time、SYBR Green Master mix等试剂购自TaKaRa公司。
1.2 实验方法
1.2.1 烟草NtKAT3的克隆
根据GenBank中收录的普通烟草NtKAT3(登录号:XP_016460285)的序列,使用Primer5.0工具设计引物NtKAT3F和NtKAT3R(表1)。扩增反应体系为:MIX 5 μL,cDNA 1 μL,NtKAT3F和NtKAT3R各0.2 μL,ddH2O 3.6 μL。扩增反应程序为:95 ℃预变性5 min; 95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,35个循环;总延伸8 min。得到的目的片段经过电泳,胶回收纯化后与pMD19-T载体16 ℃过夜连接,连接产物转化至大肠埃希菌DH5α感受态,随后均匀地涂抹于含有氨苄青霉素的LB平板上进行筛选,采用菌落PCR选出阳性克隆,电泳检测后随机选取3个独立的阳性克隆送生物技术公司测序。
1.2.2 烟草NtKAT3生物信息学分析
利用ExPASy ProtParam tool分析NtKAT3编码蛋白的理化性质;采用DNAMAN软件分析该基因表达蛋白的疏水性,并利用MAG2.0构建系统进化树;运用TMHMM 2.0进行跨膜区的预测分析;利用NCBI在线分析NtKAT3的保守功能域;运用在线工具PSORT预测NtKAT3的亚细胞定位;运用IBCP和SWISS-MODEL在线预测NtKAT3的二级、三级结构。
1.2.3 烟草NtKAT3的表达分析
根据基因序列,使用Primer Premier 5.0软件设计Real Time PCR的引物,分别是NtKAT3qF和NtKAT3qR(表1),采用烟草的18S rRNA作为内参,对NtKAT3进行表达差异研究。PCR扩增程序为: 95 ℃ 5 min;95 ℃ 30 s,72 ℃ 1.5 min,40个循环;72 ℃ 10 min。所有的样品都设置3个重复,反应结束后,基因相对表达水平用2-△△Ct方法进行计算。
2 结果与分析
2.1 基因克隆
取K326烟草的叶片,用TRIZOL法提取烟草叶片总RNA,然后以总RNA反转录合成的cDNA为模板,进行PCR扩增,电泳结果显示在2 000 bp左右位置上有清晰条带(图1)。将该条带纯化后,16 ℃条件下与pMD19-T载体进行连接,运用菌落PCR方法鉴定阳性克隆,最后随机挑选3个阳性克隆送生物公司进行测序。
2.2 NtKAT3序列分析
2.2.1 NtKAT3的理化性质及疏水性分析
NtKAT3编码蛋白的理化性质分析结果表明,该蛋白预测的分子量为75.6 ku,分子式为C3431H5351N907O969S25,理论等电点pI为7.20,该蛋白的总平均疏水性为-0.083,不稳定系数是36.66,根据理化性质分析结果,NtKAT3蛋白是一个稳定性蛋白。
表1 引物序列
Table 1 Primer sequences
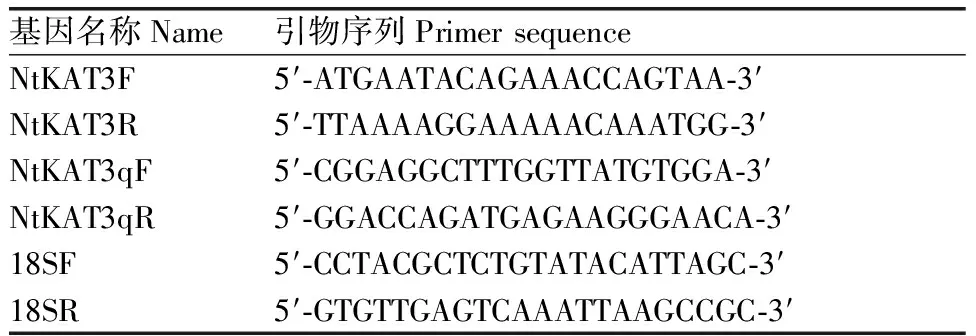
基因名称Name引物序列PrimersequenceNtKAT3F5′⁃ATGAATACAGAAACCAGTAA⁃3′NtKAT3R5′⁃TTAAAAGGAAAAACAAATGG⁃3′NtKAT3qF5′⁃CGGAGGCTTTGGTTATGTGGA⁃3′NtKAT3qR5′⁃GGACCAGATGAGAAGGGAACA⁃3′18SF5′⁃CCTACGCTCTGTATACATTAGC⁃3′18SR5′⁃GTGTTGAGTCAAATTAAGCCGC⁃3′
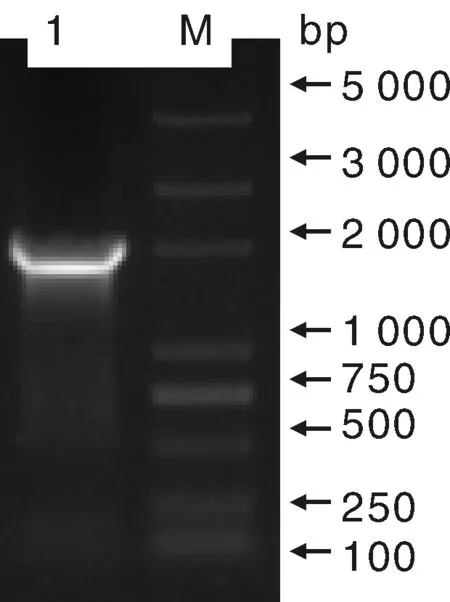
M, Marker;1, 目的基因M, Marker;1, Target gene图1 NtKAT3克隆Fig.1 Cloning of NtKAT3
利用在线ProtSCale(http:/web.expasy.org/protscale/)进行的疏水性分析结果(图2)表明,纵坐标是氨基酸标度值,正值代表疏水,负值代表亲水,横坐标表示氨基酸序列位置,总的平均疏水性为-0.083,推测NtKAT3蛋白是疏水蛋白。
2.2.2 NtKAT3的二级、三级结构预测
了解蛋白质的二级结构和三级结构有助于认识蛋白的特性,本研究利用IBCP(http://npsa-pbil.ibcp.fr)的在线工具SOPMA,对NtKAT3的二级结构进行预测,其结果表明:α-螺旋约占41.09%;无规则卷曲约占21.75%;延伸链占29.46%;β-转角占7.70%;其中α-螺旋为主要结构(图3-A)。运用SWISS-MODEL服务器对NtKAT3的三级结构进行了预测(图3-B)。
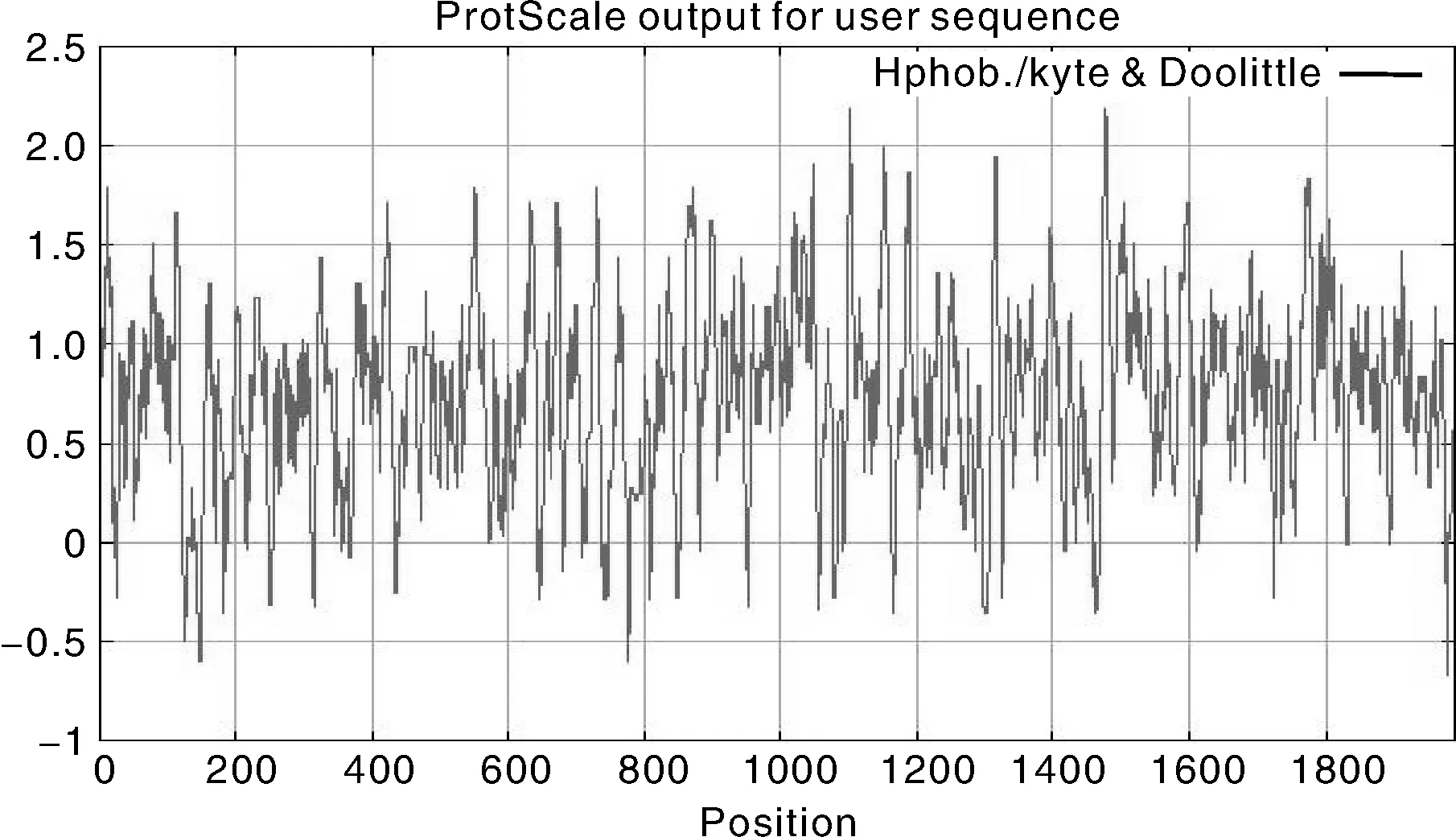
图2 NtKAT3疏水区预测Fig.2 Hydrophobic region prediction of NtKAT3
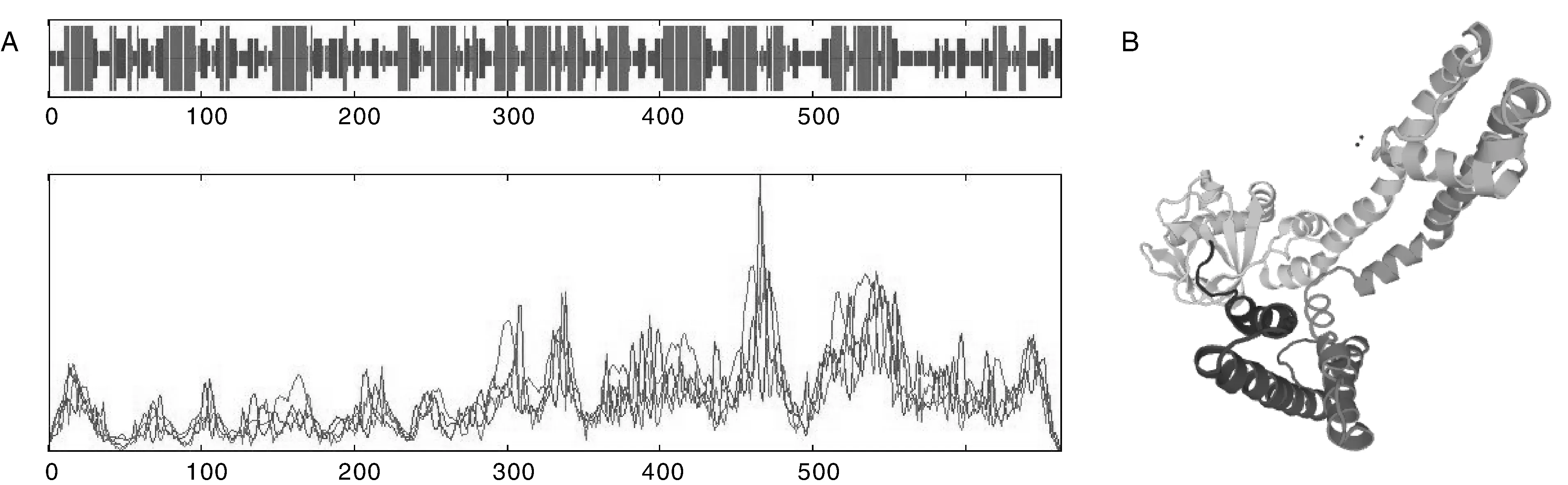
A, 二级结构预测;B, 三级结构预测A, Secondary structure prediction; B, Tertiary structure prediction图3 NtKAT3蛋白的二级结构及三级结构预测Fig.3 The secondary structure and tertiary structure prediction of NtKAT3
2.2.3 NtKAT3蛋白跨膜区域预测
NtKAT3编码蛋白的跨膜区分析结果表明,该蛋白含有5个跨膜区 (图4)。跨膜螺旋的位置分别为第46~65氨基酸,第75~96氨基酸,第116~138氨基酸,第185~204氨基酸和第262~284氨基酸。结果显示,该蛋白有5个跨膜区,推测该钾离子通道是一个膜蛋白。
2.2.4 NtKAT3同源性分析
把NtKAT3的氨基酸序列在NCBI 数据库中进行BLAST比对,按照相似性程度高低选择较高相似性的20个基因序列(包括目的钾转运体基因)构建系统进化树,结果(图5)表明,NtKAT3与绒毛烟草钾离子通道KAT3、林烟草钾离子通道KAT3等具有较高的氨基酸序列同源性(99%、97%),与野草莓钾离子通道KAT1的氨基酸序列同源性最低,为59%。
2.2.5 编码蛋白的功能保守域及亚细胞定位分析
利用 NCBI 数据库的CDD软件对NtKAT3蛋蛋白功能保守域进行了分析,结果表明(图6),该蛋白存在离子转运结构域(Ion_trans)和环核苷酸结合域(cNMP),环核苷酸结合域存在于 cAMP 及cGMP 依赖的蛋白激酶及门控离子通道中。利用PSORT(http://psort.hgc.jp/form.html)在线预测NtKAT3的亚细胞定位,结果显示,在质膜上的相似度为0.874,在微体中的相似度为0.585,在高尔基体上的相似度为0.3,在内质网(膜)上的相似度为0.2,NtKAT3蛋白与质膜相似度最高,推测该钾离子通道蛋白可能定位在质膜上。
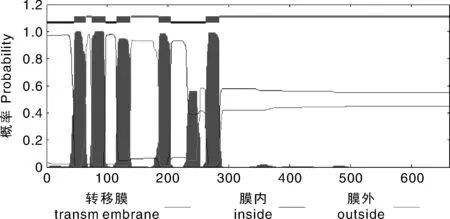
图4 NtKAT3蛋白跨膜区预测Fig.4 Prediction of transmembrane region of NtKAT3 protein

图5 NtKAT3的系统进化分析Fig.5 Phylogenetic analysis of NtKAT3
2.3NtKAT3的组织表达分析
以烟草K326的根、茎、叶、花的cDNA为模板进行Real-time PCR反应,并分析NtKAT3在各个部位的表达量,由图7可知,NtKAT3的表达量由高到低依次为根、茎、叶、花,其在根中的表达量分别是茎、叶、花中表达量的2.7、60.2、63.4倍,结果显示NtKAT3主要在烟草植株的根中表达,其表达存在组织特异性,推测NtKAT3基因调控烟草的根和茎的钾离子吸收和转运。

图6 NtKAT3功能保守域分析Fig.6 Functional conservative domain analysis of NtKAT3
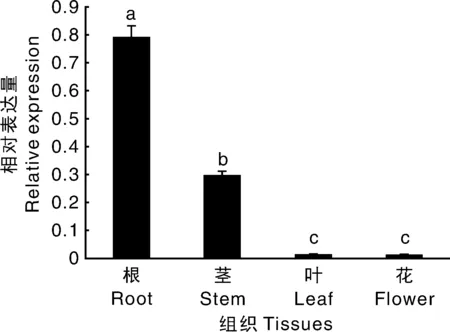
不同数据上没有相同小写字母表示差异显著(P≤0.05),下同The bars with different letters show the significant difference at the level of 0.05. The same as below图7 NtKAT3在不同组织中的相对表达量分析Fig.7 Analysis of relative expression of NtKAT3 in different tissues
2.4 低钾胁迫和盐胁迫下NtKAT3的表达分析
本研究采用Real-time PCR对NtKAT3在低钾和盐胁迫处理后的表达量进行了分析。由图8可知,该基因在低钾处理1~12 h表达量上升,12 h时达到最大,为对照(0 h)的2.6倍;随后表达量下降,48 h后表达量为对照的25%。因此低钾处理后,NtKAT3的表达量是先上调后降低;同时盐处理后的NtKAT3表达量在0~6 h降低,6~24 h升高,24~48 h降低,在24 h时NtKAT3表达量达到最大值,其表达量是0 h的1.4倍。
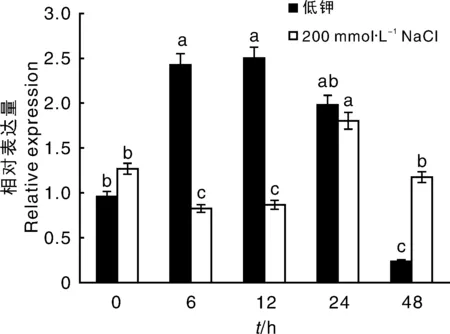
图8 NtKAT3在低钾和盐胁迫处理下的相对表达量Fig.8 Relative expression of NtKAT3 under low-K+ and salt stress treatment
3 讨论
本研究中,我们首先克隆了烟草K326的NtKAT3基因全长cDNA的序列,Shaker家族的重要标志为氨基酸序列有一个很保守的TxxTxGYGD序列(简称T盒)[21],在NtKAT3基因的氨基酸序列第241到249的序列为TMTTTGYGD,表明NtKAT3基因的氨基酸序列存在一个T盒。同时NtKAT3的进化树数据表明,克隆的NtKAT3氨基酸序列和绒毛烟草的KAT3等氨基酸序列具有较高的同源性。另一个结果显示,NtKAT3的亚细胞预测定位中NtKAT3主要定位在质膜上。到目前为止,在拟南芥中共发现了9个Shaker家族的成员,都定位于细胞质膜上,表现出高度的保守性[22]。分析NtKAT3的氨基酸序列,结果表明普通烟草的NtKAT3基因与同源基因具有相对一致性,并且利用有效的SWISS-MODEL服务,成功预测了NtKAT3基因的蛋白三级结构图,为进一步研究结构功能打下基础。然而对于NtKAT3只有5个跨膜区,目前并没有发现相关报道。
Shaker家族目前被认为是植物钾离子吸收和转运最为重要的功能蛋白,对植物保持细胞内部钾离子的平衡有着至关重要的作用[23]。Shaker家族分为AKT1,KAT1,AKT2,KC1和SKOR 5个亚族,KC1(KAT3)亚族主要表达在根毛和根的内皮层细胞,并且参与调节AKT1通道的K离子吸收[20-21]。NtKAT3表达量最高的在根,其次是茎,这表明该基因主要表达在根,这与生物信息分析,NtKAT3具有拟南芥KAT3的特点相符合。盐角草的AKT1基因在缺钾下处理48 h后表达量会升高[24]。水稻OsKAT1.1基因在缺钾诱导下根部的表达量在48 h后下降[25]。本研究表明,烟草幼苗在低钾处理后NtKAT3的表达量先升高后下降,在12 h后达到最大值,表明该基因受低钾诱导其表达量下降。对水稻的幼苗进行100 mmol·L-1Na+处理,水稻OsKAT2的表达量在48 h后下降[26],拟南芥的叶片在100 mmol·L-1Na+处理下KAT1和KAT2的表达量在48 h后下降[27]。本研究NtKAT3的表达量是先降低后升高再下降,但是在48 h的表达量与0 h时相同,这表明该基因受到盐胁迫的诱导。
综上所述,完成普通烟草NtKAT3的克隆,并对NtKAT3序列进行分析和表达模式的阐述,为后续工作打下了坚实的基础。今后的研究可以对NtKAT3构建过表达和RNAi载体进行转基因研究;可以利用酵母双杂交技术研究NtKAT3与其他家族基因的相互作用,进一步明确NtKAT3在烟草钾营养方面的功能。这为植物钾营养分子机制研究奠定基础。
[1] LEIGH R A, WYN JONES R G. A hypothesis relating critical potassium concentrations for growth to the distribution and function of this ion in the plant cell[J].NewPhytologist, 1984, 97(1):1-13.
[2] MAATHUIS F J M, DALE S. Machenisms of potassium absorption by higher plants roots[J].PhysiologiaPlantarum, 1996, 96(1):158-168.
[3] MAATHUSIS F J M, ICHIDA A M, SANDERS D, et al. Roles of higher plant K+channels[J].PlantPhysiology, 1997, 114(4):1141-1149.
[4] SMART C J, GARVIN D F, PRINCE J P, et al. The molecular basis of potassium nutrition in plants[J],PlantandSoil, 1996, 187(1):81-89.
[5] THIEL G, WOLF A H. Operation of K+-channels in stomatal movement[J],TrendsinPlantScience, 1997, 2(9):339-345.
[6] SENTENAC H, BONNEAUD N, MINET N, et al. Cloning and expression in yeast of a plant potassium ion transport system[J].Science, 1992, 5057(256): 663-668.
[7] ANDERSON J A, HUPRIKAR S S, KOCHIAN L V, et al. Functional expression of a probableArabidopsisthalianapotassium channel inSaccharomycescerevisiae[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 1997, 89(9):3736-3740.
[8] LAINÉ M, PAPAZIAN D M, ROUX B. Critical assessment of aproposed model of Shaker[J].FEBSLetters, 2004, 564(3):257-263.
[9] 库文珍,赵运林,董萌. 植物Shaker K+通道的研究进展[J]. 中国生物工程杂志, 2012, 32(10):112-118. KU W Z, ZHAO Y L, DONG M. Advances on Shaker-type K+channels in plants[J].ChinaBiotechnology, 2012, 32(10):112-118.(in Chinese with English abstract)
[10] GAMBALE F, UOZUMI N. Properties of Shaker-type potassium channels in higher plants[J].JournalofMembraneBiology, 2006, 210(1):1-19.
[11] DREYER I, ANTUNES S, HOSHI T, et al. Plant K+channel α-subunits assemble indiscriminately[J].BiophysicalJournal, 1997, 72(5):2143-2150.
[12] GEOFFREY DUBY, ERIC HOSY, CÉCILE FIZAMES, et al.AtKC1, a conditionally targeted Shaker-type subunit, regulates the activity of plant K+channels[J].PlantJournal, 2008, 53(1):115-123.
[13] DIETMAR GEIGER, DIRK BECKER, DANIEL VOSLOH, et al.AtKC1_AKT1 channels in Arabidopsis roots facilitate growth under K+-limiting conditions[J].JournalofBiologicalChemistry, 2009, 284(32):21288-21295.
[14] XUEPING WANG, LIMEI CHEN, WENXIN LIU, et al.AtKC1 andCIPK2/3 synergistically modulateAKT1-mediated low-potassium stress responses in Arabidopsis[J].PlantPhysiology, 2016, 170(4):2264-2277.
[15] 田友清,丁平,张云庆. 烟草药用研究概述[J]. 中国药业, 2015, 24(9):126-1285. TIAN Y Q, DING P, ZHANG Y Q. Overview on researches of medicinal use of tobacco[J].ChinaPharmaceuticals, 2015, 24(9):126-1285. (in Chinese with English abstract)
[16] LU L, CHEN Y, LU L, et al. Transcriptome analysis reveals dynamic changes in the gene expression of tobacco seedlings under low potassium stress[J].JournalofGenetics, 2015, 94(3):1-10.
[17] 郭兆奎, 杨谦, 颜培强,等. 黄花烟草K+通道基因NKC1克隆与序列分析[J]. 中国烟草学报, 2008, 14(5):63-68. GUO Z K, YANG Q, YAN P Q, et al. Cloning and homology modeling of a potassium channel geneNKC1 fromNicotianarustica[J].ActaTabacariaSinica, 2008, 14(5):63-68. (in Chinese with English abstract)
[18] 曲平治, 刘贯山, 刘好宝, 等. 普通烟草K+通道基因NKT4的克隆、序列和表达分析[J].植物遗传资源学报, 2009, 10(3):354-359. QU P Z, LIU G S, LIU H B, et al. Cloning and sequence and expression analysis of potassium channel geneNKT4 inNicotianatabacum[J].JournalofPlantGeneticResources, 2009, 10(3):354-359. (in Chinese with English abstract)
[19] 靳义荣, 宋毓峰, 白岩, 等. 林烟草钾离子通道基因NKT6的克隆与表达定位分析[J]. 作物学报, 2013, 39(9):1602-1611. JIN Y R, SONG Y F, BAI Y, et al. Molecular cloning and expression analysis of potassium channel gene NKT6 inNicotianasylvestris[J].ActaAgronomicaSinica, 2013, 39(9):1602-1611. (in Chinese with English abstract)
[20] REINTANZ B, SZYROKI A, IVASHIKINA N, et al.AtKC1, a silent Arabidopsis potassium channel-subunit modulates root hair K+influx[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2002, 99(6): 4079-4084.
[21] JAN L Y, JAN Y N. Cloned potassium channels from eukaryotes and prokaryotes[J].AnnualReviewofNeuroscience, 1997, 20:91-123.
[22] HEDRICH R, BECKER D, GEIGER D, et al. Role of Ion Channels in Plants[M]// OKADA Y. Patch Clamp Techniques. Tokyo: Springer Japan, 2012:295-322.
[23] DANIEL P, SCHACHTMA N. Molecular insights into the structure and function of plant K+transport mechanisms[J].BiochimicaetBiophysicaActa, 2000, 2(7):127-139.
[24] 商玲. 盐角草钾离子通道蛋白基因SeAKT1的克隆与表达[D].大连: 大连理工大学, 2013. SHANG L. Cloning and expression of a K+channel geneSeAKT1 formSalicorniaeurope[D]. Dalian: Dalian University of Technology, 2013.(in Chinese with English abstract)
[25] 李俊林,高南,刘春生,等. 水稻钾离子通道基因OsKAT1.1的克隆、表达载体的构建及其电生理功能[J]. 基因组学与应用生物学, 2011, 30(4):346-351. LI J L, GAO N, LIU C S, et al. Cloning, construction of expression vectors and electrophysiological function of potassium channel geneOsKAT1.1 in rice[J].GenomicsandAppliedBiology, 2011, 30(4):346-351. (in Chinese with English abstract)
[26] 高南, 李俊林, 郝东利. 水稻OsKAT2基因的克隆及表达分析[J]. 江苏农业学报, 2014, 30(4):691-697. GAO N, LI J L, HAO D L. Molecular cloning and expression analysis ofOsKAT2 in rice[J].JiangsuJournalofAgriculturalSciences, 2014, 30(4):691-697. (in Chinese with English abstract)
[27] PILOT G, LACOMBE B, GAYMARD F, et al. Guard cell inward K+channel activity in Arabidopsis involves expression of the twin channel subunits KAT1 and KAT2[J].JournalofBiologicalChemistry, 2001, 276(5):3215-3221.
(责任编辑 张 韵)
Cloning, sequence and expression analysis of a potassium channelNtKAT3 in tobacco
HUANG Luping, LIU Lun, LU Liming, LI Liqin*
(CollegeofAgronomy,SichuanAgriculturalUniversity,Chengdu625014,China)
Potassium channels have important physiological roles in plants. This study obtains a potassium channel gene from the tobacco variety K326 by using homologous cloning strategy. Sequences analysis showed that this gene contains 1 989 bp and encodes a protein consisting of 662 amino acids, the calculated molecular mass was 75.6 ku and the theoretical isoelectric point (pI) was 7.2. Homology analysis suggested that the gene had a high homology with the potassium channelsKAT3 of bothNicotianatomentosiformisandNicotianasylvestris, so it was named asNtKAT3. Protein structure and function analysis showed thatNtKAT3 has 5 transmembrane domains, which was a hydrophobic membrane protein. Expression patterns analysis showed that the highest expression level was observed in the roots, followed by leaves, stems and flowers. Under low potassium condition, the expression level ofNtKAT3 in tobacco seedlings increased firstly and then decreased, the highest expression level ofNtKAT3 appeared at 12 h, and the lowest level appeared at 48 h. Under 200 mmol·L-1NaCl treatment,NtKAT3 reached the lowest expression level at 6 h, while the highest level appeared at 24 h, which indicated that the geneNtKAT3 can be induced by low potassium or salt stress.
tobacco; potassium channel; gene cloning
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2017.07.01
2016-12-04
植物生理学与生物化学国家重点实验室开放课题(SKLPPBKF1505,SKLPPBKF1506)
黄路平(1993—),男,重庆云阳人,硕士研究生,主要从事烟草分子生物学研究。E-mail: 1043737331@qq.com
*通信作者,李立芹,E-mail: liliqin88@qq.com
S572
A
1004-1524(2017)07-1057-07
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(7): 1057-1063
黄路平,刘仑,鲁黎明,等. 烟草NtKAT3基因克隆、序列和表达分析[J].浙江农业学报,2017,29(7): 1057-1063.

