气相色谱-串联质谱检测烟草中15种苯氧羧酸类除草剂残留
曹桂红,王兴宁
(1.贵州食品药品检验所,贵州 贵阳 550012;2.贵州出入境检验检疫局 综合技术中心,贵州 贵阳 550081)
气相色谱-串联质谱检测烟草中15种苯氧羧酸类除草剂残留
曹桂红1,王兴宁2*
(1.贵州食品药品检验所,贵州 贵阳 550012;2.贵州出入境检验检疫局 综合技术中心,贵州 贵阳 550081)
建立了气相色谱-串联质谱技术对烟草中15种苯氧羧酸类除草剂农药残留量的分析方法。样品采用乙腈提取、Carbon TPT固相萃取柱净化、三甲基硅烷化重氮甲烷衍生化,采用气相色谱-串联质谱对15种苯氧羧酸类除草剂进行测定,通过保留时间、选择离子及相对丰度定性,外标法定量。结果表明,15种苯氧羧酸类除草剂在20~1 000 μg/L浓度范围内均呈良好线性关系,相关系数大于0.992,检出限为0.9~3.3 μg/kg,定量下限为3.2~10.8 μg/kg。在20,100,200 μg/kg 3个加标水平下的平均回收率为71.5%~105.6%,相对标准偏差(RSD)为4.5%~14.9%。该方法简便、快速、灵敏,适用于烟草中15种苯氧羧酸类除草剂的同时检测。
烟草;苯氧羧酸类除草剂;气相色谱-串联质谱(GC-MS/MS);固相萃取(SPE);甲酯化
烟草是我国重要的经济作物,近年来,除草剂的施用极大地降低了劳动强度,有效提高了农业生产效率,对烟叶产量和品质起到了积极作用[1]。苯氧羧酸类除草剂及其盐和酯对阔叶杂草有很好的防治效果,且易溶于水,但其在农田生态系统中会迁移,引起土壤、地下水、大气等污染[2]。苯氧羧酸类除草剂本身有中等毒性,其代谢产物(特别是一些卤化物)对人类和生物体会造成危害,可引起人类软组织恶性肿瘤,对动物体也表现出胎盘毒性[3-4]。
烟草中的农药残留量问题成为各国烟草贸易中倍加关注的内容,国际烟草科学研究合作中心(CORESTA) 农用化学品咨询委员会(ACAC)于2013年提出了烟草中120种农药的指导性残留限量(Guidance Residue Levels,GRLs),其中规定了3种苯氧羧酸类除草剂的残留限量,分别是麦草畏0.2 mg/kg、2,4-滴0.2 mg/kg、2,4,5-涕0.05 mg/kg[5]。
目前,国内外对苯氧羧酸类除草剂残留量的检测大多采用气相色谱法、气相色谱-质谱法、液相色谱-串联质谱法及离子色谱法等,且主要集中于谷物、水果、蔬菜、茶叶、土壤及动物组织等样品[6-10]。而采用气相色谱-串联质谱(GC-MS/MS)测定烟草中多种苯氧羧酸类农药残留量尚未见报道。烟草中富含有机酸、烟碱、还原性糖、总糖、矿物质等化学物质,成分极为复杂[11]。GC-MS/MS具有气相色谱及单级质谱的检测优势,且抗干扰能力更强[12-14],适用于烟草等复杂基质样品中残留农药的快速筛查与确证。本文对烟草中15种苯氧羧酸类除草剂多残留分析的样品提取、固相萃取净化以及GC-MS/MS的分离测定等条件进行了研究,建立了烟草中15种苯氧羧酸类除草剂残留的测定方法,方法简便、快速、净化效果较好,各项技术指标均符合残留检测的要求。
1 实验部分
1.1 仪器、试剂与材料
气相色谱仪-串联质谱仪(GC-MS/MS、7000C,美国安捷伦公司),X-22R高速冷冻离心机(美国Allegra公司),R-215旋转蒸发仪(美国Buchi公司),旋涡振荡器(美国Taiboys公司),分析天平(美国Mettler公司),TurboVap Ⅱ氮吹仪(瑞典Biotage公司)。乙腈、丙酮、正己烷(色谱纯),甲苯(分析纯),氯化钠、无水硫酸钠(农残级),三甲基硅烷化重氮甲烷衍生化试剂(0.6 mol/L),均购于美国Sigma公司;Carbon TPT固相萃取柱(2 000 mg/12 mL,天津艾杰尔公司)。
标准品:3,5-二氯苯甲酸、麦草畏、MCPP、MCPA、2,4-滴丙酸、2,4-滴、5-氯苯酚、2,4,5-涕丙酸、草灭平、2,4,5-涕、2,4-滴丁酸、苯达松、毒秀定、地乐酚及三氟羧草醚(纯度大于98%,德国DR公司)。实验用水均为Milli-Q超纯水。样品:实验室日常委托检测样品。
1.2 标准溶液的配制
标准储备液:准确称取15种苯氧羧酸类除草剂标准品各10 mg(精确至0.1 mg)分别置于50 mL容量瓶中,用丙酮溶解并定容至刻度后,得到质量浓度为200 mg/L的农药标准储备液,储存于4 ℃冰箱中。
混合标准储备液:准确移取100 μL上述200 mg/L标准储备液于10 mL容量瓶中,用丙酮定容,得到质量浓度为2 mg/L的混合标准储备液,储存于4 ℃冰箱中。
混合标准工作溶液:取2 mg/L混合标准储备液,配制成质量浓度分别为20,100,200,500,1 000 μg/L的混合标准工作溶液。
1.3 样品前处理
1.3.1 样品提取 准确称取2.00 g(精确至0.01 g)烟草样品于50 mL具塞离心管中,加入5 mL水润湿,加2 g氯化钠和15 mL乙腈溶液振荡混匀,静置30 min,以5 000 r/min离心5 min收集上清液。再加15 mL乙腈重复提取1次,合并两次提取液于100 mL浓缩瓶中,用旋转蒸发仪40 ℃水浴蒸发浓缩至约1 mL,待净化。
1.3.2 净 化 在Carbon TPT固相萃取柱中加入1 cm高的无水硫酸钠,加样前用5 mL乙腈-甲苯溶液(体积比为3∶1)预淋洗该柱,弃去淋洗液,当液面到达无水硫酸钠顶部时,迅速将样品提取浓缩液转入该柱,下接15 mL玻璃试管,分别用1 mL乙腈-甲苯溶液(3∶1)洗涤浓缩瓶3次,将全部洗涤液转入Carbon TPT固相萃取柱中,待液面到达无水硫酸钠顶部时,用15 mL乙腈-甲苯溶液(3∶1)洗脱,收集所有流出液,待衍生。
1.3.3 衍生化 将收集的洗脱液在40 ℃水浴中氮吹浓缩至近干,用5 mL正己烷淋洗试管壁,氮吹近干,再用5 mL正己烷淋洗1次,用平缓氮气吹至约1 mL,加入100 μL三甲基硅烷化重氮甲烷衍生剂,盖塞混匀后,于40 ℃下水浴10 min,再用平缓氮气流吹至近干,用丙酮溶解并定容至1 mL,过0.2 μm有机滤膜后供GC-MS/MS分析。
1.4 色谱-质谱条件
色谱柱:DB-5 MS毛细管柱 (30 m×0.25 mm×0.25 μm);进样口温度:250 ℃,不分流进样;载气:He(纯度>99.999%),流速为1 mL/min;进样量为1 μL;升温程序:起始温度70 ℃,保持2 min;以10 ℃/min升至290 ℃,保持10 min。
电子轰击离子源(EI);电子能量:70 eV;离子源温度: 230 ℃;接口温度:280 ℃;溶剂延迟时间:5 min;检测器电压:1.0 kV;碰撞气:氦气,流速1.5 mL/min;数据扫描方式:正离子;测定方式:选择反应监测方式(MRM)。每种化合物通过GC-MS/MS检测的保留时间、离子对等相关参数见表1。
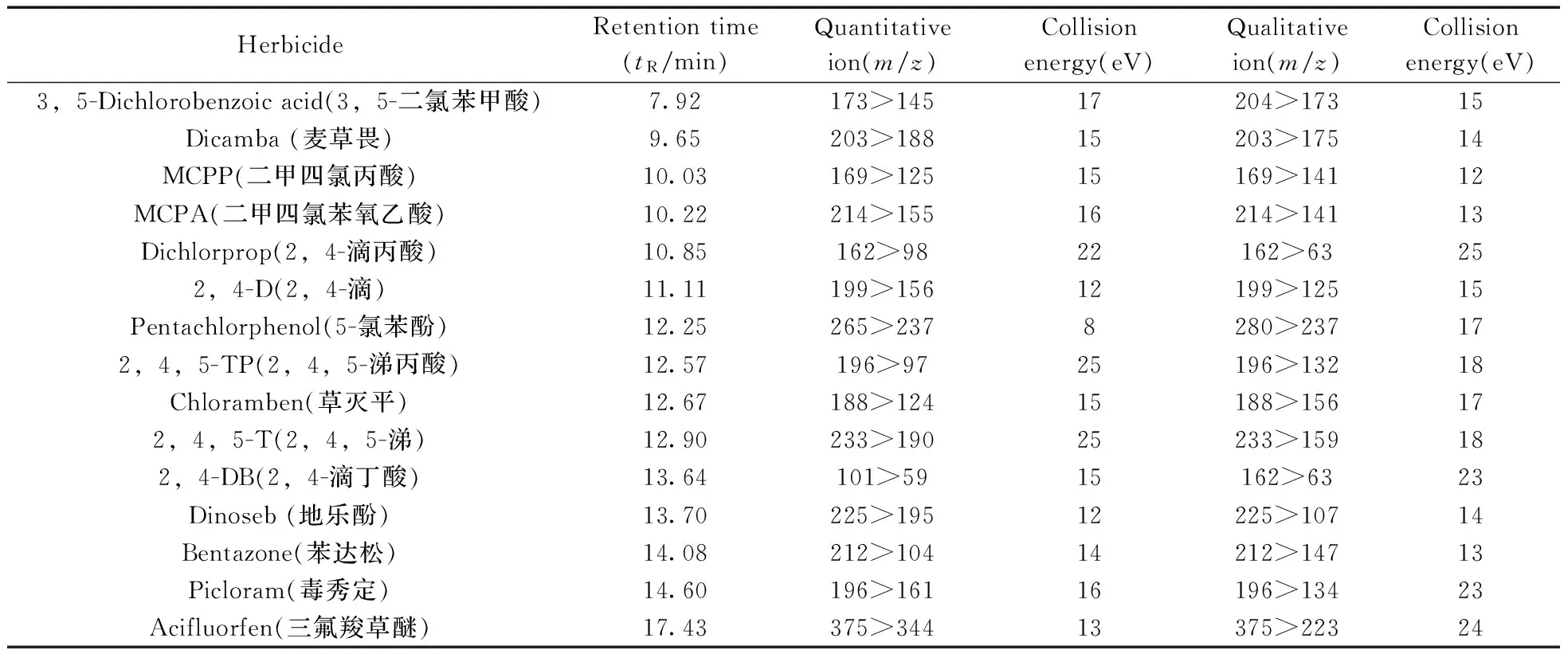
表1 15种苯氧羧酸类除草剂的色谱保留时间及质谱条件Table 1 Retention times and EI-MS/MS conditions for 15 phenoxyacid herbicides
2 结果与讨论
2.1 提取溶剂的选择
比较了常用于除草剂前处理的乙腈、甲醇、丙酮、二氯甲烷、正己烷和乙酸乙酯等溶剂的提取效果。结果表明,丙酮和甲醇的极性较强,对大多数除草剂能够充分提取,但也提取出烟草中大量的油脂和色素,从而给下一步净化带来困难。乙酸乙酯、二氯甲烷和正己烷提取的色素和油脂较少,但不能完全提取烟草组织中的残留除草剂,提取效率低。而乙腈能有效提取大多数除草剂,且对油脂和色素提取较少,易于净化,所以本实验最终选择乙腈作为提取溶剂。
2.2 净化方法的研究
固相萃取(SPE)净化技术是农残检测中较常见的前处理方式,对于不同溶液中的污染物可分别利用反相、离子交换、螯合树脂等多种手段进行,具有溶剂用量少、便捷、安全、高效等特点。本文比较了Carbon TPT、石墨化碳(GC-NH2)、弗罗里硅土(FL-PR)、C184种固相萃取柱对添加了混合标准溶液的空白样品的净化效果,以15 mL乙腈-甲苯(3∶1)为洗脱液,经衍生化和浓缩定容后检测。结果发现,Carbon TPT柱与GC-NH2柱的效果优于FL-PR柱和C18柱,这是由于FL-PR柱和C18柱对色素杂质的吸附能力较弱,基质干扰较大,而Carbon TPT柱对色素杂质的吸附性最强,净化效果最好,因此实验最终选择Carbon TPT柱为净化萃取柱。
2.3 衍生化条件的选择
分别比较了不同的温度(20、30、40、50、60 ℃)与时间(10、30、60、120 min)条件对衍生化效果的影响。结果表明,温度低于40 ℃时,随着温度的升高,其所需的衍生化时间逐渐缩短,如20 ℃时所需要的衍生时间为60 min,30 ℃时所需要的衍生时间为30 min,实验结果与文献一致[13];而当温度≥40 ℃时只需10 min即可达到理想的衍生效果,继续升高温度,易导致溶剂挥发过快,影响试验效果。因此实验最终选择衍生温度为40 ℃,衍生时间为10 min。
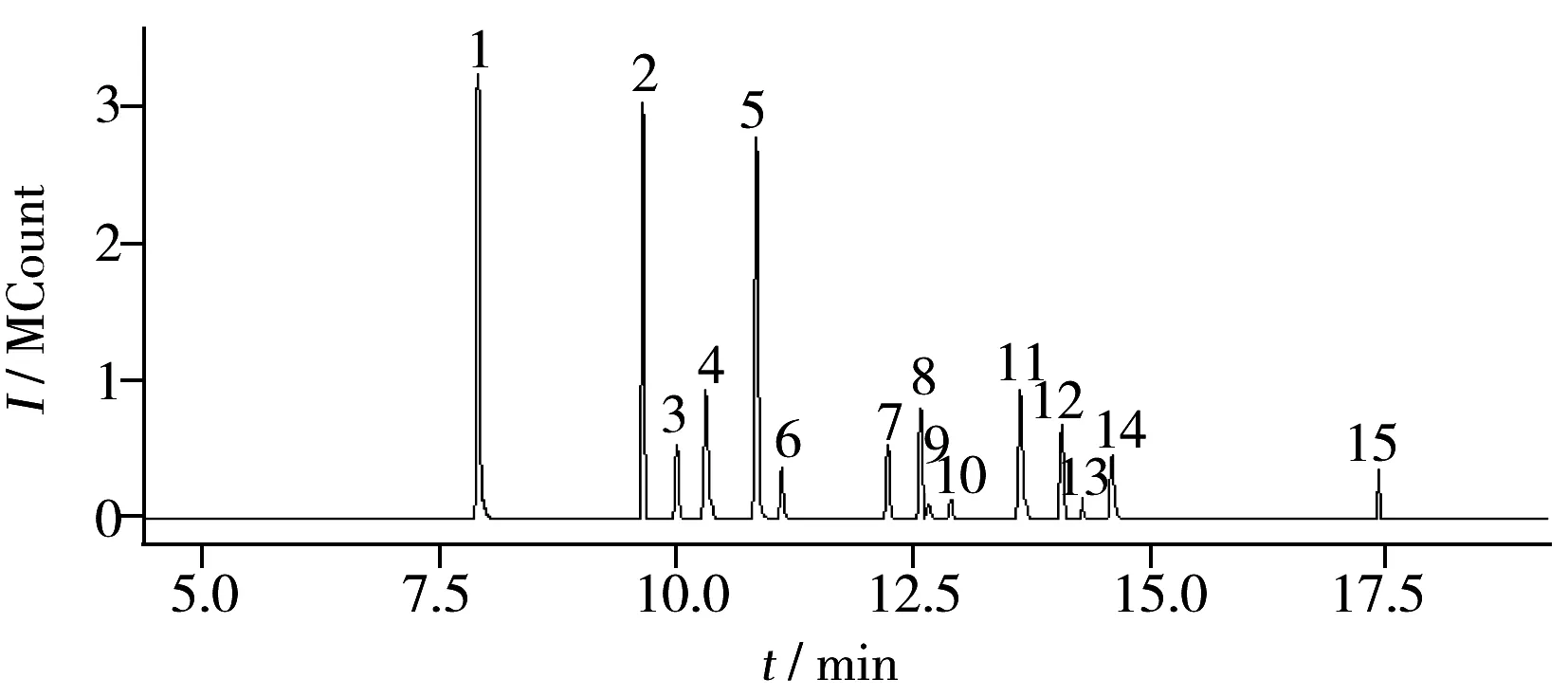
图1 15种苯氧羧酸类除草剂(100 μg/L)的MRM色谱图Fig.1 MRM chromatogram of 15 phenoxyacid herbicides(100 μg/L)1.3,5-dichlorobenzoic acid,2.dicamba,3.MCPP,4.MCPA,5.dichlorprop,6.2,4-D,7.pentachlorphenol,8.2,4,5-TP, 9.chloramben,10.2,4,5-T,11.2,4-DB,12.dinoseb, 13.bentazone,14.picloram,15.acifluorfen
2.4 质谱条件的优化
将质量浓度为5 mg/L的混合标准溶液在m/z45~500进行一级质谱全扫描(Full scan),通过仪器自带解卷积软件和NIST谱库检索对色谱图进行定性分析,确定目标化合物的保留时间、质量数及匹配度等信息。选择特征明显、质量数高、重现性好、无干扰的离子作为母离子。其次,进行二级质谱产物离子扫描,比较不同的碰撞能量获取的产物离子色谱图信息,选取重复性好、强度大、灵敏度高的碎片作为定量、定性的子离子,以丰度最高的1对子离子进行定量分析,丰度次高的1对子离子进行定性分析。最终确定各农药的母离子、子离子、碰撞能量、扫描时间等参数(表1)。在选定的质谱条件下,得到了较为理想的分离效果,混合基质标准工作溶液的MRM图见图1。从图1可以看出,除了8号与9号峰未完全分离外,其余的色谱峰峰形尖锐,对称性好,各色谱峰间完全分离。
2.5 基质效应的考察
GC-MS/MS分析方法普遍存在基质效应,基质诱导效应即目标物在纯溶剂和基质中响应存在较大差异,通常相同浓度的农药在基质中表现为基质增强效应或基质抑制[15-16]。
消除基质效应的方法有基质净化法、加入分析保护剂法、内标法、基质匹配标准溶液法等。由于分析保护剂的选择有限且价钱昂贵,而内标法与基质匹配标准溶液法的前处理操作繁琐且增加了后续数据的处理难度。本文选择基质净化法去除干扰物质,可有效降低基质效应的影响。
本文通过对比3个水平标准溶液与基质匹配标准溶液的响应强度,来考察基质效应。以在100,200,500 μg/kg 3个水平下基质匹配标准溶液中的峰面积响应之和与相对应3个水平下纯溶剂配制的标准溶液中目标物的峰面积响应的比例差异来考察基质效应。结果表明,15种除草剂基质效应的比值在0.7~1.1之间,说明通过本文的净化处理,可消除基质效应的影响。因此,本实验可以采用纯溶剂直接配制15种除草剂的工作曲线进行定量。
2.6 线性范围与相关系数
将混合标准储备溶液分别配制为20、100、200、500、1 000 μg/L系列浓度的标准工作液,以15种除草剂标准溶液的浓度为横坐标(x,μg/L)、峰面积为纵坐标(y),绘制线性关系曲线。结果表明,15种除草剂的浓度在20~1 000 μg/L范围内与峰面积呈良好的线性关系,相关系数(r2)均大于0.992(见表2)。

表2 15种苯氧羧酸类除草剂的线性方程、相关系数、线性范围、回收率、相对标准偏差(n=6)及定量下限Table 2 Linear equations,correlation coefficients(r2),linear ranges,recoveries,RSDs(n=6) and quantitative limits of 15 phenoxyacid herbicides
2.7 回收率、精密度及定量下限
选取空白样品,称取3个平行样,分别准确添加15种除草剂混合标准溶液,按前述的操作步骤进行3个浓度水平(20,100,200 μg/kg)的加标回收实验,每个水平平行测定6次,计算回收率及相对标准偏差(RSD)。结果表明,15种除草剂的平均回收率为71.5%~105.6%,RSD为4.5%~14.9%。分别根据3倍信噪比(S/N=3)及S/N=10计算15种除草剂的检出限(LOD)与定量下限(LOQ),得到15种除草剂的LOD为0.9~3.3 μg/kg,LOQ为3.2~10.8 μg/kg(见表2)。结果满足国际烟草科学研究合作中心(CORESTA)农用化学品咨询委员会(ACAC)指导残留限量(GRLs)和技术方法指导对回收率、精密度、检测灵敏度的要求。
2.8 实际样品的检测
为验证方法的可行性,对企业委托检验的20个烟草样品,按照建立的方法进行样品前处理并测定15种苯氧羧酸类除草剂的残留量。结果有2个样品分别检出麦草畏0.13 mg/kg、2,4-滴0.05 mg/kg,其他13种苯氧羧酸类除草剂均未检出。
3 结 论
本文建立了乙腈提取,TPT固相萃取柱净化,气相色谱-串联质谱同时检测和确证烟草样品中15种苯氧羧酸类除草剂残留量的分析方法。对提取溶剂、净化方式、衍生化条件、质谱参数等条件进行了优化,并考察了基质效应的影响,保证了检测结果的准确性。方法针对CORESTA 2013版农药残留指导名单的苯氧羧酸类除草剂进行了考察,结果表明,该方法能有效避免烟草中复杂基质的干扰,选择性强、灵敏度高、重现性好,能满足当前对烟草中苯氧羧酸类除草剂残留分析的相关要求。
[1] Zhao H Y,Zhu J Y,Liu S N.WeedSci.(赵浩宇,朱建义,刘胜男.杂草科学),2013,31(3):1-7.
[2] Souzasilva E A,Pawliszyn J.J.Agric.FoodChem.,2015,63(18):4464-4477.
[3] Niu Z Y,Luo X,Tang Z X,Ye X W,Sun Y F,Zhang H W,Wang F M.Chin.J.Anal.Chem.(牛增元,罗忻,汤志旭,叶曦雯,孙银峰,张鸿伟,王凤美.分析化学),2009,37(4):505-510.
[4] Kuang H,Hou Y X,Chu X G,Xu C L.Chin.J.Anal.Chem.(匡华,侯玉霞,储晓刚,胥传来.分析化学),2006,34(12):1733-1736.
[5] CORESTA Guide No.1.The Concept and Implementation of Agrochemical Guidance Residue Levels.2013.
[6] Su Y L,Mo H H,An F C.Environ.Chem.(苏允兰,莫汉宏,安凤春.环境化学),2001,20(6):577-581.
[7] Yu Y B,Zhang R,Li L.Chin.J.Anal.Chem.(于彦彬,张嵘,李莉.分析化学),2014,25(9):1354-1358.
[8] Zhou C J,Zhao B,Wu D,Deng M L,Huang S Y.Sci.Technol.FoodInd.(周纯洁,赵博,吴丹,邓美林,黄思瑜.食品工业科技),2016,37(10):467-468.
[9] Zhang F,Yi Y M,Zhang C X.Food&Machinery(张帆,易艳梅,张春霞.食品与机械),2016,11(7):61-65.
[10] Zhang F,Fu S L,Shi Y M,Li Z H,Zhang Y.J.Instrum.Anal.(张帆,付善良,施雅梅,李忠海,张莹.分析测试学报),2013,32(1):79-83.
[11] Si X X,Zhu R Z,Liu Z H,Ma X Y.J.Instrum.Anal.(司晓喜,朱瑞芝,刘志华,马雪英.分析测试学报),2016,35(5):532-538.
[12] Li X Y,Lin J Y,Zhang L,Zhang Y T,Li K.Rock.Miner.Anal.(李晓亚,林建业,张莉,张永涛,李科.岩矿测试),2011,30(3):349-352.
[13] Li Y,Xu X,Yuan H F,Gao H W,Feng H G.J.AnhuiAgric.Sci.(李殷,徐霞,袁荷芳,高蕙文,冯华刚.安徽农业科学),2014,42(27):9527-9528.
[14] Cao Y Q,Song G,Wang M M,Wang X S,Ai L F.J.Instrum.Anal.(曹亚青,宋歌,王曼曼,王学生,艾连峰.分析测试学报),2016,35(10):1273-1277.
[15] Zhang B H,Wang X W,Chen S H.J.AnhuiAgric.Sci.(张炳辉,王新旺,陈顺辉.安徽农业科学),2016,44(7):30-32.
[16] Zheng Y,Xu X L,Ji S L.Chin.J.Chromatogr.(郑阳,许秀丽,纪顺利.色谱),2016,34(5):756-758.
Determination of 15 Kinds of Phenoxyacid Herbicides in Tobacco by Gas Chromatography-Tandem Mass Spectrometry
CAO Gui-hong1,WANG Xing-ning2*
(1.Guizhou Institute for Food and Drug Inspection,Guiyang 550012,China;2.Technical Center,Guizhou Entry-Exit Inspection and Quarantine Bureau,Guiyang 550081,China)
A method was developed for the simultaneous determination of 15 phenoxyacid herbicides in tobacco.Samples were extracted with acetonitrile(MeCN),then cleaned up with TPT SPE column.The methylation of analyte was performed with trimethylsily-diazmethan,and the detection was carried out by gas chromatography-tandem mass spectrometry(GC-MS/MS).The method showed a good linearity over the concentration range of 20-1 000 μg/L with correlation coefficients all above 0.992.The limits of detection and quantitation were 0.9-3.3 μg/kg and 3.2-10.8 μg/kg,respectively.The average recoveries of analytes at three fortified levels(20,100,200 μg/kg) were in the range of 71.5%-105.6%,with RSDs of 4.5%-14.9%.The proposed method is simple,rapid and sensitive,and is suitable for the simultaneous determination of 15 phenoxyacid herbicides in tobacco.
tobacco;phenoxyacid herbicides;gas chromatography-tandem mass spectrometry(GC-MS/MS);solid phase extraction(SPE);methylation
2016-11-14;
2017-03-11
国家质检总局科研项目(2015IK085)
10.3969/j.issn.1004-4957.2017.07.013
O657.63; S482.4
A
1004-4957(2017)07-0911-05
*通讯作者:王兴宁,硕士,工程师,研究方向:食品中农药残留检测,Tel:0851-822778102,E-mail:271762880@qq.com

