MIP-SERS技术快速检测中药中非法添加的茶碱
胡 然,陆 峰,卞筱泓,许激扬*
(1.中国药科大学 生命科学与技术学院,江苏 南京 211198;2.第二军医大学 药学院,上海 200433)
MIP-SERS技术快速检测中药中非法添加的茶碱
胡 然1,陆 峰2,卞筱泓1,许激扬1*
(1.中国药科大学 生命科学与技术学院,江苏 南京 211198;2.第二军医大学 药学院,上海 200433)
建立了分子印迹技术(MIP)与表面增强拉曼光谱(SERS)联用对中药中非法添加的茶碱成分快速检测的方法。基于沉淀聚合方法合成MIP微球,对复杂中药基质中的茶碱进行简单分离,采用SERS对MIP中吸附的茶碱进行定性检测。实验利用SEM,FT-IR对MIP结构表征,考察了MIP的热力学、动力学和选择性吸附能力,以及掺杂成分的检出限。结果表明,MIP比NIP对茶碱具有更好的特异性吸附和选择性,该方法对茶碱的检出限低至0.1 μg/L。方法用于5种止咳平喘类中药的检测,其中1种中药检出非法添加了茶碱成分。该法灵敏度高,特异性强,无需前处理,简单快速,实现了掺伪中药中茶碱的快速检测,有望进一步应用于其他复杂基质体系。
分子印迹技术;表面增强拉曼光谱;中药掺伪;茶碱
近年来,中药及保健品中非法添加化学成分的现象屡见不鲜,愈演愈烈,2017年1月,国家食药总局查处了近200批次的中药饮片,检测发现存在染色、增重、掺假现象。这些非法添加的化学品由于本身的毒性或因随意大量添加均会对人体产生巨大的危害,甚至造成死亡。
目前分析领域中常见的检测手段包括传统的高效液相色谱法(HPLC)[1]、液相色谱-质谱联用法(LC-MS)[2]、气相色谱-质谱联用法(GC-MS)[3]、薄层色谱-表面增强拉曼光谱法(TLC-SERS)[4]、表面等离子共振(SPR)[5]等,但这些方法具有耗时,成本高,前处理繁琐,对仪器和操作人员要求高,需大量有机溶剂等缺点,不能满足当前分析检测领域快速、准确、简单的要求。
分子印迹技术(Molecular impriting technology,MIT)通过“抗原-抗体”原理制备仿生材料,以目标分析物作为模板,能够在复杂基质中特异性识别和分离出目标分子,从而达到有效分离和富集的作用。表面增强拉曼光谱(Surface-enhanced Raman scattering,SERS)是一种活性拉曼分子在金属表面信号被强烈放大的分子谱学技术,其灵敏度高,甚至可实现单分子检测。目前已有文献报道“MIP-SERS”联用技术在食品药品中的检测应用,包括检测苏丹红Ⅰ[6]、三聚氰胺[7]、普萘洛尔[8]、氯霉素[9]等,但国内的相关研究报道较少。本文采用“MIP-SERS”对中药中非法添加茶碱进行了检测研究,以期达到快速、简单、特异性好和灵敏度高的目的。
1 实验部分
1.1 仪器与试剂
XW-80A型旋涡混合器(上海精科实业有限公司);DF-101S集热式恒温加热磁力搅拌器(上海梅颖浦仪器仪表制造有限公司);KQ-250DB型数控超声波清洗器(昆山市超声仪器有限公司);TU-1901型双光束紫外可见分光光度计(北京普析通用仪器有限公司);TG16-WS高速离心机(上海卢湘仪离心机有限公司);BWS415-785H便携式拉曼光谱仪(B&W Tek,USA);ALPHA傅立叶变换红外光谱仪(德国Bruker公司);扫描电镜(ZeissEVOMA-10)。
甲基丙烯酸(MAA)、二甲基丙烯酸乙二醇酯(EGDMA)、偶氮异二丁腈(AIBN)均购自阿拉丁试剂有限公司,使用前均去除阻聚剂;茶碱、咖啡因、多索茶碱均由中国食品药品检定研究院提供;甲醇、乙腈、冰乙酸等购于国药集团化学试剂有限公司,除乙腈为色谱纯外,其他均为分析纯;中药样品由山东省食品药品检验所提供。实验用水为去离子水。
1.2 茶碱MIP的合成
茶碱MIP的合成方法主要参考文献[10],取茶碱47 mg,加入40 mL乙腈,超声溶解,依次加入87.5 μL MAA,770 μL EGDMA以及14 mg AIBN,氮吹10 min,密封,60 ℃水浴聚合6 h,将聚合物离心,甲醇洗去多余乙腈,再用甲醇-冰乙酸(8∶2,体积比)振荡洗脱,直至紫外检测不到茶碱模板分子,最后用甲醇洗去残余冰乙酸,用水洗去甲醇,真空干燥后即得MIP。非印迹聚合物除了不加茶碱外,其余操作步骤同上。
1.3 纳米银胶的合成
根据文献“Lee”法胶[11]的合成方法,将36 mg AgNO3溶于10 mL水,置于三颈烧瓶中,加入190 mL水加热至微沸,同时将100 mg柠檬酸钠溶于10 mL水,取4 mL快速加入三颈烧瓶中,加热回流40~50 min即可。
1.4 吸附能力考察
配制不同浓度的茶碱标准水溶液,建立标准曲线,分别取2 mL茶碱标准溶液与5 mg茶碱MIP和茶碱NIP在25 ℃室温下振荡12 h,离心,取上清液过0.22 μm滤膜,测其紫外吸光度。取一定浓度的茶碱水溶液,加入5 mg茶碱MIP,在10~180 min后分别测量吸附后的紫外吸光度。
1.5 MIP的拉曼表征
将结构相似的10 mg/L的咖啡因、茶碱、多索茶碱溶液分别与5 mg MIP微球混合,振荡12 h后,与等体积的银胶1∶1混合后采集拉曼信号。 配制不同浓度的茶碱水溶液,分别与5 mg MIP材料混合振荡2 h后,与等体积的银胶1∶1混合后采集拉曼信号。
1.6 中药样品的检测
取5份中药真实样品适量,研细,加入水中超声5 min,离心取上清液与5 mg MIP材料振荡10 min,离心,水洗3次,与银胶1∶1混合后采集其拉曼信号。
2 结果与讨论
2.1 纳米银胶的表征
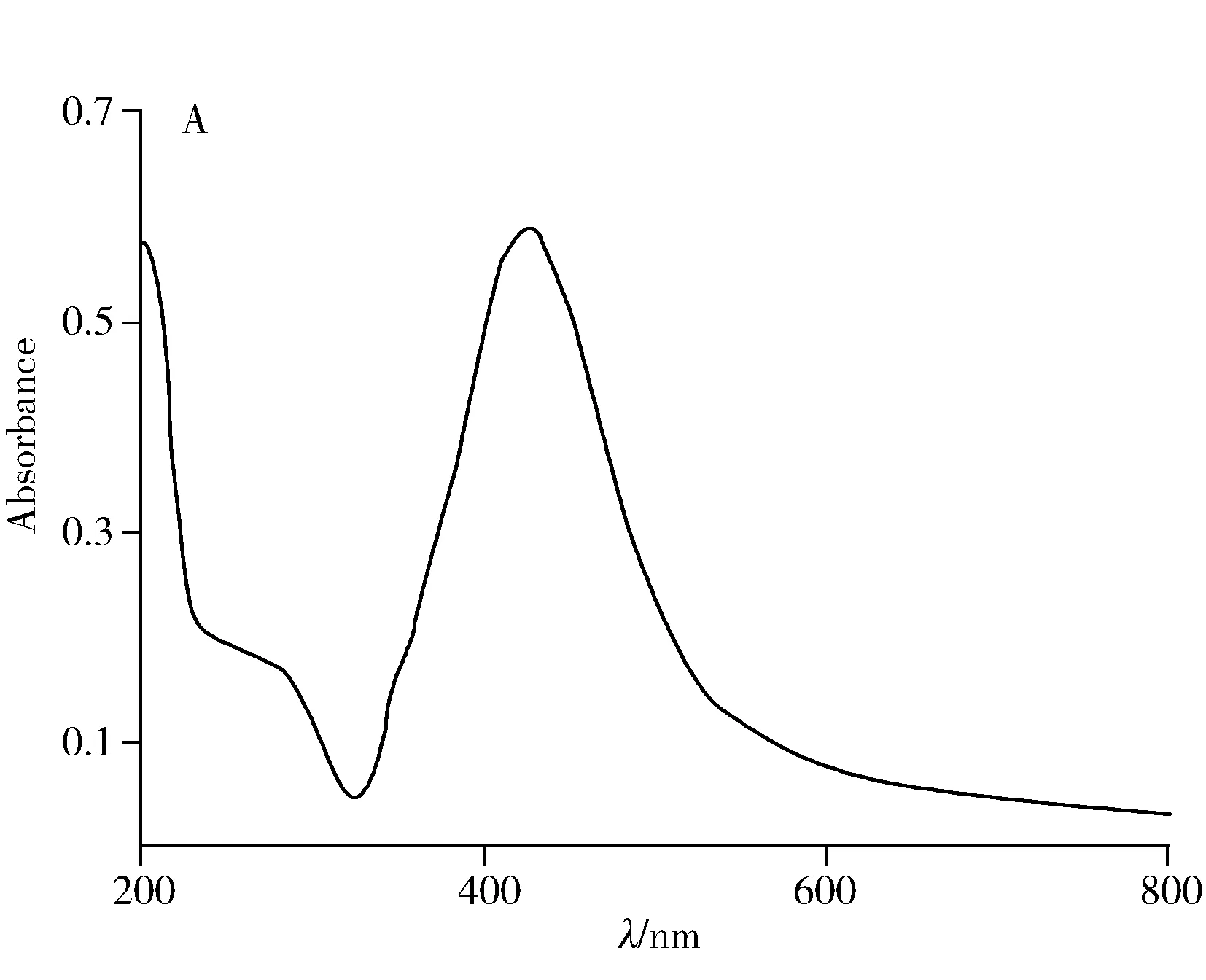
本文选择最常用的Lee法胶作为银溶胶,通过紫外图谱可以观察到纳米银在420 nm左右有1个较强的单峰(图1A),反映出纳米银颗粒呈较好的均一性球形,其直径约为40~60 nm[12],进一步通过扫描电镜(图1B)佐证纳米银颗粒的形状和直径,为SERS的增强效果和稳定性提供了保证。
2.2 茶碱MIP的合成与表征
2.2.1 茶碱与功能单体比例的优化 采用紫外光谱对茶碱模板分子和甲基丙烯酸功能单体的比例(茶碱空白,1∶1、1∶2、1∶4、1∶6、1∶8)进行筛选。观察到当甲基丙烯酸的比例不断增大时,最大吸收波长从275 nm红移至277 nm,这主要是由于茶碱与甲基丙烯酸的羧基发生了氢键结合[13],当模板分子和功能单体的比例为1∶4时,继续增大甲基丙烯酸的比例,最大吸收波长基本不发生变化,说明1个茶碱分子可结合4个甲基丙烯酸。
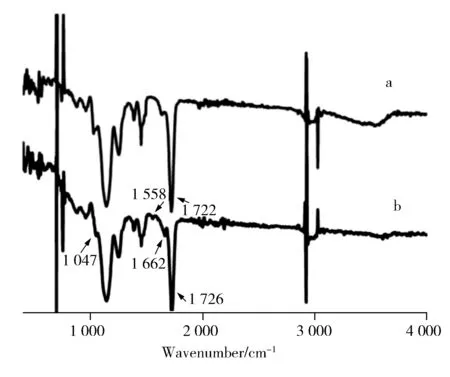
图2 MIP(a)和NIP(b)吸附茶碱后的红外光谱图Fig.2 FT-IR spectra of MIP(a) and NIP(b) after adsorpting theophylline
2.2.2 茶碱MIP及茶碱NIP 的扫描电镜图 采用扫描电镜对茶碱MIP及NIP进行表征。实验结果显示,NIP的均一性优于MIP,可能是由于相对于NIP 微球,MIP微球内部需要更多的茶碱孔穴,造成了大小、孔径和分布不均一[14],这种微观的不均一性在宏观上呈现出微球大小的不均一。

2.3 MIP的吸附曲线
茶碱与MIP和NIP分别振荡12 h后,离心,考察了MIP和NIP对茶碱的静态结合等温线。实验结果显示,MIP对茶碱的吸附能力明显强于NIP,MIP对茶碱的饱和吸附量约为22 mg/g,而NIP不足10 mg/g。这主要是因为MIP以茶碱为模板形成的三维孔穴与茶碱分子更为接近,而NIP的孔穴却无均一性,对茶碱的选择性更差。因此,对于相同浓度的茶碱溶液,MIP的吸附能力好于NIP。
2.4 THO@MIP的拉曼识别特性
图3分别为0.5 mg/L茶碱溶液与MIP和NIP结合后的SERS图谱以及茶碱本身的SERS图谱,从图中可以看到571,696,1 305 cm-1处的峰主要来自茶碱嘧啶和咪唑环的伸缩振动,1 258 cm-1处属于嘧啶环上的甲基振动峰,在吸附茶碱后,MIP的茶碱峰增大明显好于NIP,这主要是MIP对茶碱的特异性吸附导致。
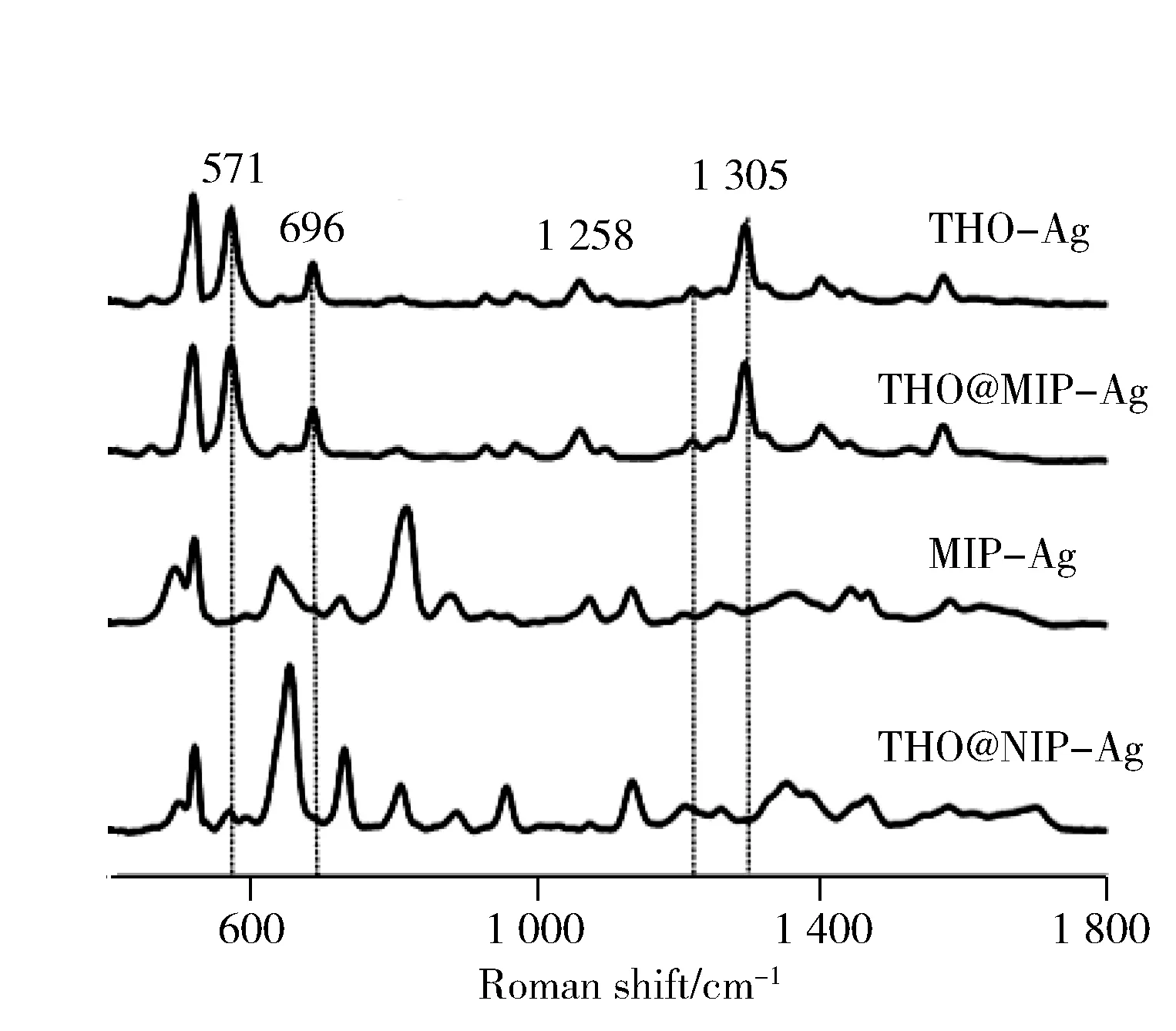
图3 MIP和NIP结合茶碱后的SERS图谱Fig.3 SERS spectra of MIP and NIP after rebinding of theophylline
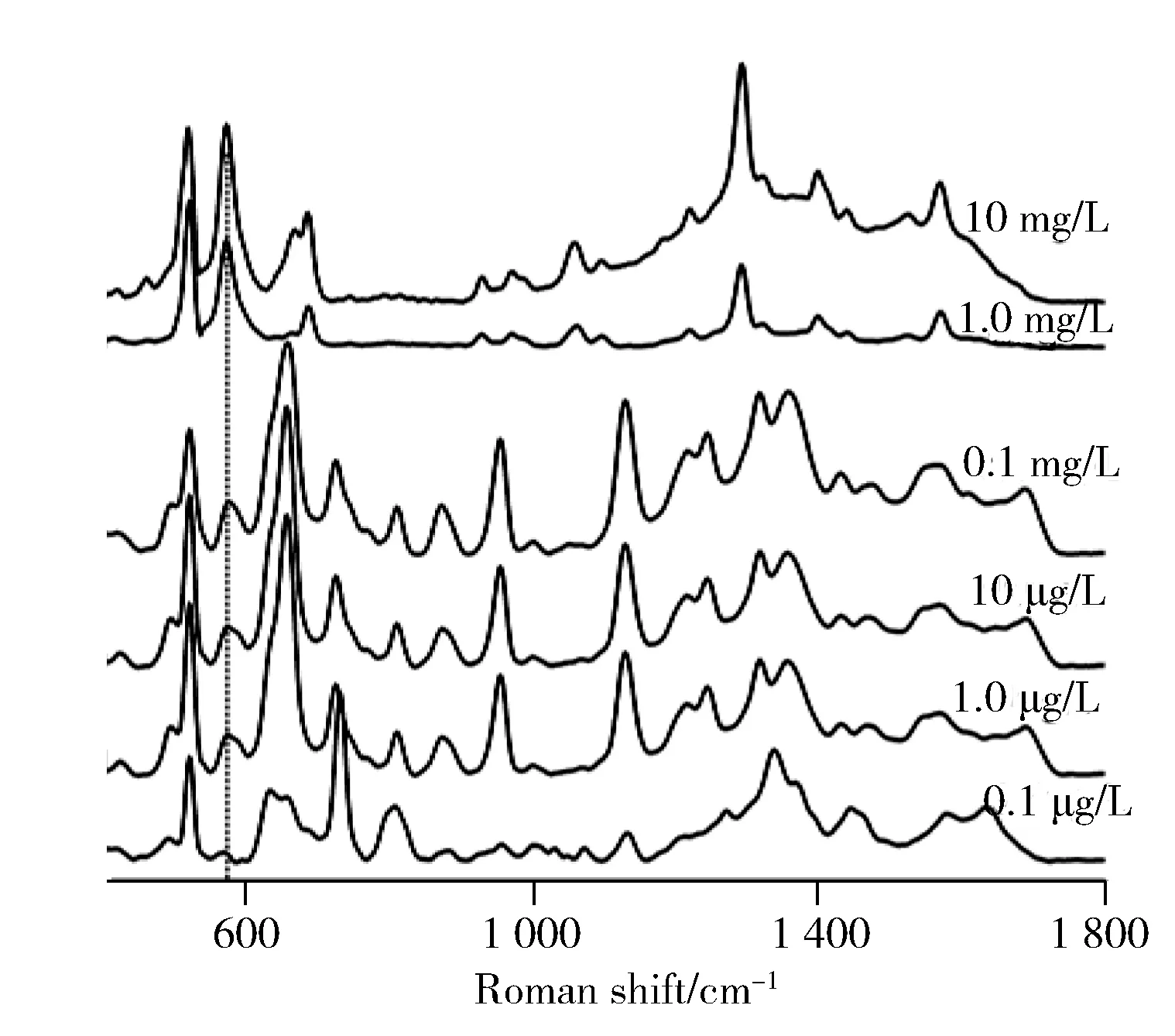
图4 MIP-SERS对茶碱检出限Fig.4 Detection limit of theophylline with MIP-SERS
2.5 THO@MIP的拉曼选择性
为了进一步考察MIP的选择性,将0.5 mg/L的茶碱、咖啡因、多索茶碱溶液分别与MIP混合搅拌一段时间。结果显示,茶碱的SERS信号好于咖啡因和多索茶碱,这也证明在结构类似物中,茶碱比咖啡因和多索茶碱更适合MIP中的孔穴,而相比于茶碱,咖啡因由于多1个甲基官能团,导致位阻增大,因此对MIP的孔穴识别能力下降,而多索茶碱的官能团更大,这可能是咖啡因的SERS强于多索茶碱的原因之一。
2.6 MIP-SERS检出限
考察了不同浓度的茶碱溶液与MIP搅拌10 min后的拉曼信号。结果显示,当茶碱浓度大于1.0 mg/L 时,拉曼图谱以茶碱信号为主,而当浓度低于1.0 mg/L时,拉曼图谱发生了变化(见图4),考虑此时茶碱浓度过低,拉曼峰以MIP材料的拉曼峰为主,571 cm-1和1 305 cm-1的两个尖锐峰属于茶碱分子不同振动模式的峰,但1 305 cm-1处的特征峰在低浓度时干扰较大,所以选择571 cm-1的茶碱特征峰为检出限的识别特征峰。以571 cm-1的茶碱特征峰为标准,当茶碱浓度低于1.0 μg/L时,仍然可以判断目标基质中含有茶碱,低于文献报道的10-7mol/L[16]。
2.7 实际样品的考察
采用MIP-SERS对5份真实中药样品进行检测,除了3号样品外,其他4份样品在571 cm-1茶碱特征峰处均未出峰,而3号样品在571 cm-1处有强峰,表明3号样品非法添加了茶碱。本方法整个检测过程不超过30 min,完全满足快速检测的要求。
3 结 论
本文以茶碱为检测对象,将“MIP-SERS”分析手段运用于中药中茶碱掺伪的快速检测,该方法灵敏度高,特异性强,简单,快速,满足当前分析检测方法的发展要求。“MIP-SERS”有望进一步应用于其他分析领域。
[1] Fan Q Y,Hao Y H,Dai C M.J.Instrum.Anal.(樊轻亚,郝艳红,代春美.分析测试学报),2017,36(1):106-111.
[2] Guo X,Sun J H,Sun Z Z,Liu J H,Huang X L,Liu Y L,Chen L.J.Instrum.Anal.(郭霞,孙建华,孙建中,刘菁华,黄雪玲,刘云璐,陈琳.分析测试学报),2016,35(12):1535-1541.
[3] Wang Y Y,Xu Z Q,Li D,Zheng J G,Zhou M H,Liu Y F,Xiao Q,Zhong Z G.J.Instrum.Anal.(王云玉,许志钦,李丹,郑建国,周明辉,刘莹峰,肖前,钟志光.分析测试学报),2014,33(6):724-727.
[4] Zhu Q X,Cao Y B,Cao Y Y,Chai Y F,Lu F.Anal.Bioanal.Chem.,2014,406(7):1877-1884.
[5] Anand M S,Satyendra K M,Banshi D G.Mater.Res.Express,2015,2(3):035007.
[6] Gao F,Hu Y X,Chen D,Li-Chan C Y L,Grant E,Lu X N.Talanta,2015,143:344-352.
[7] Hu Y X,Feng S L,Gao F,Li-Chan C Y L,Grant E,Lu X N.FoodChem.,2015,176:123-129.
[8] Bompart M,Wilde Y D,Haupt K.Adv.Mater.,2010,22(21):2343-2348.
[9] Gao F,Feng S L,Chen Z W,Li-Chan C Y L,Grant E,Lu X N.J.FoodSci.,2014,79(12):2542-2549.
[10] Ye L,Weiss R,Mosbach K.Macromolecules,2000,33(22):8239-8245.
[11] Lee P C,Meisel D.J.Phys.Chem.,1982,86(17):3391-3395.
[12] Evanoff D D,Chumanov G.J.Phys.Chem.B,2004,108(37):13957-13962.
[13] He M Y,Ye Y F,Liu Y,Li Z Z,Jiao B N,Zeng S M,Su X S.J.Instrum.Anal.(贺美艳,叶玉凤,刘炎,李珍柱,焦必宁,曾绍梅,苏学素.分析测试学报),2017,36(3):325-330.
[14] Chen W,Yang X H,Yang Z S,Wang Y M,Cao J L.J.Instrum.Anal.(陈文,杨晓花,杨支帅,王以明,曹静亮.分析测试学报),2014,34(3):271-276.
[15] Nolasco M M,Amado A M,Ribeiro-Claro P J A.ChemPhysChem.,2006,7(10):2150-2161.
[16] Kan X W,Liu T T,Zhou H,Li C.Microchim.Acta,2010,171(3):423-429.
Rapid Detection of Theophylline Illegally Mixed in Traditional Chinese Medicine by MIP-SER
SHU Ran1,LU Feng2,BIAN Xiao-hong1,XU Ji-yang1*
(1.College of Science and Technology,China Pharmceutical University,Nanjing 211198,China;2.School of
Pharmacy,The Second Military Medical University,Shanghai 200433,China)
A rapid method combining molecularly imprinted polymers with surface-enhanced Raman spectroscopy(MIPs-SERS) was established for the determination of theophyline illegally added into traditional Chinese Medicine.MIPs were synthesized by precipitation polymerization,and the theophylline was simply separated from the complex traditional Chinese medicine(TCM) substrates, then detected qualitatively by SERS.The structures of the newly synthesized MIPs were characterized by Fourier transmission infrared spectrometry(FT-IR) and scanning electron microscopy(SEM).The thermodynamics and kinetics and selective adsorption capacity of the MIPs,as well as the limit of detection for adulteration were also investigated.The results showed that MIPs had a better specificity and selectivity than NIPs,and the limit of detection was as low as 1 μg/L.Five kinds of real TCM relieving cough and asthma were tested,and one sample was detected to have theophylline components added illegally. With the advantages of high sensitivity,strong specificity,no pretreatment,simplicity and rapidness,the method could be used for the rapid detection of theophylline illegally added in TCM and further applied in other complicated matrix system.
molecularly imprinted technology;surface enhanced Raman spectroscopy;traditional Chinese medicine(TCM) adulteration;theophylline
2017-02-15;
2017-04-15
国家重大仪器开发专项项目(2012YQ18013203)
10.3969/j.issn.1004-4957.2017.07.011
O657.3;TQ460.72
A
1004-4957(2017)07-0902-05
*通讯作者:许激扬,博士,教授,研究方向:药物生物合成,Tel:025-83271306,E-mail:jiyangx@126.com

